Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 supl.1 Santa Marta Dec. 2020 Epub Sep 05, 2021
https://doi.org/10.25268/bimc.invemar.2020.49.suplesp.1068
Artículos de Investigación
Valoración actual de las poblaciones de Acropora palmata y Acropora cervicornis en el Parque Nacional Natural Tayrona, Caribe colombiano
1Grupo de investigación Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos, Universidad del Magdalena, Santa Marta, Colombia.
2Grupo de investigación Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos, Universidad del Magdalena, Santa Marta, Colombia. marco.garzon@gmail.com
3Grupo de investigación Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos, Universidad del Magdalena, Santa Marta, Colombia. silore10.se@gmail.com
The last assessment in terms of extension, status, and living coral cover (%) of Acropora palmata (29) and A. cervicornis (12) formations in Tayrona National Natural Park was done in 2001 and published in 2004. These formations were evaluated again between 2016 and 2018, including a new formation in Aguja Island, considering the same variables, with the addition of colony condition. For A. palmata, 24 formations were found with a reduction in area of 28.9 %. Mean coral cover increased about 2.0 %, with a broad size frequency distribution and an important proportion of colonies affected by damselfish territories (Stegastes). In A. cervicornis the area was reduced in 99.3 % and only one formation was found in Nenguange, although two new small formations were found in Cinto, and another one in Chengue. Mean coral cover was 8.0 %, composed mostly of small colonies and affected mainly by bleaching, macroalgae, diseases and predation. It is clear that the status of each species is different and requires specific conservation and management efforts. A. palmata formations have persisted through time, but nevertheless it is necessary to continue with similar assessments, to detect temporal changes, evaluating ecological aspects such as impacts of damselfish territories. A. cervicornis is in a critical condition and requires urgent restoration strategies and management measures to mitigate its tendency to disappear in the area.
KEY WORDS: acroporids; coral reef formations; population demography.
La última valoración sobre la extensión, estado y cobertura viva (%) de las formaciones de Acropora palmata (29) y A. cervicornis (12) en el Parque Nacional Natural Tayrona fue realizada en 2001 y publicada en 2004. Estas mismas formaciones, incluyendo una adicional en isla Aguja, fueron evaluadas de nuevo entre 2016 y 2018 teniendo en cuenta las mismas variables, y adicionalmente el registro de condición de las colonias. Para A. palmata se encontraron 24 formaciones con una reducción en área de 28,9 %. La cobertura promedio aumentó cerca de 2,0 %, y se observó una amplia distribución de frecuencia de tallas y una proporción importante de colonias con territorios de peces damisela (Stegastes). El área de las formaciones de A. cervicornis se redujo 99,3 % y solo se encontró una formación en Nenguange, aunque se registran dos nuevas y pequeñas en Cinto y otra en Chengue. La cobertura promedio fue de 8,0 %, en su mayoría constituida por colonias de talla pequeña y principalmente afectadas por blanqueamiento, macroalgas, enfermedades y depredadores. Claramente el estatus de las dos especies es diferente por lo que requieren esfuerzos diferentes para su manejo y conservación. Las formaciones de A. palmata han persistido, pero es necesario realizar estudios continuos que permitan detectar cambios temporales, con evaluaciones de aspectos ecológicos como las afectaciones por los peces damisela. El estado de A. cerviconis es crítico, por lo que demanda acciones urgentes de restauración y otras medidas de manejo para mitigar la tendencia a su desaparición en el área.
PALABRAS CLAVE: acropóridos; formaciones coralinas; demografía poblacional
INTRODUCCIÓN
Acropora palmata y A. cervicornis son dos especies de corales ramificados cuyas poblaciones se redujeron significativamente en todo el Caribe desde finales de la década de 1980 llevándolas a ser incluidas en la lista de especies amenazadas (Aronson et al., 2008a, 2008b). En Colombia, A. palmata se registra como En Peligro y A. cervicornis como Críticamente Amenazada (Ardila et al., 2002). El deterioro se ha atribuido a factores como enfermedades de tipo banda blanca (EBB) (Gladfelter, 1982; Aronson y Precht, 2001; Porter et al., 2001), serriatiosis de acropóridos (WPX) (Patterson et al., 2002), eventos de blanqueamiento (Hoegh-Guldberg, 1999; Rodríguez-Ramírez et al., 2008; Navas-Camacho et al., 2010), así como a sobrepesca, desarrollo costero y cambio climático (Buddemeier et al., 2004).
En el Caribe colombiano para la década de 1990 e inicios de los años 2000 se registró igualmente la reducción de las poblaciones de A. palmata y A. cervicornis (Díaz et al., 1995, 2000; Garzón-Ferreira, 1997; López-Victoria y Díaz, 2000; Cendales et al., 2002), con mortalidades en el Parque Nacional Natural Tayrona (PNNT) de hasta 60 % para A. palmata y 80 % para A. cervicornis (Garzón-Ferreira y Cano, 1991). Garzón-Ferreira et al. (2004) valoraron en 2001 estas dos especies en el PNNT con referencia a la ubicación, extensión, composición y cobertura de la comunidad coralina y otros organismos sésiles. Para A. palmata se estudiaron 29 formaciones que tuvieron una cobertura promedio de 10 %, una extensión de 14 000 m2 de tejido vivo, mientras que de 12 formaciones de A. cervicornis solo cuatro exhibieron colonias vivas con una cobertura promedio de 5 % para un área viva de solo 1200 m2. En general, al interior de las formaciones de estos corales las algas presentaron una cobertura de 80 %, seguidas por los corales pétreos. Los resultados indicaron que las poblaciones de estas dos especies aún no mostraban signos de recuperación.
En el Caribe en la última década se han realizado valoraciones tendientes a establecer los cambios en las poblaciones de los acropóridos, principalmente para tener evidencia de si estas han mostrado signos de recuperación o, por el contrario, su deterioro ha seguido en aumento. Estos trabajos incluyen 1) la construcción de mapas de hábitats potenciales de las dos especies para la Florida, Puerto Rico e islas Vírgenes (Wirt et al., 2013, 2015), y 2) la evaluación del estado de las poblaciones de A. palmata a lo largo de los arrecifes mesoamericanos (México, Belice, Guatemala y Honduras), donde de 107 arrecifes estudiados, solo 15 presentaron recuperación y solo en uno se observó aumento de cobertura (Rodríguez-Martínez et al., 2014). En el sistema arrecifal de Veracruz en el golfo de México, Larson et al. (2014) sugirieron recuperación de A. palmata al encontrar colonias sanas, abundantes y con una amplia distribución y mayor densidad comparada con otras regiones del Caribe. En Jamaica, luego del evento de blanqueamiento de 2005, las poblaciones de A. palmata evidenciaron una recuperación de 2 % a 22 % en 2008 (Crabbe, 2009). En islas Vírgenes entre 2003-2010, Rogers y Muller (2012) encontraron que la enfermedad de serriatosis de acropóridos sigue siendo una de las principales causas de deterioro en A. palmata. En Los Roques, Venezuela, Croquer et al. (2016) documentaron cómo se ha perdido 50 % de la distribución original de A. palmata por blanqueamientos masivos, mientras que en los arrecifes de Cuba Caballero-Aragón et al. (2020) concluyeron que A. palmata presentaba un estatus de regular a malo en cerca de 90 % de los arrecifes.
En cuanto a estudios poblacionales, al ser los acropóridos especies ramificadas y de rápido crecimiento, son susceptibles al rompimiento y fragmentación (Hughes y Connell, 1999), aunque esta es una forma de reproducción y dispersión asexual que permite una rápida colonización del sustrato (Hughes et al., 1992; Hall y Hughes, 1996). La dificultad radica en determinar tasas demográficas, que están basadas en el crecimiento, mortalidad y fecundidad, factores que dependen del tamaño de las colonias (Hughes y Jackson, 1985; Soong, 1993), y no es sencillo distinguir si las colonias pequeñas provienen de mortalidad parcial, son nuevos reclutas o se han fragmentado. Por ello, variables como el sesgo y la curtosis son usados como indicadores de la preponderancia en la distribución de tallas pequeñas o grandes, así como la transformación logarítmica que se usa para visualizar más finamente las clases de tallas pequeñas y combina menos clases de talla (Meesters et al., 2001). De acuerdo con Bak y Meesters (1998), la demografía puede cambiar con los gradientes y condiciones ambientales, lo cual se refleja en las distribuciones de talla contrastantes entre distintas poblaciones; por esto, conocer el régimen de perturbaciones puede ayudar a inferir procesos demográficos. De ahí que estudios de la estructura de tallas de las poblaciones permiten examinar diferencias espaciales, temporales o taxonómicas en la historia de vida, evaluar respuestas a perturbaciones como blanqueamiento o evaluar la estructura de edades (Adjeroud et al., 2007; Crabbe, 2009; Anderson y Pratchett, 2014).
En Colombia se ha realizado solo una evaluación del estado de las poblaciones de las dos especies de Acropora: esta se hizo luego de 15 años de iniciarse la pérdida de cobertura (Garzón-Ferreira et al., 2004). Teniendo en cuenta lo anterior, el presente estudio, casi 20 años después de dicha valoración, presenta información sobre el estado actual, cobertura, condición, áreas de las formaciones e incluye, además, aspectos de la demografía como la estructura de tallas. Estos datos son una línea de base que puede aportar a futuros estudios que permitan estimar posibles cambios espaciales y temporales de las poblaciones de acropóridos en el PNNT.
ÁREA DE ESTUDIO
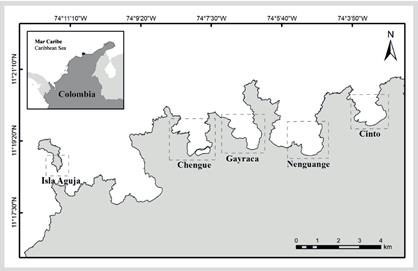
El estudio se realizó en el PNNT localizado en la costa norte de Colombia entre los 11°17′-11°22′ N y 73°53′-74°12′ W. Este incluye un número de bahías con arrecifes de coral, pastos marinos, bosques de manglar y playas arenosas (Garzón-Ferreira y Díaz, 2003). Información detallada sobre las condiciones climáticas y oceanográficas del área se encuentrean en varias publicaciones (Andrade et al., 2003, Bayraktarov et al., 2014a, 2014b). Se evaluaron las formaciones de Acropora en las bahías de Chengue, Gayranca, Nenguange y Cinto, y se incluyó la formación de A. palmata ubicada en El Torín en isla Aguja, que, aunque no fue evaluada previamente, hace parte del PNNT (Figura 1).
MATERIALES Y MÉTODOS
Estimación de las áreas de cada formación
Se realizó un mapa de referencia con las formaciones coralinas de A. palmata (FAP) y A. cervicornis (FAC) registradas para las bahías de Cinto, Nenguange, Gayraca y Chengue en el PNNT por Garzón-Ferreira et al. (2004). Los muestreos se realizaron entre octubre de 2016 y mayo de 2018 y para evaluar el área de las poblaciones de las dos especies se visitaron las mismas bahías y se verificó la ubicación geográfica de cada formación. Las formaciones se delimitaron con boyas que luego fueron georeferenciadas usando un GPS Garmin eTrex 20 de 3 m de precisión. En los parches pequeños se tomaron medidas directas del área con cintas métricas. Adicionalmente, fueron configuradas misiones con un dron Phantom 4 para registrar las formaciones más someras.
Con los puntos GPS de los límites de cada parche, se calcularon los polígonos que representaron el área estimada de cada formación; para ello se utilizó el sistema de información geográfica (SIG) ArcGIS 10.4. En las formaciones donde las condiciones de visibilidad lo permitieron, se utilizaron las imágenes aéreas para la construcción de ortofotomosaicos mediante el programa de mapeo profesional Pix4D, con los cuales se calcularon las áreas con una mayor precisión.
Estructura poblacional, cobertura y condición
En cada formación donde se encontraron colonias vivas se realizó la valoración de su cobertura, tallas y condición. Dependiendo del tamaño de cada formación, se dispusieron entre uno y cinco transectos lineales de 10 m (entre 2 y 10 m de profundidad) y se realizaron videos a lo largo del transecto. Para el cálculo de cobertura del sustrato, el registro de video fue analizado utilizando el programa Coral Point Count. Inicialmente, 20 imágenes fueron capturadas a intervalos de 5 s, y a cada una aleatoriamente se le asignaron 50 puntos. Con base en ellos se estimó la cobertura de los componentes del sustrato (Kohler y Gill, 2006). Para evaluar si existían diferencias en cobertura de los componentes de A. palmata, macroalgas y otras especies de coral (exceptuando Acropora) entre este estudio y el de Garzón-Ferreira et al. (2004) se utilizó la prueba de Wilcoxon de rangos para muestras relacionadas, al no cumplir los datos el supuesto de normalidad para la cobertura de A. palmata y las macroalgas. Mientras tanto, para la cobertura de otros corales se usó la prueba pareada de t-Student con los datos transformados a arcoseno, previo cumplimiento del supuesto de normalidad (Shapiro-Wilks). Para A. cervicornis no fue posible realizar comparaciones al no encontrarse sino una sola FAC de las previamente registradas.
A lo largo de cada formación se midió el diámetro mayor (L) y el diámetro perpendicular al diámetro mayor (l) del mayor número de colonias individuales. El área de cada colonia fue calculada aproximando a una elipse (A = (L/2 × l/2) × π; Yap et al., 1992; Linares et al., 2011). La diferencia en la talla de las colonias (cm2) entre bahías se comparó a través de la prueba de Kruskal-Wallis al no cumplir el supuesto de normalidad (Shapiro-Wilk P < 0,05) y se realizó la prueba post-hoc de Dunn. La estructura de tallas para cada bahía se examinó a través de una tabla de distribución de frecuencias, con la cual se calculó el tamaño promedio, la desviación estándar y el coeficiente de variación (CV). El sesgo (g1) fue usado para describir la proporción de colonias que son más pequeñas o grandes que la media y la curtosis (g2) para describir si las distribuciones de frecuencia tienen picos más pronunciados o más planos que una distribución normal (Anderson y Pratchett, 2014). Luego, los datos fueron transformados a logaritmo (log10) para obtener una distribución normal e incrementar la resolución de tallas pequeñas (Bak y Meesters, 1998; Vermeij y Bak, 2003). Para comprobar si las distribuciones provenían de una distribución normal, se utilizó la prueba de Kolmogorov-Smirnov con la corrección de Lilliefors.
Para evaluar la condición en términos de salud en cada formación se realizó un registro videofotográfico sobre cada colonia. Para A. palmata se registraron colonias sanas, presencia de enfermedades (WPX o EBB), territorios de damiselas, evidenciados como lesiones sobre el tejido vivo, y presencia de signos de depredación de gusanos de fuego y caracoles. Para A. cervicornis se registraron colonias sanas, EBB, competencia con macroalgas, territorios de damiselas, signos de depredación de gusano de fuego y caracoles, y blanqueamiento. Con el total de colonias muestreadas se calculó la incidencia (%) de cada tipo de condición en cada una de las formaciones.
RESULTADOS
Distribución y áreas
Se evaluó un total de 30 formaciones que cubrieron un área de 93 157 m2. De las 29 FAP descritas por Garzón-Ferreira et al. (2004) se encontraron 23 con un área de 84 825 m2 y de las 4 FAC solo se encontró una en Nenguange con 158 m2. Se incluyen dos formaciones adicionales de A. palmata en el PNNT, una en Nenguange de 6020 m2 y una en Chengue de 1996 m2, en adición a la formación de A. palmata en isla Aguja en el sector El Torín con un área de 315 m2. Para A. cervicornis se distinguieron colonias completas y se incluyen dos formaciones pequeñas en la bahía de Cinto con 24,0 y 81,0 m2 y en Chengue se georeferenció la presencia de la especie al interior de la bahía, pero eran pequeñas colonias aisladas que no constituyen una formación. El área, localización y código de identificación de cada formación aparece en Material suplementario 1.
Teniendo en cuenta únicamente la comparación del área para las formaciones previamente detectadas y aún existentes, los datos en general muestran una reducción de las FAP en las bahías del PNNT de 34 494 m2 (28,9 %). Sin embargo, se obtuvo un aumento en área para nueve formaciones equivalente a 5480 m2, mientras la reducción se dio en 14 formaciones (28 031 m2). Las formaciones 4P en Chengue y 25P en Cinto siguen siendo las de mayor área en todo el PNNT. Sin embargo, hubo una reducción importante de 40,7 % en Cinto, mientras solo de 3,6 % en Chengue. Para las FAC la reducción en área en general fue de 99,3 %, y solamente la formación de Nenguange 7C presentó colonias vivas, y pasó de 924 m2 a 158 m2 (reducción de 83 %).
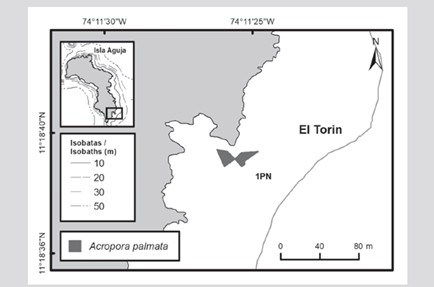
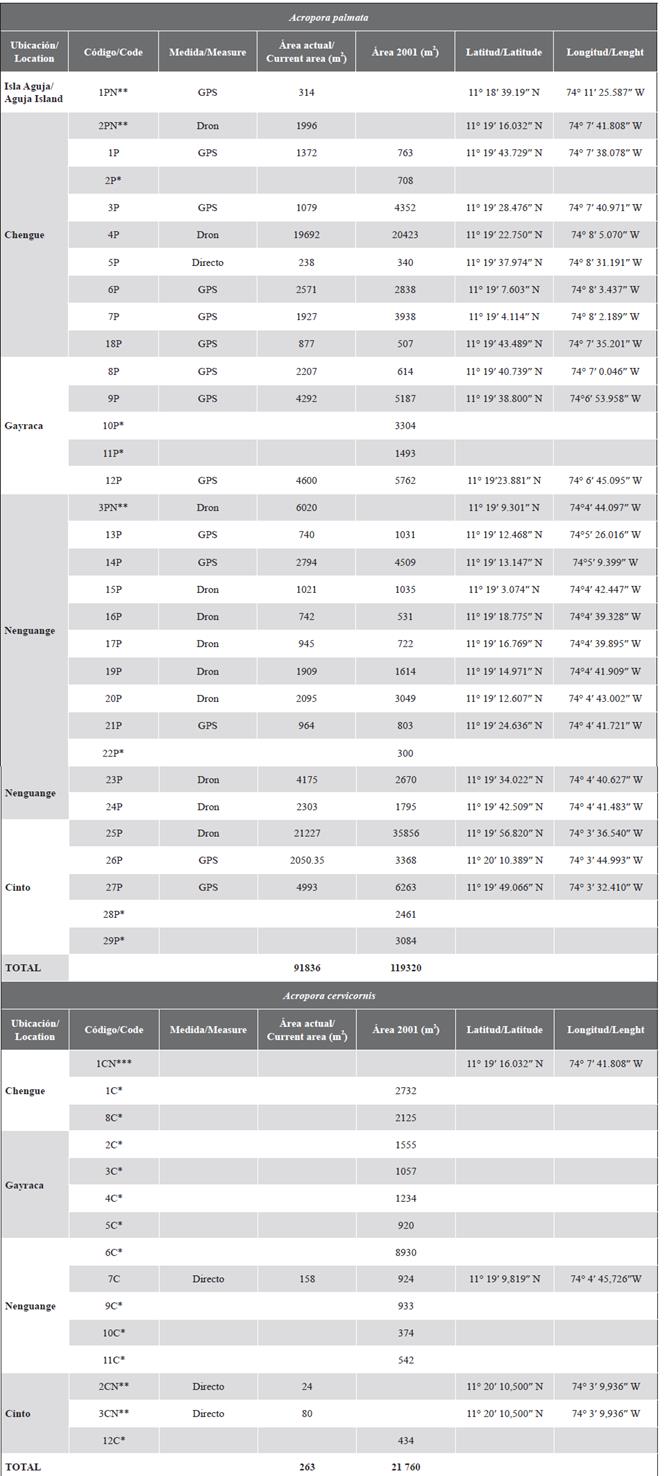
En la formación del sector de El Torín, al sureste de isla Aguja, es posible encontrar colonias dispersas de A. palmata entre 5 y 8 m de profundidad. Estas continúan hasta llegar a la parte somera, muy expuesta al embate de las olas a 1 m de profundidad (Figura 2). En la bahía de Chengue, no se encontró la formación 2P, pero se registró una formación adicional en el sector protegido (3PN) a 2 m de profundidad, que comparte sectores con parches importantes de Millepora spp., Madracis decactis y colonias masivas como Orbicella faveolata y Pseudodiploria strigosa (Figura 3). En Gayraca no se encontró la formación 10P del lado expuesto de la bahía y la 11P del lado protegido (Figura 4). En Nenguange aún se encuentra el mayor número de formaciones (n = 10) de las registradas por Garzón-Ferreira et al. (2004). En esta bahía no fue posible ubicar la formación 22P, aunque se incluye la formación del lado protegido, la cual fue denominada 3PN, al considerar que podría hacer parte de la formación 20P previamente descrita, pero que de acuerdo con el método utilizado pudo quedar fuera de la evaluada en 2001 (Figura 5). En Cinto igualmente no se encontraron dos formaciones del lado protegido (28P y 29P) y, aunque se ha reducido la formación 25P, esta sigue cubriendo un área importante (Figura 6).
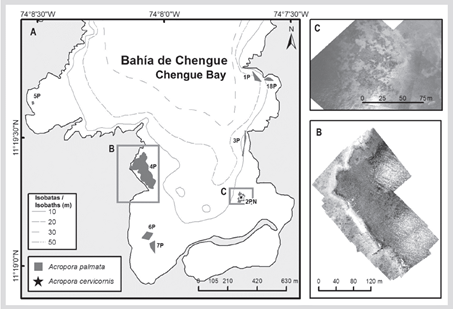
Figura 3 A) Ubicación de las formaciones de Acropora palmata y colonias aisladas de A. cervicornis en la bahía de Chengue, 2016-2018. B) Mosaico de fotografías aéreas para delimitar 2PN (parche nuevo de A palmata). C) Mosaico de fotografías aéreas para delimitar 4P.
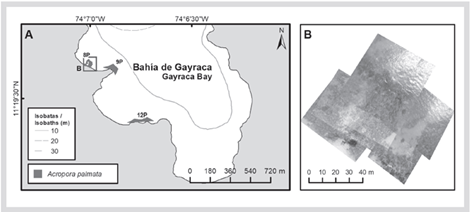
Figura 4 A) Ubicación de las formaciones de Acropora palmata en la bahía de Gayraca, 2016-2018. B) Mosaico de fotografías aéreas para delimitar 8P.

Figura 5 A) Ubicación de las formaciones de Acropora palmata y A. cervicornis en la bahía de Nenguange, 2016-2018. B) Mosaico de fotogramas aéreas para delimitar 24P. C) Mosaico de fotogramas aéreas para delimitar 23P. D) Mosaico de fotogramas para delimitar los polígonos 16P, 17P, 20P, 3PN y 15P.
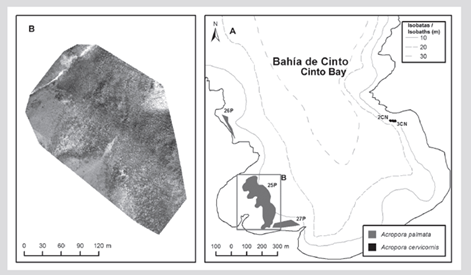
Figura 6 A) Ubicación de las formaciones de Acropora palmata y A. cervicornis en la bahía de Cinto, 2016-2018. B) Mosaico de fotogramas aéreas para delimitar 25P.
En cuanto a las FAC solo la formación 7C fue encontrada en la bahía de Nenguange (Figura 5). Se incluye el registro realizado en 2009 de la formación en buen estado de salud, en 2010 con registro de blanqueamiento y en 2011 ya se observaba su deterioro (Figura 7).

Figura 7 Formación de Acropora cervicornis en playa Pescador en la bahía de Nenguange. A) Septiembre de 2009 en buen estado. B) Septiembre de 2010 durante evento de blanqueamiento. C) Abril de 2011 muestra deterioro y pérdida importante. Fotos: Sven Zea.
Cobertura de Acropora palmata
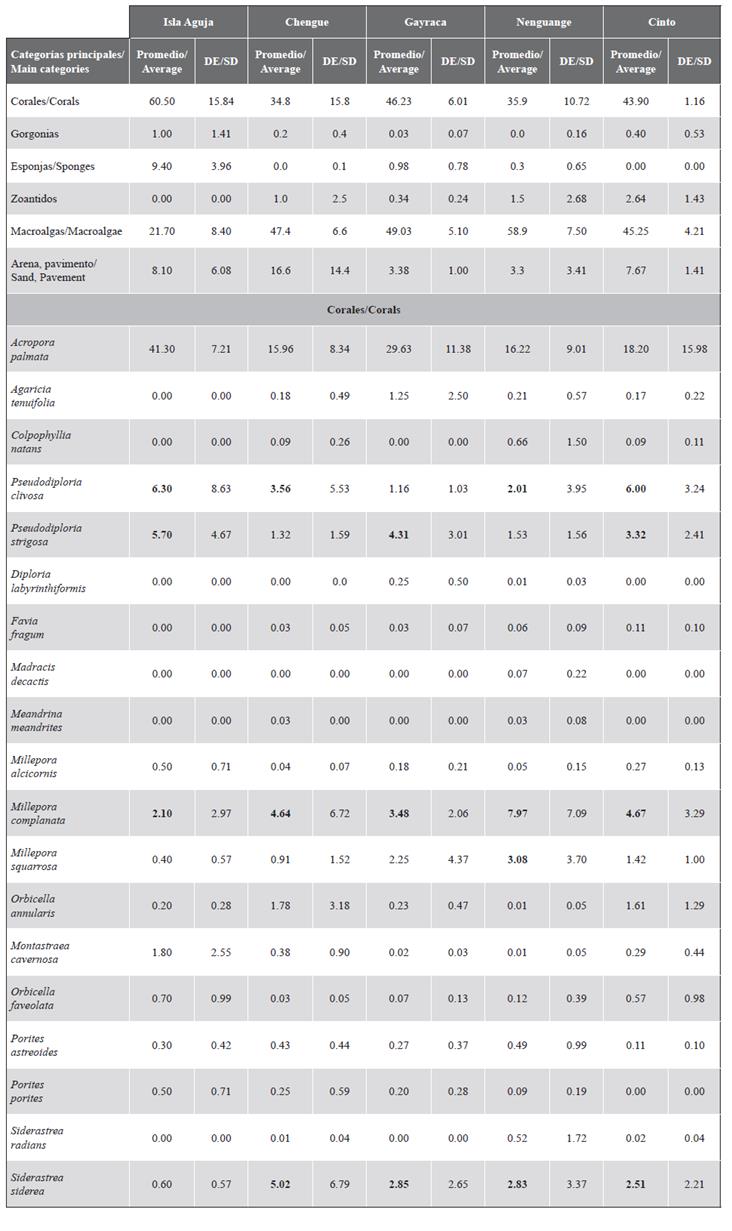
La cobertura promedio (± desviación estándar) de A. palmata en el PNNT fue de 19,9 ± 9,2 %; de macroalgas 52,0 ± 11,1 % y de corales en general 19,1 ± 11,6 %. La menor cobertura se encontró en la formación 6P de Chengue con tan solo 1,8 % y la mayor en Gayraca 8P con 42,3 % (Figura 8). De las 23 FAP en que se logró comparar la cobertura de A. palmata con respecto a la valoración del 2001, solo en cinco no se observó aumento en cobertura, resaltándose la mayor pérdida en 6P (64,0 %), 4P (50 %) y 5P (50,0 %) en la bahía de Chengue. El análisis de las 23 FAP comparadas mostró un aumento significativo en cobertura promedio (Prueba de Wilcoxon T23= 2,49; P = 0,012) de 11 % en Garzón-Ferreira et al. (2004) a 19,9 % en este estudio. Las macroalgas mostraron una disminución significativa en todas las FAP a excepción de la 8P en Gayraca. La diferencia en total fue de 27 % con respecto a 2001 (Prueba de Wilcoxon T23= 3,92; P < 0,001). Con respecto a la cobertura de las otras especies de coral, el aumento fue de 12,8 % y se vio igualmente en todas las FAP a excepción de 6P en Chengue y 16P en Nenguange (Prueba de t de Student para muestras pareadas t23= 5,491; P < 0,001) (Figura 8). Las principales especies con coberturas de más de 2 % fueron Millepora complanata, M. squarrosa, Siderastrea siderea, Pseudodiploria strigosa y P. clivosa (Material suplementario 2).
En cuanto a las formaciones registradas como adicionales al interior de las bahías del PNNT, la formación 2PN en Chengue presentó un porcentaje de A. palmata, corales y macrolagas de 21,0, 17,5 y 44,7 %, respectivamente, mientras en Nenguange la formación 3PN presentó valores de 14,3, 17,8 y 63,1 %, respectivamente (Figura 8). Para el sector de El Torín en isla Aguja la formación 1PN presentó una cobertura de A. palmata de 41,3 %, de macroalgas de 31,1 % y de otros corales de 19,2 %, esta última compuesta principalmente por las especies Pseudodiploria clivosa y P. strigosa.
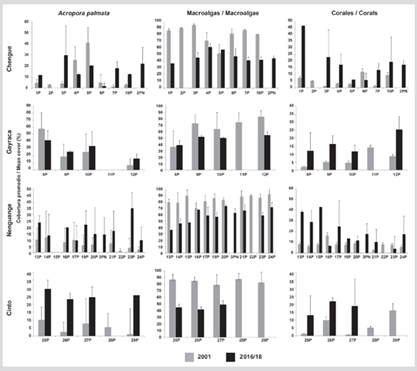
Figura 8 Cobertura promedio (%) + DE de los principales componentes del sustrato (A. palmata, macroalgas y otros corales) en el PNNT entre 2001 (Garzón-Ferreria et al., 2004) y 2016/18.
Estructura poblacional de Acropora palmata
Un total de 606 colonias fueron medidas. Las colonias > 10 000 cm2 representaron un 32,0 % de las colonias en todo el PNNT. En las bahías este porcentaje osciló entre 25,0 y 57,3 %, siendo isla Aguja donde se encontró la mayor proporción de colonias grandes. Colonias pequeñas (< 100 cm2) se encontraron en todas las bahías, a excepción de la bahía de Cinto (Figura 9). Hubo diferencias significativas en el tamaño de las colonias entre las diferentes bahías (Kruskal-Wallis H3= 30,2 P < 0,001) y la prueba de Dunn por pares mostró a isla Aguja y Cinto como los sitios en donde se encontraron las colonias de mayor tamaño, y a Nenguange, Gayraca y Chengue como similares, con colonias en todos los intervalos de talla (datos sin transformar; Figura 9).
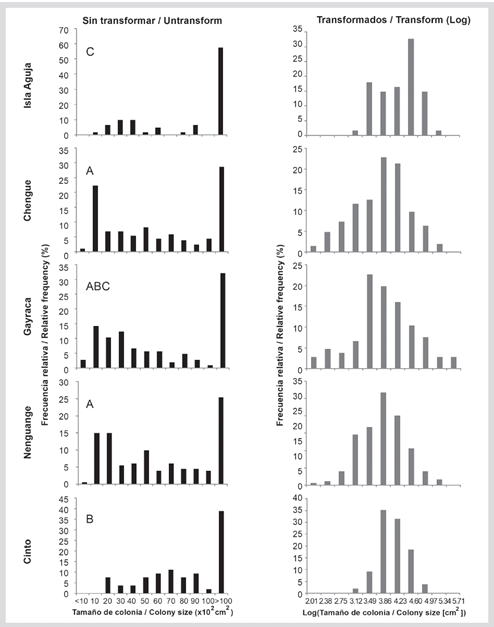
Figura 9 Distribución de frecuencias (%) de talla de Acropora palmata para los datos sin transformar y transformados a logaritmo en base 10 en las bahías del PNNT. Letras sobre datos sin transformar indican el resultado del análisis post hoc de Dunn de las tallas de colonias.
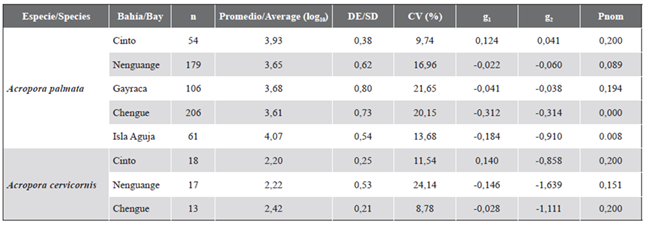
Los datos de tallas transformados logarítmicamente se distribuyeron en 11 intervalos de clase, entre 1,74 y 5,71 y estuvieron normalmente distribuidos en las bahías de Cinto, Nenguange y Gayraca. En Chengue e isla Aguja las tallas no mostraron una distribución normal (Tabla 1). Aunque se encontraron colonias grandes en todas las bahías, en isla Aguja y Gayraca se encontró el mayor porcentaje (16,3 y 13,2 %, respectivamente). Colonias pequeñas (i. e. en los tres primeros intervalos de clase) estuvieron presentes en Nenguange 1,7 %, Chengue 6,3 % y Gayraca 7,5 % y ausentes en Cinto e isla Aguja (Figura 9). El sesgo negativo fue dominante en todas las bahías con valores entre -0,022 y -0,312, indicando la predominancia de colonias grandes. Para la bahía de Cinto el sesgo fue positivo (0,124) aunque cercano al valor medio y con el menor coeficiente de variación (9,75 %), lo que se refleja en colonias de tamaño intermedio. La curtosis fue principalmente negativa a excepción de la bahía de Cinto (0,041). En el resto de las bahías el coeficiente de variación (CV) osciló entre 16,7 y 21,7 % (Tabla 1).
Tabla 1 Resumen estadístico de los datos de distribución de frecuencias de talla para las especies de Acropora en el PNNT. Convenciones: n = número de colonias. log10= valor promedio del tamaño de las colonias previa transformación a logaritmo. DE = desviación estándar. CV = coeficiente de variación. g1= sesgo. g2= curtosis. Pnom (prueba de Kolmogorov-Smirnov con ajuste de Lilliefors) = probabilidad de que los datos presenten una distribución normal.
Condición de Acropora palmate
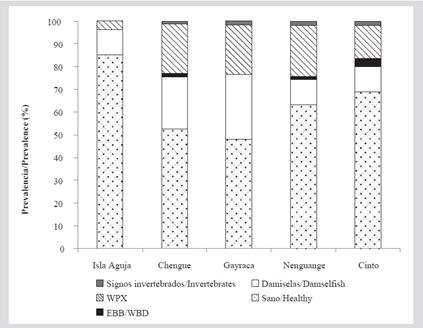
Se evaluó un total de 595 colonias, 58 % estaban sanas, 20 % con lesiones de WPX, 19 % con territorios de peces damisela y 3 % con signos de depredación por gusanos, caracoles y EBB. En isla Aguja se observó el mayor número de colonias sanas (85 %), siendo menor al interior de las bahías y oscilando entre 48 % en la bahía de Gayraca y 69 % en la bahía Chengue. Se observó igualmente una menor frecuencia de afectaciones en isla Aguja con 10 % de las colonias con territorios de damiselas y 3 % con WPX, mientras que en las cuatro bahías se observaron signos de depredación por invertebrados con baja frecuencia (entre 1,2 y 1,9 %). La EBB se observó en Chengue, Nenguange y Cinto con una frecuencia menor de 4 %, mientras que más de 10 % de las colonias presentaron territorios de damiselas y la enfermedad de WPX (Figura 10).
Cobertura de Acropora cervicornis
La cobertura promedio total de A. cervicornis del PNNT de las FAC previamente descritas más las formaciones adicionales ubicadas en las bahías de Chengue y Cinto fue de 8,0 ± 1,6 %. Las macroalgas cubrieron 39,1 ± 4,9 % y los corales 21,9 ± 5,0 % del sustrato (Figura 11). La única FAC en que se logró comparar la cobertura con respecto a 2001 fue en Nenguange (7C), donde se encontró una reducción de 69,6 % de A. cervicornis y de 51,2 % para las macroalgas, mientras en otros corales se encontró un incremento de 62 %, constituido por las especies Agaricia tenuifolia, Pseudodiploria strigosa, Madracis decactis, Millepora complanata, Montastraea cavernosa y Siderastrea siderea con más de 1 % de cobertura. En las otras dos FAC en Nenguange (6C y 9C) solo fueron reconocibles esqueletos muertos. Las formaciones nuevas para las bahías de Cinto y Chengue presentaron coberturas vivas de A. cerviconis de 9,6 y 9,4 % respectivamente, 19,9 y 24,0 % de otros corales y 49,7 y 31,2 % de macroalgas.
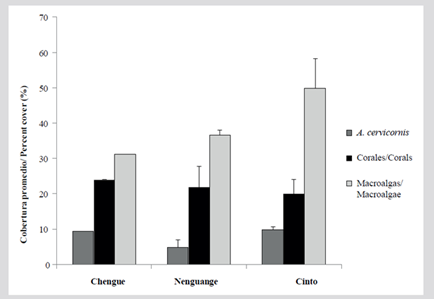
Figura 11 Cobertura relativa (%) de los principales componentes del sustrato: Acropora cervicornis, macroalgas y otros corales en las formaciones de A. cervicornis el PNNT.
Estructura poblacional de Acropora cervicornis
Solo 48 colonias fueron medidas, las cuales tuvieron tallas entre 23 y 890 cm2. La única FAC encontrada de las registradas por Garzón-Ferreira et al. (2004) fue la 7C en la bahía de Nenguange, principalmente compuesta por colonias de tamaño pequeño (47,0 %, n = 8); el resto fueron colonias grandes (53,0 %, n = 9). En esta bahía se ha estado desarrollando una iniciativa de restauración para esta especie; sin embargo, no se tuvieron en cuenta estas colonias por provenir de fragmentaciones y estar en proceso de trasplante. Las formaciones nuevas evidenciadas en Cinto y Chengue estuvieron constituidas por colonias grandes en Chengue, y por colonias con una distribución de tallas más amplia en Cinto (Figura 11). El análisis de Kruskal-Wallis no mostró diferencias significativas en el tamaño de las colonias entre bahías (H2= 3,43, P = 0,179).
Las tallas de las colonias transformadas logarítmicamente se distribuyeron en siete intervalos de clase, entre 1,36 y 3,04 y estuvieron normalmente distribuidos en las tres bahías (Tabla 1). Nenguange y Cinto tuvieron una amplia distribución de tallas, mientras que Chengue presentó colonias de talla intermedia (Figura 12). El sesgo negativo en Chengue y Nenguange con valores de g1 entre -0,028 y -0,146 indica la predominancia de colonias grandes. Para la bahía de Cinto el sesgo fue positivo (g1= 0,140), lo cual indica la predominancia de colonias pequeñas. El coeficiente de variación fue mayor en Nenguange (24,1 %) y menor en Chengue (8,8 %) y la curtosis presentó valores negativos en las tres bahías (Tabla 1).
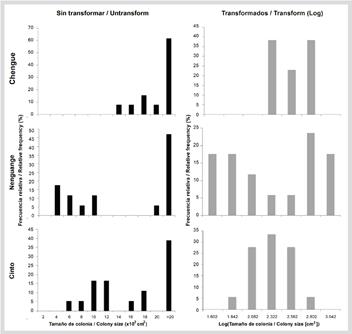
Figura 12 Distribución de frecuencias de talla de Acropora cervicornis para los datos sin transformar y transformados (Log10) en el PNNT.
Condición de Acropora cervicornis
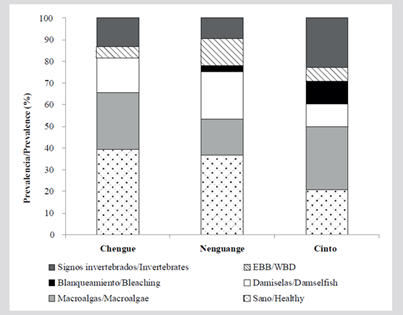
Un total de 159 colonias vivas fueron evaluadas en las bahías de Chengue (n = 38), Cinto (n = 48) y Nenguange (n = 73). De estas, 33 % se encontraron en buen estado de salud, 23 % presentaron macroalgas, 17 % tuvieron territorios de damisela y 14 % presentaron signos de depredación por invertebrados. Finalmente, 13 % de las colonias presentaron EBB o blanqueamiento. Por bahías, Cinto presentó el menor porcentaje de colonias en buen estado de salud (21 %), así como la mayor prevalencia de colonias con macroalgas (29 %) y con signos de depredación por invertebrados (23 %). La bahía de Nenguange fue la que presentó la mayor afectación de la EBB (12 %) y junto con Cinto presentaron blanqueamiento, pero este no se observó en Chengue (Figura 13).
DISCUSIÓN
La mortalidad de las especies de Acropora en todo el Caribe fue registrada desde el inicio de la década de 1980. A la fecha, pocos estudios han documentado la recuperación o pérdida progresiva de las poblaciones de estas especies. Por lo anterior, el estudio realizado por Garzón-Ferreira et al. (2004) se constituye en un referente que permite, en conjunto con este estudio, conocer de forma comparativa el cambio que han sufrido y el estado actual de las poblaciones de Acropora palmata y A. cervicornis en el PNNT.
Aunque la estimación de las áreas fue realizada con métodos distintos, la fotografía aérea permite estimar el área, y como cualquier método siempre existe un margen de error respecto al tamaño que realmente ocupa un ecosistema; sin embargo, se obtuvo una aproximación de las áreas potenciales de muy buena resolución, principalmente de las formaciones de A. palmata, al ser hábitats someros. Selgrath et al. (2016) recomiendan el uso de sensores remotos cuando se desea una mejor precisión. Además, Ekebom y Enkkilä (2003) mencionan cómo la resolución de imágenes aéreas provee información suficiente para una identificación confiable del hábitat. Para A. palmata,Garzón-Ferreira et al. (2004) registraron un área de 119 319 m2 y para A. cervicornis de 1200 m2; los datos en este estudio demuestran que estas formaciones han sufrido una reducción de 30 % y 99,3 %, respectivamente.
Aunque ha habido una reducción general del área ocupada por A. palmata, esta especie continúa cubriendo un área significativa en el PNNT. La reducción es debida a la disminución del tamaño de 14 formaciones y a que no se encontraron seis que fueron evaluadas en 2001 (Garzón-Ferreira et al., 2004). Sin embargo, nueve formaciones mostraron un aumento en su área, que sumado a la inclusión de la formación 20P en Nenguange (la cual no fue tenida en cuenta en 2001), y dos nuevas formaciones (una en Chengue y otra en isla Aguja), dan lugar a un área total de casi 85 000 m2 de A. palmata en el PNNT en comparación con los 119 319 m2 estimados en 2001 (Garzón-Ferreira et al., 2004). Si bien en algunas FAP individuales se encontró una reducción de la cobertura, la tendencia en la mayoría de las formaciones fue de aumento, con una cobertura general de 17,0 % en 2001, a casi 20,0 % en este estudio. Así mismo, las macroalgas que cubrían 80 % del sustrato pasaron a 50 %. Vega-Sequeda et al. (2008) registraron igualmente menores coberturas de macroalgas: 32,4 % en Gayraca y 67,4 % en Cinto. Los corales aumentaron en 12,8 % con respecto a lo reportado por Garzón-Ferreira (2004), y su composición, teniendo en cuenta las especies con mayor cobertura, ha permanecido estable debido a que tanto M. complanata (3,5 y 7,9 %), S. siderea (2,5 y 5,0 %) y P. strigosa (1,2 y 8,6 %) siguen siendo las especies que permanecen como los principales componentes de las FAP. Sin embargo, se hubiese esperado que M. complanata, al tener cortos periodos larvales (Lewis, 1989), o Porites astreoides, con una estrategia de autofertilización (Doropoulus et al., 2015), hubiesen continuado colonizando el sustrato disponible, tal como ha sido visto en crestas arrecifales de Cuba (Caballero-Aragón, 2020), pero en el PNNT ambas especies se han reducido.
La frecuencia de colonias de tamaño grande (> 10 000 cm2) de A. palmata en el PNNT entre 25,0 y 57,3 % es alta en comparación con otros estudios que han abordado la distribución de frecuencias de talla a nivel regional. Esto es muy importante, teniendo en cuenta que la estructura tridimensional de las colonias de esta especie aporta complejidad y funcionalidad ecológica al ecosistema. Por ejemplo, es de esperarse que estas colonias tengan un alto potencial reproductivo, ya que ellas son fértiles a partir de 1000 cm2 (Soong y Lang, 1992), y en el PNNT 79,8 % tuvieron tallas mayores a 1000 cm2. A pesar de que distinguir nuevos reclutas es difícil, se observaron colonias pequeñas colonizando espacios disponibles. Además, la distribución normal de los datos transformados a logaritmo y las variables de asimetría y curtosis negativo, también dan cuenta de un buen estado de la población, con una posible transición de clases de talla más rápida como resultado de su rápido crecimiento. Knowlton (2001) menciona que, para que una población pueda recuperarse, necesita estar dominada por colonias sanas y caracterizadas por una amplia distribución de frecuencia de tallas como fue la tendencia encontrada en este estudio.
El resultado de tallas grandes igualmente puede obedecer al régimen de perturbación a los cuales están sometidos los arrecifes. Gardner et al. (2005), quienes modelaron la información de 286 arrecifes a lo largo del Caribe entre 1980 y 2001, encontraron cómo 177 sitios experimentaron el impacto de huracanes con una reducción de cobertura en promedio de 17 %. Lo anterior conlleva a la fragmentación de colonias y a la generación de colonias pequeñas. Vardi et al. (2012) valoraron entre 2004 y 2010 las poblaciones de A. palmata en los cayos de la Florida observando la reducción en la cobertura, colonias de tallas entre 100 y 900 cm2 (≈ 32 %) y dominancia de colonias pequeñas de < 100 cm2 (56 %). Si bien es muy infrecuente el paso de huracanes por la costa continental del Caribe colombiano (Ortíz-Royero, 2007), en Santa Marta sí se han dado coletazos de huracanes como Matthew en octubre de 2016. Aunque este generó el rompimiento de colonias, tal como fue observado en isla Aguja, no existían datos de cobertura ni de la distribución de frecuencia de tallas que permitieran evaluar los efectos de este evento. Sin embargo, los datos de este estudio muestran la resiliencia de esta población de A. palmata, ya que la valoración en 2018 da cuenta de colonias de gran tamaño y una pronta recuperación.
En cuanto a la condición de las poblaciones de A. palmata, se destaca su afectación por los depredadores comunes descritos para la especie en el Caribe (Knowlton et al., 1990). Aunque las formaciones presentan un buen estado de salud, una importante proporción de colonias presentan el establecimiento de territorios de peces damisela (Stegastes spp.), evidenciado por las lesiones en forma de ″chimeneas″ sobre la superficie del tejido coralino (Kramer et al., 2008). Según Ceccarelli et al. (2005), esto puede ser negativo, dado que los peces territoriales (damiselas) excluyen a los peces herbívoros ramoneadores, y en su ausencia incrementa la biomasa de macroalgas con una consecuente disminución del tejido coralino. Aunque este estudio mostró una menor cobertura de macroalgas, es recomendable seguir adelantando estudios que evalúen este efecto en las FAP del PNNT.
La enfermedad de WPX se ha postulado como una de las principales causas de la pérdida poblacional de Acropora en el Caribe (Bruckner y Bruckner, 1997; Rodríguez-Martínez et al., 2001; Patterson et al., 2002). En el PNNT varias colonias presentaron la enfermedad; sin embargo, estas lesiones afectaron < 10 % del tejido coralino vivo, y durante el estudio se observó su reducción y en algunos casos su desaparición, lo cual coincide con Rogers y Muller (2012) quienes observaron cómo A. palmata se recupera de lesiones de WPX en un tiempo de 1,7 meses. Las colonias del PNNT están influenciadas por la disminución de la temperatura en la época de surgencia entre los meses de diciembre a abril (Bayraktarov et al., 2014b) y como proponen Muller y van Woesik (2014), la severidad, frecuencia, y recuperación de esta patología se encuentra relacionada con anomalías térmicas, lo que plantea un escenario favorable, puesto que estos descensos de temperatura pueden otorgarle una ventaja en la salud poblacional.
En contraste con A. palmata, la situación es evidentemente grave para A. cervicornis. Para esta especie, aunque se habían registrado 12 formaciones y no todas con cobertura viva, el criterio para su definición estuvo dado por la presencia de esqueletos reconocibles. A la fecha, solo se logró establecer una formación de este tipo con una reducción en área de 83 %. A pesar de ello, se ubicaron dos formaciones distintas en la bahía de Cinto y la presencia de colonias aisladas en Chengue. En Nenguange se llevan a cabo iniciativas por la Unidad de Parques Nacionales Naturales de Colombia a fin de repoblar la especie; sin embargo, se requieren registros de supervivencia que provean información sobre el éxito del programa. La reducción en cobertura fue también significativa. El único sitio en el que se cuantificó fue en Nenguange, que pasó de 40,5 % (Garzón-Ferreira et al., 2004) a 4,8 %, mientras que las formaciones nuevas en Chengue y Cinto no alcanzaron 10 %. La tendencia de reducción de macroalgas y aumento de corales fue similar a lo descrito en A. palmata y estas formaciones estuvieron además compuestas por M. complanata, Orbicella annularis, Colpophillia natans, Diploria labyrinthiformis y P. strigosa, siendo especies comúnmente presentes en las formaciones evaluadas por Garzón-Ferreira et al. (2004).
El número de colonias encontrado fue reducido en las tres bahías donde se encontró A. cervicornis, representada por colonias grandes y sin evidencia de reclutas. En general, para todo el Caribe, esta especie ha mostrado signos de mayor deterioro y se han evidenciado pérdidas importantes por eventos de blanqueamiento y enfermedades. En la región de Santa Marta, Rodríguez-Ramírez et al. (2008) en el PNNT en 2003 mencionaron una incidencia de blanqueamiento de 2,9 % y en la bahía de Chengue el Sistema Nacional de Monitoreo de Arrecifes de Coral (SIMAC) en 2010 registró cerca de 18 % de corales blanqueados. Se ha atribuido a la temperatura como la principal causa de deterioro; sin embargo, Romero-Rodríguez et al. (2014) incorporaron diferentes variables ambientales en series de datos entre 1998 y 2010, y encontraron que además de la temperatura, las descargas continentales influyen en el blanqueamiento. Para 2005 (entre septiembre y noviembre) y 2010 (agosto, noviembre y diciembre), se registró blanqueamiento. Si bien no hay evidencia del deterioro de la especie en 2005, las series de tiempo muestran cómo una formación en buen estado en 2009 pasó en 2010 a presentar blanqueamiento y en abril de 2011 a prácticamente desaparecer. Estos registros son una evidencia del deterioro, sin embargo, son muchos más los efectos combinados que han llevado a la reducción de las poblaciones.
Cuando se evaluó la condición de A. cervicornis, el promedio de colonias con territorios de Stegastes spp. fue de 17 % y con macroalgas 22 %. Esto puede ser resultado del comportamiento de territorialidad de los peces damisela, que excluye a los herbívoros arrecifales ramoneadores (Ceccarelli et al., 2005), y que resulta en un incremento de macroalgas (Hoey y Bellwood, 2010). Mejía-Niño y Garzón-Ferrerira (2003) ya mostraban en el PNNT cómo de las interacciones evaluadas alga-coral predominaban algas frondosas que ocasionaban daños físicos por abrasión; sin embargo, no hay evaluaciones directas al respecto que puedan dar indicios si estas interacciones están en las causas que han comprometido estas poblaciones. Al respecto, Schopmeyer y Lirman (2015) documentaron la prevalencia de los peces damisela y los efectos negativos de los céspedes algales en A. cervicornis a lo largo de los cayos de Florida. Los resultados mostraron cómo la ocupación por los peces fue la principal causa de mortalidad (34,6 %) en aquellas colonias evaluadas con signos de estrés, comparado con enfermedades (1,6 %), recubrimiento de algas/esponjas (5,6 %) o depredación por invertebrados coralívoros (7,9 %). La presencia del caracol Coralliophilia erosa y otros invertebrados, así como las lesiones derivadas, fueron evidentes en este estudio (14,5 %) y aunque Schopmeyer y Lirman (2015) obtuvieron resultados similares y sugieren que la disminución de la depredación de caracoles se debe a la presencia de peces damisela, es necesario evaluar esto a mediano y largo plazo para obtener evidencias sobre el impacto en la salud poblacional. Los depredadores reportados contribuyen al deterioro poblacional de A. cervicornis que, sumado a su baja cobertura, demuestra la crítica condición de esta especie en el PNNT.
En general, aunque la EBB no fue una condición tan evidente; su manifestación puede deberse al incremento en patógenos que puedan estar albergados en las macroalgas como lo demuestran Sweet et al. (2013). Esos autores sugieren que algas y corales hospedan grupos procariotas diferentes y que dentro del microbioma de las algas residen grupos potencialmente patógenos para corales. Sin embargo, Nugues et al. (2004) mencionan que debe haber un estrés físico como requisito previo para que exista una transmisión de patógenos entre alga y coral. Durante este estudio no se registró la temperatura, y debido a que el área del PNNT está sujeta a la dinámica estacional de surgencia de aguas relativamente frías (Bayraktarov et al., 2014b), se requiere la medición periódica de algunas variables que, para el caso crítico de A. cervicornis, puedan tenerse en cuenta en los programas de restauración y permitan tomar decisiones que puedan ayudar a su mantenimiento.
AGRADECIMIENTOS
Este trabajo fue financiado por Colciencias (código 11177141011) y la Universidad del Magdalena en el marco del proyecto ″Acropora: género clave para la conservación. Diversidad genética, conectividad y actualización de sus poblaciones en el Caribe colombiano″. Los autores agradecen a la Unidad de Parques Nacionales Naturales de Colombia (permiso 001 del 6 de marzo de 2017) y al grupo de investigación Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos.
REFERENCIAS
Adjeroud, M., M.S. Pratchett, M.C. Kospartov, C., Lejeusne, and Penin ,L. 2007. Small-scale variability in the size structure of scleractinian corals around Moorea, French Polynesia: patterns across depths and locations. Hydrobiologia., 589: 117-12. [ Links ]
Anderson, K.D and M.S., Pratchett. 2014. Variation in size-frequency distributions of branching corals between a tropical versus sub-tropical reef. Mar. Ecol. Prog. Ser., 502: 117-128. [ Links ]
Andrade, C.A., E.D., Barton, and C.N.K., Mooers. 2003. Evidence for an eastward flow along the Central and South American Caribbean Coast. J. Geophys. Res., 108(C6): 3185. https://doi.org/10.1029/2002JC001549 [ Links ]
Ardila, N., G.R., Navas y J., Reyes. 2002. Libro rojo de invertebrados marinos de Colombia. Invemar y Ministerio del Medio Ambiente, Bogotá. 180 p. [ Links ]
Aronson, R.B. and W.F., Precht. 2001. White-band disease and the and the changing face of Caribbean coral reefs. Hydrobiología., 460: 25-38. [ Links ]
Aronson, R.B., A.W. Bruckner, J. Moore, W.F. Precht, and E. Weil. 2008a . IUCN Red List of Threatened Species: Acropora palmata. www.iucnredlist.org. 20/01/2020. [ Links ]
Aronson, R.B., A.W. Bruckner, J. Moore, W.F. Precht y E. Weil. 2008b. IUCN Red List of Threatened Species: Acropora cervicornis. www.iucnredlist.org.20/01/2020. [ Links ]
Bak, R.P.M. and E.H. Meesters. 1998. Coral population structure: the hidden information of colony size-frequency distributions. Mar. Ecol. Prog. Ser., 162: 301-306. [ Links ]
Bayraktarov, E., V. Pizarro, and C. Wild. 2014a. Spatial and temporal variability of water quality in the coral reefs of Tayrona National Natural Park, Colombian Caribbean. Environ. Monit. Assess., 186(6): 3641-3659. [ Links ]
Bayraktarov, E., M.L. Bastidas-Salamanca, and C. Wild. 2014b. The physical environment in coral reefs of the Tayrona National Natural Park (Colombian Caribbean) in response to seasonal upwelling. Bol. Invest. Mar. Cost., 43(1): 137-157. [ Links ]
Bruckner, A. and R. Bruckner. 1997. Outbreak of coral disease in Puerto Rico. Coral Reefs., 16: 260. [ Links ]
Buddemeier, R., J. Kleypas, and B. Aronson. 2004. Coral reefs and global climate change. Potential contributions of climate change to stresses on Coral Reefs Ecosystems. Pew Center of Global Climate Change, 15(3): 44 p. [ Links ]
Caballero-Aragón, H., S. Perera-Valderrama, N. Rey-Villiers, J. González-Méndez, and M. Armenteros. 2020. Population status of Acropora palmata (Lamarck,1816) in Cuban coral reefs. Reg. Stud. Mar. Sci., 34. https://doi.org/10.1016/j.rsma.2019.101029 [ Links ]
Ceccarelli, D., G. Jones, and L. McCook. 2005. Foragers versus farmers. Contrasting effects of two behavioural groups of herbivores on coral reefs. Oecologia., 145: 445-453. [ Links ]
Cendales M.H., S. Zea y J.M. Díaz. 2002. Geomorfología y unidades ecológicas del complejo de arrecifes de las islas del Rosario e isla Barú (mar Caribe, Colombia). Rev. Acad. Colomb. Cien., 26(101): 497-510. [ Links ]
Crabbe, M.J.C. 2009. Scleractinian coral population size structures and growth rates indicate coral resilience on the fringing reefs of North Jamaica. Mar. Env. Res., 67: 189-198. [ Links ]
Croquer, A., F. Cavada-Blanco, A.L. Zubillaga, E.A. Agudo-Adriani, and M. Sweet. 2016. Is Acropora palmata recovering? A case study in Los Roques National Park, Venezuela. Peer J., 4: e1539. https://doi.org/10.7717/peerj.1539 [ Links ]
Díaz, J.M., J. Garzón-Ferreira y, S. Zea . 1995. Los arrecifes coralinos de la Isla de San Andrés, Colombia: estado actual y perspectivas para su conservación. Acad. Colomb. Cienc. Exac. Fís. Nat., Colec. Jorge Álvarez Lleras, 7: 150 p. [ Links ]
Díaz, J.M, L.M. Barrios, M. Cendales, J., Garzón-Ferreira, J. Geister, M. López-Victoria, G. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Ser. Publ. Espec. Invemar, (5): 176 p. [ Links ]
Ekebom, J. and A. Enkkilä. 2003. Using aerial photography for identification of marine and coastal habitats under the EU′s habitats directive. Aquat. Conser: Mar. Fresh. Eco., 13: 287-304. doi:10.1002/aqc.553 [ Links ]
Garzón-Ferreira, J. 1997. Arrecifes coralinos: un tesoro camino a la extinción? Colombia: Ciencia y Tecnología, 15(1): 11-19. [ Links ]
Garzón-Ferreira, J. y M. Cano. 1991. Tipos, distribución, extensión y estado de conservación de los ecosistemas marinos costeros del Parque Nacional Natural Tayrona. Séptimo Concurso Nacional de Ecología. Fondo para la Protección del Medio Ambiente, Bogotá. 82 p. [ Links ]
Garzón-Ferreira, J. and J.M. Díaz. 2003. The Caribbean coral reefs of Colombia. 275-301. En J. Cortés (Ed.), Latin American coral reefs. Amsterdam: Elsevier. [ Links ]
Garzón-Ferreira, J., M. Moreno-Bonilla y J.M. Valderrama. 2004. Condición actual de las formaciones coralinas de Acropora palmata y A. cervicornis en el Parque Nacional Natural Tayrona (Colombia). Bol. Invest. Mar. Cost., 33: 117-136. [ Links ]
Gladfelter, W. 1982. White band disease in Acropora palmata: implications for the structure and growth of shallow reefs. Bull. Mar. Sci., 32: 639-643. [ Links ]
Hall, V.R. and T.P. Hughes. 1996. Reproductive strategies of modular organisms: comparative studies of reef-building corals. Ecology., 77: 950-963. [ Links ]
Hoegh-Guldberg, O. 1999. Climate change, coral bleaching and the future of the world′s coral reefs. Mar. Fresh. Res., 50: 839-866. [ Links ]
Hoey, A.S and D.R. Bellwood. 2010. Damselfish territories as a refuge for macroalgae on coral reefs. Coral Reefs, 29: 107-118. [ Links ]
Hughes, T.P. and J.B.C. Jackson. 1985. Population dynamics and life histories of foliaceous corals. Ecol. Monogr., 55: 141-166. [ Links ]
Hughes, T.P and J.H. Connell. 1999. Multiple stressors on coral reefs: a long-term perspective. Limnol. Oceanogr., 44: 932-940. [ Links ]
Hughes, T.P., D. Ayre, and J.H. Connell. 1992. The evolutionary ecology of corals. Trends. Ecol. Evol., 7: 292-295. [ Links ]
Knowlton, N. 2001. The future of coral reefs. Proc. Nat. Acad. Sci., 5419-5428. [ Links ]
Knowlton, N., J. Lang, and B. Keller. 1990. Case study of natural population collapse: Post-hurricane predation on Jamaican staghorn coral. Smithson. Contrib. Mar. Sci. 1-25. https://doi.org/10.5479/si.01960768.31.1 [ Links ]
Kohler, K.E. and S.M. Gill. 2006. Coral Point Count with Excel extensions (CPCe): a Visual Basic program for the determination of coral and substrate coverage using random point count methodology. Comp. Geos., 32: 1259-1269. [ Links ]
Kramer, K., D. Williams, M. Miller, C. Begin, J. Fry, and A. Valdivia. 2008. Demographic comparison of the threatened Elkhorn coral, Acropora palmata, in the Caribbean: a case study in successful volunteer partnerships in a regional-scale monitoring program. 765-769. Proc. 11th Int. Coral Reef. Symp., Florida. [ Links ]
Larson, E.A., D.S. Gilliam, M. Lόpez Padierna, and B.K. Walker. 2014. Possible recovery of Acropora palmata (Scleractinia: Acroporidae) within the Veracruz Reef System, Gulf of Mexico: a survey of 24 reefs to assess the benthic communities. Rev. Biol. Trop., 62(3): 75-84. [ Links ]
Lewis, J.B. 1989. The ecology of Millepora. A review. Coral Reefs, 8: 99-107. [ Links ]
Linares, C., M.S. Pratchett, and D.J. Coker. 2011. Recolonisation of Acropora hyacinthus following climate-induced coral bleaching on the Great Barrier Reef. Mar. Ecol. Prog. Ser., 438: 97-104. [ Links ]
López-Victoria, M. y J.M. Díaz. 2000. Morfología y estructura de las formaciones coralinas del archipiélago de San Bernardo, Caribe colombiano. Rev. Acad. Colomb. Cienc., 24(91): 219-230. [ Links ]
Meesters, E.H., M. Hilterman, E. Kardinaal, M. Keetman, M. de Vries y R.P.M. Bak. 2001. Colony size-frequency distributions of scleractinian coral populations: spatial and interspecific variation. Mar. Ecol. Prog. Ser., 209: 43-54. [ Links ]
Mejía-Niño, N. y J. Garzón-Ferreira. 2003. Dinámica de las interacciones alga-coral en dos bahías de la región de Santa Marta (Caribe colombiano) con distinto grado de influencia antropogénica. Bol. Invest. Mar. Cost., 32: 243-261. [ Links ]
Muller, E. y R. Van Woesik. 2014. Genetic susceptibility, colony size, and water temperature drive white-pox disease on the coral Acropora palmata. PLoS ONE., 9(11): e110759. [ Links ]
Navas-Camacho, R., D.L. Gil-Agudelo, A. Rodríguez-Ramírez, M.C. Reyes-Nivia y J. Garzón-Ferreira. 2010. Coral diseases and bleaching on Colombian Caribbean coral reefs. Rev Biol Trop., 58(1): 95-106. [ Links ]
Nugues, M., G. Smith, R. van Hooidonk, M. Seabra y R. Bak. 2004. Algal contact as a trigger for coral disease. Ecol. Lett., 7: 919-923. [ Links ]
Ortíz-Royero, J.C. 2007. Huracanes y tormentas tropicales en el mar Caribe colombiano desde 1900. Bol. Cient. CIOH., 25: 54-60. [ Links ]
Patterson, K., J. Porter, K. Ritchie, S. Polson, E. Mueller, E. Peters, D. Santavy, and G. Smith. 2002. The etiology of white pox, a lethal disease of the Caribbean elkhorn coral, Acropora palmata. Ecology, 99(13): 8725-8730. [ Links ]
Porter, J.W., P. Dustan, W.C. Jaap, K.L. Patterson, V. Kosmynin, O.W. Meier, M.E. Patterson, and M. Parsons. 2001. Patterns of spread of coral disease in the Florida Keys. 1-24. In: Porter, J. (Ed.). The ecology and etiology of newly emerging marine diseases. Netherlands: Springer. [ Links ]
Rodríguez-Martínez, R.E., A. Banaszak, and E. Jordan-Dahlgren. 2001. Necrotic patches affect Acropora palmata (Scleractinia: Acroporidae) in the mexican Caribbean. Dis. Aq. Org., 47: 229-234. [ Links ]
Rodríguez-Martínez, R.E., A. Banaszak, M.D. McField, A.U. Beltrán-Torres, and L. Álvarez-Filip. 2014. Assessment of Acropora palmata in the Mesoamerican Reef System. PloS ONE, 9: e96140. https://doi.org/10.1371/journal.pone.0096140 [ Links ]
Rodríguez-Ramírez, A., C. Bastidas, S. Rodríguez, Z. Leão, R. Kikuchi, M. Oliveira, D.L. Gil, J. Garzón-Ferreira, M.C. Reyes-Nivia, R. Navas-Camacho, N. Santodomingo, G. Díaz-Pulido, D. Venera-Ponton, L. Flórez-Leiva, A. Rangel-Campo, C. Orozco, J.C. Márquez, S. Zea, M. López-Victoria, J.A. Sánchez, and M.C. Hurtado. 2008. The effects of coral bleaching in the Southern Tropical America: Brazil, Colombia, and Venezuela. 105-114. En: Wilkinson, C and D., Souter (Eds.). Status of Caribbean Coral Reefs after bleaching and hurricanes in 2005. Global Coral Reef Monitoring Network and Reef and Rainforest Research Centre, Townswille. 152 p. [ Links ]
Rogers, C.S and E.M. Muller. 2012. Bleaching, disease and recovery in the threatened scleractinian coral Acropora palmata in St. John, US Virgin Islands: 2003-2010. Coral Reefs., 31: 807-819. [ Links ]
Romero-Rodríguez, D., G. Bernal y S. Zea. 2014. Variables ambientales durante blanqueamiento coralino en el Caribe colombiano. Rev. Acad. Colomb. Cienc., 38(149): 347-355. [ Links ]
Schopmeyer, S. and D. Lirman. 2015. Occupation dynamics and impacts of damselfish territoriality on recovering populations of the threatened staghorn coral, Acropora cervicornis. PLoS ONE., 10(11): e0141302. [ Links ]
Selgrath, J. C., C. Roelfsema, S.E. Gergel y A.C.J. Vincent. 2016. Mapping for coral reef conservation: Comparing the value of participatory and remote sensing approaches. Ecosphere., 7: 1-17. https://doi.org/10.1002/ecs2.1325 [ Links ]
Soong, K. 1993. Colony size as a species character in massive reef corals. Coral Reefs., 12: 77-83. [ Links ]
Soong, K. and J.C., Lang. 1992. Reproductive integration in reef corals. Biol. Bull., 183: 418-431. [ Links ]
Sweet, M., J. Bythell, and M. Nugues. 2013. Algae as reservoirs for coral pathogens. PLoS ONE., 8(7): e69717. [ Links ]
Vega-Sequeda, J., A. Rodríguez-Ramírez, M.C. Reyes-Nivia y R. Navas-Camacho. 2008. Formaciones coralinas del área de Santa Marta: estado y patrones de distribución espacial de la comunidad béntica. Bol. Invest. Mar. Cost., 37: 87-105. [ Links ]
Vermeij, M.J.A and R.B. Bak. 2003. Species-specific populations structure of closely related coral morphospecies along a depth gradient (5-60 m) over a Caribbean reef slope. Bull. Mar. Sci., 73: 725-744. [ Links ]
Wirt, K.E., P. Hallock, D. Palandro, and K.L. Daly. 2013. Potential habitat of Acropora spp. on Florida reefs. Ap. Geog., 39: 118-127. [ Links ]
Wirt, K.E., P. Hallock, D. Palandro, K.D. Semon, and K. Lunz. 2015. Potential Habitat of Acropora spp. on Reefs of Florida, Puerto Rico, and the US Virgin Islands. Glob. Ecol. Conserv., 3: 242-255. [ Links ]
Yap, H.T., P.M. Aliño, and E.D. Gómez. 1992. Trends in growth and mortality of three coral species (Anthozoa: Scleractinia), including effects of transplantation. Mar. Ecol. Prog. Ser., 83: 91-101. [ Links ]
Material suplementario 2 Cobertura promedio y desviación estándar (DE) de los componentes principales del sustrato y especies de coral asociadas a las formaciones de Acropora palmata en el Parque Nacional Natural Tayrona e isla Aguja (sector del Torín) (2016-2018). Valores en negrilla resaltan las coberturas más altas.
Recibido: 27 de Julio de 2020; Aprobado: 01 de Noviembre de 2020











 text in
text in