Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.18 no.2 Bogotá July/Dec. 2016
https://doi.org/10.15446/rev.colomb.biote.v18n2.47678
DOI: http://dx.doi.org/10.15446/rev.colomb.biote.v18n2.47678
ARTÍCULO DE INVESTIGACIÓN
Cuantificación de bacterias diazótrofas aisladas de suelos cacaoteros (Theobroma cacao L.), por la técnica de Número Más Probable (NMP)
Quantification of diazotrophs bacteria isolated from cocoa soils (Theobroma cacao L.), by the technique of Most Probable Number (MPN)
Adriana Zulay Argüello-Navarro*, Niccolay Madiedo Soler**, Laura Yolima Moreno-Rozo***
* MSc. Agronomía. Profesor Ocasional. Departamento Medio Ambiente. Grupo de investigación en Ciencias Biológicas - Majumba. Universidad Francisco de Paula Santander. Cúcuta, Norte de Santander, Colombia. E-mail de correspondencia:
adrianaarguello@ufps.edu.co
** Ing. Biotecnológico. Semillero de Investigación en Biotecnología Aplicada - Seiba. Universidad Francisco de Paula Santander. Cúcuta, Norte de Santander, Colombia. E-mail:
niccolaymadiedosoler4@gmail.com
*** Ph.D. En Educación. Profesor Titular. Departamento de Ciencias Básicas. Grupo de investigación en Ciencias Biológicas - Majumba. Universidad Francisco de Paula Santander. Cúcuta, Norte de Santander, Colombia. E-mail:
laurayolimamr@ufps.edu.co
Recibido: marzo 16 de 2016 Aprobado: octubre 22 de 2016
Resumen
Esta investigación tuvo como objetivo cuantificar bacterias diazótrofas y comparar fisicoquímicamente suelos rizosféricos de tres cacaotales (Theobroma cacao L.) del Departamento Norte de Santander, Colombia; para lo cual se caracterizaron, diferenciándose en área cultivada, manejo agronómico y edad del cultivo. A partir de diluciones seriadas de las muestras y empleando la técnica de Número Más Probable (NMP), en medios de cultivo semiselectivos (NFb, JMV, LGI, JNFb) semisólidos, se cuantificaron las diazótrofas, evaluando como positivo la formación de una película subsuperficial en el medio contenido en viales sellados; muestras pares se enviaron al laboratorio Bioambiental (UNET) para los análisis fisicoquímicos. Como resultado, las muestras evaluadas mostraron deficiencias en el porcentaje de materia orgánica y elementos como Potasio, Fósforo y Magnesio. Se reportaron estadísticamente diferencias altamente significativas en NMP. La mayor cuantificación de diazótrofas se reportó en la finca Florilandia, que se caracterizó por tener riego por goteo. La mayor cuantificación de diazotrófas se registró en los medios NFb y JMV, demostrándose una mayor presencia de los presuntos géneros Azospirillum sp. y Burkholderia sp. los cuales son fácilmente aislados de suelos rizosféricos, a diferencia de los géneros Herbaspirillum sp. y Gluconacetobacter sp. que por su carácter endófito suelen ser menos predominantes en este tipo de muestras. Se concluye además, que las características fisicoquímicas del suelo, la humedad y las relaciones climáticas al momento de la toma de las muestras, condicionan la cantidad de exudados de las raíces y por tanto son factores que condicionaron la presencia de diazótrofas en las muestras.
Palabras clave: Azospirillum, Burkholderia, cacao, rizósfera.
Abstract
The objective of this research was to quantify diazotrophic bacteria and compare physicochemically rhizospheric soils of three cocoa plantations (Theobroma cacao L.) in Norte de Santander Department, Colombia; for which they were characterized, differing in cultivated area, agronomic management and crop age. From serial dilutions of the samples and using the technique of Most Probable Number (MPN), In semisolid culture media (NFb, JMV, LGI, JNFb), the diazotrophs were quantified, evaluating as positive the formation of a subsurface film in the medium contained in sealed vials; equal samples were sent to the Bioambiental laboratory (UNET) for physicochemical analyzes. As a result, the evaluated samples showed deficiencies in the percentage of organic matter and elements such as Potassium, Phosphorus and Magnesium. Statistically highly significant differences in MPN were reported. The highest quantification of diazotrophs was reported in the Florilandia farm, which was characterized by drip irrigation. The highest quantification of diazotrophs was recorded in the media NFb and JMV, demonstrating a greater presence of the presumed genera Azospirillum sp. and Burkholderia sp. which are easily isolated from rhizospheric soils, unlike the genera Herbaspirillum sp. and Gluconacetobacter sp. which by their endophytic character tend to be less predominant in this type of samples. It is also concluded that the physicochemical characteristics of the soil, humidity and climatic relationships at the moment of sampling, condition the amount of root exudates and therefore are factors that conditioned the presence of diazotrophs in the samples.
Keywords: Azospirillum, Burkholderia, cocoa, rhizosphere.
Introducción
El cacao (Theobroma cacao L.), es un árbol nativo de las regiones tropicales húmedas de Suramérica (Motamayor et al., 2002); es un cultivo perenne de cuyos frutos llamados mazorcas, se extraen los granos o semillas que son ricos en nutrientes y grasas que se utilizan para la fabricación de diversos productos agroindustriales, llegando a ser uno de los cultivos de mayor importancia socioeconómica en Colombia, debido a que aporta más de 71 millones de dólares al producto interno bruto del país y genera trabajo para el sostenimiento de más de 24 mil hogares colombianos (Pinzón et al., 2009).
En muchas regiones incluyendo Norte de Santander; dada la necesidad de una mayor producción con el uso de suelos poco fértiles y con altos requerimientos nutricionales para la agricultura, se ha aumentado el uso de fertilizantes químicos con el fin de proveer al suelo de elementos necesarios como Nitrógeno (N), Fosforo (P) y Potasio (K), esenciales para el desarrollo óptimo de las plantas (Uribe et al., 2000); no considerándose, que el uso continuo y cada vez mayor de este tipo de fertilizantes y de otros productos empleados sin la correcta dosificación, da como resultado la acidificación y erosión de los suelos, la alteración de sus propiedades físicas y químicas, y la destrucción de la vida microbiana presente en él, alterando procesos microscópicos que ayudan a mejorar la calidad del suelo y de los cultivos (Rodríguez & López, 2009).
De ahí, que el objeto de esta investigación consistió en cuantificar las poblaciones de bacterias fijadoras de Nitrógeno (diazótrofas), aisladas de muestras compuestas de tres suelos rizosféricos de cacao y compararlos fisicoquímicamente; dado que la actividad microbiana de la rizósfera en gran medida, es responsable del funcionamiento del ecosistema y de la fertilidad de los suelos agrícolas (Jaizme-Vega & Rodríguez-Romero, 2008).
El mejoramiento del desarrollo y nutrición de la planta y el aumento de la tolerancia de los cultivos frente al estrés, son algunos de los beneficios que las bacterias rizosféricas presentes en los cultivos, pueden aportarle a la agricultura (Compant et al., 2010). Este tipo de bacterias, aseguran la sostenibilidad de los cultivos contribuyendo a mejorar la calidad del suelo, limitar el aporte de nutrientes e incrementar los rendimientos en producción (Hernández et al., 2006).
Las bacterias diazotrófas son de gran importancia agrícola como intermediarios en el proceso de fijación biológica del nitrógeno, reduciendo el nitrógeno atmosférico no asimilable por las plantas a amonio, ayudando así a suplir carencias de este elemento en los cultivos (Vallejo et al., 2008). El N tiene la capacidad de aumentar la fertilidad del suelo mediante la formación de humus, que posee la facultad de almacenar N, disminuir la pérdida de K, Ca y Mg, y al mismo tiempo mantiene la humedad del suelo, mejorando los procesos biológicos desarrollados en él (Mayz-Figueroa, 2004).
Dado que el crecimiento y la buena producción del cultivo de cacao dependen en gran medida de la existencia de buenas condiciones físicas y químicas del suelo, descriptivamente se realizó la caracterización de los cultivos de cacao seleccionados, mediante previa encuesta realizada a los propietarios; además, y por el método de investigación experimental, se tomaron muestras compuestas de suelo rizosférico para el análisis de las características físicas y nutricionales; y a partir de muestras pares se realizó la cuantificación de diazótrofas por la técnica de número más probable (NMP), la cual da una estimación realista de un organismo estudio, al señalar su presencia o ausencia en las réplicas y en la dilución más alta posible, lo que demuestra en los resultados, el cálculo de la población presente en una muestra (Ranganayaki et al., 2006, Soares et al., 2006).
Con los resultados obtenidos se concluyó que aunque los cultivos se ubican en una misma zona, estos difieren en cuanto a manejo agronómico, nivel de producción, propiedades físicas y químicas de los suelos, reportando condiciones moderadamente aptas para el cultivo, según los requerimientos eco-fisiológicos y de manejo para el cultivo de cacao en Colombia de Rojas y Sacristán (2009); sin embargo estos logran mantenerse dado que el cultivo de cacao tiene una gran adaptabilidad a condiciones adversas (Argüello-Navarro & Moreno-Rozo, 2014). En lo referente a la cuantificación de diazótrofas, estadísticamente se reportan diferencias altamente significativas en los medios de cultivo Nfb y JMV donde crecen presuntivamente los géneros bacterianos Azospirillum sp. y Burkholderia sp. respectivamente y que son predominantes en la zona de rizósfera. La menor presencia se cuantificó en los medios JNFb y LGI donde crecen presuntivamente los géneros bacterianos de Herbaspirillum sp. y Gluconacetobacter sp., dado que son de naturaleza más endófita.
Materiales y métodos
Caracterización de los cultivos de cacao
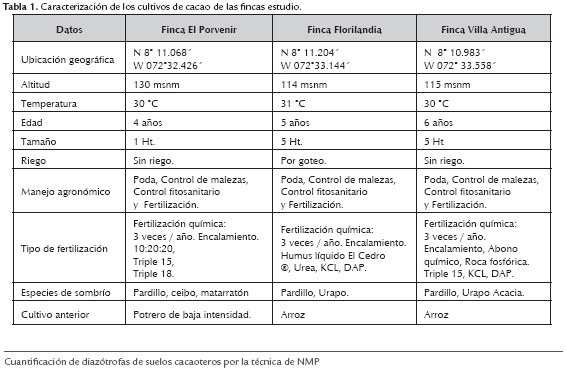
Se elaboró un formato de encuesta la cual se aplicó a los propietarios de los cultivos de cacao de las fincas El Porvenir, Florilandia y Villa antigua, de la Vereda Astilleros, municipio El Zulia, Departamento Norte de Santander, Colombia; sobre el manejo que los cacaotales, edad del cultivo, área sembrada, manejo agronómico, tipo de fertilización, sistema de riego, producción, especies de sombrío, uso anterior de suelo, georreferenciando cada cultivo mediante el uso de GPS Marca Garmin MAP 78s.
Toma de muestras de suelos cacaoteros
Para la toma de muestras se recorrieron los lotes en zig-zag, seleccionando árboles de cacao al azar que presentaran buen estado fitosanitario y se encontraran cercanos al centro del cultivo. Dentro de cada uno de los tres cultivos, se tomaron tres muestras compuestas de suelo rizosférico para un total de nueve muestras, las cuales se conformaron tomando submuestras (20 por Ha) hasta los 10 cm de profundidad en forma de "V", limpiando previamente la superficie del terreno, teniendo en cuenta que cada submuestra fuera del mismo volumen que las demás y representara la misma sección transversal del volumen del que se tomaba la muestra (una misma profundidad) (Sosa, 2002), estas submuestras se depositaron en un balde limpio y se mezclaron para tomar 1 kg de muestra compuesta, que fue puesta en una bolsa limpia y debidamente rotulada con la información de la muestra.
Análisis físicos y químicos
Muestras pares de suelo rizosférico se trasladaron hasta el laboratorio Bioambiental de la Universidad Nacional Experimental del Táchira (UNET) para los análisis fisicoquímicos. La textura se determinó por el método del hidrómetro de Bouyoucos (Bouyoucos, 1962); el porcentaje de materia orgánica (MO) se determinó por el método de digestión húmeda de Wakley y Black (Jackson, 1970); Calcio, Magnesio y Potasio con solución de Acetato de amonio y se hizo lectura mediante absorción atómica (Perkin Elmer AAnalyst 100), la conductividad eléctrica se realizó por medio de un conductímetro sobre extracto de suelo. Para la medición del P soluble se utilizó el método de Bray I (Bray y Kurtz, 1945), la cuantificación se llevó a cabo por colorimetría azul de molibdeno (Spectronic 2.0, ThermoSpectronic). El pH fue determinado por suspensión acuosa: 1:5 suelo en agua agitada durante 20 minutos (Jackson, 1970) utilizando un electrodo de vidrio (pH METER BT-600, Boeco). Los micronutrientes (Magnesio, Zinc, Hierro, Cobre) se determinaron por el método de extracción con la solución Carolina del Norte, haciendo lectura por espectrofotometría de absorción atómica (Perkin Elmer AAnalyst 100).
Cuantificación de bacterias diazótrofas por la técnica de Número Más Probable (NMP)
En un erlenmeyer con 90 mL de agua peptona, se agregaron 10 gr del suelo rizosférico, el cual se agitó por 5 minutos y se dejó en reposo por 10 minutos, tomando de la interfase formada, un 1 mL con pipeta estéril para iniciar el proceso de diluciones seriadas hasta 10-7 en tubos con tapa de rosca con 9 mL de agua peptona. Una vez obtenidas las diluciones, se inoculó 0,1 mL (100 μL) en la dilución 10-2 hasta 10-7 en tres réplicas por triplicado, (repitiendo este mismo procedimiento para cada una de las muestras compuestas), empleando viales de vidrio incoloro estériles con 5 mL de medio semisólido NFb (semiespecífico para Azospirillum spp. Ácido málico 5 g/L; K2HPO4 0.5 g/L; MgSO4.7H2O 0.2 g/L; NaCl 0,1 g/L; CaCl2.2H2O 0.02 g/L; Solución Micronutrientes 2 mL; Azul de Bromotimol 2 mL (Solución 0.5 % en 0.2 N KOH); FeEDTA 4 mL; Solución Vitaminas 1 mL; KOH 4.5 g/L). JMV (semiespecífico para Burkholderia spp.: Manitol 5 g/L; KH2PO4 0.6 g/L; MgSO4.7H2O 0.2 g/L; NaCl 0.1 g/L; CaCl2.2H2O 0.2 g/L; Solución de Micronutrientes 2 mL; Azul de Bromotimol 2 mL; FeEDTA 4 mL; Solución Vitaminas 1 mL). LGI (semiespecífico para Gluconacetobacter spp.: Sacarosa 100 g/L; K2HPO4 0.2 g/L; KH2PO4 0.6 g/L; MgSO4.7H2O 0.2 g/L; CaCl2.2H2O 0.02 g/L; Na2MO4.2H2O 0.002 g/L; FeCl3.6H2O 0.01 g/L; Azul de Bromotimol 5 mL (Solución 0,5% en 0,2 N KOH), JNFb (semiespecífico para Herbaspirillum spp.: Ácido málico 5.0 g/L; K2HPO4 0.5 g/L; KH2PO4 1.8 g/L; MgSO4.7H2O 0.2 g/L; NaCl 0.1 g/L; CaCl2.2H2O 0.02 g/L; Solución de Micronutrientes 2 mL; Azul de Bromotimol 2 mL (Solución 0,5% en 0,2N KOH); FeEDTA 4 mL; Solución de Vitaminas 1 mL; KOH 4,5 g/L), sellados con tapones de gasa estéril.
La solución de micronutrientes se preparó con CuSO4.5H2O 0,04 g/L; ZnSO4.7H2O 1,20 g/L; H3BO3 1,40 g/L; Na2MoO4.H2O 1,00 g/L; MnSO4.H2O 1,175 g/L. La solución de vitaminas: Biotina 10 mg; Piridoxol-HCl 20 mg; disuelta en baño maría y completado el volumen para 100 mL con agua destilada. La solución Fe EDTA (Solución 1,64% - g/100mL): NaEDTA 0,746 g; FeSO4 0,556 g. Para la preparación del medio semisólido se adicionó 1.8 gr / Litro de agar ajustándose pH para NFb (6,8), JMV (4.5), LGI (6,0), JNFb (5.8) (Baldani et al., 1996).
Los viales inoculados con las diluciones, se incubaron durante 7 días a 32 °C, observando la formación de película subsuperficial para crecimiento positivo, para cada dilución y cada repetición realizada. Los datos de la cuantificación por NMP de las bacterias diazótrofas, se interpretaron según la tabla de McCraddy (Döbereiner et al., 1995) y transformados a logaritmo mediante el software Statgraphics 15.0.
Resultados y discusión
Caracterización de los cultivos de cacao
El sistema de producción de cacao en Colombia tradicionalmente ha sido una explotación de economía campesina, por lo cual se requiere consultar directamente al productor; por ello entre más completo sea el sistema de recolección de información de la finca y del cultivo, se dispondrá de más información para analizar y lograr comprender el estado del mismo. De allí que la caracterización previa de las zonas de muestreo es de gran importancia, ya que proporciona información que con el diagnóstico visual no es posible detectar (tabla 1).
Los cacaotales de las fincas estudio, se encuentran en terrenos topográficamente planos, entre los 114 y 130 msnm, temperatura promedio de 30 °C y una precipitación anual de 910-1610 mm, que acorde con lo reportado por Rojas & Sacristán (2009), se encuentran en unas condiciones ecofisiológicas moderadamente aptas para el cultivo, dado que este cultivo en Colombia se desarrolla mejor sobre los 400 msnm, a una temperatura promedio entre 24 y 28 °C, y una precipitación promedio anual mayor a los 1800 mm.
Dado que el árbol de cacao es una especie umbrófila, es decir, que requiere de sombra para su normal desarrollo; los cultivos se hallaron acompañados de especies de sombrío permanente como ceibo (Cedrela adorata), pardillo (Cordia alliodora), acacia (Acacia mangium wild) y/o Urapo (Tabebuia rosea), lo que trae además beneficios ambientales y económicos tanto para el agricultor como para el cultivo, ya que los árboles de sombra ayudan a reducir el estrés, debido a que mejoran las condiciones climáticas adversas y los desequilibrios nutricionales (Beer et al.,1987), además de aumentar el contenido de materia orgánica mediante el reciclaje de nutrientes.
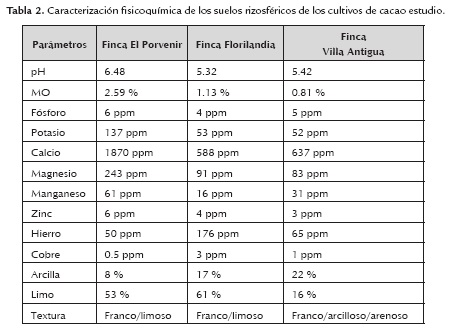
La caracterización fisicoquímica de las muestras de suelo rizosférico se reporta detalladamente en la tabla 2.
El contenido de materia orgánica presente en los suelos cacaoteros analizados osciló entre 0.81 y 2.59 %, una concentración baja según lo reportado por Rojo & Urbano (1992) quienes indican que el porcentaje normal debería ser de 3 a 5 % en los horizontes superficiales de los suelos sometidos a laboreo, y con lo reportado por Rojas y Sacristán (2009) quienes establecen que un porcentaje mayor al 4%, es la cantidad ideal para el cultivo de cacao. El mayor contenido de MO se reportó en El Porvenir (2.59 %), infiriéndose que esta concentración es debida al pH (6.48), a la mayor vegetación y pasturas presentes en el lugar; además a que este suelo se había utilizado anteriormente como potrero de baja intensidad.
Los análisis fisicoquímicos reportaron además bajas cantidades de elementos importantes como Potasio (K) y Fósforo (P), lo cual puede afectar procesos metabólicos en las plantas, incidiendo de forma morfológica o celular el desarrollo del cultivo (Rojo & Urbano 1992). Ormeño & Ovalle (2011) reportan que el uso de fertilizantes nitrogenados como la urea ayudan a remover el Calcio (Ca) y en menor grado el Magnesio (Mg); los resultados de los suelos de la finca Florilandia coinciden con esta afirmación, encontrándose valores muy bajos de estos elementos (Mg: 91ppm, Ca: 588 ppm) para el cultivo, lo que podría deberse al uso de urea como fertilizante. Así mismo las bajas concentraciones de Ca, se evidencian con necrosis en los bordes o puntas de las hojas jóvenes, impidiendo el crecimiento de las plantas, generando una clorosis general e interviniendo en los procesos fotosintéticos (Mantilla et al., 2009).
El Mg es el elemento base en la formación de clorofila, indispensable en la fotosíntesis, activa los sistemas enzimáticos y contribuye al aprovechamiento de P dentro de la planta, necesario en la síntesis de carbohidratos y por consiguiente en la producción de grasas que es esencial para determinar la calidad del grano de cacao (Urquhart, 1963); en las muestras de Florilanda (91 ppm) y Villa antigua (83 ppm) en comparación con las muestras de El porvenir (243 ppm) la marcada deficiencia de este elemento puede verse relacionada a la acidez de los suelos, dado que como también lo menciona el mismo autor, el Mg se pierde de forma acelerada conforme el suelo va aumentando en acidez como se evidencia en este caso. Los valores de pH más ácidos correspondieron a los suelos de Florilandia (5.32) y Villa Antigua (5.42), suelos que anteriormente fueron cultivados por más de 2 años con arroz, por consiguiente estos valores de acidez se atribuyen a que los suelos tardan más tiempo en recuperarse del exceso de agroquímicos como los empleados en este tipo de cultivo (Santos et al., 2008). Por otro, lado el pH de Porvenir (6.48) favorece al cultivo dado que las formas más solubles y disponibles de P, están presentes en el rango de 6.0 a 7.0 (Inpofos, 1997).
Con respecto al contenido de micronutrientes, estos se encontraron en concentraciones variadas. El contenido de Cobre fue mayor en las muestras de Florilandia con un valor de 3 ppm. Aunque este micronutriente es poco requerido por los cultivos, puede generar en casos extremos de escases, clorosis y muerte descendente de los crecimientos terminales (Mantilla et al., 2009). Así mismo, el contenido de Fe, fue mayor en la finca Florilandia con un valor de 176 ppm, pero su deficiencia puede generar clorosis férrica en las plantas de cacao de El Porvenir (50 ppm) y Villa Antigua (65 ppm), debido a que este elemento es importante para la iniciación de la nodulación y para el proceso de fijación biológica del Nitrógeno (Taiz & Zeiger, 2006).
NMP (método del Numero Más Probable)
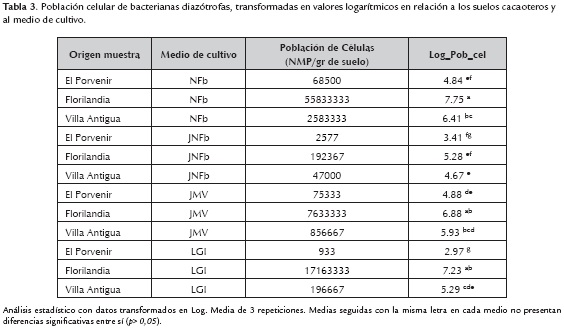
El análisis de varianza realizado a los resultados de cuantificación por la técnica de NMP, registró diferencias significativas (p>0,05) entre los suelos cacaoteros respecto a los medios de cultivo NFb, JMV, LGI, JNFb para las poblaciones de géneros bacterianos diazotróficos (tabla 3), por lo cual se infiere que el manejo de los suelos, influye directamente en el tamaño de estas poblaciones, acorde a lo reportado por Soares et al. (2006), quien encontró variabilidad en muestras de suelo rizosférico del cultivo de avena (Avena sativa), manejado agronómicamente de forma diferente.
La mayor abundancia de diazótrofas, fue hallada en los suelos de Florilandia, la cual maneja un sistema de riego por goteo, influyendo positivamente en la zona de rizósfera y en la planta, dado que según Jadin & Jacquemart (1978), este tipo de irrigación acelera la tasa de desarrollo de las plantas, aumenta el número de flores y los rendimientos del cultivo, al acrecentar la auto-defensa de los cacaotales con relación a las plagas y ofreciendo otras ventajas adicionales como alta uniformidad, la posibilidad de aplicar fertilizantes disueltos en el agua de riego, y los menores requerimientos de mano de obra (Sellés et al., 2003). Tal abundancia se atribuye además, a que este cultivo fue el único abonado orgánicamente con humus líquido, el cual según lo reportado por Ormeño & Ovalle (2011), es una forma de aplicar nutrientes para las plantas y mejorar la calidad química de los suelos, con ello se favorecen las condiciones para preservar y fomentar la diversidad bacteriana de la zona de rizósfera.
Las menores poblaciones de diazótrofas se cuantificaron en las muestras de El Porvenir, cuyo suelo reportó un pH de 6.48, al contrario que las muestras de Florilandia (5.32) y Villa Antigua (5.42), las cuales presentaron un pH más ácido, pudiendo ser este un factor determinante en el número de bacterias con características similares a los géneros Herbaspirillum sp., Gluconacetobacter sp. y Burkholderia sp. debido, a que estas tienen unos requerimientos de pH ácidos o ligeramente ácidos, de entre 5.5 – 6.2 para poder crecer.
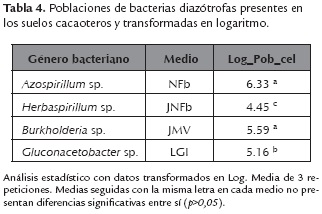
Al contrastar las poblaciones bacterianas, se reportan diferencias altamente significativas de los morfotipos presentes en los medios de cultivo Nfb y JMV, en contraste con JNFb y LGI, donde se reportaron las poblaciones más bajas. En la tabla 4 se indican en unidades logarítmicas las poblaciones de morfotipos obtenidos con características similares a diazótrofas de los géneros Azospirillum sp., Herbaspirillum sp., Burkholderia sp., Gluconacetobacter sp.
La mayor cuantificación, para el género presuntivamente Azospirillum sp. se reportó en el medio NFb, seguido de Burkholderia sp., ello debido a que estos géneros bacterianos pueden establecerse en la raíz de las plantas, así como en el suelo subyacente (Cárdenas et al., 2010). Además, Burkholderia sp., es un buen colonizador de la rizósfera y representa uno de los grupos bacterianos más predominantes en diversos cultivos como en el maíz (Perín et al., 2006).
La población diazótrofa de morfotipos similares a los géneros Gluconacetobacter sp. y Herbaspirillum sp. estuvo presente en menor cantidad, debido a que estos son en su mayoría microorganismos endófitos, los cuales pasan la mayor parte de su ciclo vital en el interior de las plantas sin causarles daños aparentes (Schmid et al., 2006, Punschke & Mayans, 2011). Sin embargo, Gluconacetobacter sp. al ser predominantemente endófito, se puede encontrar también en los suelos rizosféricos, liberado por medio de los lixiviados radicales, que a su vez, enriquecen el suelo con nutrientes esenciales como P y K, contribuyendo al reciclaje de nutrientes por parte de las plantas (Taiz & Zeiger, 2006), así mismo las bacterias exudan hormonas vegetales como las auxinas, citoquininas y giberelinas, las cuales les permiten adaptarse y colonizar el ambiente rizosférico con mayor facilidad (Cárdenas et al., 2010). La baja cuantificación de Herbaspirillum sp. concuerda con Melloni et al., (2004), quien reportó que la población de este género se ve afectada por las condiciones del suelo los tipos de vegetación y la época climática en la cual se realicen los muestreos de los suelos.
Conclusiones
La caracterización de los tres cultivos reportó diferencias en el área cultivada, manejo del riego, edad del cultivo de cacao, manejo agronómico y tipo de fertilización, pudiendo incidir en el estado del suelo y en las condiciones para el establecimiento de bacterias diazótrofas. Las condiciones agroecológicas y fisicoquímicas de los suelos son moderadamente aptas para el cultivo de cacao; teniendo en cuenta que el grado de acidez de las muestras es influenciado por el uso anterior del suelo.
La fertilización aplicada en los cultivos de cacao caracterizados es principalmente inorgánica, y no se sigue un plan de fertilización, previo estudio de las condiciones fisicoquímica del suelo y de las condiciones agroecológicas.
La cuantificación de bacterias diazótrofas por NMP reporta mayores poblaciones de diazótrofas presuntivamente de los géneros Azospirillum sp. y Bukholderia sp. las cuales abundan en la zona de rizósfera, respecto a los géneros Herbaspirillum sp. y Gluconacetobacter sp. que se reportaron en menor población debido a la naturaleza endófita de estos.
La menor cuantificación de bacterias diazótrofas se reportó en los suelos rizosféricos de la finca El Porvenir producto de que estos suelos habían sido sembrados anteriormente con cultivos de arroz, reportando además propiedades físicas y químicas moderadamente aptas para el cacao.
La mayor cuantificación de bacterias diazótrofas se reportó en las muestras de la finca Florilandia, dado que utiliza un sistema de riego por goteo y anualmente se le aplica al cultivo un humus líquido, condiciones que se infiere, favorecieron el hábitat microbiano.
Los factores que condicionaron la presencia o ausencia de bacterias diazótrofas en las muestras de suelo rizosférico de árboles de cacao fueron: las condiciones físicoquímicas del suelo, el contenido de materia orgánica, humedad/riego, pH, y las relaciones climáticas al momento de la toma de las muestras que condicionan a su vez la cantidad de exudados de las raíces de la plantas.
Agradecimientos
A la Universidad Francisco de Paula Santander por la financiación del proyecto, a los cacaocultores de la Vereda Astilleros y a la Federación de cacaocultores – Fedecacao, regional Norte de Santander.
Referencias bibliográficas
Argüello-Navarro, A. Z., & Moreno-Rozo, L. Y. (2014). Evaluación del potencial biofertilizante de bacterias diazótrofas aisladas de suelos con cultivo de cacao (Theobroma cacao L.). Acta Agronómica, 63(3), 1-12. [ Links ]
Baldani, V. L. D., Baldani, J. I., & Dobereiner, J. (1996). Meios de cultura específicos para o isolamento de bacterías endofíticas que fixam N2 atmosférico. Embrapa Agrobiology. Comunicado Técnico No. 12 CNPAB, p. 4. [ Links ]
Beer, J. (1987). Advantages, disadvantages and desirable characteristics of shade trees for coffee, cacao and tea. Agroforestry Systems, 5, 3-13. [ Links ]
Bouyoucos, G. (1962). Hydrometer method improved for making particle size analysis of soils. Agronomy Journal, 54, 464-465. [ Links ]
Bray, R. H., & Kurtz, L. T. (1945). Determination of total, organic and available form of phosphorus in soil. Soil Science, 59, 360-361. [ Links ]
Cárdenas, D., Garrido, M., Bonilla, R., & Baldani, V. (2010). Aislamiento e identificación de cepas de Azospirillum sp. en pasto guinea (Panicum maximum Jacq.) del Valle del Cesar. Pastos y Forrajes, 33(3), 11. [ Links ]
Compant, S., Clément, C., & Sessitsch, A. (2010). Plant growth-promoting bacteria in the rhizo-and endosphere of plants: Their role, colonization, mechanisms involved and prospects for utilization. Soil Biology Biochemistry, 42(5), 669-678. [ Links ]
Döbereiner, J., Baldani, V., & Baldani, J. (1995). Como isolar e identificar bactérias diazotróficas de plantas ñao leguminosas. Brasil, Embrapa SPI, p. 60. [ Links ]
Hernández, A., Heydrich, M., Velázquez, M., & Hernández, A.N. (2006). Perspectivas del empleo de rizobacterias como agentes de control biológico en cultivos de importancia económica. Revista Mexicana De Fitopatología, 24(1), 42-49. [ Links ]
Inpofos. Instituto de la Potasa y Fósforo. (1997). Versión en Español. Manual internacional de fertilidad de suelos. Canadá, p. 174. [ Links ]
Jackson, M.L. (1970). Análisis químico de los suelos. Madrid. 2a. ed. Editorial Omega. p. 662. [ Links ]
Jadin, P., & Jacquemart, J.P. (1978). Effet de l'irrigation sur la précocité des jeunes cacaoyers. Café Cacao, 22(1), 31-35. [ Links ]
Jaizme-Vega, M., & Rodríguez-Romero, A. (2008). Integración de microorganismos benéficos (hongos micorrícicos y bactérias rizosféricas) en agrosistemas de las Islas Canarias. Agroecología,3, 33-39. [ Links ]
Mantilla, A., Cardona, G., Peña, C., Murcia, U., Rodríguez, M., & Zambrano, M. (2009). Distribución de bacterias potencialmente fijadoras de nitrógeno y su relación con parámetros fisicoquímicos en suelos con tres coberturas vegetales en el sur de la Amazonia colombiana. Revista De Biología Tropical, 57(4), 915-927. [ Links ]
Mayz-Figueroa, J. (2004). Fijación biológica de nitrógeno. Revista UDO Agrícola, 4(1), 1-20. [ Links ]
Melloni, R., Nóbrega, R., Moreira, F., & Siqueira, J. (2004). Densidade e diversidade fenotípica de bactérias diazotróficas endofíticas em solos de mineração de bauxite, em reabilitação. Revista Brasileira de Ciência do Solo, 28(1), 85-93. [ Links ]
Motamayor, J., Risterucci, A., Lopez, P., Ortiz, C., Moreno, A., & Lanaud, C. (2002). Cacao domestication I: The origin of the cacao cultivated by the Mayas. Heredity, 89, 380-386. [ Links ]
Ormeño, M., & Ovalle, A. (2011). Efecto de la aplicación de abonos orgánicos en la calidad química de los suelos cacaoteros y el crecimiento de las plántulas en vivero. Ed. Instituto Nacional de Investigaciones Agrícolas, INIA, Mérida. En: Memorias XIX Congreso Venezolano de la Ciencia del Suelo, p. 6. [ Links ]
Perín, L., Martínez, L., Castro, R., Estrada, P., Cabellos, T., Guedes, H., Resi, V., & Caballero, J. (2006). Diazotrophic Burkholderia Species Associated with Field-Grown Maize and Sugarcane. Applied and Environmental Microbiology, 72(5), 3103-3110. [ Links ]
Pinzón, J., Rojas, J., Rojas, F., & Ramírez, O. (2009). Guía técnica para el cultivo de cacao. 4 ed. Federación Nacional de Cacaoteros - Fedecacao Bogotá, Colombia, p 186. [ Links ]
Punschke, K., & Mayans, M. (2011). Selección de cepas de Herbaspirillum spp. promotoras del crecimiento de arroz. Agrociencia Uruguay,15(1), 19-26. [ Links ]
Ranganayaki, N., Kolluru, T., Chakravarthula, M., & Krishna, M. (2006). Methods and techniques for isolation, enumeration and characterization of rhizosphere microorganism. Cap.2 En: Microbial Activity in the Rhizosphere. Mukerji, KG, Manoharachary, C, Singh, J. Springer Soil Biology, (7), 349. [ Links ]
Rodríguez, B., & López, M. (2009). Evaluación de la fertilización biológica del frijol con cepas nativas de rhizobium aisladas de un ultisol de la altiplanicie del estado guárico. Agronomía Tropical, 59(4), 381-386. [ Links ]
Rojas, F., & Sacristán, E. (2009). Guía ambiental para el cultivo del cacao. Federación Nacional de Cacaoteros-Fedecacao. Colombia, p. 111. [ Links ]
Rojo, C., & Urbano, P. (1992). Condiciones del suelo y desarrollo de las plantas según Russel. Ediciones Mundi-Prensa. Madrid-España, p. 471-495. [ Links ]
Sánchez, F., Parra, D., Gamboal, E., & Rincón, J. (2005). Rendimiento de una plantación comercial de cacao ante diferentes dosis de fertilización con NPK en el sureste del Estado Táchira, Venezuela. Bioagro, 17(2), 119-122. [ Links ]
Santos, M., Santos, M. T., & Cárdenas, D. (2008). Aislamiento e identificación de microorganismos con potencial biofertilizante de suelos arroceros del distrito de riego del rio Zulia, Norte de Santander. Revista Respuestas, 11(2), 5-13. [ Links ]
Schmid, M., Baldani, J., & Hartmann, J. (2006). The Genus Herbaspirillum. En: The Prokaryotes. Dworkin M, Falkow S, Rosenberg E, Schleifer K, Stackebrandt. 3th ed. Ed. Springer. New York, University of Minnesota, USA, p. 141-150. [ Links ]
Sellés van Sch, G., Ferreyra, R., Contreras, G., Ahumada, R., Valenzuela, J., & Bravo, R. (2003). Manejo de riego por goteo en uva de mesa cv. Thompson seedless cultivada en suelos de textura fina. Agricultura Técnica, 63(2), 180-192. [ Links ]
Soares, R., Roesch, L., Zanata, G., De Oliveira, F., & Passaglia, L. (2006). Occurrence and distribution of nitrogen fixing bacterial community associated with oat (Avena sativa) assessed by molecular and microbiological techniques. Applied Soil Ecology, 33(3), 221-234. [ Links ]
Sosa, A. (2002). Muestreo de suelos. Instituto Nacional de Tecnología Agropecuaria - INTA. Buenos Aires, Argentina, p. 6. [ Links ]
Taiz, L., & Zeiger, E. (2006). Fisiología vegetal. Plant physiology. 4th ed. Sunderland, MA. Sianuer Associates Inc., p. 1338. [ Links ]
Uribe, A., Méndez, H., & Mantillo, J. (2000). Efecto de niveles de nitrógeno, fósforo y potasio en la producción de cacao en Colombia. Informaciones Agronómicas, (41), 1- 4. [ Links ]
Urquhart, D. H. (1963). Cacao. Centro Agronómico Tropical de Investigación y Enseñanza, InterAmerican Institute for Cooperation on Agriculture IICA-CIRA. Turrialba, Costa Rica. Ed. SIC, p. 322. [ Links ]
Vallejo, M., Bonilla, C., & Castilla, L. (2008). Evaluación de la asociación bacterias fijadoras de nitrógeno - líneas interespecíficas de arroz-nitrógeno, en Typic haplustalf. Ibagué, Colombia. Acta Agronómica, 57(1), 43-49. [ Links ]