Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Iatreia
versión impresa ISSN 0121-0793
Iatreia v.18 n.2 Medellín qbr./jun. 2005
ARTÍCULO DE REVISIÓN
Manifestaciones reumáticas de la infección por el virus de inmunodeficiencia humana (VIH)
Rheumatological manifestations of HIV infection
Alberto Reino Buelvas1; Gloria Vásquez Duque2
1. MD, Residente de Medicina Interna, Universidad de Antioquia, Medellín, Colombia
2. MD, Reumatóloga, Profesora de la Sección de Reumatología del Departamento de Medicina Interna, Universidad de Antioquia, Medellín, Colombia.
Correspondencia: Alberto Reino
Direcciones electrónica: sarracana@yahoo.com
RESUMEN
Son la aparición del VIH/SIDA se ha puesto de manifiesto un espectro de manifestaciones clínicas reumáticas. El compromiso articular incluye las artralgias, la artritis por VIH, el síndrome de Reiter, la artritis psoriásica y la espondiloartropatía indiferenciada. También se ha documentado una miopatía inducida por el VIH en cuyo diagnóstico diferencial se deben tener en cuenta la miopatía inducida por zidovudina y la debida a toxoplasmosis, cuya presentación clínica es más parecida a la miopatía inducida por el VIH que a otras afecciones musculares. El síndrome de linfocitosis con infiltración difusa es una entidad parecida al síndrome de Sjögren, que es exclusiva de los pacientes VIH positivos, con algunas diferencias en la presentación clínica e inmunológica. Por último, es frecuente la presencia de fenómenos autoinmunes el más común de los cuales es la hipergamaglobulinemia policlonal. También se han descrito diferentes tipos de vasculitis como parte de esta enfermedad.
PALABRAS CLAVE: autoanticuerpos, enfermedad articular, infección por vih, miopatía, síndrome de inmunodeficiencia humana, síndrome de linfocitosis con infiltración difusa, vasculitis
SUMMARY
With the appearance of the HIV/AIDS complex several rheumatic manifestations have become evident. Joint involvement includes arthralgia, HIVassociated arthritis, Reiter.s syndrome, psoriatic arthritis and undifferentiated spondyloarthropathy. A kind of myopathy induced by HIV has also been documented and it must be distinguished from zidovudine–induced, and Toxoplasma–produced myopathies. Diffuse Infiltrative Lymphocytosis Syndrome (DILS) is exclusive of patients positive for HIV; it resembles Sjögren.s syndrome but there are some clinical and immunological differences between them. The presence of autoimmune phenomena is frequent in HIV–infected patients; the most frequent of them is polyclonal hypergammaglobulinemia. Different types of vasculitis have also been described in the HIV/AIDS complex.
KEY WORDS: acquired immune deficiency syndrome, autoantibodies, diffuse infiltrative lymphocytosis syndrome, hiv–infection, joint diseases, myopathy, vasculitis.
INTRODUCCIÓN
Con la aparición del virus de la inmunodeficiencia humana (VIH) en 1981 se abrió otro capítulo en el estudio de las enfermedades reumáticas. Esta infección se caracteriza por tener una amplia variedad de manifestaciones clínicas, desde el período asintomático hasta el síndrome de inmunodeficiencia humana (SIDA). Durante la primoinfección puede observarse un cuadro similar a la mononucleosis aguda, el cual es ocasionado por la intensa viremia. Durante este período, el virus se disemina con predilección por el sistema reticuloendotelial, donde infecta las células que expresan CD4 en su membrana, porque este es el receptor primario del virus. Entre estas células los linfocitos T CD4+ (LT CD4+) son extraordinariamente sensibles a la infección, pero el virus también invade los macrófagos, monocitos y otras células presentadoras de antígenos. Unas semanas después de la primoinfección se desarrolla una fase de latencia clínica, caracterizada por una respuesta inmune que lleva a la formación de anticuerpos específicos, con la consecuente reducción de la viremia. La respuesta inmune es incapaz de eliminar la infección y permite que el virus se concentre en los ganglios linfáticos de forma latente. La tercera fase se caracteriza por el deterioro clínico progresivo que se hace evidente con la caída del conteo de linfocitos T CD4+ (LT CD4+) y la aparición de las infecciones oportunistas o las neoplasias definitorias de SIDA. Algunos pacientes pueden presentar linfadenopatías generalizadas de aparición precoz y que pueden persistir; probablemente se deben a una respuesta inmune exagerada.1
El principal mecanismo de inducción del SIDA es la caída de los LT CD4+, aunque también se afectan otras líneas celulares. Durante la etapa aguda se eleva el número total de LT CD8+ y posteriormente puede elevarse, disminuir o permanecer estable. Además, existe una marcada actividad de los linfocitos B, que se manifiesta por un grado elevado de proliferación in vitro, aumento de las gamaglobulinas séricas y gran producción de anticuerpos. A pesar de la hiperactividad de los linfocitos B, estos no son capaces de controlar la infección, ya que disminuyen en la sangre periférica y además tienen una menor capacidad de producir anticuerpos específicos.1,2
En conclusión, en esta enfermedad hay un compromiso inmunológico manifestado por activación de los linfocitos B, reducción en la actividad de los macrófagos y disminución en la actividad citotóxica por parte de los linfocitos T. Adicionalmente hay una pérdida de los LT CD4+ acompañada de un trastorno en la relación de los LT CD4+, con disminución de los LT ayudadores (Th1, del inglés T helper) que promueven la respuesta celular, y aumento de los Th2 que promueven la respuesta humoral.3
Diversas manifestaciones reumáticas se han asociado a la infección por VIH (Tabla Nº 1).1,4–8
La autoinmunidad inducida por los retrovirus puede ser explicada por varios mecanismos. Uno de ellos es el mimetismo molecular, que está sustentado en la observación de una similitud entre los aminoácidos de las proteínas del virus y las del huésped. La correspondiente respuesta inmune puede continuar aun sin la presencia del virus, como ocurre en muchas infecciones virales transitorias en las que se puede desarrollar algún grado de autoinmunidad. Aunque este mecanismo puede ser aplicado a casi todos los virus, en el caso de los retrovirus el mimetismo molecular también puede ser explicado por la inducción de anticuerpos contra proteínas incorporadas al interior de la célula.6,9 Además, se ha observado similitud en la secuencia de aminoácidos entre una porción de la glicoproteína de envoltura 120 (gp120) del VIH y varios tipos de colágeno humano. Esta observación ha llevado a pensar que anticuerpos contra la tercera región hipervariable (V3) de la gp120 del VIH–1 (anticuerpos V3 específicos) pueden tener un papel en los fenómenos de autoinmunidad observados en estos pacientes.6,10
Otro mecanismo propuesto para la generación de autoanticuerpos es que estos pacientes por su inmunosupresión están predispuestos a la presencia de microorganismos artritogénicos; esto se apoya en la observación de una mayor frecuencia del síndrome de Reiter en los pacientes que se infectaron por vía sexual, en contraste con los usuarios de drogas intravenosas que presentan una baja frecuencia de este síndrome.2,6,11 También se ha sugerido el origen viral de la artritis, debido a que en algunos animales se ha logrado inducir artritis por lentivirus.6
Se ha reportado mejoría de los pacientes con algunas enfermedades reumáticas, tales como el lupus eritematoso sistémico (LES) y la artritis reumatoide (AR) cuando sufren infección por VIH, lo cual es explicable por la disminución de los LT CD4+ que se presenta en esta infección. 4 La relación del VIH con otras enfermedades autoinmunes y con anticuerpos circulantes se detallará más adelante.
Es de anotar que no se ha aclarado totalmente el mecanismo patogénico íntimo por el cual la infección por VIH es capaz de inducir las diversas manifestaciones reumáticas. Algunas de estas podrían estar condicionadas por las prácticas de riesgo responsables de la transmisión de la infección, como se mencionó antes.
La pandemia VIH/SIDA afectó en dos décadas 190 países y a más de 40 millones de personas hasta el año 2001; su incidencia se está incrementando rápidamente, sobre todo en los países pobres de África (28.1 millones), el sureste asiático (7 millones) y América latina (2 millones).1,6 Por su alta frecuencia es posible observar en la práctica médica diaria todo tipo de manifestaciones clínicas, incluso las más inusitadas.
ENFERMEDAD ARTICULAR ASOCIADA A LA INFECCIÓN POR VIH
Artralgia asociada a la infección por VIH
Las artralgias son las manifestaciones articulares más frecuentes en los pacientes infectados por VIH y pueden ocurrir en cualquier estadio. En el curso de la primoinfección se presentan con una frecuencia que oscila entre 25 y 70%, y suelen estar asociadas a mialgias, faringitis, adenopatías y eritema cutáneo, manifestaciones que son comunes e inespecíficas en las infecciones virales. 2,6,12 Característicamente las artralgias son poliarticulares y comprometen principalmente las rodillas, los hombros y los codos; se resuelven espontáneamente en una a cuatro semanas, sin recidivar y sin dejar secuelas. En los estadios posteriores de la enfermedad se han descrito artralgias en un porcentaje menor (entre 35–42%), caracterizadas por ser intermitentes, oligoarticulares o monoarticulares y con afección de las grandes articulaciones.2,6,12
Puede atribuirse la patogénesis de las artralgias a varios factores, entre ellos la viremia, el depósito de complejos inmunes formados durante la infección u otra infección asociada, pero es de anotar que aún no está aclarada.4 El tratamiento recomendado para estos pacientes es con analgésicos no narcóticos (acetaminofén o tramadol).4
Síndrome doloroso articular
Es un síndrome autolimitado de etiología desconocida, que dura entre 2 y 24 horas y que ha sido reportado hasta en el 10% de los pacientes infectados por VIH.13 Se caracteriza por el comienzo súbito de un dolor óseo y articular intenso en especial de grandes articulaciones, con mucha impotencia funcional y típicamente sin evidencia de sinovitis ni de otros signos de inflamación.2,4,7
Su manejo es sintomático, teniendo en cuenta que la respuesta a los antiinflamatorios no esteroides (AINE) es mala; se requiere, por lo tanto, la administración de analgésicos narcóticos.2
Artritis asociada a la infección por VIH
Los primeros reportes de artritis seronegativas asociadas al VIH ocurrieron en 1988, con una frecuencia inicial de hasta el 12%;4 en informes más recientes se describe una prevalencia hasta del 30–35%.6,8 Se caracteriza por el curso subagudo de oligoartritis no erosivas, asociadas a dolor intenso, gran impotencia funcional, predominio en los miembros inferiores (rodillas y tobillos) y tendencia a autolimitarse (duración de 6 semanas). A pesar del intenso dolor y de la presencia de signos inflamatorios, el líquido sinovial (LS) tiene un componente inflamatorio moderado (500–2.000 células/mL) o está ausente; en la sinovia se ha documentado sinovitis crónica.2,12 El HLA B27, el factor reumatoide y los ANA suelen ser negativos. En una serie ninguno de los pacientes presentó lesiones cutáneas compatibles con psoriasis ni rasgos de síndrome de Reiter (Tabla Nº 2).2,4,12
En la cavidad articular se han encontrado partículas virales, ADN viral en las células dendríticas del líquido sinovial, antígeno p24 e infiltrado con linfocitos T CD8+.2,14 Un reporte describió la presencia de inclusiones tubolorreticulares, lo que sugiere una etiología viral.4 La mejoría de los pacientes al ser tratados con zidovudina (ZDV), asociada a los hallazgos mencionados, sugiere la infección articular directa por el VIH.
El tratamiento incluye AINE y, en los casos más graves, dosis bajas de esteroides. 2 La hidroxicloroquina,15 las sales de oro y la sulfasalazina,2 han sido efectivas.
Síndrome de Reiter (SRe) y artritis reactiva
En 1987 se reportaron los primeros casos de la coexistencia de VIH y SRe;2,4,12,16 desde entonces este síndrome se ha convertido en la principal manifestación reumática relacionada con el VIH/SIDA, con una frecuencia que oscila entre 0.1% y 10%. Estas diferencias parecen estar asociadas con la vía de transmisión de la enfermedad, ya que se ha observado una mayor frecuencia en las personas que adquirieron la infección por vía sexual, mientras que es menos frecuente en los adictos a drogas intravenosas.2,4,6,7,12,16 por lo que se ha relacionado el SRe con otras infecciones de transmisión sexual más que con el propio virus; de hecho, los niños infectados por vía maternoinfantil no presentan artritis reactivas.2
La presentación de esta entidad en los individuos VIH positivos es similar a la observada en los VIH negativos, aunque con ciertas peculiaridades.17,18 Su curso clínico es más grave, progresivo y de difícil manejo en los infectados por el VIH. En general se inicia en los últimos estadios de la enfermedad y se caracteriza por ser una artritis oligoarticular asimétrica, que afecta principalmente articulaciones de los miembros inferiores e interfalángicas de las manos y los pies, con o sin onicodistrofia. Usualmente se acompaña de entesitis y contractura articular que son rasgos incapacitantes.2,3,4,6,7,17 Las manifestaciones mucocutáneas son muy comunes (más del 50%) y pueden dominar el cuadro clínico, entre ellas la queratodermia blenorrágica, la balanitis circinada, úlceras orales y un exantema que muchas veces es difícil de distinguir de la psoriasis, lo que ha llevado a la especulación de que estas dos entidades pueden ser un continuum.2,3,4,6,7,17 Otras manifestaciones extraarticulares incluyen uretritis o cervicitis, compromiso ocular transitorio, fiebre, adenopatías, pérdida de peso y diarrea. La enfermedad axial y la uveítis son manifestaciones infrecuentes (Tabla Nº 2). El líquido sinovial muestra un infiltrado inflamatorio, con recuento celular entre 2.000 y 10.000 células blancas por mL.2,3,4,6,7,17
La inmunopatogénesis del SRe se ha asociado a la presencia del HLA B27, por lo cual este ha sido descrito como un factor de susceptibilidad. El HLA B27 se encuentra en el 70–90% de los pacientes de raza blanca con SRe asociado al VIH, con una frecuencia similar a la observada en los pacientes VIH negativos.4,6,17,18 Sin embargo, en estudios de africanos con SRe se ha reportado una mayoría de pacientes HLA B27 negativos.4,6,19 La asociación entre VIH y SRe puede explicarse en el escenario de una inmunosupresión grave que predispone a infecciones por microorganismos artritogénicos (Shigella spp, Chlamydia trachomatis, Entamoeba histolytica, Giardia lamblia, Criptosporidium spp, Isospora belli, Candida spp y Citomegalovirus), que pueden tener una variada presentación clínica y muchas veces pasar desapercibidas.4,6
El tratamiento es similar al de los pacientes VIH negativos. Los AINE son los medicamentos de elección, y entre estos, la indometacina, no solo por su eficacia, sino también por su capacidad de inhibir la replicación viral, observada in vitro. 4,20 Frecuentemente no hay una respuesta adecuada a los AINE cuando se los usa solos y, por lo tanto, se recomienda adicionar otro medicamento para lograr el control de los síntomas. La fenilbutazona, ahora raramente usada debido a sus múltiples efectos adversos, puede ser útil en casos refractarios;4 la sulfasalazina ha sido efectiva en algunos estudios a dosis de 1.5 a 2 g/día4 y, de hecho, un estudio sugiere que atenúa la infección por VIH.4,21 El metotrexate se consideró inicialmente contraindicado debido a su efecto inmunosupresor; de hecho, en reportes tempranos se lo asoció con neumonía por Pneumocystis carinii y otros oportunistas; 4 por eso se requieren un control cuidadoso de la carga viral y del conteo de CD4, así como del estado clínico del paciente cuando se vaya a usar este medicamento.4 Estudios recientes han sugerido que el metotrexate tiene un lugar en el tratamiento del síndrome de Reiter y la artritis psoriásica en pacientes infectados por VIH.4,22 La hidroxicloroquina ha sido reportada como efectiva no solo en el tratamiento del síndrome de Reiter, sino también por reducir la replicación viral in vitro y la carga viral in vivo. 4,23
Artritis psoriásica
Se ha reportado una alta prevalencia de artritis psoriásica (Apso) (entre 25–50%) en los pacientes VIH positivos. 3,6 Se considera que un 5–8% de los pacientes VIH negativos con psoriasis desarrollar án artritis en algún momento de su enfermedad, mientras que los VIH positivos pueden desarrollarla hasta en el 32% de los casos.3 La artritis psoriásica se asocia casi universalmente con la infección por VIH en negros zambianos.6 Las manifestaciones clínicas de la psoriasis no difieren significativamente entre los individuos infectados y los no infectados por VIH. El patrón de compromiso observado con mayor frecuencia es el de una artritis poliarticular y simétrica que a menudo afecta articulaciones de los pies, las sacroilíacas y las de la columna asociada a entesopatía, dactilitis y compromiso ungueal, el cual ocurre en la mayoría de los pacientes VIH positivos con inflamación articular.4,3,6,7,24 El curso clínico de la Apso durante la infección por VIH es variable; la psoriasis preexistente puede exacerbarse, con tendencia a progresar junto con la caída de los LT CD4+ y además a ser refractaria al tratamiento convencional. En este contexto la psoriasis puede ser un indicador de mal pronóstico.3,4,6 Los pacientes con SIDA que sufren una exacerbación fuerte de la psoriasis están propensos a desarrollar infecciones graves (por ejemplo por Staphylococcus aureus), contrariamente a lo que ocurre en el psoriásico inmunocompetente.3
La asociación entre el HLA B27, Cw6 (Cw*0602) y la presencia de psoriasis observada en pacientes VIH negativos, de diferentes grupos raciales,2,3,25 también se ha demostrado en el 79% de los VIH positivos.3
Aunque hay consenso en que los LT juegan un papel importante en la patogénesis de la psoriasis, hay controversia sobre cuáles de sus subpoblaciones son las mediadoras en esta enfermedad. Hay una fuerte evidencia de que tanto una activación policlonal de los LT por superantígenos como una activación oligoclonal de los LT por antígenos clásicos juegan un papel disparador o de mantenimiento de las lesiones psoriásicas. La ocurrencia de psoriasis en los pacientes con infección por VIH es interesante, ya que no hay una explicación de por qué se presenta en un paciente con LT bajos. Se ha evidenciado el papel del virus como mediador en la patogénesis de esta entidad en ratones transgénicos.3,26
El tratamiento no difiere del que se usa en los pacientes VIH negativos con psoriasis; son de elección las preparaciones tópicas, que pueden usarse solas o en combinación con agentes de segunda línea como la fototerapia y los retinoides en los casos graves; la ciclosporina y el metotrexate se han usado con precaución en casos graves y resistentes.3 El tratamiento antiviral ha demostrado beneficios en estos pacientes.3,4,27
Espondiloartropatía indiferenciada
Se observa con frecuencia en los pacientes VIH positivos; por ejemplo en Zambia la prevalencia fue 180 por 100.000 habitantes, mientras que en la población general fue 15 por 100.000.6,19 En áreas donde la infección por VIH se ha convertido en epidemia, la espondiloartropatía puede ser la artritis predominante independiente de la frecuencia de HLA B27.17 El tratamiento es sintomático (AINE y esteroides intralesionales, cuando están indicados); en pacientes con enfermedad más extensa puede recurrirse a la sulfasalazina.4
ENFERMEDAD MUSCULAR ASOCIADA AL VIH
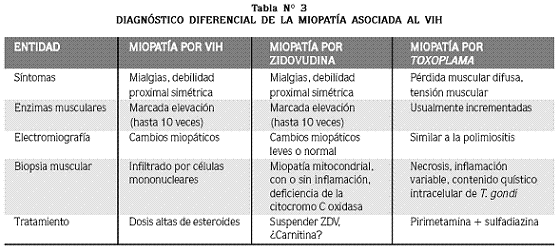
El compromiso muscular en pacientes VIH positivos va desde mialgias no complicadas, fibromialgia y elevación asintomática de la creatinquinasa (CPK) hasta la polimiositis grave e incapacitante asociada al VIH y la piomiositis.4 Durante la etapa de seroconversión pueden encontrarse mioglobinuria y mialgias, lo que sugiere un miotropismo del VIH en los estadios tempranos de la infección.4,28 En la tabla Nº 3 se resume el diagnóstico diferencial de las principales miopatías en pacientes con VIH.
Mialgias y fibromialgia
En series de pacientes VIH positivos se han encontrado mialgias hasta en un tercio de los casos.4,8 La fibromialgia se ha relacionado con la infección viral crónica. Se han publicado dos series en las que se encontró una frecuencia de fibromialgia de hasta el 10% en los pacientes infectados.2,29 En otra serie se encontró asociación entre fibromialgia y antecedentes de depresión.4 El tratamiento es similar al de los pacientes VIH negativos.4
Miopatía asociada al VIH
Una miopatía parecida a la polimiositis idiopática (PMI) puede ocurrir en pacientes VIH positivos. Esta entidad puede ser la primera manifestación o aparecer meses o años después de la infección. Cursa con mialgias, sensibilidad muscular y debilidad muscular proximal y simétrica, con predilección por los miembros inferiores, aunque también puede afectar los músculos faciales y los flexores del cuello. Puede asociarse a neuropatía periférica.2,30 El reto diagnóstico en un paciente con VIH es diferenciar esta miopatía de la causada por zidovudina (ZDV). La diferenciación exitosa entre estas dos entidades requiere suspender la ZDV y monitorizar la respuesta (Tabla Nº 3).
Al igual que en la PMI, la miopatía asociada al VIH puede presentarse con elevación de la CPK y un patrón miopático con alteración de la actividad espontánea en la electromiografía (EMG) (aumento de la actividad de inserción, ondas agudas positivas en reposo o en diente de sierra, trazado pseudomiotónico espontáneo de alta frecuencia, potenciales bifásicos de baja amplitud durante la contración voluntaria), hallazgos que son indistinguibles de los de la PMI.2,30 En la biopsia muscular se observa un infiltrado inflamatorio formado por macrófagos, LT CD8+ y células gigantes multinucleadas, con áreas de necrosis y fibrosis muscular. En ocasiones aparecen cuerpos de nemalina y necrosis de la fibra muscular sin infiltrado inflamatorio; esta es una alteración miofibrilar resultante de la ruptura de las bandas Z; este patrón también aparece en la miopatía mitocondrial del adulto; sin embargo, la presencia de cuerpos de nemalina sugiere la infección por VIH.2,30
La patogénesis de la miopatía asociada al VIH no ha sido completamente aclarada.2,30 Es posible que el daño muscular sea causado por invasión directa de la célula muscular por el virus o se deba a mecanismos inmunológicos mediados por células, o a ambos. La teoría de la invasión directa es soportada por el estudio de simios con SIDA, en los cuales el retrovirus ha sido aislado del tejido muscular y ha mostrado ser capaz de infectar células musculares sanas en cultivos.30 Sin embargo, la detección de antígenos virales en células musculares humanas por microscopía electrónica o técnicas de inmunocitoquímica no ha sido exitosa.30 Alternativamente, la invasión de la célula muscular por el VIH puede ser transitoria, pero capaz de inducir un cambio antigénico en la célula muscular que posteriormente dispara un infiltrado inflamatorio mediado inmunológicamente y miositis. 30 Se ha sugerido que los casos de rabdomiolisis reportados al inicio de la infección por VIH o con la seroconversión son evidencia de la invasión viral directa y el daño temprano de la célula muscular en el curso de la infección por el VIH.30
El tratamiento, al igual que en la PMI, son los esteroides, que han sido eficaces en dosis altas. La normalización de las enzimas y la mejoría de la fuerza ocurren después de 1 a 2 meses de haber iniciado la terapia. No hay información en la literatura con respecto a los pacientes que no responden a los esteroides.30 El metotrexate y la azatioprina se usan en la PMI pero están contraindicados en la miopatía asociada al VIH. Se recomienda vigilar cuidadosamente al paciente durante el período de disminución de los esteroides, evaluando la aparición de debilidad y los signos de toxicidad medicamentosa. Cuando falla el tratamiento con prednisona, debe plantearse como diagnóstico diferencial la miopatía por esteroides; este diagnóstico lo sugiere la debilidad muscular con enzimas musculares normales. Un enfoque empírico es reducir la dosis de esteroides y vigilar la fuerza muscular. 2,30
Miopatía por zidovudina (ZDV)
Se han documentado alteraciones musculares reversibles desde que empezó a utilizarse la zidovudina y se han convertido en la principal alteración miopática asociada al VIH. Esta miopatía es clínicamente semejante a la miopatía asociada al VIH y a la PMI.1,2,30 Debe sospecharse el diagnóstico en pacientes que desarrollan miopatía luego de varios meses de tratamiento con ZDV. La enfermedad evoluciona con elevación de las enzimas musculares y en la EMG se pueden hallar cambios miopáticos leves o un patrón anormal.1,2,30
En la biopsia muscular, en contraste con la miopatía asociada al VIH, la microscopía de luz evidencia pocos cambios inflamatorios o una leve infiltración endomisial por LT. Lo más frecuente en el estudio ultraestructural es encontrar una alteración mitocondrial con inclusiones paracristalinas.2,30 Puede identificarse, por tinciones especiales, la deficiencia de citocromo C oxidasa en la biopsia muscular; este hallazgo puede ser útil para distinguir la miopatía por zidovudina de la asociada al VIH.30
La miopatía por ZDV es dependiente de la dosis y responde a la suspensión del medicamento. Las enzimas regresan a su nivel normal después de 1 a 2 meses de la suspensión.2,30 Los AINE son útiles para tratar las mialgias. Hay evidencia in vitro de que la carnitina puede prevenir esta miopatía.30
Miopatía por Toxoplasma
La infección muscular por Toxoplasma se parece más a la miopatía asociada al VIH o por ZDV que a otras afecciones musculares (Tabla Nº 3). A menudo puede encontrarse compromiso del sistema nervioso central.1,2,30 Usualmente están elevadas las enzimas musculares. La biopsia muscular muestra necrosis e inflamación de grado variable usualmente con más neutrófilos que en la miopatía asociada al VIH o en la PMI. La presencia de quistes intracelulares con Toxoplasma gondii establece el diagnóstico. La serología para Toxoplasma puede ser positiva.1,2,7,30 El régimen de elección para el tratamiento de la toxoplasmosis extrapulmonar es la combinación de pirimetamina y sulfadiazina.1,7,30,31
SÍNDROME DE LINFOCITOSIS CON INFILTRACIÓN DIFUSA
Este síndrome se conoce con la sigla DILS (del inglés, Diffuse Infiltrative Lymphocytosis syndrome). A mediados de los años 80 del siglo XX se describió un síndrome muy parecido al de Sjögren en pacientes VIH–positivos.4,32,33 En un estudio de 522 pacientes ambulatorios VIH–positivos en una clínica de VIH en Texas (EE. UU.), se encontró una prevalencia del 3– 4%.4,34 En otro estudio, en Grecia, se evaluaron 77 pacientes VIH–positivos ambulatorios y se encontró una prevalencia de DILS del 7.8%.4,35 Esta entidad afecta con mayor frecuencia a los afroamericanos que a los miembros de otros grupos étnicos.1,34
En el síndrome de Sjögren primario existe una asociación con los HLA–DR2 y HLA–DR3; además, con el HLA–DR4 cuando el síndrome es secundario a artritis reumatoide;32 en el DILS se encontró una asociación en negros VIH positivos (OR: 8.3) con el HLA–DR5 y en caucásicos, una frecuencia incrementada de HLA–DRw6/HLA–DR7. En los pacientes HLA–B35 VIH positivos se ha visto un incremento significativo en la tasa de progresión de la enfermedad a SIDA y muerte. También se encontró que los pacientes con DILS (tanto caucásicos como negros) tenían una frecuencia menor de HLA–B35 y, por consiguiente, una menor tasa de progresión de la enfermedad. Una interpretación de esos datos es que la ausencia de HLA–B35 permite el desarrollo de ciertos clones de LT CD8 con posible actividad anti–VIH, que pueden retardar la expresión de la enfermedad.33
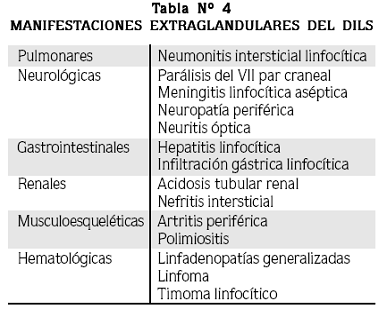
El DILS se caracteriza por un crecimiento no doloroso y a menudo masivo de la glándula parótida. Muy a menudo ocurre crecimiento concomitante de las glándulas submandibular y lacrimal. Este crecimiento se acompaña en el 60% de los casos de síntomas secos. En un estudio el tiempo promedio entre el diagnóstico de la infección por VIH y la aparición de los síntomas del DILS fue de 3.4 años.1,4,6,32 Al igual que en el síndrome de Sjögren primario, en el DILS también se han descrito manifestaciones extraglandulares (Tabla Nº 4).1,4,6,32
En los reportes iniciales la frecuencia de neumonitis intersticial linfocítica (NIL) en pacientes con DILS era entre 25 y 50%; luego de la introducción de los inhibidores de proteasas su frecuencia ha disminuido.1,4,6,32 Las manifestaciones neurológicas son también una característica importante del síndrome; probablemente la complicación más común sea la parálisis del VII par craneal, usualmente debida a compresión mecánica del nervio por el tejido glandular inflamado. Otras manifestaciones del DILS incluyen acidosis tubular renal, polimiositis, hepatitis linfocítica y linfomas; estos últimos se asocian a mal pronóstico.1,4,6,32
El DILS y el síndrome de Sjögren tienen características comunes, pero también grandes diferencias (Tabla Nº 5).
El crecimiento de la parótida ocurre en menos de un tercio de los pacientes con síndrome de Sjögren, mientras que se presenta en casi todos los afectados por DILS.1,4,6,32 La NIL y la parálisis del VII par son infrecuentes en el síndrome de Sjögren. Los anticuerpos antinucleares (ANA), el factor reumatoide (FR), anti Ro (SS–A) y anti La (SS–B) que son característicos del síndrome de Sjögren, se encuentran raramente en el DILS.1,4,6,32 Existen otras enfermedades que pueden estar asociadas con síntomas secos, entre ellas la infección por HTLV–1 y la enfermedad crónica de injerto contra huésped.32
Los criterios diagnósticos propuestos para el DILS son los siguientes:4, 35, 36
•Prueba de ELISA y Western blot positivos para VIH.
•Crecimiento bilateral de las glándulas salivares o xerostomía persistente por más de 6 meses.
Se debe documentar el compromiso histológico con infiltración linfocitaria de las glándulas salivares o lacrimales en ausencia de lesiones granulomatosas o neoplásicas.4,36 Se ha usado la gamagrafía con Galio (Ga67) de las glándulas salivares cuando no es posible la biopsia de labios (pacientes hemofílicos) o cuando sus resultados son equívocos.4,36
Los esteroides en dosis moderadas (30–40 mg/día de prednisona) han sido efectivos en el manejo del crecimiento glandular y los síntomas secos, sin aumentar la frecuencia de infecciones oportunistas, ni incrementar la carga viral o disminuir el recuento de LT CD4+. En los casos de NIL pueden requerirse dosis altas de esteroides, hasta de 60 mg/día de prednisolona. Otras medidas incluyen el uso de pilocarpina para los síntomas secos y el drenaje o la infiltración con esteroides de los quistes linfoepiteliales de la parótida, que en ocasiones pueden ser muy dolorosos.4
SÍNDROME DE VASCULITIS ASOCIADA CON LA INFECCIÓN POR VIH
La asociación entre las vasculitis sistémicas y las enfermedades infecciosas ha sido un fenómeno bien descrito; por ello no es sorprendente la concomitancia de vasculitis con la infección por el VIH.
De una serie de 148 pacientes VIH positivos, 11 reunieron los criterios del ACR (American College of Rheumatology) para vasculitis, incluyendo 6 con vasculitis de hipersensibilidad, 4 con poliarteritis nodosa y 1 con púrpura de Henoch–Schönlein.4 Se han reportado otras vasculitis entre ellas el síndrome de Behçet, el síndrome de Churg–Strauss, la poliangeítis microscópica, la granulomatosis linfomatoide, la angeítis primaria del sistema nervioso central, la enfermedad de Kawasaki y la arteritis de células gigantes.4,37
Las infecciones pueden causar daño vascular por varios mecanismos a saber: toxicidad sobre el endotelio bien sea directa por el agente infeccioso o indirecta, por toxinas resultantes de su metabolismo; el depósito de complejos inmunes o la formación de estos in situ, desencadenando en última instancia una activación del complemento; la inmunidad celular también puede estar implicada en la patogénesis, ya sea por una activación de las células citotóxicas o una activación policlonal o monoclonal de células T o B. Aunque no está completamente claro el mecanismo exacto de cómo el VIH desencadena el daño endotelial, parece que la invasión del endotelio por el virus puede jugar un papel importante, ya sea directo o indirecto.4,37
Los esteroides siguen siendo la piedra angular en el manejo de la vasculitis asociada a VIH, aunque se han empleado agentes citotóxicos en casos refractarios.4
AUTOANTICUERPOS Y VIH
Se ha observado una variedad de fenómenos inmunes asociados a la infección por VIH; entre estos se incluyen hipergamaglobulinemia policlonal, complejos inmunes circulantes, ANA, FR, anticuerpos anticardiolipina (aCL), anticuerpos antiplaquetarios.4,38
La anormalidad de laboratorio más común es la hipergamaglobulinemia policlonal, que se encuentra hasta en el 45% de los individuos VIH positivos.
Esto refleja, al menos en parte, el incremento en el nivel de los complejos inmunes circulantes, los cuales en raras ocasiones tienen consecuencias clínicas. Los ANA y el FR se han descrito en algunas series hasta en el 17% de estos pacientes, usualmente en títulos bajos. Esos anticuerpos son el resultado de la activación policlonal de las células B y, por lo tanto, pueden ser moléculas proteicas no específicas con un bajo estado funcional como anticuerpos.4,38
Los aCL IgG se han encontrado hasta en el 95% de los pacientes con SIDA, particularmente en casos de enfermedad avanzada y en el 20–30% de los individuos infectados por VIH. Se ha hallado correlación de los aCL con los complejos inmunes circulantes y con la trombocitopenia. La prevalencia de altos niveles de aCL no se ha correlacionado con alteraciones de las pruebas de coagulación y además varios estudios han fallado en relacionar los aCL con fenómenos trombóticos en los pacientes VIH positivos. Los aCL aparecen con otras alteraciones inmunes en los pacientes VIH positivos y no sirven como marcador pronóstico.4,38,39
También se han descrito los ANCA (anticuerpos contra el citoplasma del neutrófilo), tanto c–ANCA como p–ANCA. Se han encontrado anticuerpos contra los linfocitos hasta en el 75% de los casos de infección por VIH; estos anticuerpos pueden contribuir al deterioro funcional de los LT CD4+ y posteriormente llevar a la disminución de los LT CD8+ que se observa tardíamente en la enfermedad.38,39
CONCLUSIONES
Debido a la amplia distribución de la infección por el virus de la inmunodeficiencia humana, no es de extrañar la frecuencia de las diferentes manifestaciones clínicas. Las manifestaciones reumáticas tienen un amplio espectro que comprende desde el compromiso articular y muscular hasta fenómenos vasculíticos, la producción de autoanticuerpos y el síndrome de linfocitosis con infiltración difusa.
La autoinmunidad es un fenómeno que se ha ligado por diferentes mecanismos a la infección VIH. Uno de ellos ha sido el mimetismo molecular, que es común en muchas infecciones virales, incluyendo el VIH. En particular con este virus se han postulado ciertos trastornos inmunes, como una pérdida en la relación de los linfocitos T ayudadores, la cual favorece más la inmunidad humoral, con la consecuente activación policlonal de los linfocitos B, que se evidencia por una hipergamaglobulinemia policlonal. Además se ha postulado al propio virus como desencadenante de la respuesta inmune al expresar moléculas propias que se convierten en autoantígenos dentro de la célula infectada.
Es muy importante tener en cuenta que las manifestaciones reumáticas no son exclusivas de la interacción directa del virus con el sistema inmune, sino consecuencia de algunos otros aspectos de la enfermedad como es el caso de las miopatías por zidovudina, por Toxoplasma o por esteroides. Por esta razón, en un paciente con un trastorno de la inmunidad siempre se deben descartar otras causas, como las infecciosas, medicamentosas o neoplásicas. Es muy llamativo que en estos pacientes la frecuencia de artritis séptica sea igual a la de la población general. Con la aparición de la pandemia de VIH/SIDA se ha abierto un nuevo capítulo en el estudio de los pacientes reumatológicos, y es de interés para los profesionales de la salud que estén en contacto con estos pacientes conocer el espectro de estas manifestaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. DE VITA VT, HELLMAN S, CURRAN J, et al. AIDS: Etiology, Diagnosis, Treatment and Prevention. Philadelphia: Lippincott–Raven; 1997. [ Links ]
2. CARREÑO L, MONTEAGUDO I. Artritis por virus: VIH, parvovirus. Manual de enfermedades reumáticas. Madrid: Editorial Panamericana; 2001. [ Links ]
3. MALLON E. Retrovirus and psoriasis. Curr Opin Infectious Dis 2000; 13: 103–107. [ Links ]
4. REVEILLE J. En: KELLY, Textbook of Rheumatology: Rheumatic Manifestations of Human Immunodeficiency Virus Infection. 5ª ed. Philadelphia: Saunders; 2001. [ Links ]
5. STANLEY RP, REVA CL, LAWRANCE ES. AIDS and rheumatic disease. Rheum Dis Clin N Am 1991; 17:1–3. [ Links ]
6. MEDINA F. Rheumatic manifestations of human immunodeficiency virus infection. Rheum Dis Clin N Am 2003; 29:145–161. [ Links ]
7. FAUCI A, BRAUNWALD E, ISSELBACHER K, WILSON J, et al, eds. Harrison's Principles of Internal Medicine, 16th ed. New York: McGraw–Hill; 2004. [ Links ]
8. BERMAN A, ESPINOZA LR, DIAZ JD. Rheumatic manifestations of human immunodeficiency virus infection. Am J Med 1988; 85: 59–64. [ Links ]
9. FUJINAMI RS, OLDSTONE MB. Amino acid homology between encephalitogenic site of myelin basic protein and virus: mechanism for autoimmunity. Science 1985; 230: 1.043–1.045. [ Links ]
10. PETKOVIC M, METLAS R. Cross–reactivity of the V3–specific antibodies with the humans C1q. Z Naturforsch 2001; 56: 1.135–1.143. [ Links ]
11. MOYLETT EH, SHEARER WT. HIV: Clinical manifestations. J Allerg Clin Immunol 2002; 110: 13–16. [ Links ]
12. RYNES RI. Painful rheumatic syndromes associated with Human Immunodeficiency Virus Infection. Rheum Dis Clin N Am 1991; 17: 1–3. [ Links ]
13. BILECKOT R, MOUAYA A, MAKUWA M. Prevalence and clinical presentations of arthritis in HIV–positive patients seen at a rheumatology department in Congo–Brazzaville. Rev Rheum Engl Ed 1998; 65: 549–554. [ Links ]
14. BENTIN J, FEREMANS W, PASTEELS JL, HAUZEUR JP, MENU R, et al. Chronic acquired immunodeficiency syndrome associated arthritis: a sinovial ultrastructural study. Arthritis Rheum 1990; 33: 268–733. [ Links ]
15. ORNSTEIN MH, SPERBER K. The anti–inflammatory and antiviral effects of hydroxychloroquine in two patients with acquired immunodeficiency syndrome and active inflammatory arthritis. Arthritis Rheum 1996; 39: 157–161. [ Links ]
16. KEAT A, ROWE I. Reiter's syndrome and associated arthritides. Rheum Dis Clin N Am 1991; 17: 25–42. [ Links ]
17. YU DT, WIESENHUTTER CW. Definition and diagnosis of undifferentiated spondyloarthropathy, Reiter's syndrome, and reactive arthritis. In: UpToDate, Rose BD, ed. Wellesley, MA: UpToDate; 2003. [ Links ]
18. WINCHESTER R, BERNSTEIN DH, FISHER HD, ENLOW R, SOLOMON G. The co–ocurrence of Reiter's syndrome and acquired immunodeficiency. Ann Intern Med 1987; 106: 19–26. [ Links ]
19. NJOBVU P, MCGILL P, KERR H, JELLIS J, POBEE J. Spondyloarthropathy and human immunodeficiency virus infection in Zambia. J Rheumatol 1998; 25: 1.553–1.559. [ Links ]
20. BOURINBAIAR AS, LEE–HUANG S. The non–steroidal anti–inflammatory drug, indomethacin, as an inhibitor of HIV replication. FEEB Letters 1995; 360: 85–88. [ Links ]
21. DISLA E, RHIM HR, REDDY A, Taranta A. Improvement in CD4 lymphocyte count in HIV–Reiter.s syndrome after treatment with sulfasalazine. J Rheumatol 1993: 21: 662. [ Links ]
22. MASSON C, CHENNEBAULT JM, LECLECH C. Is HIV infection a contraindication to use of methotrexate in psoriatic arthritis? J Rheumatol 1995; 22: 2.191. [ Links ]
23. SPERBER K, KALB TH, STECHER VJ, et al. Inhibition of human immunodeficiency virus type I replication by hydroxychloroquine in T cells and monocytes. AIDS Res Human Retrovir 1993; 9: 91–98. [ Links ]
24. GLADMAN DD. Clinical manifestation and diagnosis of psoriasis. In: UpToDate, Rose BD, ed. Wellesley, MA: UpToDate; 2003. [ Links ]
25. GLADMAN DD. Pathogenesis of psoriatic arthritis. In: UpToDate, Rose BD, ed. Wellesley, MA: UpToDate; 2003. [ Links ]
26. LEONARD JM, ABRAMCZUK JW, PEZEN DS. Development of disease and virus recovery in transgenic mice containing HIV proviral DNA. Science 1998; 242: 1.665–1.670. [ Links ]
27. GLADMAN DD. Treatment of psoriatic arthritis. In: UpToDate, Rose BD, ed, Wellesley, MA: UpToDate; 2003. [ Links ]
28. DALAKAS M. Clinical, immunopathologic, and therapeutic considerations of inflammatory myopathies. Clin Neuropharmacol 1992; 15: 327–351. [ Links ]
29. FREUNDLICH B, LEVENTHAL L. The fibromyalgia syndrome. En: Schumacher HR, Klippel JH, Koopman WJ, eds. Primer on the Rheumatic Disease. Atlanta: Arthritis Foundation; 1993: 247–249. [ Links ]
30. MILLER ML. Muscle disease in HIV–infected patients. In: UpToDate, Rose BD, ed, Wellesley, MA; UpToDate; 2003. [ Links ]
31. GILBERT D, MOELLERING R, SANDE M. The Sanford Guide of antimicrobial therapy. 94. North Carolina: Antimicrobial Therapy; 2003. [ Links ]
32. ITESCU S, BRANCATO LJ, BUXBAUM J, et al. A diffuse infiltrative CD8 lymphocytosis syndrome in human immunodeficiency virus (HIV) infection: A host immune response associated with HLA–DR5. Ann Intern Med 1991; 112: 3. [ Links ]
33. ITESCU S. Diffuse Infiltrative Lymphocytosis Syndrome in Human Immunodeficiency Virus Infection . A Sjögren's–Like Disease. Rheum Dis Clin N Am 1991; 17: 1–3. [ Links ]
34. WILLIAMS FM, COHEN PR, JUMSHYD J, REVEILLE JD, et al. Prevalence of the Diffuse Infiltrative Lymphocytosis Syndrome in human immunodeficiency virus type 1–positive outpatients. Arthritis Rheum 1998; 41: 863–868. [ Links ]
35. KORDOSSIS T, PAIKOS S, ARONI K, et al. Prevalence of Sjögren's–like syndrome in a cohort of VIH 1–positive patients: descriptive pathology and immunopathology. Br J Rheumatol 1998; 37: 691–695. [ Links ]
36. ITESCU S, WINCHESTER R. Diffuse Infiltrative Lymphocytosis Syndrome: A disorder occurring in Human Immunodeficiency virus–1 Infection that may present as a sicca syndrome. Rheum Dis Clin N Am 1992; 18: 683–697. [ Links ]
37. CALABRESE LH. Vasculitis and infection with the Human Immunodeficiency virus. Rheum Dis Clin N Am 1991; 17: 131–147. [ Links ]
38. SOLINGER AM, HESS EV. Rheumatic diseases and AIDS is the association real? [see comment]. [Case Reports. Journal Article] J. Rheum 1993; 20: 678–683. [ Links ]
39. BERNARD C, EXQUIS B, REBER G, et al. Determination of anticardiolipin and other antibodies in HIV–1 infected patients. J Acquired Inm Defic Synd 1990; 3: 536–539. [ Links ]
Recibido: 3 de noviembre de 2004
Aceptado: 25 de enero de 2005