Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
CT&F - Ciencia, Tecnología y Futuro
versión impresa ISSN 0122-5383versión On-line ISSN 2382-4581
C.T.F Cienc. Tecnol. Futuro v.1 n.4 Bucaramanga ene./dic. 1998
SELECCIÓN DE MICROORGANISMOS MESÓFILOS BIODESULFURIZADORES
RESUMEN
En el desarrollo de procesos de biodesulfurizadón de hidrocarburos (BDS) se requiere de métodos rápidos y confiables para la selección de microorganismos. En este trabajo se presentan los resultados correspondientes al proceso de selección de cepas mesófilas nativas de Colombia con utilidad potencial para procesos de BDS. El criterio de selección de las cepas fue la detección cualitativa y cuantitativa del 2-hidroxibifenilo (2-HBP), metabolito típico de la ruta conservativa del azufre orgánico (ruta 4S), en los ensayos bacterianos. Los microorganismos se cultivaron siguiendo dos metodologías diferentes, denominadas A y B, y se empleó como sustrato el compuesto modelo dibenzotiofeno (DBT). La evaluación cuantitativa de los metabolitos generados en ambos casos se realizó mediante cromatografía líquida de alta eficiencia (HPLC). Trece cepas bacterianas, incluyendo el Rhodococcus rhodocrous (IGTS 8), se valoraron y compararon con los métodos A y B. En el método A, el inoculo es expuesto al DBT desde el inicio del crecimiento. El método B consta de dos etapas: (i) Período de crecimiento bajo condiciones limitantes de azufre, (ii) Período de transformación en el cual el inoculo crecido es expuesto al sustrato orgánico azufrado. El cultivo de aislamientos bacterianos mesófilos, siguiendo la metodología B, permitió inducir la expresión del metabolismo del azufre orgánico y valorar la capacidad desulfurizadora de cuatro cepas nativas. En los cultivos de estas bacterias se detectó, tanto cualitativa como cuantitativamente, 2- hidroxibifenilo (2- HBP), producto del metabolismo del DBT.
Palabras clave: biodesulfurización, aeróbico, dibenzotiofeno, DBT, degradación.
ABSTRACTT
The development of biodesulfurization ( BDS) processes for hydrocarbons requires fast and reliable methods for the screening of microorganisms. This work shows the results of the screening process for indigenous Colombian strains with a BDS potential capacity. The main criteria for the screening was the qualitative and quantitative determination of 2-hydroxybiphenyl (2-HBP) as the typical metabolite of the 4S specific pathway. Microorganisms were cultured by two methodologies, A and B, using DBT as the model compound. The quantitative determination of metabolites was made by HPLC. Thirteen strains were evaluated, including the strain Rhodococcus rhodocrous IGTS8, by methods A and B. In method A, the inoculum was exposed to DBT since the beginning of the culture. Method B, employed two stages: (i) Growth period under limiting sulfur conditions, (ii) Transforming period, in which the pre-grown inoculum was exposed to the organic sulfur substrate. The culture of mesophilic microorganisms isolated by method B, served to find a mechanism for the organic sulfur metabolism, and the evaluation of the sulfur removal capability of five indigenous strains. In the cultures of these strains, 2- hydroxybiphenyl (2-HBP) was detected as a byproduct of DBT metabolism, both qualitatively and quantitatively.
Keywords: biodesulfurization, aerobic, dibenzothiophene, DBT, degradation.
INTRODUCCIÓN
El azufre orgánico presente en los combustibles fósiles está directamente relacionado con la corrosión de tuberías, bombas y equipos de refinería y con el daño prematuro de la maquinaria de combustión. Además, el azufre es la causa de envenenamiento de muchos catalizadores empleados en la industria de la refinación del petróleo. Por otra parte, la emisión atmosférica de productos azufrados, como el dióxido de azufre, durante la precombustión y combustión tiende a formar depósitos ácidos, conocidos como lluvia acida, la cual causa deterioro sobre ecosistemas acuáticos, forestales y agrícolas, (Monticello, 1993).
El azufre es el tercer elemento en abundancia en el petróleo y su concentración relativa en las fracciones del crudo se incrementa en el orden: saturados < aromáticos < resinas < asfáltenos (Hartdegen et al, 1984).
Actualmente en las refinerías se trata el petróleo para disminuir el contenido de azufre por medios fisicoquímicos, como la hidrodesulfurización. Sin embargo, existen algunas formas orgánicas que son difíciles y costosas de eliminar por esta vía. Una alternativa es la utilización de microorganismos con capacidad de remover selectivamente el azufre de los combustibles sin modificar su poder calorífico, tal es el caso de Rhodo-coccus rhodochrous IGTS 8 (Kilbane, 1990).
Idealmente los microorganismos con capacidad biodesulfurizadora podrían atacar el azufre presente en los hidrocarburos sin alterar el esqueleto carbonado o afectar otros componentes valiosos del crudo o del carbón (Shennan, 1996). De esta forma el desarrollo en el área de la biodesulfurización tiene como objetivo prioritario identificar y caracterizar biocatalizadores adecuados para remover, a escala industrial, el azufre orgánico presente en los combustibles fósiles, (Yamada et al, 1968; Kayser et al, 1993; Monticello, 1993; Monticello, 1994; Shennan, 1996; Ózbas et al, 1996).
Empleando como compuesto modelo el dibenzotiofeno y sus derivados, algunos investigadores han reportado el hallazgo de microorganismos con capacidad para remover selectivamente el azufre de los combustibles sin modificar su poder calorífico, liberando los átomos de azufre como sulfato en procesos aeróbicos o sulfuro de hidrógeno en procesos anaeróbicos (Crawford and Gupta, 1990; Kilbane II and Jackowski, 1992; Wang and Krawiec, 1994; Ohshiro et al, 1995).
Hasta el momento se han reportado tres rutas para la biodegradación °de DBT: (i) Ruta anillo-destructiva, en la que un anillo del DBT es destruido produciendo un compuesto hidrolizado, pero el azufre permanece. (ii) Ruta destructiva, en la que el DBT es transformado a dióxido de carbono, sulfito y agua, (iii) Ruta denominada azufre específica o ruta 4S. En este caso el azufre presente en el DBT se remueve como sulfato y se genera el 2-hidroxibifenilo (2-HBP) (Ohshiro et al, 1995). Algunos de los intermediarios metabólicos en esta ruta son el 5-óxido de dibenzotiofeno o sulfona de dibenzotiofeno (DBT-S02) y el 5,5-dióxido de dibenzotiofeno o sulfóxido de dibenzotiofeno (DBT-SO), (Oldfield et al., 1997). La Figura 1 ilustra la ruta azufre específica ó 4S.
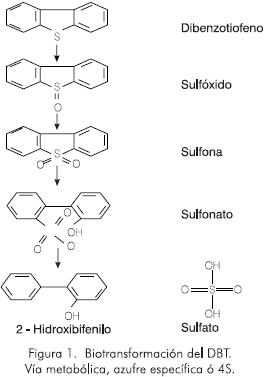
Sólo las cepas que siguen la segunda y la tercera ruta podrían ser aplicadas en los procesos de desulfurización microbiana porque liberan el azufre de los anillos bencénicos. Entre las cepas reportadas como azufre específicas se tienen Rhodococcus rhodochrous (IGT8), Rhodococcus KUCC 8801, Rhodococcus erythropolis D-l y Rhodococcus erythropolis H-2, Desulfovibrio desulfuricans Mb, Cunninghamella elegans y Corynebacterium sp. strain SYI, entre otras (Crawford and Gupta, 1990; Kim et al, 1990; Sorkhoh et al, 1990; Kilbane II and Jackowski, 1992; Omori et al, 1992; Olson et al, 1993; Gallagher et al, 1993; Izumi et al, 1994; Ohshiro et al, 1995.). Los estudios muestran que, en los procesos de desulfurización empleando la cepa Rhodococcus rhodochrous, el 2-HBP, se genera durante la fase estacionaria (Gallagher et al., 1993; Ohshiro et al, 1995).
Existen varios métodos reportados para la evaluación de microorganismos con utilidad potencial en procesos de BDS: (i) Prueba de biodisponibilidad, mediante la cual se evalúa el metabolismo microbiano ante fuentes orgánicas e inorgánicas azufradas, con la presencia o ausencia de la fuente de carbono (Kilbane II and Woodstock III., 1991ay 1991b). (ii) Fluorescencia en placa, metodología en la cual se detecta la fluorescencia azul como resultado de la producción de 2-HBP (Krawiec, 1990). (iii) Cultivos microbiológicos en los que se evalúan analíticamente los metabolitos (Yamada et al, 1968; Kodama et al, 1970; Kodama et al, 1973).
En este trabajo se aplicaron los métodos (ii) y (iii) como criterio de evaluación cualitativa y cuantitativa de los metabolitos típicos de la ruta de biodesulfurización 4S. La evaluación cualitativa corresponde a la detección de la fluorescencia generada por el metabolito 2-HBP en cultivos en placa. Los cultivos microbianos se prepararon siguiendo las metodologías denominadas A y B. En el primer caso existe una exposición al sustrato orgánico azufrado DBT, desde el momento de la inoculación (Yamada et al., 1968 ), mientras que en el segundo se da un precrecimiento de las células en condiciones limitantes de azufre, con posterior exposición al compuesto modelo. El método B, implementado en el laboratorio de Biotecnología del ICP, se fundamenta en las condiciones de estrés microbiano, en los cuales se aumenta la capacidad de las cepas para metabolizar azufre orgánico y se induce la ruta metabólica 4S. De esta manera es posible detectar y seleccionar microorganismos biodesulfurizadores que, al ser evaluados por otras técnicas de selección, serían descartados. Los metabolitos generados en ambos casos se cuantificaron mediante la técnica de HPLC y se emplearon como criterio para determinar la capacidad desulfurizadora de las bacterias y sus condiciones de cultivo.
MATERIALES Y MÉTODOS
Medio de cultivo
Los microorganismos se cultivaron en el medio basal de sales descrito en la Tabla 1, denominado "Medio Basal Salino ICP", una modificación del reportado por Kilbane and Bielaga en 1990, debido a que, en previos ensayos, con esta formulación se presentó mayor crecimiento de la población microbiana.
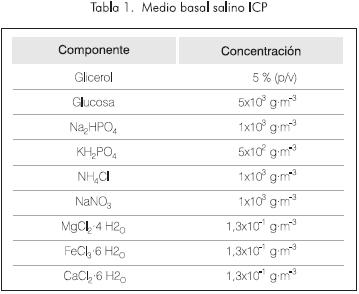
La capacidad desulfurizadora que presentan las cepas bacterianas nativas se evaluó empleando el DBT como molécula patrón. Éste se adicionó solubilizado en etanol (1% v/v) hasta obtener una concentración final de 10 g·m-3 en el medio de cultivo.
Microorganismos
Los microorganismos nativos evaluados en el ensayo de biodesulfurización se aislaron previamente en el Laboratorio de Biotecnología del Instituto Colombiano del Petróleo a partir de fuentes naturales y derivados del petróleo, mediante enriquecimiento y aislamiento directo. El medio descrito en la Tabla 1 se completó con glutamato (5·3 g·m-3), con el fin de aumentar la potencia de la fuente de carbono, con 0,5 g de sulfato de potasio (K2S04) como fuente inorgánica de azufre. Los microorganismos se adicionaron al medio en una concentración del 10% v/v y se incubaron en agitación (150 rpm) a 303 K por tres días. Después de tres pases sucesivos en las condiciones descritas se cambió la fuente azufrada por DBT en una concentración final de 20 g·m-3. Las 13 cepas aisladas, denominadas BDS 1, BDS 3, BDS 10, BDS 11, BDS 12, BDS 27, BDS 28, BDS 29, BDS 30, BDS 31, BDS 32, BDS 33, y BDS 34, se caracterizaron mediante tinción de gram, como cocobacilos gram negativos y bacilos gram positivos. Además se incluyó como control positivo la cepa Rhodococcus rhodochrous IGTS8, proveniente del cultivo de colección de la ATTC. No. 53968, la cual metaboliza el DBT siguiendo la ruta 4S (Patel et al, 1997).
Evaluación de la capacidad bioesulfurizadora
La capacidad que presentan las cepas nativas para metabolizar DBT se determinó en cultivos sólidos y líquidos mediante la técnica cualitativa de fluorescencia en placa y la técnica cuantitativa de cromatografía líquida de alta eficiencia, respectivamente. Todos los ensayos se realizaron por duplicado.
Fluorescencia en placa
Los microorganismos se sembraron por agotamiento en medio sólido, constituido por las sales descritas en la Tabla 1, solidificado con agar al 1,5 %. Una vez logrado el crecimiento microbiano se realizaron tres aspersiones consecutivas de una solución de 1.000 g·m-3 de DBT en éter dietílico. Las placas se incubaron a 303 K, durante ocho días. Transcurrido este período de tiempo las placas se irradiaron con luz ultravioleta empleando un trasluminador Fotodyne operado a 260 nM. El análisis se realizó con base en la fluorescencia emitida por el 2-HBP, generado durante la biotransformación del DBT. Como controles positivos se utilizaron placas del mismo medio, suplementadas con 25, 50 y 100 g·m-3 de 2-HBP. Todos los ensayos se realizaron por triplicado y como control negativo se utilizó el medio de cultivo sin inocular.
Cultivos líquidos
Los cultivos bacterianos se prepararon mediante las metodologías denominadas A y B, ilustradas en la Figura 2. En cada caso los sobrenadantes fueron extractados y analizados mediante cromatografía líquida de alta eficiencia.
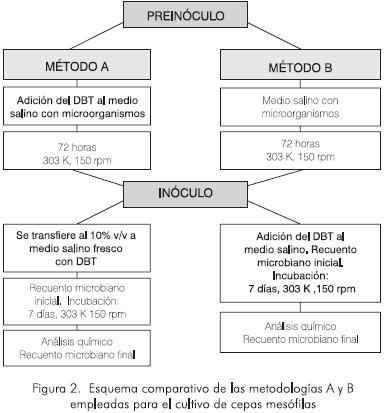
Metodología A
Figura 2. Esquema comparativo de las metodologías A y B empleadas para el cultivo de cepas mesófilas los microorganismos por evaluar. Para esto, una colonia proveniente de medio sólido (agar nutritivo) se adicionó a un tubo de ensayo de 15·106m3 que contenía 1,98·10-6m3 del medio salino descrito en la Tabla 1 y 2·10-3m3 de una solución concentrada (1.000 g·m-3) de DBT en etanol. Cada tubo se incubó con agitación vertical (150 rpm) a 303 K durante 72 h.
Fase II. El preinóculo de la Fase I se mezcló con medio de cultivo fresco en una concentración del 10 % v/v, hasta alcanzar un volumen final de 1·10-5 m3. Los cultivos resultantes se incubaron en las mismas condiciones de la preincubación durante siete días. Los metabolitos generados en el proceso de biotransformación se analizaron mediante HPLC y la población microbiana se cuantificó al inicio y al final del experimento. Para cada experimento de biodegradación se preparó un control negativo, al que no se adicionaron microorganismos y, como control positivo, se realizó el ensayo con la coca. Rhodococcus rhodochrous IGTS8.
Metodología B
Fase I. En tubos de ensayo de 15·10-6 m3 se adicionaron 9·10-6 m3 del medio de cultivo descrito en la Tabla 1. En cada tubo se adicionó una colonia del microorganismo por evaluar, proveniente de un cultivo en medio sólido (agar nutritivo). Estos tubos se incubaron con agitación vertical (150 rpm) a 303 K durante 72 h.
Fase II. Transcurrido este período de preincubación, a cada tubo se le adicionó 0,1·10-6 m3 de una solución concentrada (1.000 g·m-3) de DBT en etanol y 0,9·10-6m3 de medio salino, con el fin de alcanzar una concentración final de 10 g·m-3 DBT en la reacción. Después de adicionar el sustrato azufrado se continuó con el proceso de incubación durante siete días, en idénticas condiciones de la preincubación.
En ambos procedimientos la población microbiana inicial se cuantificó al adicionar el DBT al medio de reacción. Es decir, al finalizar el primer periodo de incubación (Fase I) y la población microbiana final, se determinó al finalizar el período de biotransformación (Fase II) (Figura 2). La capacidad desulfurizadora de las cepas se determinó con base en el análisis cualitativo y cuantitativo de los metabolites orgánicos típicos de la ruta 4S, generados durante el proceso microbiano y evaluados mediante cromatografía líquida de alta eficiencia. Todos los ensayos de biodesulfurización se realizaron por duplicado. Se incluyeron cuatro controles negativos preparados y procesados siguiendo el protocolo descrito anteriormente, excluyendo la adición de células microbianas. Además se incluyó un control positivo usando la cepa Rhodococcus rhodochrous IGTS8, la cual sigue la ruta metabólica 4S (Pate etal., 1997).
Crecimiento microbiano
El crecimiento microbiano se cuantificó mediante la técnica de recuento estándar en placa, utilizando agar nutritivo.
Cromatografía líquida de alta eficiencia (HPLC)
Después de la incubación, los cultivos se acidificaron con ácido clorhídrico 0,1 N a pH < 2 y se extrajeron, con 3·10-6 m3 de n-hexano, tres veces consecutivas. La fracciones orgánicas se unieron y concentraron bajo corriente de nitrógeno hasta un volumen de 1·10-6 m3. La identificación y cuantificación de los metabolites generados durante el proceso se realizó mediante cromatografía líquida de alta eficiencia. 5·10-10 m3 del extracto orgánico se inyectaron a un cromatógrafo líquido Hewlett-Packard (HP) 1090 equipado con un detector de luz ultravioleta (254 nm) y un sistema computarizado de datos (SCD). Para la separación de los metabolites se utilizó una columna capilar de silica fundida con fases reversas de polimetilsiloxano (HF-5-C18, Perkin Elmer) de 0,25 m x 4,6·10-3 m I.D. x 0,5 um de espesor de película interna. Como eluente se empleó una mezcla de agua y acetonitrilo, en relación 70:30, con gradiente de acetonitrilo hasta 100 y un flujo de 1·10-6m3·min-1.
La identificación de los componentes presentes en la muestra se realizó con base en sus tiempos de retención relativos a una sustancia patrón: 2-hidroxibifenilo (2-HBP), bifenilo (BP) y sulfona de dibenzotiofeno (DBTS02). Para el análisis cuantitativo de las muestras se empleó el método de estándar externo, con curvas de calibración para los patrones en el rango de 0 -100 g·m-3
RESULTADOS Y DISCUSIÓN
De las trece cepas evaluadas mediante cultivos en placa, sólo las cepas BDS1, BDS 3, BDS 10, BDS 11 y BDS 12 emitieron fluorescencia bajo la radiación ultravioleta, indicativo de la generación de 2-HBP. Sin embargo, estos resultados no fueron repetitivos para las tres réplicas evaluadas y se corroboraron únicamente en los cultivos líquidos preparados utilizando la metodología B, en los cuales se detectó y cuantificó, mediante HPLC, el 2-HBP (Tabla 2). Este comportamiento sugiere que los microorganismos en fases tardías de crecimiento y bajo condiciones de estrés, debido a la baja concentración de azufre en el medio, metabolizan el DBT generando 2-HBP, metabolite típico de la ruta 4S. Los resultados analíticos obtenidos para cada una de las cepas cultivadas mediante las metodologías A y B y evaluadas mediante HPLC se registran en la Tabla 2.
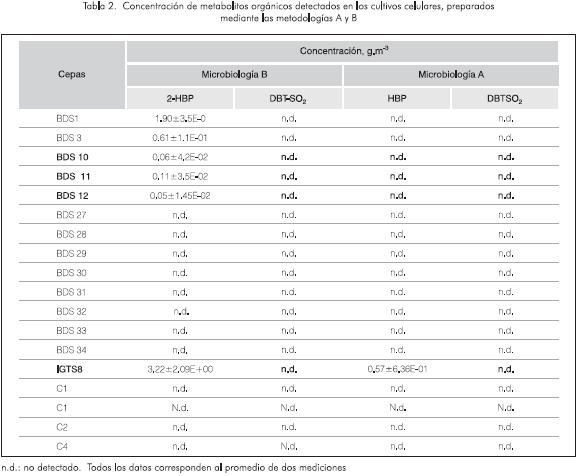
La cepa utilizada como control positivo, Rhodococcus rhodochrous IGTS8, afectada por transformaciones genéticas y con capacidad para metabolizar azufre, generó una concentración de 2-HBP más alta cuando se cultivó siguiendo la metodología B (Tabla 2). Esto indica que la metodología propuesta en el laboratorio de Biotecnología del ICP puede ser más apropiada para evaluar microorganismos biodesulfurizadores dado que, bajo estas condiciones, las bacterias generan mayores concentraciones de 2-HBP, lo que permite seleccionar aun aquellas cepas que tienen baja capacidad para biotransformar el DBT y que posteriormente podrían ser mejoradas mediante ingeniería genética.
Ninguno de los cultivos celulares preparados mediante las dos metodologías mostró cambios poblacionales significativos (datos no tabulados), ni la generación de DBT-S02.
CONCLUSIONES
-
Los cultivos microbianos mesófilos, evaluados mediante la metodología B, permitieron inducir la expresión del metabolismo del azufre orgánico en las cepas bacterianas. De esta forma se detectaron y
-
seleccionaron como biodesulfurizadoras cinco cepas nativas, que no mostraron capacidad para metabolizar el DBT al ser cultivadas mediante la metodología A. Las cepas denominadas BDS 1, BDS 3, BDS 10, BDS 11 y BDS 12 biotransformaron el DBT generando 2- HBP, metabolito típico de la ruta 4S, lo que permite suponer que podrían ser utilizadas en procesos de biorrefinación, sin alterar el poder calorífico del crudo.
-
Las cepas nativas aisladas y seleccionadas en el laboratorio de Biotecnología del ICP, a partir de cultivos preparados siguiendo la metodología B, son promisorias en la búsqueda de un biocatalizador para remover el azufre orgánico presente en el petróleo,y podrían ser transformadas genéticamente a fin de incrementar su capacidad biodesulfurizadora.
-
De estos ensayos se concluye que la metodología B, propuesta en el laboratorio de Biotecnología del ICP para el cultivo microbiano de cepas mesófilas, juega un papel muy importante en el proceso de selección de cepas desulfurizadoras, permitiendo detectar cepas que bajo las condiciones de cultivo propuestas en la metodología A no muestran capacidad de BDS.
AGRADECIMIENTO
Los autores expresan sus agradecimientos al grupo de biodesulfurización, especialmente a la ingeniera Gladys Rosero, al químico Giovanny Varón, la microbióloga Fanny Devia y al bioquímico Rodrigo Torres por el aporte de sus experiencias. A los laboratorios de Biotecnología y de Cromatografía del Instituto Colombiano de Petróleo por su colaboración en el procesamiento de las muestras y al Instituto Colombiano del Petróleo por la financiación del presente proyecto .
REFERENCIAS
Crawford D. L. and Gupta R. K., 1990. "Oxidation of dibenzothiphene by Cunninghamella elegans", Curr Microbiol, 21: 229-231. [ Links ]
Gallagher, J. R, Olson, E. S. and Stanley D. C, 1993. "Microbial desulfurization of dibenzotiofene: A sulfur-specific pathway", FEMS Microbiology Letters, 107: 31-36. [ Links ]
Hartdegen, E. J., Coburn, J. M. and Roberts, R. L, 1984. "Microbial Desulfurization of Petroleum", CEP: 63 - 67. [ Links ]
Izumi, Y, Ohshiro, T., Ogino, H., Hiñe, Y and Shimao M., 1994. " Selective desulfurization of dibenzothiophene by Rhodococcus erythropolis D", Appl. Microbiol Biotechnol., 60: 223 -226. [ Links ]
Kayser, K. J., Bielaga, B. A., Jackowski, K., Odusan, O. and Kilbane II, J. J.1993. "Utilization of organosulfur compounds by axenic and mixed cultures of Rhodococcus rhodochorous IGTS 8", J. Gen Microbiol, 139: 3123 -3129. [ Links ]
Kilbane, J. J. 1990. "Biodesulfurization: future prospects in coal cleaning", Proc. 7Th annual int Pittsburgh coal conf.: 373 - 382. [ Links ]
Kilbane,J J. and Bielaga, B. A. 1990. "Toward sulfur - free fuels", Chemtech, 20: 747-51. [ Links ]
Kilbane II, J. J and Jackowski, K. 1992. "Biodesulfurization of water-soluble coal - derived material by Rhodococcus rhodochorous IGTS 8", Biotechnol Bioeng, 40: 1107 -1114. [ Links ]
Kilbane II J. J. and Woodstock III., 1991a. "Mutant Microorganisms useful for cleavage of organic C - S bonds", Patent 5002888. [ Links ]
Kilbane II J. J. and Woodstock III. 1991b. "Mutant Microorganisms useful for cleavage of organic C - S bonds", Patent 5104801. [ Links ]
Kim, H. Y, Kim, T. S. And Kim, B. H., 1990. "Degradationof organic sulfur compounds and the reduction of diben-zotiophene to biphenyl and hydrogen sulfide by Desulfovibrio desulfuricansMb" Biotechnollett., 12: 761-764. [ Links ]
Kodama, K, Nakatani, S. And Umehara, K. 1970. "Microbial conversion of petro - sulfur compounds part III. Isolation and identification of products from DBT", Agrie. Biol. Chem, 34: 1320 -1324. [ Links ]
Kodama, K, Umehara, K. and Minoda, S. 1973. "Identification of microbial products from DBT and its proposed oxidation pathway", Agr Biol. Chem., 37:1320 -1324. [ Links ]
Krawiec, S. 1990. "Bacterial desulfurizaation of thiophenes: screening techniques and some speculation regarding the biochemical and genetic bases", Dev. Ind. Microbiol 32: 103-114. [ Links ]
Monticello, D. J., 1993. "Biocatalytic desulfurization of petroleum and middle distillates", Environmental Progress, 12 (1): 1-4. [ Links ]
Monticello, D. J., 1994. "Biocatalytic desulfurization, Hydrocarbon Processing", Clean Fuels Technology (February): 39-45. [ Links ]
Ohshiro, T., Hirata T. and Izumi, Y, 1995. "Microbial desulfurization of dibenzothiophene in the presence of hydrocarbons", Appl. Microbiol Biotechnol., 44: 249 -252. [ Links ]
Olson, E. S., Stanley, D. C. and Gallagher, J. R, 1993. "Characterization of intermediates in the microbial desulfurization of dibenzothiophene", Energy & Fuels, 7: 159-164. [ Links ]
Oldfield, C, Pagrebinsky, O, Simons, J., Olson, E. S. and Kulpa, Ch. F. 1997."Elucidation of the metabolic pathway for dibenzothiophene desulfurization by Rhodococcus sp. strain IGTS8 (ATCC 53968)", Microbiology, 143: 2961 -2973. [ Links ]
Omori, T., Monna, L., Saiki, Y. and Kodama T., 1992. "Desulfiirization of dibenzothiophene by Corynebacterium sp. strain SYI", Appl. Environ Microbiol, 58: 911 - 915. [ Links ]
Özbas;, T., Durusoy, T. Erincin, E. and Yürüm, Y 1996." Optimization of the growth parameters of Rhodococcus rhodochorous, a sulfur - removing", Fuel, 75 (13): 1556 -1600. [ Links ]
Patel, S. B., Kilbane II, J. J. and Webster D. A. 1997. "Biodesulphurization of dibenzothiophene in hydrophobic media by Rhodococcus sp. strain IGTS", Chem Tech. Biotechnol, 68: 1-7. [ Links ]
Shennan J. L. 1996. "Microbial attack on sulphur containing hydrocarbon implications for Biodesulfurization of oils and coals", J.Chem. Tech. Biotechnology, 67: 109 -123. [ Links ]
Sorkhoh, N. A., Ghannoum, M. A., Ibrahim. A. S., Stretton, R. J. and Radwan, S.S., 1990. "Crude oil and hydrocar-bodegrading strain of Rhodococcus rhodochrous isolated from soil and marine environments in Kuwait", Environment Pollution, 65: 1-17. [ Links ]
Wang P. and Krawiec, S., 1994. "Desulfurization of dibenzothiophene to 2- hydroxybiphenyl by some newly isolated bacterial strains", Arch Microbiol, 161: 266 -271. [ Links ]
Yamada, K., Minoda, Y, Kodama, K, Nakatani, S. and AkasaM, T., 1968. "Microbial conversion of petro - sulfur compounds. Part I. Isolation and identyification of Dibenzothiophene utilizing Bacteria", Agr Biol. Chem. 32 (7): 840-845. [ Links ]














