Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.1 Bogotá ene./jun. 2015
Inventario y estimación de la riqueza específica de artrópodos en bosques del Noreste de Argentina
Inventory and estimation of the species richness of arthropods in forests of Northeast of Argentina
MARÍA BELÉN CAVA1, MARÍA DEL CARMEN COSCARON2 y JOSÉ ANTONIO CORRONCA3
1 Dra. de la FCN y M-UNP. Pos Doc. CONICET-IEBI-FCN (UNSa). Av. Bolivia 5150 (4400), Salta, Argentina. belencava@iebi.com.ar. Autor para correspondencia.
2 Dra. de la FCN y M-UNP. Investigador Principal CONICET. Paseo del Bosque s/n° (1900), La Plata, Buenos Aires, Argentina. mcoscaron@ fcnym.edu.ar.
3 Dr. de la UNT. Investigador Adjunto CONICET-IEBI-FCN (UNSa). Prof. Asociado Cátedra de Artrópodos, UNSa. Av. Bolivia 5150 (4400), Salta, Argentina. jcorronca@iebi.com.ar
Resumen: El propósito de este estudio fue el realizar un relevamiento, estimación y comparación de la riqueza de especies de artrópodos entre los ambientes de Chaco Húmedo, Selva Paranaense y de la Isla Apipé Grande en la provincia de Corrientes. Se realizaron dos muestreos en 15 parches de bosques en el área de estudio, cinco en cada uno de los ambientes considerados, las muestras se tomaron con un G-Vac ("garden-vaccum") sobre vegetación. Se recolectaron 19.348 artrópodos de 1.242 morfoespecies. Los inventarios obtenidos en cada ambiente superaron el 74% alcanzando un 87% de completitud en el área de estudio. La Selva Paranaense es la que presentó una mayor abundancia y riqueza de especies en comparación con los otros dos ambientes. Las arañas, coleópteros, dípteros, hemípteros e himenópteros representaron el 90% de las especies registradas en todo el muestreo, obteniendo los mayores valores de diversidad. Estos grupos son considerados como indicadores de diversidad y responden a varios aspectos de la heterogeneidad del hábitat.
Palabras clave: Número de especies. Arthropoda. Biodiversidad. Ensambles.
Abstract: The purpose of this study was to estimate and compare the species richness of arthropods in environments of the Chaco Húmedo, Selva Paranaense and Isla Apipé Grande in Corrientes Province (Argentina). Two samplings in 15 forests patches in the study area were made, five on each of the three considered environments. The samples were taken with a G -Vac (garden-vaccum) over vegetation. A total of 19,348 arthropods were collected of 1,242 morphospecies. Inventories obtained in each environment exceeded the 74% until the 87% of completeness. The Selva Paranaense showed the highest abundance and species richness. Spiders, beetles, dipterans, hemipterans and hymenopterans accounted the 90% of all recorded species in the samplings, obtaining the highest values of diversity. These groups are considered as indicators of biodiversity and respond to various aspects of habitat heterogeneity, as this heterogeneity may influence the abundance and diversity patterns of these arthropod orders.
Key words: Number of species. Arthropoda. Biodiversity. Assemblages.
Introducción
El concepto de "riqueza de especies" es uno de los fundamentales en ecología de comunidades (Peet 1974). Teóricamente, el número total de especies puede determinarse para cualquier comunidad, considerando que es dependiente del tamaño de muestra (Walther y Morand 1998). Así, los inventarios de biodiversidad deben diseñarse en torno al uso de muestreos eficaces y procedimientos de estimación, sobre todo para grupos megadiversos como los artrópodos. Los urgentes desafíos del cambio climático, la transformación masiva del hábitat y la amenaza de extinción generalizada, han hecho de la extrapolación y la predicción un componente fundamental de muchos programas de estimación de diversidad (Colwell y Coddington 1994).
Para conservar la biodiversidad es necesario identificar e incluir una muestra lo más amplia y representativa posible de los componentes que conforman la biota de una región determinada (Humphries et al. 1995). Por lo tanto, la planificación de estrategias de conservación, sólo puede desarrollarse e im-plementarse una vez que los inventarios, o al menos inventarios parciales, sean completados (Whitmore et al. 2002). La diversidad local o diversidad alfa depende de los fenómenos locales ecológicos, cómo la selección de hábitat y las interacciones biológicas que varían en corto plazo (Moreno y Rodríguez 2010). Muchos de los trabajos de inventarios y estimaciones son realizados con especies/morfoespecies. Las morfoespecies pueden ser usadas para clasificar y representar la diversidad de insectos sin comprometer la precisión, reflejando que la medida más usada de diversidad es la riqueza de especies (Samways et al. 2010).
En la provincia de Corrientes existen tres regiones fito-geográficas: el Chaco Húmedo, la Selva Paranaense y el Espinal. Al norte de la provincia se encuentran las dos primeras regiones, adyacentes a la Isla Apipé Grande. Las características ambientales de las dos regiones y la isla son diferentes, por lo tanto resulta interesante comparar los inventarios faunísticos de los tres ambientes a fin de determinar si existen diferencias entre los distintos hábitats en función de dichas características ambientales y geográficas. Los artrópodos son totalmente dependientes del hábitat, por lo que se espera que cada ambiente presente ensambles particulares de acuerdo a los requerimientos ambientales de cada especie.
Existen algunos estudios realizados en grupos específicos de artrópodos en ambientes particulares de la provincia de Corrientes, por ejemplo, sobre odonatos (Muzón et al. 2008), dípteros (Coscarón 2003; Oscherov et al. 2005, 2007), isópteros (Torales et al. 2003), lepidópteros (Lazzeri et al. 2010), hormigas (Arbinoy Godoy 2003; Vittar 2008), heterópteros (Coscarón et al.2009), Araneae (Avalos et al. 2002; Avalos et al. 2005, 2007, 2009; Rubio et al. 2004) y artrópodos en general (Bar et al. 2004, 2005). Este estudio sería el primero en Corrientes en realizar un relevamiento, estimación y comparación de la riqueza de especies de artrópodos entre los ambientes de bosque del Chaco Húmedo, Selva Paranaense y de la Isla Apipé Grande. Corrientes está sufriendo una avanzada destrucción por acción antrópica de sus ambientes naturales donde seguramente una fauna importante se extinguirá antes de ser estudiada o recolectada. Este último año, la Isla Apipé Grande sufrió una de las grandes inundaciones de las últimas décadas debido a la crecida del Río Paraná que produjo la apertura de todas las compuertas de la represa Yacyretá, produciendo que el agua sobrepase el nivel máximo de las barrancas costeras de la isla. Por lo tanto, se considera que los Resultados obtenidos en colectas anteriores a esta catástrofe son de valor para el conocimiento general de la biodiversidad de esta área tan diversa del noroeste de Argentina. Al mismo tiempo, Morrone y Coscarón (1998) sostienen que es necesario un inventario faunístico para alcanzar una serie de objetivos a mediano y largo plazo, tales como el desarrollo de los medios útiles para preservar la biodiversidad de los artrópodos argentinos, manejar de modo sustentable los artrópodos como recursos biológicos, mantener servicios ecológicos fundamentales como la calidad del agua o el clima y el control de la erosión y generar recursos económicos.
Materiales y métodosÁrea de estudio. Se extiende entre los 29°11'05,59"S 58° 04'33,04"O en la provincia de Corrientes, Argentina, donde están representados ambientes pertenecientes a la Selva Paranaense, Chaco Húmedo e Isla Apipé Grande. El Chaco Oriental Húmedo es una extensa región que abarca la mitad oriental de Formosa y Chaco, Noroeste de Corrientes y Norte de Santa Fe. Los humedales cubren más del 80% del territorio del Chaco Oriental. Las comunidades vegetales se encuentran condicionadas por el gradiente topográfico que ocupan, y éste está relacionado, a su vez, con el gradiente de inundación (Brown et al. 2005). La Selva Paranaense ocupa toda la provincia de Misiones y el extremo Noreste de Comentes, y se continúa por el Este de Paraguay y Sur de Brasil (Bertonatti y Corcuera 2000). Esta selva posee los bloques boscosos remanentes más grandes y el valor más alto de bio-diversidad del país junto con las Yungas (Placi y Di Bitteti 2005). La Isla Apipé Grande, integra el sistema de reservas de la Provincia de Corrientes, en el que se incluyen Rincón Santa María, la Unidad de Conservación Galarza y la Reserva Natural Iberá (Colonia Pellegrini), las dos últimas en el sistema de los Esteros del Iberá. Esta isla se ubica en el norte de la provincia, frente al departamento Ituzaingó, a 2 km río abajo de la represa de Yacyretá, y comprende casi 30.000 ha. La región presenta un clima subtropical perhúmedo.
Muestreo y análisis de datos. Se realizaron dos muestreos, uno en primavera (noviembre 2006) y otro en otoño (mayo 2007) siendo estas estaciones del año complementarias para la captura de artrópodos (Coscarón et al. 2009). Se seleccionaron 15 sitios de bosque en el área de estudio, cinco en cada uno de los ambientes considerad os (Chaco Húmedo, Selva Paranaense y la Isla Apipé Grande), separados por no menos de 1 km y de acuerdo con la posibilidad de acceso dentro de las isletas de bosques. En cada sitio de muestreo georeferen-ciado, se tomaron 10 muestras de artrópodos con un "garden-vaccum" (G-Vac) Stihl sobre la vegetación, el cual posee un tubo aspirador de 1.10 m de longitud y 12 cm de diámetro, dividido en el medio donde contiene una malla delgada para recolectar artrópodos. Cada muestra, separada por 10 m, fue tomada al azar y consistió en la succión de la vegetación en un área de un metro cuadrado por el término de un minuto, hasta 2 m de altitud. El material recolectado en cada una de las muestras fue colocado en bolsas de polietileno con alcohol etílico al 70%, debidamente rotuladas y se trasladaron al laboratorio.
Se generaron curvas de rarefacción basadas en individuos para cada sitio usando el programa Ecosim (Entsminger 2012), a fin de asegurar que cualquier respuesta que se detecte no sea producto de sesgos del muestreo (Krebs 1989). También se realizaron curvas de acumulación de especies basadas en individuos para cada sitio usando el programa EstimateS 7.0 (Colwell 2004). Con el mismo programa se evaluó el desempeño de diferentes estimadores no paramétricos de riqueza de especies (ACE, Chao1, Jacknife1, y Michaelis-Menten) en cada uno de los sitios estudiados los que de compararon con la riqueza observada (Sobs) para analizar cuan completo fue el inventario obtenido (Walther y Morand 1998).
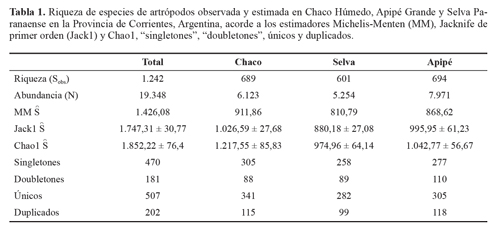
Resultados Inventario y estimadores no paramétricosUn total de 19.348 artrópodos adultos se recolectaron en 150 muestras, representantes de 1.242 especies/morfoespecies y 20 órdenes. La Selva Paranaense es la que presentó una mayor abundancia y riqueza de especies (S = 694 n = 7.971) en comparación con el Chaco Húmedo (S = 689 n = 6.123) y la Isla Apipé Grande (S = 601 n = 5.254).
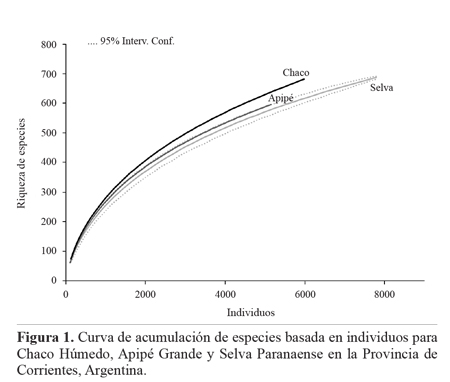
En el análisis de rarefacción se observó que interpolando al menor número de individuos (n = 5.254), el Chaco fue el ambiente más rico en especies (S = 644; DS = 11), por lo que pudo determinarse que la riqueza observada en este ambiente fue significativamente mayor que la riqueza de especies de los otros dos. El ambiente con menor número de especies fue Selva Paranaense (S = 585; DS = 17) (Fig. 1).
Los inventarios obtenidos en cada ambiente superaron en todos los casos el 74% de los valores esperados mediante el estimador Michelis-Menten. Se evidenció que el inventario de Selva Paranaense fue el más completo donde los estimadores Michaelis-Menten y Jacknife1 calcularon un 20 y 30% de especies más que las observadas, respectivamente (Tabla 1).
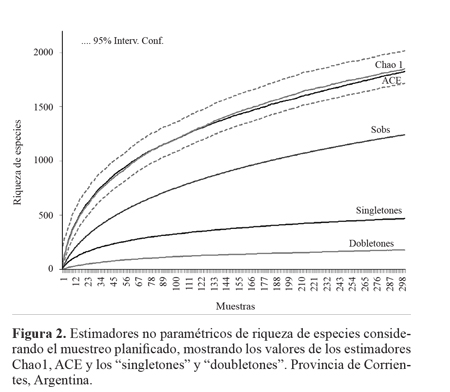
Asimismo, las curva de "singletones" y "doubletones" tienden a una asíntota, ratificando que se logró un buen inventario (Fig. 2; Tabla 1). El porcentaje de "singletones" fue moderado, llegando a un poco menos del 38%, mientras que el de "doubletones" fue bajo (14,57%). El porcentaje de "singletones"en Chaco fue bastante elevado, con un 44% y el de "doubletones" fue bajo con 13%. En Apipé los "singletones" llegaron al 43% y los "doubletones" 15%, mientras que en Selva ellos representaron el 40% y 16%, respectivamente.
Composición de los ensambles de los órdenes más representativos
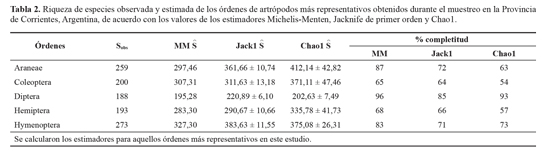
Arañas, coleópteros, dípteros, hemípteros e himenópteros representaron el 90% de las especies registradas en este estudio. Al comparar la completitud del inventario de dichos órdenes se determinó, a partir de estimadores no paramétricos basados en incidencia y abundancia, que el protocolo de muestreo fue eficiente para cada uno de ellos, aunque tanto en arañas, dípteros e himenópteros se logró un porcentaje más elevado de completitud del inventario (Tabla 2).
Se recolectaron 21 órdenes de artrópodos, de los cuales Diptera, Araneae, Hymenoptera, Coleoptera y Hemipte-ra fueron los más abundantes y ricos en especies (Tabla 3) al comparar los ambientes estudiados. Si bien los dípteros, arañas, himenópteros, coleópteros y hemípteros fueron los grupos más abundantes y diversos en cuanto a riqueza de especies, se observó un cambio en los ensambles de los artrópodos en los tres ambientes estudiados (Fig. 3).
La comunidad de arañas del Chaco Húmedo presentó el mayor número de especies y la mayor abundancia en comparación a los otros dos ambientes, siendo Apipé quien presentó los menores valores (Fig. 3A). La familia con mayor número de especies en los tres ambientes fue Araneidae, la que a su vez fue la más abundante en Apipé Grande (34%), Linyphii-dae representó el 45% del total de arañas de Chaco, mientras que en Selva Paranaense, tanto Linyphiidae (21%), Aranei-dae (19%), Anyphaenidae (18%) como Theridiidae (16%) mostraron abundancias similares. Theridiidae y Salticidae fueron ricas en especies en todos los ambientes.
El mayor porcentaje de coleópteros fue registrado en Chaco (46%) y el menor en Apipé Grande (22%), mostrando la Selva Paranaense una mayor diversidad de ellos en el área de estudio. Chrysomelidae fue la familia con más representantes tanto en Chaco como en Selva Paranaense, mientras que en Apipé dominó Curculionidae (Fig. 3B).
Entre los dípteros, los quironómidos mostraron una destacada dominancia en los tres ambientes, con abundancias marcadamente superiores al resto de las familias (Chaco: 43%, Apipé: 66%, Selva: 34%). En Apipé y Selva Paranaen-se, Ceratopogonidae presentó el mayor número de especies, mientras que en el Chaco ellos con los clorópidos estuvieron representados por 18 especies cada uno (Fig. 3C). Selva Pa-ranaense obtuvo los valores más altos en número de especies e individuos de dípteros, seguido por Chaco en cuanto a la riqueza y Apipé a la abundancia.
Dentro del orden Hemiptera (Fig. 3D), los cicadélidos fueron los más representativos tanto en riqueza de especies como en abundancia, seguidos por los míridos que en los tres ambientes presentaron la mayor riqueza específica. El resto de las familias, si bien no fueron abundantes, mostraron cambios en su abundancia relativa en los distintos ambientes. Mientras que algunas resultaron exclusivas de algún ambiente, otras se encontraron ausentes en alguno de ellos. La riqueza de especies y la abundancia de hemípteros en Chaco y Selva fueron similares, mientras que en Apipé se obtuvo la mayor abundancia y la menor riqueza de especies.
Los formícidos fueron el grupo más abundante dentro de los himenópteros en todos los ambientes (Fig. 3E), siendo la misma especie de Crematogaster Lund, 1831 (Hymenoptera: Formicidae) dominante en Chaco Húmedo y Selva Paranaen-se, mientras que otra especie del mismo género (Crematogaster sp. 2) lo fue en Apipé Grande. Otras tres familias exclusivamente de parasitoides fueron abundantes en todos los ambientes: Braconidae, Eulophidae y Scelionidae. Las hormigas también presentaron el mayor número de especies en Chaco y Selva; mientras que en Apipé fueron los bracónidos. La riqueza de especies de himenópteros fue prácticamente la misma en los tres ambientes (con cuatro especies más en Selva que en Chaco y Apipé).
DiscusiónEl número de especies es, quizás, el atributo más frecuentemente utilizado a la hora de describir una comunidad, y es un parámetro comúnmente empleado para comparar localidades diferentes (Gaston 1996; Gotelli y Colwell 2001; Magurran 2004), lo que le confiere una gran importancia en los estudios de Biodiversidad y Biología de la Conservación. Sin embargo, la mayoría de los inventarios faunísticos son forzosamente incompletos, debido a la imposibilidad de registrar el total de especies cuando trabajamos con grupos muy diversos pero pobremente conocidos como los artrópodos (Colwell y Coddington 1994; Hammond 1994). A pesar de ello, mediante nuestro relevamiento se logró un inventario completo con valores superiores al 87% de las especies estimadas por los estimadores no paramétricos más próximos a la riqueza observada para el área de estudio. La elevada proporción de especies/morfoespecies representadas por un solo individuo y dos individuos ("singletones" y "doubletones") en nuestro estudio, coincide con la fauna tropical y neotropical de artrópodos, caracterizadas por presentar un alto número de especies, las cuales en su mayoría exhiben bajas densidades poblacionales o son raras (Silva 1996; Silva y Coddington 1996; Flórez 1998; Avalos et al. 2009).
En las unidades de paisaje exploradas dentro de cada clase (Insecta, Arachnida y Crustacea) hubo órdenes constantes, mientras que otros fueron ocasionales (Dermaptera, Pseu-doescorpionida e Isopoda). Las arañas, dípteros, himenóp-teros (principalmente formícidos), coleópteros y hemípteros fueron dominantes respecto a otros en los distintos ambientes. En arañas, dípteros e himenópteros el inventario obtenido es completo, mientras que en los de coleópteros y hemípteros llegan un poco más del 50% de completitud, indicando que el protocolo de muestreo fue bastante eficiente para cada uno de estos órdenes, debido a que cuando hay menos del 50% de especies no detectadas, el muestreo se considera completo (Chao et al. 2009).
Las arañas son un grupo clave en cualquier ecosistema y pueden ser utilizadas como indicadoras de calidad ambiental (Pinkus-Rendón et al. 2006), debido a que son dependientes del hábitat y su complejidad (Weeks y Holtzer 2000; Pearce et al. 2003). La familia Araneidae es la más diversa en todos los ambientes estudiados ya que habita casi todos los estratos arbóreos y ocupa una gran cantidad de nichos ecológicos. Estos datos concuerdan con los Resultados obtenidos por diversos autores (Flórez 1998; Avalos et al. 2005; Rico et al. 2005; Avalos et al. 2007; Cabra-García et al. 2010; Escorcia et al. 2012) donde las comunidades de arañas de telas orbiculares (Araneidae), encuentran una gran oferta de hábitats entre los estratos de la vegetación arbóreo-arbustiva para construir la tela y capturar sus presas (Jiménez-Valverde et al. 2009). La estructura del hábitat, y más precisamente la complejidad de la vegetación, ha sido consistentemente reconocida como uno de los factores más importantes que determinan la presencia de arañas, así como su riqueza de especies y composición (Jiménez-Valverde y Lobo 2007). Así, a pesar de la ausencia de una fuerte asociación de las arañas con la planta hospeda-dora, el tipo de vegetación puede ser un importante factor en la determinación de los ensambles de arañas por su relación con la estructura de la vegetación (Jiménez-Valverde y Lobo 2007). Theridiidae y Salticidae (arañas saltadoras) también presentaron una elevada riqueza de especies. Los theridiidos son de habitos sedentarios que permanecen en la parte inferior de telas irregulares dispuestas entre la vegetación de los estratos inferiores, en cambio los saltícidos tienen especies de hábitos cursoriales, mayormente diurnos y son excelentes depredadores con alta capacidad visual (Jackson y Pollard 1996); su alta diversidad de comportamientos que consiste en tácticas depredadoras específicas, sumado a su mimetismo que se refleja en sus patrones de coloración y formas de su cuerpo, puede explicar su alta diversidad en los diferentes tipos de ambientes estudiados.
Los coleópteros son el mayor orden de insectos, cuya importancia funcional se refleja en la diversidad de comportamientos alimenticios, pudiendo actuar como detritívoros, herbívoros, fungívoros o depredadores (Lawrence y Britton 1994). Nuestros Resultados muestran un elevado número de especies y varios estudios relacionan a estos insectos con las características del entorno y demuestran que la complejidad del hábitat es un buen predictor de la abundancia y la riqueza de especies, y a menudo, las preferencias de un hábitat determinado pueden reflejar sus hábitos de alimentación (Lassau et al. 2005).
En el caso de los dípteros, ellos también han sido propuestos como un grupo indicador de biodiversidad y del estado de los ecosistemas (Hanski y Koskela 1997), ya que sus patrones de diversidad están estrechamente relacionados con el tipo de hábitat y la disponibilidad de alimento (Woodcock et al. 2003). Se destacan como un grupo con gran predominio ecológico gracias a que explotan una gran variedad de recursos, lo cual se observa en los hábitos ali-mentidos, que van desde saprófagos, fitófagos, hematófagos, nectarívoros, polinívoros, parasitoides y depredadores (Sánchez y Amat-García 2005). En nuestro estudio se encontraron 29 familias pero sólo algunas de ellas presentan abundancias relativas y riqueza específica altas, observándose el mismo patrón de abundancia y riqueza de dípteros en los tres ambientes. Los ceratopogónidos y los quironómidos presentan un alto predominio y éxito ecológico, lo cual se evidencia por su alta riqueza y abundancia en todas las comunidades estudiadas. Esto puede estar relacionado con el hecho que los dípteros pueden responder a varios aspectos de la heterogeneidad del hábitat, la cual puede influir en los patrones de abundancia y diversidad de este grupo de artrópodos (Haslett 2001).
A pesar del esfuerzo de muestreo, los estimadores sugieren que una buena cantidad de especies de hemípteros aún no se registraron. Se encontraron 27 familias, donde los ci-cadélidos fueron particularmente diversos y abundantes. Estos insectos fitófagos encuentran en los bosques una amplia gama de recursos alimenticios. Bar et al. (2005) capturaron 15 familias en la Reserva Iberá, a pesar de haber utilizado una amplia variedad de métodos de muestreo. De las 13 familias de heterópteros registrados en nuestro estudio, los míridos fueron los más diversos en los tres ambientes (19 especies), lo mismo fue registrado por Coscarón et al. (2009) en Colonia Pellegrini, donde Miridae fue la familia que presentó el mayor número de especies. Sin embargo, dichos autores registraron 10 familias de chinches que no se encontraron en nuestro estudio, posiblemente debido a que los heterópteros ocupan diferentes hábitats, microhábitats y nichos tróficos y, por lo tanto, requieren distintos métodos de muestreo para su recolección (Marrero et al. 2008). Aparentemente Miridae es la familia de heterópteros más fácil de muestrear y nuestros Resultados apoyan lo obtenido por Coscarón et al. (2009) y Cava et al. (2012) donde sugieren que son muy buenos candidatos como grupo indicador de calidad ambiental en los estudios de monitoreo a largo plazo en ambientes naturales y perturbados.
En nuestros sitios de muestreo, las hormigas son los hi-menópteros más abundantes. Ellas muestran ser buenas indicadoras ecológicas y/o de biodiversidad (Arcila y Lozano-Zambrano 2003), dependiendo altamente de la cobertura boscosa (Chacón de Ulloa et al. 2008; Chaves et al. 2008; Jiménez et al. 2008), donde se asocian a diferentes plantas en busca de recursos alimenticios y de anidamiento (Lattke 2003; Chacón de Ulloa et al. 2008; Fernández y Arias-Penna 2008). La alta diversidad de parasitoides observada en el área de estudio, particularmente los bracónidos y los eulópidos, posiblemente se deba a una gran oferta de alimento que presentan los ambientes analizados, ya que ellos son parasitoides de una gran variedad de artrópodos, especialmente lepidópteros, coleópteros, dípteros, himenópteros, hemípteros y tisa-nópteros; muchos de estos grupos abundantes en el área de estudio.
Nuestros Resultados son los primeros para la zona en estudio donde se consideran inventarios de artrópodos y se comparan los cambios en los ensambles de los órdenes más representativos en cuanto a riqueza de especies y abundancia. Ellos permiten inferir que la complejidad estructural de la vegetación influye sobre la alta diversidad de artrópodos encontrada en los parches de bosques estudiados, ya que tal heterogeneidad genera microhábitats potencialmente ocupados por las diferentes especies/morfoespecies de artrópodos. Esta es una temática que necesita ser profundizada y evaluada con detenimiento para cada grupo de artrópodos en futuros estudios.
AgradecimientosLos autores agradecen al CIUNSa (Consejo Nacional de Investigaciones de la Universidad Nacional de Salta), CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas) y UNNE (Universidad Nacional del Nordeste) por su apoyo y la colaboración en el desarrollo de este proyecto.
Literatura citadaARBINO, M. O.; GODOY, M. C. 2003. Formícidos (Hymenoptera) asociados a termiteros en el Macrosistema Ibera. pp. 55-74. En: Alvarez, B. (Ed.). Fauna del Ibera. EUDENE. 375 p. [ Links ]
ARCILA, A. M.; LOZANO-ZAMBRANO, F. H. 2003. Hormigas como herramientas para la bioindicación y el monitoreo. Capítulo 9. pp. 159-166. En: Fernández, F. (Ed.). Introducción a las hormigas de la región neotropical. XXVI. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, Colombia, 398 p. [ Links ]
AVALOS, G.; RUBIO, G. D.; BAR, M. E.; DAMBORSKY, M. 2002. Contribución al conocimiento del orden Araneae en la provincia de Corrientes. Comunicaciones Científicas y Tecnológicas. Universidad Nacional de Nordeste, Corrientes, Argentina 1-4. [ Links ]
AVALOS, G.; RUBIO, G. D.; BAR, M. E.; DAMBORSKY, M. P.; OSCHEROV, E. B. 2005. Composición y distribución de la ara-neofauna del Iberá. Comunicaciones Científicas y Tecnológicas B-056: 1-3. [ Links ]
AVALOS, G.; RUBIO, G. D.; BAR, M. E.; GONZÁLEZ, A. 2007. Arañas (Arachnida) asociadas a dos bosques degradados del Chaco húmedo en Corrientes, Argentina. Revista de Biología Tropical 55: 899-909. [ Links ]
AVALOS, G.; DAMBORSKY, M. P.; BAR, M. E.; OSCHEROV, E. B.; PORCEL, E. 2009. Composición de la fauna de Araneae (Arachnida) de la Reserva provincial Iberá, Corrientes, Argentina. Revista de Biología Tropical 57: 339-351. [ Links ]
BAR, M. E.; OSCHEROV, E. B.; DAMBORSKY, M. P.; AVALOS, G., RUBIO, G. 2004. Comunidades de Arthropoda en la Cuenca de Iberá, Corrientes. Comunicaciones Científicas y Tecnológicas B-053: 1-4. [ Links ]
BAR, M. E.; DAMBORSKY, M. P.; AVALOS, G.; MONTERESI-NO, E.; OSCHEROV, E. B. 2005. Fauna de Arthropoda de la Reserva Iberá, Corrientes, Argentina. Serie Correlación Geológica, Argentina 14: 293-310. [ Links ]
BERTONATTI, C.; CORCUERA, J. 2000. Situación Ambiental Argentina 2000. Fundación Vida Silvestre Argentina. 440 p. [ Links ]
BROWN, A.; MARTíNEZ ORTIZ, U.; ACERBI, M.; CORCUE-RA, J. 2005. Situación ambiental Argentina 2005. Fundación Vida Silvestre Argentina. 257 p. [ Links ]
CABRA-GARCíA, J.; MONTEALEGRE, L.; ARCE, M. I. 2010. Evaluación rápida de la riqueza de arañas en un bosque húmedo tropical del departamento del Valle del Cauca, Colombia. Boletín del Museo de Entomología de la Universidad del Valle 11 (1): 1-9. [ Links ]
CAVA, M. B.; CORRONCA, J. A.; COSCARÓN, M. C. 2012. Composition and structure of Heteroptera communities (Insecta: He-miptera) in high altitude habitats of a national protected area in Argentina. Munis Entomology and Zoology 7 (2): 1214-1226. [ Links ]
CHACÓN DE ULLOA, P.; ARMBRECHT, I.; LOZANO-ZAMBRANO, F. 2008. Aspectos de la ecología de hormigas cazadoras en bosques secos colombianos. Capítulo 15. pp. 513-530. En: Lozano Zambrano, F.; Fernández, F.; Jiménez, E.; Arias, T. (Eds.). Sistemática, biogeografía y conservación de las hormigas cazadoras de Colombia. Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt, Bogotá Colombia. 617 p. [ Links ]
CHAO, A.; COLWELL, R. K.; LIN, C. W.; GOTELLI, N. J. 2009. Sufficient sampling for asymptotic minimum species richness estimators. Ecology 90 (4): 1125-1133. [ Links ]
CHAVES, M. C.; CHACÓN DE ULLOA, P.; LOZANO-ZAMBRANO, F. 2008. Riqueza y rareza de hormigas cazadoras en el gradiente bosque-borde-pastizal de un fragmento de bosque subandino (Quindío, Colombia). Capítulo 10. pp. 425-438. En: Lozano-Zambrano, F.; Fernández, F.; Jiménez, E.; Arias, T. (Eds.). Sistemática, biogeografía y conservación de las hormigas cazadoras de Colombia. Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt, Bogotá Colombia. 617 p. [ Links ]
COLWELL, R. 2004. EstimateS 7.0b. Statistical estimation of species richness and shared species from samples. Disponible en: http://viceroy.eeb.uconn.edu. Fecha revisión: 7 marzo 2014. [ Links ]
COLWELL, R.; CODDINGTON, J. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions Royal Society of London B. 345: 101-118. [ Links ]
COSCARÓN, S. 2003. Biodiversidad de Simuliidae y Tabanidae del Iberá. pp. 3-16. En: Alvarez, B. B. (Ed.). Fauna del Iberá, EUDENE. 375 p. [ Links ]
COSCARÓN, M. C.; MELO, M. C.; CODDINGTON, J.; CORRONCA, J. 2009. Estimating biodiversity: a case study on true bugs in Argentinian wetlands. Biodiversity 18: 1491-1507. [ Links ]
ENTSMINGER, G. L. 2012. Ecosim Professional: Null modeling software for ecologists, Version 1. Acquired Intelligence Inc., Kesey-Bear, Pinyon Publishing. Montrose, C. O. 81403. Disponible en: http://www.garyentsminger.com/ecosim/index.htm. Fecha revisión: 7 marzo 2014. [ Links ]
ESCORCIA, R. Y. G., MARTÍNEZ, N. J. H., SILVA, J. P. T. 2012. Estudio de la diversidad de arañas de un bosque seco tropical (BS-T) en Sabanalarga, Atlántico, Colombia. Boletín Científico del Museo de Historia Natural Universidad de Caldas 16 (1): 247-260. [ Links ]
FERNÁNDEZ, F.; ARIAS-PENNA, T. M. 2008. Las hormigas cazadoras en la región neotropical. Capítulo 1. pp. 3-31. En: Lozano-Zambrano, F.; Fernández, F.; Jiménez, E.; Arias, T. (Eds.). Sistemática, biogeografía y conservación de las hormigas cazadoras de Colombia. Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. Bogotá Colombia. 617 p. [ Links ]
FLÓREZ, D. E. 1998. Estructura de comunidades de arañas (Araneae) en el departamento del Valle, suroccidente de Colombia. Caldasia 20: 173-192. [ Links ]
GASTON, K. J. 1996. Biodiversity: a biology of numbers and difference. Blackwell Science. [ Links ]
GOTELLI, N. J.; COLWELL, R. K. 2001. Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecology Letters 4: 379-391. [ Links ]
HAMMOND, P. M. 1994. Practical approaches to the estimation of the extent of biodiversity in species e groups. Philosophical Transactions Royal Society of London B. 345: 119-136. [ Links ]
HANSKI, I.; KOSKELA, H. 1997. Niche relations among dung-inhabiliting beetles. Oecología 28: 203-231. [ Links ]
HASLETT, J. R. 2001. Biodiversity and conservation of Diptera in heterogeneous land mosaics: A fly's eye view. Journal Insect Conservation 5: 71-75. [ Links ]
HUMPHRIES, V. J, WILSON, P. H., VANE-WRIGHT, R. I. 1995. Measuring biodiversity value for conservation. Annual Review of Ecology and Systematics 26: 93-111. [ Links ]
JACKSON, R. R.; POLLARD, S. D. 1996. Predatory behavior of jumping spiders. Annual Review of Entomology 41: 287-308. [ Links ]
JIMÉNEZ, E.; LOZANO-ZAMBRANO, F.; ALVARÉZ-SAA, G. 2008. Diversidad alfa (a) y beta (P) de hormigas cazadoras de suelo en tres paisajes ganaderos de los andes centrales de Colombia. pp. 439- 459. En: Lozano-Zambrano, F.; Fernández, F.; Jiménez, E.; Arias, T. (Eds.). Sistemática, biogeografía y conservación de las hormigas cazadoras de Colombia. Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. Bogotá Colombia. 617 p. [ Links ]
JIMÉNEZ-VALVERDE, A.; LOBO, J. M. 2007. Determinants of local spider (Aranidae and Thomisidae) species richness on a regional scale: climate and altitude vs. habitat structure. Ecological Entomology 32: 113-122. [ Links ]
JIMÉNEZ-VALVERDE, A.; BASELGA, A.; MELIC, A.; TYASKO, N. 2009. Climate and regional beta-diversity gradients in spiders: dispersal capacity has nothing to say? Insect Conservation and Diversity 3: 1-10. [ Links ]
KREBS, C. J. 1989. Ecological methodology. New York, Cambridge, Philadelphia, San Francisco. 645 p. [ Links ]
LASSAU S. A.; HOCHULI, D. F.; CASSIS, G.; REID, C. A. M. 2005. Effects of habitat complexity on forest beetle diversity: do functional groups respond consistently? Diversity Distribution 11: 73-82. [ Links ]
LATTKE, J. E 2003. Subfamilia Ponerinae. pp. 261-276. En: Fernández, F. (Ed.). 2003. Introducción a las hormigas de la región neotropical. Instituto de Investigación de recursos Biológicos Alexander von Humboldt, Bogotá- Colombia. 617 p. [ Links ]
LAWRENCE, J. F.; BRITTON, E. B. 1994. Australian beetles. Carlton, Melbourne University Press, Carlton, Victoria, Australia. 192 p. [ Links ]
LAZZERI, M. G.; BAR, M. E.; PIERI DAMBORSKY, M. 2010. Diversidad del orden Lepidoptera (Hesperioidea y Papilionoidea) de la ciudad Corrientes, Argentina. Revista de Biología Tropical 59 (1): 299-308. [ Links ]
MARRERO, H. J.; ZELBA, S. M.; CARPINTERO, D. L. 2008. Eficiencia relativa de distintas técnicas de captura de heterópteros terrestres en un pastizal de montaña. Bioscriba 1: 3-9. [ Links ]
MAGURRAN, A. 2004. Ecological diversity and its measurement. Princeton University Press, New Jersey. 256 p. [ Links ]
MORENO, C. E.; RODRIGUEZ, P. 2010. A consistent terminology for quantifying species diversity? Oecología 163: 279-282. [ Links ]
MORRONE, J. J.; COSCARÓN, S. (Eds.). 1998. Biodiversidad de artrópodos argentinos. Una perspectiva biotaxonómica. Ediciones Sur. 594 p. [ Links ]
MUZÓN, J.; VON ELLENRIEDER, N.; PESSACQ, P.; LOZANO, F. ; GARRÉ, A.; LAMBRUSCHINI, J.; RAMOS, L.; WEIGEL MUÑOZ, M. S. 2008. Odonata from Iberá (Corrientes, Argentina): preliminary inventory and biodiversity. Revista de la Sociedad Entomológica Argentina 67 (1-2): 59-67. [ Links ]
OSCHEROV, E. B.; DAMBORSKY, M. P.; BAR, M. E.; AVALOS, G. 2005. Composición de la fauna de Culicidae (Diptera) en la Reserva Provincial Iberá, Corrientes, Argentina. Comunicaciones Científicas y Tecnológicas Universidad Nacional del Nordeste, Corrientes, Argentina B-055: 1-3. [ Links ]
OSCHEROV, E. B.; BAR, M. E.; DAMBORSKY, M. P.; AVALOS, G. 2007. Culicidae (Diptera) de la Reserva Provincial Iberá, Corrientes, Argentina. Boletín de Malariología y Salud Ambiental, Venezuela 47 (2): 221-229. [ Links ]
PEET, R. K. 1974. The measurement of species diversity. Annual Review of Ecology and Systematics 5: 285-307. [ Links ]
PEARCE, J. L.; VENIER, L. A.; ECCLES, G.; PEDLAR, J.; MCKENNEY, D. 2003. Influence of habitat and microhabitat on epigeal spider (Araneae) assemblages in four stand types. Biodiversity and Conservation 13: 1305-1334. [ Links ]
PINKUS-RENDÓN, M. A.; LEÓN-CORTÉS, J. L.; IBARRA-NUÑEZ, G. 2006. Spiders diversity in a tropical habitat gradient in Chiapas, Mexico. Diversity and Distribution 12: 61-69. [ Links ]
PLACI, G.; DI BITETTI, M. 2005. Situación ambiental en la ecorregión del Bosque Atlántico del Alto Paraná. pp. 197-225. En: La situación ambiental argentina. Fundación Vida Silvestre Argentina, Buenos Aires. [ Links ]
RICO, A. G.; BELTRÁN, J. P; ÁLVAREZ, A. D.; FLÓREZ, E. D. 2005. Diversidad de arañas (Arachnida: Araneae) en el Parque Nacional Natural Isla Gorgona, Pacífico Colombiano. Biota Neotropica 13 (1): 1-12. [ Links ]
RUBIO, G. D.; DAMBORSKY, M. P.; CORRONCA, J. A. 2004. Araneofauna (Arachnida, Araneae) en un área natural protegida. Corrientes, Argentina. Comunicaciones Científicas y Tecnológicas B-048: 1-3. [ Links ]
SAMWAYS, M. J.; MAC.GEOCH, M. A.; NEW, T. R. 2010. Insect Conservation. A handbook of approaches and methods. Techniques in Ecology & Conservation Series. Oxford. 441 p. [ Links ]
SÁNCHEZ, N. D.; AMAT-GARCÍA, G. D. 2005. Diversidad de la fauna de artrópodos terrestres en el Humedal Jaboque, Bogotá-Colombia. Caldasia 27 (2): 311-329. [ Links ]
SILVA, D. 1996. Species composition y community structure of Peruvian rainforest spiders: a case study from a seasonally inundated forest along the Samiria river. Revue Suisse de Zoologie 2: 597-610. [ Links ]
SILVA, D.; CODDINGTON, J. A. 1996. Spiders of Pakitza (Madre de Dios, Peru): species richness y notes in community structure. pp. 241-299. En: Wilson, D. E.; Sandoval, A. (Eds.). The biodiversity of Pakitzaand its environs. Smithsonian Institution. [ Links ]
TORALES, G. J.; LAFFONT, E. R.; CORONEL, J. M. 2003. Termito fauna del Iberá. pp. 17-53. En: Alvarez B. B. (Ed.). Fauna del Iberá. EUDENE. 375 p. [ Links ]
VITTAR, F. 2008. Hormigas (Hymenoptera: Formicidae) de la Mesopotamia Argentina. Serie Correlación Geológica 17 (2): 447-466. [ Links ]
WALTHER, B. A.; MORAND, S. 1998. Comparative performance of species richness estimation methods. Parasitology 116: 395-405. [ Links ]
WEEKS, R. D. Jr.; HOLTZER, T. O. 2000. Habitat and season in structuring ground-dwelling spider (Araneae) communities in a short grass steppe ecosystem. Environmental Entomology 29: 1164-1172. [ Links ]
WHITMORE, C.; SLOTOW, R.; CROUCH, T. E.; DIPPENAAR SCHOEMAN, A. S. 2002. Diversity of spiders (Araneae) in a savanna Reserve, Northern Province, South Africa. Journal of Arachnology 30: 344-356. [ Links ]
WOODCOCK, B. A.; WATT, A. D.; LEATHER, S. R. 2003. Influence of an deciduous woodlands. Agriculture, Ecosystems & Environment 95: 443-452. [ Links ]
Recibido: 13-ago-2014
Aceptado: 9-mar-2015
Citación sugerida:
CAVA, M. B.; COSCARÓN, M. C.; CORRONCA, J. A. 2015. Inventario y estimación de la riqueza específica de artrópodos en bosques del Noreste de Argentina. Revista Colombiana de Entomología 41 (1): 139-146. Enero-Junio 2015. ISSN 0120-0488.