Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Química
versión impresa ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.3 Bogotá sep./dic. 2012
Densidades y propiedades volumétricas de la glicina en soluciones acuosas de tiosulfato de sodio pentahidratado (Na2S2O3.5H2O) a diferentes temperaturas.
Densities and volumetric properties of glycine in aqueous solutions of sodium thiosulfate pentahydrate (Na2S2O3.5H2O) at different temperatures.
Densidades e propriedades volumétricas da glicina em soluções aquosas de tiossulfato de sódio penta-hidratado (Na2S2O3.5H2O) em diferentes temperaturas.
Manuel S. Páez a, bPlinio D. Canteroa Elfrin J. Marzolaa
a Universidad de Córdoba, Departamento de Química, Facultad de Ciencias Básicas. Cra. 6 nro. 76-103 km 3, vía Cereté, Montería, Córdoba, Colombia.
b mspaezm@unal.edu.co, mspaezm@gmail.com
RESUMEN
Se determinaron las densidades de la glicina en soluciones acuosas de tiosulfato de sodio pentahidratado (0,01-2,0 mol kg-1) usando un densímetro de tubo vibrador DMA 5000 a las temperaturas de (283,15; 288,15; 293,15; 298,15; 303,15; 308,15; 313,15 y 318,15) K y 101,1 Kpa. Se calcularon los volúmenes molares aparentes ( Vø ), los volúmenes molares aparentes a dilución infinita (Vø ∞), la pendiente experimental (S*v), los volúmenes estándares de transferencia (Δ trV°2,m), las expansibilidades molares parciales a dilución infinita (VE ∞), la segunda derivada del volumen molar aparente a dilución infinita con respecto a la temperatura (δ² Vø ∞ / δT²)p y los números de hidratación (nH ). Los valores obtenidos para estos parámetros se analizaron en términos de las interacciones que ocurren a nivel de la solución. Adicionalmente, los valores de ΔtrV°2m,se interpretaron en función de las interacciones soluto-cosoluto de acuerdo al modelo de la coesfera y calculándose a partir de estos los los parámetros de interacción volumétricos dobles VAB y triples VABB,, usando la teoría de McMillan-Mayer. Los valores de ΔtrV°2m, son positivos y aumentan con el aumento de la molalidad del Na2S2O3.5H2O, mientras que los valores de (∂2Vø∞/∂T2)P son negativos en todas las concentraciones de solvente mixto; lo que sugiere que a nivel de la solución se favorecen las interacciones soluto-solvente y que la glicina actúa como un disruptor de la estructura de las soluciones acuosas de tiosulfato de sodio pentahidratado.
Palabras clave: densidad, glicina, interacciones soluto-solvente, modelo de la coesfera, parámetros de interacción volumétricos.
ABSTRACT
Densities of glycine in aqueous solutions sodium thiosulfate pentahydrate (0,01- 2,0 mol kg-1) were determined using a vibrating-tube densimeter DMA 5000, at temperatures of (283,15; 288,15; 293,15; 298,15; 303,15; 308,15; 313,15 and 318,15) K and 101,1 Kpa. Apparent molar volumes (Vø), apparent molar volumes at infinite dilution (Vø ∞), experimental slope (S*v), standard partial molar volumes of transfer (Δ trV°2,m), partial molar expansivities at infinite dilution (VE ∞), second derivative apparent molar volume at infinite dilution with respect to temperature (δ² Vø ∞ / δT²)p and hydration numbers (nH ) were calculated. The values obtained for these parameters were discussed in terms of the interactions present in solution. Additionally, values of ΔtrV°2m,, have been interpreted in terms of solute-cosolute interactions on the basis of a cosphere overlap model and calculated from these parameters the double of VAB and triple VABB, volumetric interaction,using the McMillan-Mayer theory. The values of ΔtrV°2m, are positive and increase with the increase of Na2S2O3.5H2O molality, while negative values of (∂2Vø∞/∂T2)P are all mixed solvent concentrations, suggesting that the level of solution are favored and solutesolvent interactions that glycine acts as a disruptor of the structure of the aqueous solutions of sodium thiosulfate pentahydrate.
Key words: density, glycine, solutesolvent interactions, the model of cosphere volumetric interaction parameters.
RESUMO
As densidades foram determinados doglicina em soluções aquosas pentahydrate tiossulfato de sódio (0,01-2,0 mol kg-1) em temperaturas de (283,15; 288,15; 293,15; 298,15; 303,15; 308,15; 313,15 and 318,15) K 101,1 Kpa, usando um tubo vibrando densímetro DMA 5000. Foram calculados volumes molares aparentes (Vø), volume aparente molar a diluição infinita (Vø ∞),inclinaçõ experimentais ((S*v),transferir volume padrão (Δ trV°2,m), expansividades molaresparciais à diluição infinita (VE ∞), segundo volume aparente derivado molar a diluição infinita em relação à temperatura (δ² Vø ∞ / δT²)pe números de hidratação (nH). Os valores obtidos para os parmetros foram analisados em termos das interacções que ocorrem na solução de. Além disso, os valores de ΔtrV°2m, foram interpretados de acordo com as interacções soluto-cosoluto de acordo com o modelo de coesfera e calcular a partir destes parâmetros dos duplos VAB e triplos VABB, interacção volumétricas, utilizando a teoria da McMillan- Mayer.ΔtrV°2m, valores são positivos e aumenta com o aumento da molalidade Na2S2O3.5H2O enquanto (∂2Vø∞/∂T2)P são valores negativos em todas as concentrações de solvente misto, sugerindo que o nível da solução é de interacções favoráveis soluto-solvente e que a glicina actua como um disruptor da estrutura das soluções aquosas de tiossulfato de sódio penta-hidratado.
Palavras-chave: densidade, glycine, interações soluto-solvente, o modelo de coesfera volumétrico parmetros interacção.
Recibido: 20/10/12 - Aceptado: 13/12/12
INTRODUCCIÓN
Las proteínas y sus unidades estructurales (aminoácidos) son uno de los sistemas que más han fascinado a la comunidad científica debido al papel que desempeñan en los procesos biológicos, a su alta especificidad catalítica, su estructura tridimensional y a su auto-organización en dicha estructura (1). Es por ello, que propiedades como la estabilidad conformacional, solubilidad, actividad enzimática, disociación en subunidades, desnaturalización, separación y purificación de estas macromoléculas son claramente influidas por diversas interacciones moleculares entre los grupos funcionales presentes que son direccionados por factores como la temperatura, presencia de sustancias de baja masa molar como sustratos, coenzimas, inhibidores y activadores que específicamente ligan a la estructura nativa y el medio en el cual se encuentran disueltas (2, 3).
Uno de los medios que tiene grandes efectos sobre las propiedades anteriormente mencionadas son las soluciones salinas; sin embargo, el estudio del comportamiento termodinámico de las proteínas en medios salinos resulta fundamentalmente complejo, debido a que se rige por muchas interacciones entre ellas las fuerzas electrostáticas inducidas por sales, donde la naturaleza de estas interacciones depende de la magnitud relativa de la electrostricción causada por el extremo de los grupos polares, estabilidad de la estructura debida a la influencia de la hidrofobicidad de los grupos alquilos y la magnitud de interacciones entre los grupos hidrófobos presentes en los aminoácidos (2, 4). Se ha encontrado, por ejemplo que los electrolitos cuando son disueltos en agua perturban el orden de las moléculas de agua por el fuerte campo eléctrico de los iones constituyentes. Así mismo, se ha demostrado experimentalmente que las soluciones salinas tienen un efecto negativo sobre las propiedades y la estabilidad estructural de las proteínas, por ejemplo una alta concentración de sulfato de sodio (Na2SO4), acetato de sodio (CH3COONa) y sulfato de magnesio (MgSO4) estabilizan las proteínas, mientras que sales tales como MgCl2, CaCl2 y KSCN desnaturalizan las proteínas generando así cambios de volumen en el sistema (5, 6). Es por ello que muchos investigadores (5-10) se han interesado en indagar el papel que juegan las sustancias electrolíticas sobre las unidades más pequeñas de estas macromoléculas biológicas como es el caso de los aminoácidos y así determinar el efecto que causa la adición de electrolitos sobre la estabilidad conformacional, solubilidad, actividad enzimática, disociación en subunidades y desnaturalización, entre otras propiedades de las proteínas. En este sentido, las propiedades volumétricas son útiles para determinar el efecto que causa la adición de una sal sobre el comportamiento de los aminoácidos; siendo esta información de gran importancia para el estudio de la hidratación de péptidos y proteínas en medios salinos (11, 12). Por tal motivo, en este trabajo se reportan las densidades (ρ) de glicina en diferentes molalidades de tiosulfato de sodio pentahidratado (Na2S2O3.5H2O) a una presión atmosférica de 101,1 Kpa a las temperaturas de (283,15; 288,15; 293,15; 298,15; 303,15; 308,15; 313,15 y 318,15) K. Los valores experimentales de ρ se usaron para calcular los volúmenes molares aparentes ( Vø ), los volúmenes molares aparentes a dilución infinita (Vø∞), la pendiente experimental, (S*V),los volúmenes estándares de transferencia (Δtr°2,m,) las expansibilidades molares parciales a dilución infinita ( VE∞), la segunda derivada del volumen molar aparente a dilución infinita con respecto a la temperatura (∂² Vø ∞ / ∂T²)p y los números de hidratación (nH). El comportamiento de estos parámetros con la concentración y la temperatura se analizaron en términos de las interacciones que ocurren en la solución.
MATERIALES Y MÉTODOS
Los reactivos empleados son los siguientes: glicina (99% de pureza, Alfa Aesar), tiosulfato de sodio pentahidratado (99% de pureza, Merck), la glicina fue doblemente recristalizada desde soluciones acuosas de etanol y secada al vacío sobre P2O5. El agua usada fue desgasificada, doblemente destilada y desionizada garantizando una conductividad menor de 2µS cm-1.
Las soluciones se prepararon por el método gravimétrico usando una balanza (OHAUS, modelo Explorer) con una sensibilidad de ± 1x10-4 g en botellas herméticamente cerradas para evitar pérdida por evaporación de alguno de los componentes. Las densidades de los líquidos puros y/o mezclas se determinaron usando un densímetro de tubo vibratorio (Anton Paar, DMA 5000, Austria). La densidad del líquido puro y/o la solución problema (ρ) está dada por la ecuación [1].
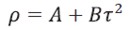 | [1] |
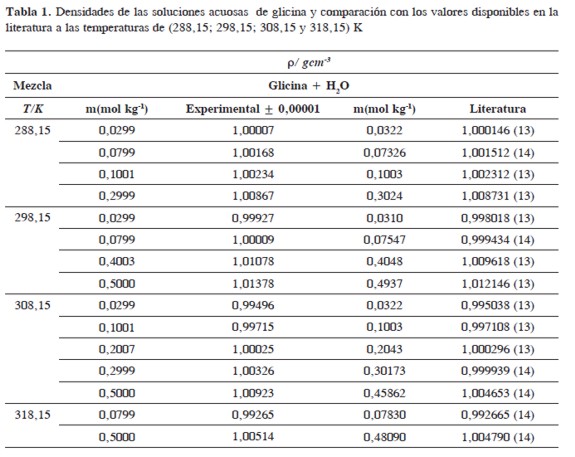
donde A y B son constantes internas del densímetro que dependen de la geometría de la celda que contiene la muestra y τ, es el periodo de oscilación del líquido y/o la solución problema. La incertidumbre experimental en la determinación de las densidades es del orden de ± 1x10-6 g/cm3. El densímetro fue calibrado con aire seco y agua bidestilada y desgasificada como líquido puro de referencia. Esta calibración se verificó mediante la determinación de las densidades de soluciones acuosas de glicina, las cuales se presentan en la Tabla 1 junto con los valores reportados por otros investigadores, observándose que estas se encuentran en buen acuerdo con los valores reportados en la literatura; lo que garantiza la confiabilidad de las mediciones experimentales.
RESULTADOS Y DISCUSIÓN
Las densidades (ρ) obtenidas en este trabajo desde 283,15K hasta 318,15K para las diferentes concentraciones de glicina y tiosulfato de sodio pentahidratado se muestran en la Tabla 1.
Los volúmenes molares aparentes fueron calculados usando la ecuación [2]
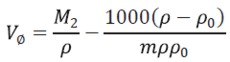 | [2] |
donde M2,ρ, m, ρ0 son la masa molar del soluto (g mol-1), la densidad de la solución (g cm-3), la molalidad de la solución(mol kg-1), y la densidad del solvente respectivamente. Los valores obtenidos de los volúmenes molares aparentes (Vø) en el intervalo de temperaturas de estudio a las distintas concentraciones de aminoácido y la sal se reportan en la Tabla 2. Las incertidumbres en los valores de(Vø)en el sistema binario así como en el sistema pseudobinario son del orden de ±0,01cm3 mol-1.
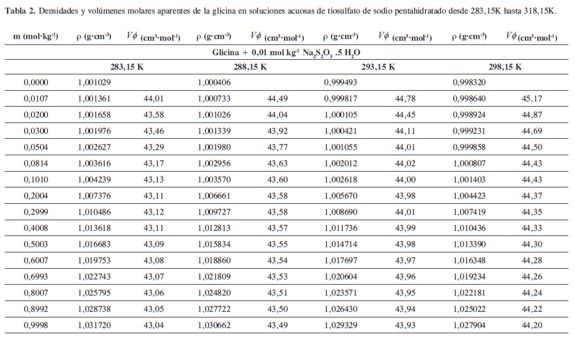
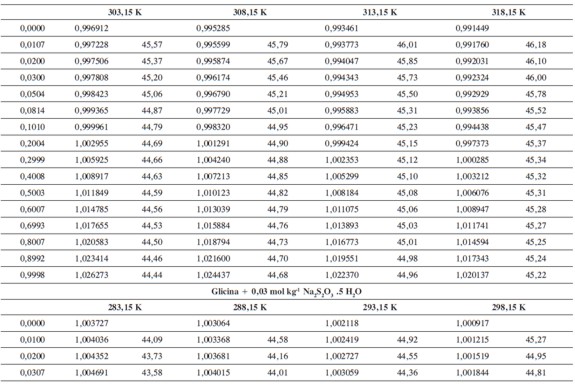
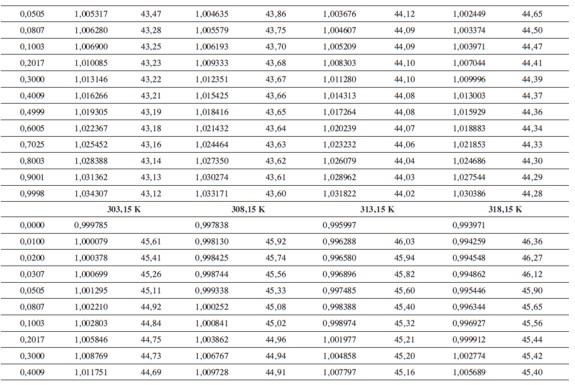
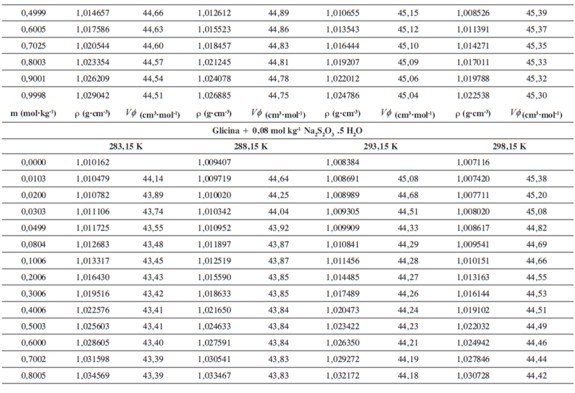
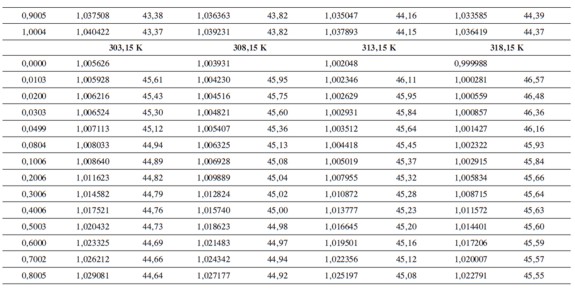
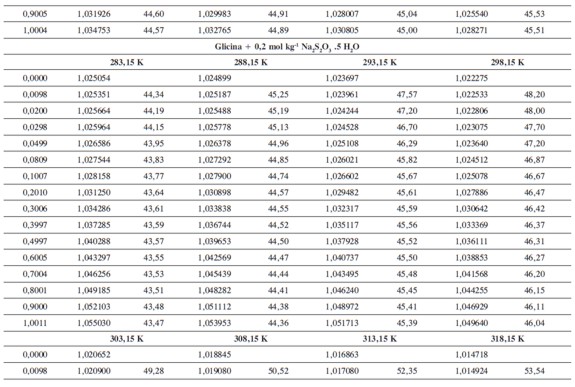
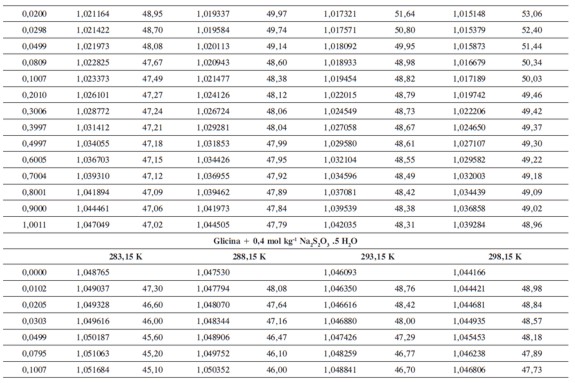
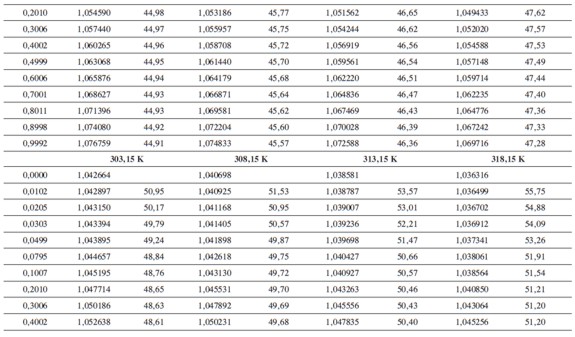
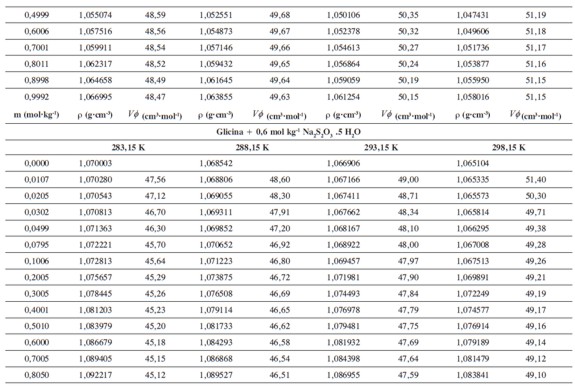
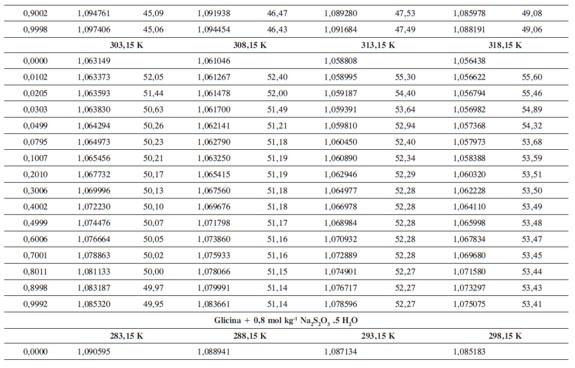
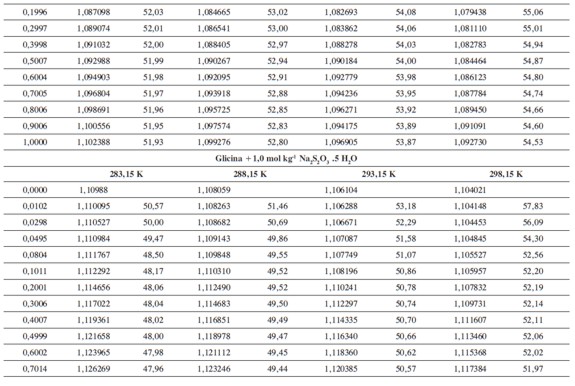
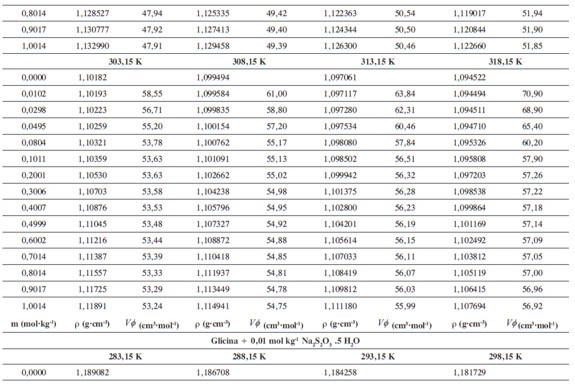
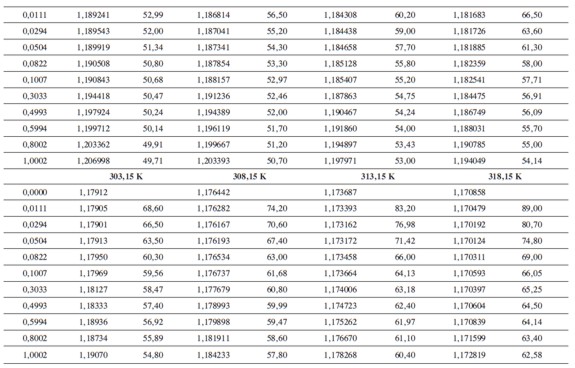
En la Tabla 2 se puede observar que las densidades del sistema pseudobinario (glicina + soluciones acuosas de tiosulfato de sodio pentahidratado) disminuyen con el aumento de la temperatura y se incrementan con el aumento de la concentración del aminoácido y del solvente mixto. Los valores de ( Vø )incrementan con el aumento de la concentración de las soluciones de Na2S2O3.5H2O y disminuyen con el aumento de la concentración de glicina; este comportamiento podría indicar un favorecimiento de las interacciones soluto-solvente con el aumento de la composición del solvente mixto (8).
Los valores de(Vø )se representados adecuadamente por la ecuación [3]
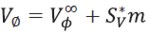 | [3] |
donde (Vø∞) es el volumen molar aparente a dilución infinita, m es la molalidad de la solución,S*V es la pendiente experimental y representa el cambio en el volumen molar aparente con la molalidad a temperatura y presión constantes. Los valores de Vø∞ )y (S*V)se obtuvieron a través del método de los mínimos cuadrados y se registraron en la Tabla 3 junto con sus respectivas incertidumbres. La gráfica de (Vø)contra m manifiesta un comportamiento lineal en todos los casos aproximadamente a partir de 0,2000 m de glicina, excepto en la composición de solvente mixto de 2,0000 m donde ocurre a partir de 0,1007 m de glicina. Una ilustración del comportamiento de ( Vø)contra m a diferentes concentraciones de glicina y 0,2000 m de Na2S2O3.5H2O se muestra en la Figura 1.
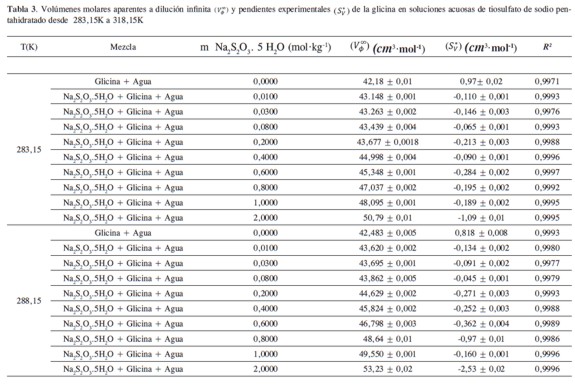
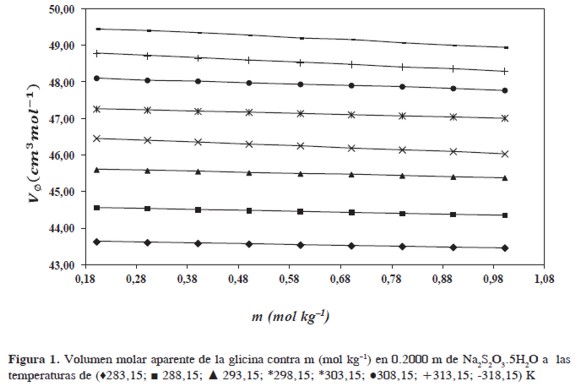
A concentraciones inferiores a 0,2000 m de glicina aproximadamente ocurre un comportamiento abrupto del volumen molar aparente en función de la molalidad, manifestándose tendencias muy bien definidas a alta dilución primando otro tipo de interacciones y son las debidas a interacciones entre la cadena apolar de la glicina y el agua; conocidas como interacciones de tipo hidrofóbico bastante importantes en los procesos de estabilidad de macromoléculas de interés biológico (15).
En la Tabla 3, se observa que los valores de(Vø∞) son positivos y aumentan con el incremento de la molalidad del Na2S2O3.5H2O; este comportamiento se asocia con al favorecimiento de interacciones fuertes soluto-solvente en ausencia de las interacciones ion-ion en el estado de dilución infinita (16,17). De esta forma a pH neutro (como es el caso de nuestros sistema de estudio) los aminoácidos existen como zwiterions y por ello la presencia de Na2S2O3.5H2O puede afectar las esferas de hidratación de los grupos terminales cargados de los zwiterions, dando como resultado interacciones Na+-COO-, S2O32-,-NH3+, que son el producto del solapamiento de las coesferas de hidratación de estas especies y que a su vez origina un relajamiento de las regiones electrostrisadas (15,17,18).
De otra parte, el incremento de los volúmenes molares aparentes a dilución infinita con el aumento de la temperatura podría ser atribuido a una expansión del volumen de los zwiterions hidratados o a una reducción en la electrostricción (17). Se observa en la Tabla 2 que los valores de(S*V)son negativos y pequeños, hecho que indica en la solución existen débiles interacciones soluto-soluto y que son menos complejas que cuando la formación de iones tiene lugar (8,17).
Los volúmenes estándares de transferencia ΔtrV°2,m, desde el agua hasta las soluciones acuosas de Na2S2O3.5H2O se obtuvieron mediante la expresión [4]
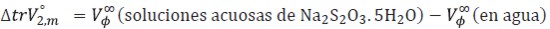 | [4] |
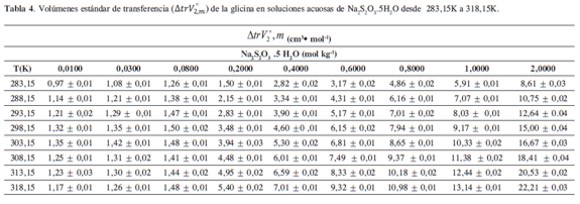
Los resultados obtenidos de ΔtrV°2,m se muestran en la Tabla 4. En esta tabla es notorio que los volúmenes estándares de transferencia son positivos e incrementan con el aumento de la temperatura y la concentración del solvente mixto. Un comportamiento similar también ha sido observado en otros sistemas de aminoácidos en medios electrolíticos (14, 19, 20, 21, 22, 23).
Los valores positivos de ΔtrV°2,m fueron interpretados de acuerdo con el modelo de la co-esfera desarrollado por Friedman y Krishnan (24,25). Según este modelo las propiedades de hidratación de las moléculas de agua dependen de la naturaleza del soluto. De esta forma las interacciones que podrían ocurrir se pueden clasificar de la siguiente forma (26, 27):
1. Interacciones ion-ion entre el ión Na+ del solvente mixto y el grupo COO- de la glicina.
2. Interacciones ion-ion entre el ion S2O3 2- y el grupo NH3+ de la glicina.
3. Interacción ion-hidrofóbica que ocurren entre los iones del solvente mixto y las partes no polares del aminoácido.
De acuerdo con el modelo de la coesfera las interacciones tipo 1 y 2 dan como resultado valores positivos para ΔtrV°2,m; mientras que las de tipo 3 originan contribuciones negativas del volumen estándar de transferencia. En este trabajo los valores positivos de ΔtrV°2,msugieren que en la solución se presentan las interacciones de tipo 1 y 2.En este sentido la tendencia observada para los volúmenes estándares de transferencia puede ser también explicada utilizando la ecuación modificada por Shahidi y Farrell (28) para el volumen molar aparente a dilución infinita como lo muestra la ecuación [ 5]
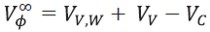 | [5] |
Donde VV,W,VV y VC son el volumen de Van der Waals, el volumen asociado a los espacios vacíos o nulos y el volumen de contracción que es causado por la electrostricción del disolvente. Asumiendo que los valores de VV,W y VV no son afectados significativamente por la presencia de Na2S2O3.5H2O, los valores positivos de ΔtrV°2,m pueden ser atribuidos a una disminución del volumen de contracción debido a la presencia de Na2S2O3.5H2O, lo cual, podría ser producto de fuertes interacciones entre los grupos zwiteriónicos de la glicina (COO-,NH3+)y los iones del cosoluto (Na+,S2 O32-),donde probablemente se formen pares de iones no covalentes causando que la electrostricción de las moléculas de agua cercanas a estos centros cargados se reduzca y ocasione una disminución del volumen de contracción(14).
La variación de (Vø∞) con la temperatura se puede expresar de la siguiente forma:
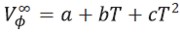 | [6] |
donde a, b, y c son constantes y T es la temperatura en Kelvin.
Las expansibilidades molares parciales a dilución infinita( VE∞) se evaluaron a través de la diferenciación de la ecuación (6) con respecto a la temperatura, obteniendo la ecuación [7]
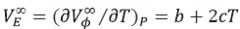
Los valores de (VE∞) ∞ obtenidos a las diferentes temperaturas se reportan en la Tabla 5. En la Tabla 4 se observa que los valores de (VE∞) disminuyen con el incremento de la temperatura en todas las composiciones de solvente mixto; este comportamiento podría considerarse que se debe a que la estructura del solvente mixto se debilita con el incremento de la temperatura, es decir, algunas moléculas del disolvente pueden ser liberadas de las capas de solvatación del soluto (29). Los valores de (VE∞) aumentan con el aumento de la concentración de Na2S2O3.5H2O (excepto en 0.1000 m y 0.6000 m de Na2S2O3.5H2O), lo que podría indicar que la glicina actúa como un disruptor de la estructura del solvente; favoreciéndose de esta manera las interacciones solutosolvente (10, 30). De acuerdo a Hepler (28, 31) el mejor criterio para caracterizar la habilidad de un soluto para comportarse como disruptor o formador de la estructura del solvente lo constituye la segunda derivada del volumen molar aparente a dilución infinita con respecto a la temperatura ( ∂2Vø∞/∂T2)P ; así de esta forma si: ( ∂2Vø∞/∂T2)P>0 el soluto actúa como un formador de la estructura del solvente, un comportamiento opuesto indica que el soluto actúa como un disruptor de la estructura del solvente. Los resultados obtenidos para ( ∂2VE∞/∂T)P) = (∂2Vø∞/∂T2)P se muestran en la Tabla 5.
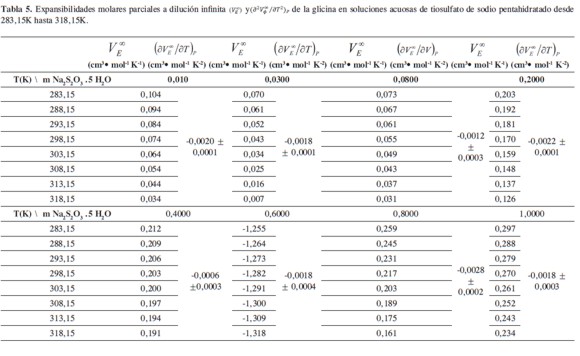

Los valores de (∂2VE∞/∂T)P mostrados en la Tabla 5 son negativos a todas las concentraciones de solvente mixto; lo que podría indicar que la glicina actúa como un disruptor de la estructura de las soluciones acuosas de tiosulfato de sodio pentahidratado.
Los números de hidratación (nH ) para la glicina a cada temperatura se calcularon usando el método reportado por Millero (31) a partir de los volúmenes molares parciales 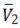 ,los cuales se pueden expresar mediante la ecuación [8]
,los cuales se pueden expresar mediante la ecuación [8]
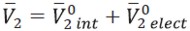 | [8] |
Donde 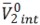
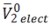 son elvolumen molar parcial intrínseco del aminoácido y el volumen molar parcial de electrostricción debido a la hidratación de cada aminoácido. El volumen molar parcial intrínseco del aminoácido
son elvolumen molar parcial intrínseco del aminoácido y el volumen molar parcial de electrostricción debido a la hidratación de cada aminoácido. El volumen molar parcial intrínseco del aminoácido 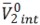 depende de la contribución de dos términos: 1) el volumen de Van der Waals y 2) el volumen debido a los efectos de empaquetamiento. Los valores
depende de la contribución de dos términos: 1) el volumen de Van der Waals y 2) el volumen debido a los efectos de empaquetamiento. Los valores 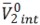 calcularon utilizando la siguiente ecuación (32, 33)
calcularon utilizando la siguiente ecuación (32, 33)
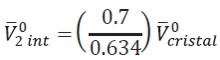 | [9] |
donde 0.7 es la densidad de empaquetamiento para el aminoácido en un cristal orgánico,0.634 es la densidad para una esfera con un empaquetamiento aleatorio.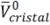 se calcula mediante la división del masa molar de la glicina entre su densidad. Para la aplicación de la ecuación [9] se asume que tanto la densidad como el volumen del cristal permanecen constantes a lo largo de todo el intervalo de temperaturas de estudio. Millero (34) reporta la relación entre el volumen molar parcial de electrostricción y los números de hidratación a través de la ecuación [10]
se calcula mediante la división del masa molar de la glicina entre su densidad. Para la aplicación de la ecuación [9] se asume que tanto la densidad como el volumen del cristal permanecen constantes a lo largo de todo el intervalo de temperaturas de estudio. Millero (34) reporta la relación entre el volumen molar parcial de electrostricción y los números de hidratación a través de la ecuación [10]
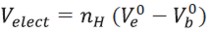 | [10] |
Donde Ve0 es el volumen de agua electrostrictada y Vb0 es el volumen de agua voluminosa. Este modelo asume que por cada molécula de agua tomada de la fase voluminosa a la región acuosa que rodea a los aminoácidos, el volumen se reduce en (Ve0 - Vb0).Usando (Ve0 - Vb0) -2.9, -3,3, -4,0 cm3 mol-1 a 288,15; 298,15 y 308,15 K respectivamente (6,14) y obteniendo (Ve0 - Vb0)-2,7; -3,1; -3,6 y -4,6cm3 mol-1 a 283,15; 293,15; 303,15 y 313,15 K de los datos reportados por Yan y Lark (35, 36) desde 278,15 a 313,15K. Los números de hidratación (nH ) calculados para la Glicina son reportados en la Tabla 6.
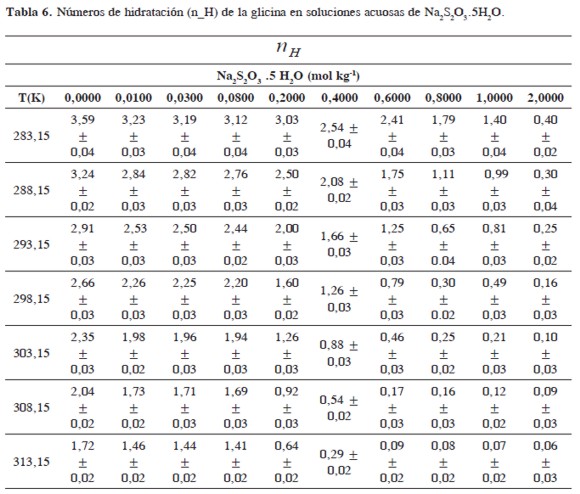
En la Tabla 6 se observa que los números de hidratación (nH) de la glicina en soluciones acuosas de Na2S2O3.5H2O son menores que los obtenidos en agua pura y disminuyen con el aumento de la temperatura y de la concentración del solvente mixto. Este hecho sugiere que las interacciones que involucran a los iones presentes en el solvente mixto (Na+,S2 O3 2-) con los centros cargados de la glicina (COO-,NH3+)son fuertes; debilitando el efecto de electrostricción que existe alrededor de estos, originando a su vez un efecto de deshidratación y por consiguiente un favorecimiento de las interacciones soluto-solvente (14,33). Resultados similares también han sido observados en sistemas de aminoácidos en soluciones acuosas de cloruro de zinc(ZnCl2), hidrocloruro de metformina (C4H11N5), cloruro de calcio (CaCl2), sulfato de salbutamol (C13H21NO3) y sulfato de sodio (Na2SO4) (14, 33, 35, 36).
La teoría de soluciones de McMillan- Mayer (37) fue propuesta inicialmente por Kozak (38) y posteriormente discutida por Friedman, Krishnan y Frank (25, 39, 40) en orden de aplicarla al estudio de las interacciones soluto-cosoluto en las esferas de solvatación del soluto. De acuerdo a este tratamiento los volúmenes estándares de transferencia se pueden expresar mediante la ecuación [11]
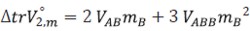 | [11] |
Aquí A simboliza el subíndice que representa a la glicina y B el subíndice para el Na2S2O3.5H2O, y son los parámetros de interacción volumétricos dobles y triples respectivamente. Estos parámetros se calculan usando el método de los mínimos cuadrados y son presentados en la tabla 7.

Los valores de VAB son positivos, mientras que los valores de son negativos a todas las temperaturas de estudio. Los valores positivos de VAB sugieren que las interacciones entre el soluto y el cosoluto ocurren debido al solapamiento de sus esferas de hidratación. Esta observación está en correspondencia con las conclusiones deducidas para el modelo de la coesfera (8, 14, 33, 40).
CONCLUSIONES
En este trabajo se reportan los datos experimentales para las densidades del sistema glicina en soluciones acuosas de tiosulfato de sodio pentahidratado (0,01-2,0 mol kg-1) a las temperaturas de (283,15; 288,15; 293,15; 298,15; 303,15; 308,15; 313,15 y 318,15) K y 101,1 Kpa.
Los resultados para los volúmenes estándar de transferencia ΔtrV°2,m son positivos y se incrementan con el aumento de la temperatura y la concentración del solvente mixto, lo que podría indicar que en la solución se favorecen las interacciones soluto-solvente, que de acuerdo con el modelo de la coesfera podrían ser asociadas a dos tipos de interacciones: 1) Interacciones ion -ion entre el ión Na+ del solvente mixto y el grupo COO- de la glicina y 2) Interacciones ion- ion entre el ion S2O32- y el grupo NH3+ de la glicina. Los valores de la segunda derivada del volumen molar aparente a dilución infinita con respecto a la temperatura (∂² Vø ∞ / ∂T²)p son negativos en todas las concentraciones de solvente mixto, hecho que sugiere que la glicina actúa como un disruptor de la estructura de las soluciones acuosas de tiosulfato de sodio pentahidratado. Los números de hidratación (nH) de la glicina en soluciones acuosas de Na2S2O3.5H2O son menores que los obtenidos en agua pura y disminuyen con el aumento de la temperatura y de la concentración del solvente mixto. Este hecho sugiere que las interacciones que involucran a los iones presentes en el solvente mixto (Na+, S2 O32- con los centros cargados de la glicina (COO-,NH3 +) son fuertes; debilitando así el efecto de electrostricción que existe alrededor de estos.
Finalmente el signo positivo de podría ser asociado a que las interacciones entre el soluto y el cosoluto ocurren debido al solapamiento de sus esferas de hidratación.
REFERENCIAS BIBLIOGRÁFICAS
1. Romero, C.; Albis, A. Influence of Polyols and Glucose on the Surface Tension of Bovine σ Lactalbumin in Aqueous Solution. J. Solution Chem. 2010. 39: 1865-1876. [ Links ]
2. Sinha, B.; Sarkar, A.; Kumar, P.; Brahman, D. Physicochemical Properties of L-Alanine in Aqueous Silver Sulphate Solutions at (298.15, 308.15, and 318.15) K. Int. J. Thermophys. 2010. 32: 1-17. [ Links ]
3. Ali, A.; Shahjahan, A. Density and viscosity of σ amino acids in aqueous solutions of cetyltrimethylammonium bromide. Russian Chemical Bulletin. 2010. 59: 1999-2004. [ Links ]
4. Shekaari, H.; Jebali, F. Solute-Solvent Interactions of Amino Acids in Aqueous 1-Propyl-3-Methylimidazolium Bromide Ionic Liquid Solutions at 298.15 K. J. Solution Chem. 2010. 39: 1409-1427. [ Links ]
5. Bairagi, M.; Nand, K. Partial Molar Volumes of Some of σ Amino Acids in Binary Aqueous Solutions of Mg-SO4.7H2O at 298.15K. J. Solution Chem. 2006. 35: 1441-1451. [ Links ]
6. Wang, J.; Yan, Z.; Zhao, Y.; Cui, F. Partial Molar Volumes and Viscosities of Some σ -Amino Acids in Micellar Solutions of Sodium Caprylate. J. Chem. Eng. Data. 2004. 49: 1354-1358. [ Links ]
7. Yan, Z.; Wang, X.; Xing, R.; Wang, J. Interactions of some glycyl dipeptides with sodium butyrate in aqueous solution at 298.15 K: A volumetric and conductometric study. J. Chem. Eng. Data. 2009. 54. 1787-1792. [ Links ]
8. Amalendu, P.; Suresh, K. Volumetric studies of some amino acids in binary aqueous solutions of Mg-Cl2.6H2O at 288.15 and 308.15 K. J. Chem. Sci. 2005. 117: 267-273. [ Links ]
9. Yan, Z.; Wang, J.; Kong, W.; Lu, J. Effect of temperature on volumetric and viscosity properties of some σ-amino acids in aqueous calcium chloride solutions. Fluid Phase Equilib. 2004. 215: 143-150. [ Links ]
10. Hemayat, S.; Fatemeh, J. Solute-Solvent Interactions of Amino Acids in Aqueous 1-Propyl-3-Methylimidazolium Bromide Ionic Liquid Solutions at 298.15 K. J. solution Chem. 2010. 39: 1409-1427. [ Links ]
11. Akhtar, Y. Volumetric and viscometric behaviour of some amino acids in aqueous metal electrolyte solutions at 308 K. Fluid Phase Equilib. 2007. 258: 125-130. [ Links ]
12. Deeying, N.; Sagarik, K. Effects of metal ion and solute conformation change on hydration of small amino acid. Biophys. Chem. 2009. 125: 72-91. [ Links ]
13. Biswajit, S.; Pran, K. R.; Mahendra, N. R. Apparent Molar Volumes and Viscosity B-Coefficients of Glycine in Aqueous Silver Sulphate Solutions at T = (298.15, 308.15, 318.15) K. Acta Chim. Slov. 2010. 57: 651-659. [ Links ]
14. Tarlok, S. B.; Jasbir, K.; Parampaul, K; Kultar, S. Study of Interactions between Amino Acids and Zinc Chloride in Aqueous Solutions through Volumetric Measurements at T = (288.15 to 318.15) K. J. Chem. Eng. Data. 2008. 53: 1803-1816. [ Links ]
15. Romero, C.; Moreno, E.; Rojas, J. Apparent Molal Volumes and Viscosities of DL - Alpha - Alanine in Water - Alcohol Mixtures. Thermochimica Acta. 1999. 328: 33-38. [ Links ]
16. Chunli, L.; Chonggui, R. Transfer Properties of Amino Acids from Water to Aqueous Sodium Sulfate Solutions at 298.15 K. J. Chem. Eng. Data. 2009. 54: 3296-3299. [ Links ]
17. Riyazuddeen, P.; Khan, I. Effect of KCl and KNO3 on Partial Molal Volumes and Partial Molal Compressibilities of Some Amino Acids at Different Temperatures. Int. J. Thermophys. 2009. 30: 475-489. [ Links ]
18. Henry, S. F.; Marjorie, W. E. Free Volume and Entropy in Condensed Systems III. Entropy in Binary Liquid Mixtures; Partial Molal Entropy in Dilute Solutions; Structure and Thermodynamics in Aqueous Electrolytes. J. Chem. Phys. 1945. 13: 478-483. [ Links ]
19. Lark, B. S.; Patyar, P.; Banipal, T. S. Temperature effect on the viscosity and heat capacity behaviour of some amino acids in water and aqueous magnesium chloride solutions. J. Chem. Thermodyn. 2007. 39: 344-360. [ Links ]
20. Natarajan, M.; Wadi, R. K.; Gaur, H. C. Apparent molar volumes and viscosities of some and σ,ω amino acids in aqueous ammonium chloride solutions at 298.15 K. J. Chem. Eng. Data. 1990. 35: 87-9. [ Links ]
21. Banipal, T. S.; Bhatia, A.; Banipal, P. K.; Singh, G.; Kaur, D. Partial molar volumes and viscosities of some amino acids in aqueous electrolyte and non-electrolyte solutions. J. Indian Chem Soc. 2004. 81: 126-131. [ Links ]
22. Bhat, R.; Ahluwalia, J. C. Effect of calcium chloride on the conformation of proteins. Int. J. Pept. 1987. 30: 145-152. [ Links ]
23. Bhat, R.; Ahluwalia, J. C. Partial molar heat capacities and volumes of transfer of some amino acids and peptide from water to aqueous sodium chloride solution at 298.5 K. J. Phys. Chem. 1985.89:1099-1105. [ Links ]
24. Rajagopal, K.; Jayabalakrishnan, S. Volumetric and Viscometric Studies of 4-Aminobutyric Acid in Aqueous Solutions of Salbutamol Sulphate at 308.15, 313.15 and 318.15 K. Chin. J. Chem. Eng. 2009. 17: 796-804. [ Links ]
25. Friedman, H.; Krishnan, C. V. Thermodynamics of Ion Hydration, in: Water, A comprehensive treatise. Plenum Press. Vol. 3. New York. pp. 1-18. 1973. [ Links ]
26. Bhat, R.; Kishore, N.; Ahluwalia, J. C. Thermodynamic studies of transfer of some amino acids and peptides from water to aqueous glucose and sucrose solutions at 298.15 K. J. Chem. Soc., Faraday Trans. I. 1988. 84: 2561-2665. [ Links ]
27. Li, Z.; Sang, W.; Lin, R. Partial molar volumes of glycine, L-alanine and L-serine in aqueous glucose solutions at T = 298.15 K. J. Chem. Thermodyn. 2002. 34: 1761-1768. [ Links ]
28. Shahidi, F.; Farrell, P. G. Partial molar volumes of some aminocarboxylic acid in water. J. Chem. Soc., Faraday Trans. 1981.77: 963-968. [ Links ]
29. Kabiraz, D. C.; Biswas, T. K.; Islam, M. N.; Huque, M. E. Studies on Molecular Interactions of Some Electrolytes in Water by Volumetric and Viscometric Measurements at T = (303.15 to 323.15 K). J. Sci. Res. 2011. 3: 437-444. [ Links ]
30. Zhenning, Y.; Qian, Z.; Wei, L.; Wang, J. Effect of Temperature on the Interactions of Glycyl Dipep tides with Sodium Dodecyl Sulfate in Aqueous Solution: A Volumetric, Conductometric, and Fluorescence Probe Study, J. Chem. Eng. Data. 2010. 55: 3560-3566. [ Links ]
31. Hepler, L. G. Thermal expansion and structure in water and aqueous solutions. Can. J. Chem. 1969. 47: 4613-4617. [ Links ]
32. Rajagopal, K.; Jayabalakrishnan, S. Effect of Temperature on Volumetric and Viscometric Properties of Homologous Amino Acids in Aqueous Solutions of Metformin Hydrochloride. Chin. J. Chem. Eng. 2010. 18: 425-445. [ Links ]
33. Berlin, E.; Pallansch, M. J. Densities of several proteins and L-aminoacids in the dry state. J. Phys. Chem. 1968. 72: 1887-1889. [ Links ]
34. Millero, F. J.; Antonio, L. S.; Charles, S. The apparent molar volumes and adiabatic compressibilities of aqueous amino acids at 25 °C. J. Phys. Chem. 1978. 82: 784-792. [ Links ]
35. Yan, Z.; Wang, J.; Kong, W.; Lu, J. Effect of temperature on volumetric and viscosity properties of some [alpha]-amino acids in aqueous calcium chloride solutions. Fluid Phase Equilib. 2004. 215: 143-150. [ Links ]
36. Wadi, R. K.; Ramasami, R. Partial molar volumes and adiabatic compressibilities of transfer of glycine and DL-alanine from water to aqueous sodium sulphate at 288.15, 298.15 and 308.15 K. J. Chem. Soc., Faraday Trans. 1997.93: 243-247. [ Links ]
37. McMillan, W. G.; Mayer, J. E. The statistical thermodynamics of multicomponent system. J. Chem. Phys. 1945. 13: 276-305. [ Links ]
38. Kozak, J.; Knight, W.; Kauzmann, W. Solute-Solute Interactions in Aqueous Solutions. J. Chem. Phys.1968. 48: 675-691. [ Links ]
39. Bartlomiej, P.; Dunal, J.; Waliszewski, D. Enthalpic Interaction Coefficients of Several l σ Amino Acids in Aqueous Sodium Chloride Solutions at 298.15 K. J. Chem. Eng. Data. 2010. 55: 5216-5218. [ Links ]
40. Tarlok, S. B.; Jasbir, K.; Parampaul, K.; Ashwani, K.; Kultar, S. Volumetric and Viscometric Studies of Some Amino Acids in Aqueous Solutions of Cadmium Chloride at T = (288.15 to 318.15) K and at Atmospheric Pressure. J. Chem. Eng. Data. 2011. 56: 2751-2760. [ Links ]
41. Lark, B. S.; Patyar, P.; Banipal, T. S. Thermodynamic studies on the interactions of diglycine with MgCl2 in aqueous medium at different temperatures, J. Chem. Thermodyn. 2006. 38: 1592-1605. [ Links ]













