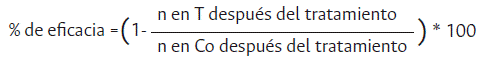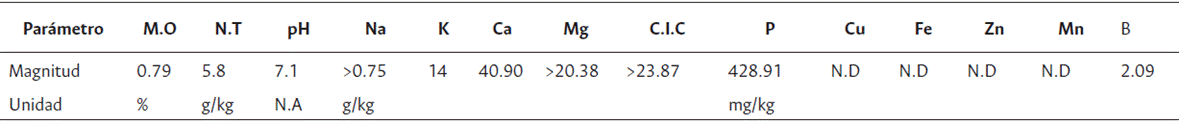Introducción
El arroz constituye una base importante para la seguridad alimentaria de las familias colombianas. No obstante, la presencia de insectos fitófagos es un factor trascendental que ocasiona pérdidas en el rendimiento del cultivo y en la calidad de la semilla de arroz; lo que, además, provoca una reducción de ingresos para los agricultores (Cuevas et al., 2018).
El control de insectos fitófagos en los cultivos de arroz depende principalmente de los insecticidas sintéticos, y aunque estos agentes sean útiles para regular poblaciones de insectos, su uso constante ha reducido la eficacia del control biológico. Esto ocurre debido a que generan resistencia en plagas, pierden efectividad, aumentan costos de producción y obligan a los agricultores a utilizar mayores cantidades del producto, o cambiar a un ingrediente activo con mayor toxicidad o concentración (Senthil-Nathan et al., 2009).
El problema ambiental derivado del manejo del cultivo de arroz con sustancias sintéticas comerciales (herbicidas, insecticidas) no solo está asociado con el riesgo sobre la salud pública entre cultivadores y poblaciones locales (Varona et al., 2016), sino también con los efectos negativos sobre depredadores y parasitoides, como, por ejemplo, coccinélidos y avispas, respectivamente (Tanaka et al., 2000; Senthil-Nathan et al., 2009). Por lo tanto, se debe propender por una producción agrícola de calidad, y ambientalmente amigable, que contribuya con la seguridad alimentaria, a través de prácticas agrícolas sostenibles, que reduzcan daños y desequilibrio ecosistémico, y con reducción en costos para grandes y pequeños agricultores (Bala et al., 2017).
Investigaciones relacionadas con interacciones insecto-planta (química ecológica) han mostrado el potencial semioquímico de los metabolitos secundarios de origen vegetal (Senthil-Nathan et al., 2009; El-Ghany y Nesreen, 2019). Se ha reportado el uso de aceites esenciales y extractos de origen vegetal como insecticidas y/o insectistáticos (Akhoundi et al., 2023; Muskat y Patel, 2022; Pickett, 2014; Novaes et al., 2013). Estos extractos poseen sustancias que generalmente inducen efectos subletales en insectos, como la inhibición del crecimiento y/o cambios en el comportamiento (anti-apetentes). Así, entre las plantas evaluadas como repelentes o atrayentes de insectos se encuentran: neem (Azadirachta indica A. Juss.); ají (Capsicum sp.); ajo (Allium sativum L.); tabaco (Nicotiana tabacum L.); anón (Annona coriacea Mart.); Memora peregrina (Miers) Sandwith; Ocotea velloziana (Meisn.) Mez; Eugenia malaccensis L. y Magonia pubescens A.St.-Hil. (Cuevas et al., 2018; Novaes et al., 2013).
Específicamente, el árbol de neem (Azadirachta indica A. Juss.), de la familia Meliaceae, que se cultiva principalmente en la India, ha sido muy utilizado con fines agrícolas y medicinales, desde la prehistoria hasta la actualidad, por lo que ha sido reconocido por las Naciones Unidas y La Academia Nacional de Ciencias de Estados Unidos (Kumar y Navaratnam, 2013; National Research Council [US], 1992).
En la década de los sesenta, se divulgó el conocimiento de agricultores indios, sobre langostas (plaga) que evitaban los árboles de neem, e incluso podían morirse por inanición. Así, se investigó sobre la acción insecticida del neem, y se confirmó que era efectivo contra más de 200 insectos plagas, incluyendo zancudos y chinches (vectores de enfermedades); además, se demostró que era seguro para animales y humanos (Pijoan, 2004). El neem y sus derivados funcionan como insecticidas sistémicos; que son absorbidos por la planta, e ingeridos por insectos fitófagos. Además, no es posible desarrollar resistencia frente a estos, a diferencia de los pesticidas sintéticos (Jilani y Saxena, 1990).
Los compuestos del neem tienen efectos diversos, dependiendo de la especie de insecto con la que interaccionan. Estudios indican que más de 300 especies de insectos son susceptibles, frente a estos. En el cultivo de arroz, las plagas más importantes que se afectan por el extracto del neem se encuentran entre los órdenes: Coleoptera, Diptera, Homoptera, Hemiptera, Ortoptera y Lepidoptera (Cuevas et al., 2018). Se tiene registro que el principal compuesto activo de la planta del neem (azadiractina), afecta insectos plaga en cultivos de arroz, trigo, vegetales y otros, sin atacar organismos no objetos de control, como, por ejemplo, insectos ocasionales y/o controladores biológicos. También, se tiene registro que es efectivo contra algunos nemátodos y hongos fitopatógenos (Diniz et al., 2006). El neem se ha utilizado en enmiendas orgánicas, con un impacto positivo en la diversidad de artrópodos de los arrozales, y es particularmente beneficioso para la restauración de enemigos naturales y mejora del entorno ecológico (Shanker, 2012).
El principio activo del neem (azadiractina) hace parte de una mezcla compleja de limonoides presentes en la planta que tienen diversos efectos sobre el comportamiento de cierta variedad de insectos (Schmutterer, 1990). Los limonoides presentes en el neem se encuentran en diferentes concentraciones en todas las partes de la planta: fruto, cáscara, semillas y hojas. La azadiractina afecta la fisiología del insecto, principalmente en larvas, inhibiendo el crecimiento y alterando la metamorfosis (hormona mudadora ecdisoma), reduce la fecundidad de hembras y causa que los huevos no sean fértiles (Alarcón, 2010). Los limonoides tienen un amplio espectro de acción y pueden actuar por contacto e ingestión. Además de la azadiractina se encuentran la nimbina y la salanita con efecto repelente y anti-alimentario en numerosos insectos y ácaros (Alarcón, 2010). Prates et al. (2003) comprobaron la eficacia del extracto acuoso del neem contra larvas de lepidóptera (Spodoptera frugiperda), con una CL50 de 27 mg mL-1 y un 79 % de mortalidad. Otros estudios han demostrado que el neem no perjudica especies predadoras como Euborellia annulipes (Dermaptero), por el contrario, aumentan su fase ninfal, en la que el insecto inicia su actividad predatoria contra insectos fitófagos, es decir, aumenta su potencial como controlador biológico (Pereira et al., 2007).
El efecto del extracto de hojas de neem también ha sido evaluado sobre: hongos (Alternaria solani y Fusarium oxysporum), plantas de tomate (Hassanein et al., 2010), cultivo de arroz (Kamarulzaman et al., 2018), y contra Sitophilus oryzae (Imran et al., 2021). Se ha documentado que el neem inhibe la germinación y el crecimiento de varias especies vegetales: alfalfa (Medicago sativa L.), judía (Vigna angularis [Willd.] Ohwi & H. Ohwi), zanahoria (Daucus carota L.), rábano (Raphanus sativus L.), arroz (Oryza sativa L.), y sésamo (Sesamum indicum L.) (Xuan, 2004). Son pocos los estudios que han incluido la evaluación del impacto del neem sobre especies no objetivo (Tavares, 2021).
De acuerdo con lo anterior, el objetivo de este estudio fue evaluar el efecto bio-controlador o el impacto del extracto acuoso de hojas de Azadiracta indica, sobre la población de insectos en un cultivo experimental de arroz en fase vegetativa. Se propone que las sustancias de origen natural pueden actuar como “biocontroladoras” cuando ayudan a reducir la población de insectos considerados como plaga, mediante un equilibrio sistémico que permite la conservación de la diversidad biológica. De tal manera que, no se evalúa de manera directa el modo de acción (insecticida, repelente o insectistático), sino el manejo holístico de la población de insectos en el cultivo.
Materiales y métodos
Localización
La investigación se realizó en la granja “El Cairo”, de la Universidad Nacional de Colombia - sede Orinoquía, km 9 vía Caño Limón, municipio de Arauca, departamento Arauca, Colombia. Coordenadas: 7”00´36” N, 70”44´34” W.
Establecimiento y manejo de parcelas (cultivo arroz)
Inicialmente se realizaron labores de preparación del suelo con tractor, efectuando pases de rastre y pulida; posteriormente, labranza manual con la construcción de camellones y drenajes, dividiendo el lote en subparcelas o bloques de 20 m2 (Figura 1). Se realizó el análisis de suelos previo a la siembra; después se realizó labor agronómica de fertilización, así como la nutrición con compostaje orgánico.
Debido a la época del cultivo (verano), se adecuó un sistema de riego apropiado, con un volumen de 0.3 m3 por parcela, garantizando la inundación requerida por la fisiología del arroz. Adicionalmente, fueron realizadas labores culturales de deshierbe manual.
Diseño experimental de bloques aleatorios (cultivo arroz)
Se realizó un diseño de bloques completamente aleatorio, ya que este es el más adecuado para parcelas experimentales en ensayos de evaluación de eficacia plaguicida (Agrocalidad, 2016). El diseño consistió en cuatro tratamientos con disoluciones acuosas preparadas a partir de hojas de neem. Las concentraciones de las disoluciones usadas para tratamientos en las parcelas fueron: Tt 0 = 0 % (testigo negativo, sin neem), Tto 1 = 5 %, Tto 2 = 10 %, y Tto 3 = 20 % (% v/v). En la Figura 1 se observa la distribución de las parcelas en campo con sus respectivos tratamientos y la distribución de los bloques.
Preparación y aplicación de tratamientos
Ramas de hojas frescas de neem fueron cosechadas manualmente y secadas a temperatura ambiente durante 48 h. Luego, el material vegetal se calentó durante 60 min a 70oC. El material seco fue triturado con molinos manual y eléctrico para la obtención de material pulverizado. A partir de este, se preparó una suspensión usando una proporción de 100 g de polvo/1000 ml de agua recién hervida, con una temperatura de 85oC (para pasteurización del extracto) (Prates et al., 2003). La mezcla se dejó en agitación a 1000 rpm durante 12 h, en oscuridad para mantener las propiedades químicas del extracto.
Posteriormente, a partir de la suspensión, con centrifugación, seguida de filtración al vacío, se separó el extracto acuoso (rendimiento de disolución stock: 500 ml ca.). Mediante dilución del extracto acuoso se prepararon 15 l de cada concentración (0, 5, 10, y 15 % v/v) para los tratamientos Tt 0, Tto 1, Tto 2 y Tto 3, que se aplicaron en las parcelas experimentales de arroz.
Los tratamientos se aplicaron a la parte foliar utilizando una bomba de espalda a motor (boquilla de cono lleno), con una frecuencia de una vez por semana, durante 1 mes, y garantizando la aspersión homogénea y completa de cada parcela.
Previo a la aplicación, la bomba de fumigación fue calibrada en campo, y se determinó el volumen de aplicación o de descarga de los tratamientos para cada parcela (2 l).
Las aspersiones fueron realizadas entre 4:30 pm y 5:30 pm, debido a que en ese período se presenta la mayor actividad de diversas plagas y se mejora la acción insecticida de la azadiractina, por disminución de su foto-degradación. En adición, para evitar pérdidas o interferencias en los tratamientos, durante cada aplicación, fueron protegidos los bordes de cada parcela.
Monitoreo en campo
Para el monitoreo en campo de insectos en vuelo o en plantas bajas fueron utilizados 2 métodos de muestreo:
Red entomológica (jama): consistió en un aro de 40 cm de diámetro, con un cono de tela muy suave de 100 cm de largo, y punta de cono redondo para evitar daño alar (Andrade et al., 2013). La captura fue realizada con 5 pases dobles por parcela, a la altura de las plantas y cerca de 10 cm del suelo.
Manojo al azar: consistió en seleccionar al azar en cada parcela 5 plantas de altura y densidad media. En las plantas escogidas fueron capturados todos los insectos presentes en raíz, tallo, hoja y espiga (Cuevas et al. 2018).
El muestreo fue realizado excluyendo los bordes de cada parcela para disminuir las variables de error por posible contaminación con el tratamiento aplicado en parcelas vecinas. Una vez capturados, los insectos fueron dispuestos en viales de vidrio de 10 ml, con alcohol al 70 %, para su posterior identificación y conteo. Los monitoreos fueron realizados semanalmente, el día después de cada aplicación del tratamiento, con el fin de verificar su eficacia, siguiendo las normas del manual de protocolos de ensayos de eficacia (Agrocalidad, 2016).
Identificación de insectos
Los insectos colectados en campo fueron separados a nivel de orden, a partir de la “Clave para identificar los principales órdenes de la Clase Insecto” (Cheli, 2018). Posteriormente, los insectos que a partir de literatura específica y el relato de productores podrían ser considerados como plaga fueron separados por familia. Las familias con número significativo de individuos fueron identificadas en morfo-especies.
Los especímenes recolectados (insectos) fueron trasladados a la Colección Entomológica de la Orinoquía (CEO) para su limpieza, montaje e identificación con ayuda de claves taxonómicas, estereoscopios (Nikon SMZ-10A), entre otros. Los especímenes se encuentran en proceso de catalogación.
Análisis de datos
La eficacia de los tratamientos aplicados para el control de plagas se determinó mediante la fórmula de Abbott (1987) (ecuación 1). Los datos obtenidos sobre colecta de insectos vivos en las parcelas experimentales de arroz se utilizaron para evaluar la eficacia de las disoluciones acuosas de extracto de neem, según lo propuesto por Agrocalidad (2016).
Donde, n= población de la plaga, T= tratados, Co= control
Además de hallar el porcentaje de eficacia del extracto en insectos considerados como plaga, también se analizó el aumento o disminución de insectos benéficos, entre otros. Se usaron pruebas estadísticas de normalidad de datos, análisis de varianza, pruebas paramétricas y no paramétricas y pruebas de Tukey, para comparaciones múltiples mediante el software estadístico R Studio, versión 3.4.1.
Resultados y discusión
Análisis de suelos
El análisis de suelo previo a la aplicación del compost orgánico mostró un suelo con características ácidas (pH entre 3.5 y 4.5), lo que implicaría toxicidad y deficiencias de algunos elementos como P, Ca, Mg y Mo, para las plantas cultivadas (Soil Science Division Staff, USDA, 2017). Además, se encontró un bajo contenido de materia orgánica (<2 %), aún para clima cálido. P y K mostraron una baja concentración (Tabla 1).
Tabla 1 Características fisicoquímicas de suelos de parcelas experimentales, previo a fertilización y siembra
N.A: no aplica; M.O: materia orgánica; N.T.: nitrógeno total; C.I.C.: capacidad de intercambio catiónico.
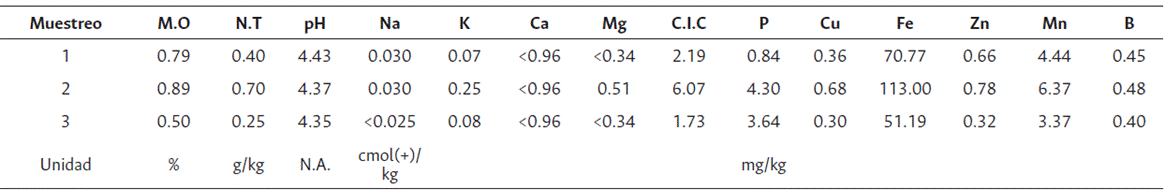
Se aplicó compost orgánico proveniente de la Granja Experimental el Cairo, el cual aportó materia orgánica y macroelementos esenciales para la nutrición del cultivo de arroz (Tabla 2).
Población de artrópodos
Durante los muestreos fueron colectados un total de 7418 individuos, clasificados hasta el nivel de orden (Diptera, Hemiptera, Coleoptera, Hymenopteraa, Orthoptera) (Figura 2). Algunos individuos fueron clasificados a nivel más específico, llegando hasta familia y especie. El mayor número de insectos fue encontrado en el orden Diptera (2670 individuos), sin embargo, la mayoría fueron zancudos, una especie que no afecta ni beneficia al cultivo en términos agronómicos. Esta alta población (41 % del total de díptera) podría deberse a factores climáticos y a la alta humedad de la zona.
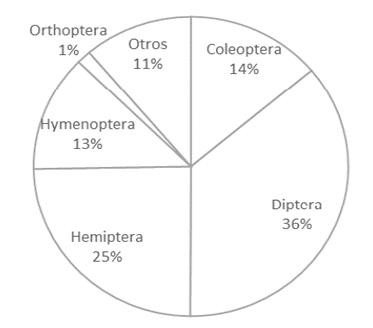
Figura 2 Distribución de la población de artrópodos (bajo el nivel taxonómico orden), encontrados en las parcelas experimentales.
El orden Hemiptera tuvo una abundancia del 25 % en la población colectada. Dentro de este grupo se encontraron insectos conocidos como “loritos” (familia Cicadellidae), que causan daños a cultivos, ya que tienen una dieta fitófaga; además, se colectaron insectos de la familia Delphacidae. A esta última se asocian insectos que se consideran como plaga de importancia económica en plantaciones de arroz, puesto que son depredadores (Peñaranda, 1999; Wolff, 2006).
En tercer y cuarto lugar se encontraron insectos de los órdenes Coleoptera e Hymenoptera, en los que existe una gran población de depredadores y parasitoides de insectos fitófagos perjudiciales en las plantaciones de arroz. Fueron encontrados los géneros Tagosodes sp. y Oebalus sp. (Hemiptera), de las familias Delphacidae y Pentatomidae, respectivamente. Los dos géneros son considerados plagas de importancia agrícola en la zona de los Llanos Orientales de Colombia (Peñaranda, 1999). El daño económico para Tagosodes sp. se asocia al número de insectos colectados en diez pases dobles de jama (pdj), siendo 10 individuos el número umbral. Así, una colecta mayor que 10 indica nivel de riesgo menor; más de 50 un riesgo medio, y más de 200 se considera riesgo alto (Peñaranda, 1999). Para Oebalus sp., el umbral varía desde 0.3 hasta 1.1 insectos por panícula de arroz (Meneses, 2008).
En nuestro caso de estudio, ningún insecto colectado fue considerado como plaga de importancia económica, ya que todos estaban por debajo del umbral de daño, mencionado por Peñaranda (1999). Esto puede ser debido a la alta presencia de controladores biológicos en la zona. Se encontraron artrópodos como mariquitas (Coleoptera: Coccinellidae), estafilínidos (Coleoptera: Stafilinidae), arañas (Araneae) y, parasitoides como avispas (Hymenoptera: Vespoideae), moscas (Diptera), entre otros. No obstante, se debe considerar que la densidad de enemigos naturales y predadores varía en diferentes épocas, dependiendo de condiciones ambientales aptas para su desarrollo (Shah et al., 2017).
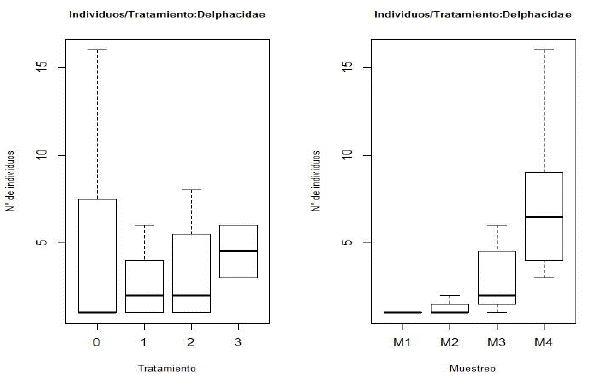
En la Figura 3 se observa el comportamiento de la población de los individuos de la familia Delphacidae, de acuerdo con el periodo de muestreo y la concentración del extracto de neem aplicado (tratamiento). Se muestra que hubo un aumento en el crecimiento poblacional a medida que el cultivo fue llegando a su etapa reproductiva. Sin embargo, normalmente las mayores poblaciones de Delphacidae, en la fenología del arroz, se encuentran desde la germinación al macollamiento (Cuevas et al., 2018). Este incremento poblacional, a pesar de que no llega al umbral de acción, se podría deber a alta población de arvenses gramíneas que son hospederos alternos de las plagas (Peñaranda, 1999).
Así mismo, se observaron diferencias en el comportamiento de la población Delphacidae, a lo largo del tiempo, y de acuerdo con el factor tratamiento. Así, con el tratamiento control (Tt 0), hubo mayor crecimiento de esta población de insectos, en cada muestreo. Para el tratamiento de mayor concentración (Tto 3), durante los tres primeros muestreos, no se encontraron individuos de esta familia de insectos. No obstante, el hallazgo en m4 (Tto 3), puede ser por el incremento de arvenses que no fueron manejadas culturalmente.
De acuerdo con el análisis de varianza, se encontró diferencia significativa entre la media de las poblaciones de Delphacidae, tanto en tratamientos como en muestreos (con un nivel de confianza del 95 %). En la Figura 4 (cajas y bigotes), se indica que existe diferencia en las medianas de los muestreos y una mayor en el m4, con respecto a los demás. En cuanto a los tratamientos, se tiene un caso similar en el que la mediana del tratamiento con mayor concentración del extracto (Tto 3), se encuentra por encima de los demás tratamientos, incluyendo al testigo (Tt 0). Para determinar estas diferencias se realizó el análisis de varianza (Anova), con el modelo de interacción entre los factores muestreo y tratamiento, con la media de individuos como variable respuesta. Se obtuvo como resultado una diferencia estadísticamente significativa entre los factores muestreo, tratamiento y la interacción de estos con la variable respuesta.
En la Figura 5 se muestra la distribución de datos (residuales del modelo del Anova), y se confirma el supuesto de normalidad de los datos (Figura 5) de acuerdo con la prueba de Shapiro, por lo que se acepta el uso de esta prueba para la comparación de las medias.
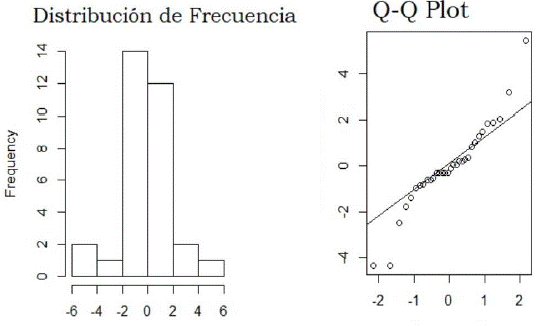
Figura 5 Gráfico Q-Q para diagnosticar distribución de los datos (izq) e histograma de frecuencia (der).
Mediante la prueba de comparaciones múltiples de Tukey se determinaron grandes diferencias en el último muestreo (m4, F = 24.530, d.f = 3, p < 0.05), lo que se puede explicar con base en las altas poblaciones de gramíneas (hospederas de la plaga, Delphacidae), en el momento del muestreo (etapa de germinación).
La diferencia entre los tratamientos se presentó entre el Tto 3 y Tt 0 (F = 3.766, d.f = 3, p < 0.05), es decir, el de mayor concentración del extracto relativo al tratamiento control. Para los demás tratamientos no se encontró diferencia significativa.
El análisis estadístico comprobó los resultados de la prueba de eficacia de Abbott, en la que se obtuvo una eficacia de 74 % para el Tto 3, respecto al testigo Tt 0. Además, este resultado confirma lo mostrado por Senthil-Nathan et al. (2009), en el que se indica la capacidad insecticida e insectistática del extracto de neem contra Nilaparvata lugens (Hemiptera - Delphacidae).
Evaluación de eficacia
La ecuación 1 se usó para el cálculo del porcentaje de eficacia del extracto de neem sobre la población de individuos del género Tagosodes sp., ya que se consideran plaga de gran importancia económica en la región de los Llanos Orientales (Peñaranda, 1999). Los resultados se indican en la Tabla 3.
Tabla 3 Resultados de eficacia de los tratamientos, respecto a la población de la familia Delphacidae
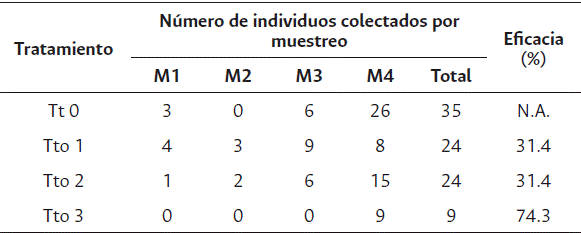
N.A: no aplica.
De acuerdo con las condiciones aplicadas al manejo del cultivo, el tratamiento Tto 3 (20 % v/v) alcanzó la eficacia mínima requerida para considerarlo como biocontrolador (Agrocalidad, 2016), específicamente en el control de especies de la familia Delphacidae (Tagosodes sp.). Aunque la población de insectos plaga no fue muy alta respecto a la esperada, incluso con la alta diversidad de arvenses presentes en el cultivo, la población de Delphacidae disminuyó, lo que puede dar certeza de la funcionalidad del extracto de neem como biocontrolador.
La baja población del insecto (Tagosodes sp.) puede deberse a la distribución de esta plaga en el cultivo. Tal como concluyeron Shah et al. (2017), la preferencia del insecto y el momento de aplicación del insecticida botánico influyen en la eficacia, por lo que debe haber sincronización entre la actividad del insecto plaga y la aplicación, además de otros factores de manejo agronómico. En este caso, las aplicaciones fueron realizadas en la etapa vegetativa.
Con la alta población de artrópodos benéficos en todos los tratamientos, se puede inferir que el biocontrolador, formulado con base en extracto de hojas de neem, no tiene efectos perjudiciales en los controladores biológicos de insectos fitófagos del cultivo de arroz.
Conclusiones
El extracto acuoso de hojas secas de neem (Azadirachta indica) en una concentración del 20 % v/v tuvo una eficacia del 74 %, para el control de insectos fitófagos de la familia Delphacidae.
La aplicación del biocontrolador no perjudica la población de controladores biológicos, lo cual es un aspecto muy positivo para el cultivo, ya que mantiene activa a las poblaciones de enemigos naturales, durante la fase vegetativa del cultivo de arroz.
Se recomienda el control adecuado de las arvenses (manejo cultural), puesto que se considera que influyen significativamente en el aumento de las poblaciones de plagas y, por ende, en la disminución de la productividad.
Se recomienda la aplicación de biocontroladores naturales, como el neem, puesto que además de los efectos benéficos relacionados con la reducción de plagas, también se contribuye a la conservación de los enemigos naturales de estas, lo cual es importante en el manejo del agro-ecosistema (biológico y económico), mediante un equilibrio sistémico, con conservación de la diversidad biológica. Debe tenerse una visión holística para el manejo del cultivo, entendiendo la ecología de las poblaciones.