Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá oct./dic. 2022 Epub 12-Jul-2023
https://doi.org/10.22516/25007440.837
Reporte de caso
Reservoritis secundaria a infección por citomegalovirus: reporte de caso y revisión de la literatura
1Internal medicine specialist, gastroenterologist. Professor of clinical-surgical gastroenterology, Universidad de Caldas. Manizales, Colombia.
2General surgery specialist, Clinical-surgical gastroenterologist. Professor of clinical-surgical gastroenterology, Universidad de Caldas. Manizales, Colombia.
3General surgery specialist, Resident of clinical-surgical gastroenterologist, Universidad de Caldas. Manizales, Colombia.
4General surgery specialist, Clinical-surgical gastroenterologist. Clinical-surgical gastroenterologist program coordinator, Universidad de Caldas. Manizales, Colombia. President of the Asociación Colombiana de Endoscopia Digestiva (ACED) (2020-2022).
La proctocolectomía total con reservorio ileal es el procedimiento quirúrgico de elección para la colitis ulcerativa refractaria (CUR) al tratamiento médico y la reservoritis es la complicación más frecuente y puede afectar hasta al 50% de los pacientes en los primeros 5 años del procedimiento. Aunque la etiología no está bien establecida, su presentación podría estar relacionada con disbiosis como resultado de la estasis fecal en individuos genéticamente susceptibles y con una respuesta inmunitaria alterada. Los síntomas típicos de reservoritis como diarrea, dolor abdominal, tenesmo, urgencia, incontinencia fecal y, menos frecuentemente, sangrado rectal no son específicos y el diagnóstico debe confirmarse mediante una evaluación endoscópica e histológica. La infección por citomegalovirus es infrecuente como causa de reservoritis; sin embargo, debe considerarse en pacientes con reservoritis refractaria al manejo antibiótico inicial. Las pruebas diagnósticas incluyen pruebas serológicas como la medición de anticuerpos, antigenemia y proteína C-reactiva (PCR) en sangre. El tratamiento de elección es el ganciclovir, medicamento de administración endovenosa que puede inducir complicaciones graves como mielosupresión, neutropenia y trombocitopenia. Se recomienda el seguimiento endoscópico posterior al tratamiento para asegurar la cicatrización mucosa, especialmente cuando hay sospecha de enfermedad de Crohn o compromiso del asa aferente en la endoscopia inicial.
Palabras clave: Colitis ulcerativa; reservoritis; citomegalovirus; proctocolectomía; reservorio ileal
Total proctocolectomy with ileal pouch is the surgical procedure of choice for ulcerative colitis refractory to medical treatment, and pouchitis is the most frequent complication. It can affect up to 50% of patients in the first five years of the procedure. Although the etiology is not well established, its manifestation could be related to dysbiosis resulting from fecal stasis in genetically susceptible individuals with altered immune responses. Typical symptoms of pouchitis, such as diarrhea, abdominal pain, tenesmus, urgency, fecal incontinence, and, less commonly, rectal bleeding, are nonspecific, and the diagnosis must be confirmed by endoscopic and histologic examination. Cytomegalovirus infection is an infrequent cause of pouchitis; however, it should be considered in patients with pouchitis refractory to initial antibiotic management. Diagnostic tests include serological tests such as the measurement of antibodies, antigenemia, and C-reactive protein (CRP) in blood. The treatment of choice is ganciclovir, an intravenous drug that can induce severe complications such as myelosuppression, neutropenia, and thrombocytopenia. Post-treatment endoscopic follow-up is recommended to ensure mucosal healing, especially when there is suspicion of Crohn’s disease or involvement of the afferent loop on initial endoscopy.
Keywords: Ulcerative colitis; pouchitis; cytomegalovirus; proctocolectomy; ileal pouch
Introducción
Se presume que entre el 6% y el 15% de los pacientes con colitis ulcerativa van a requerir manejo quirúrgico a pesar de los avances en la terapia farmacológica; esto se da principalmente en casos de enfermedad refractaria o desarrollo de carcinoma colorrectal durante el curso de la enfermedad1. La proctocolectomía total con reservorio ileal se considera la primera línea de tratamiento quirúrgico, y la reservoritis es la complicación más frecuente ya que afecta aproximadamente al 20% de los pacientes durante el primer año y a cerca del 50% en los primeros 5 años del procedimiento quirúrgico2,3. Se han descrito diferentes técnicas para la realización del reservorio ileal y complicaciones asociadas que se pueden clasificar como tempranas (en los primeros treinta días del procedimiento) o tardías4 (Figura 1, Tabla 1).
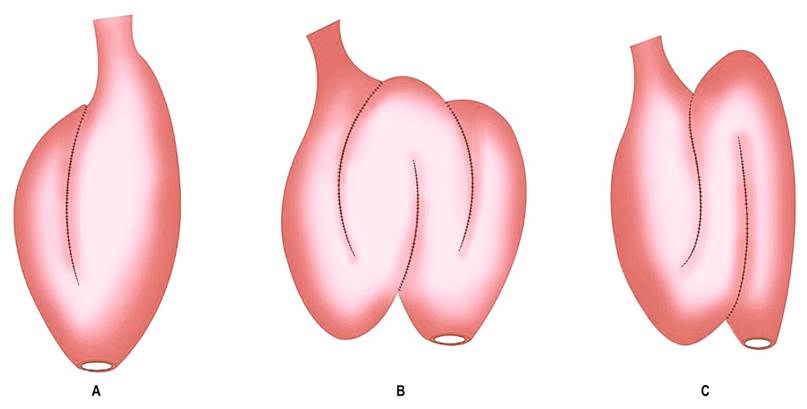
Figura 1 Tipos de reservorio ileal. A. Reservorio ileal en “J”. B. Reservorio ileal en “W”. C. Reservorio ileal en “S”. Modificada de4.
Tabla 1 Complicaciones asociadas a la realización del reservorio ileal
| Tempranas |
|---|
| Hemorragia (línea de sutura, isquemia del reservorio, sangrado intraabdominal, sangrado intramural) |
| Sepsis (fuga anastomótica, hematoma infectado) |
| Trombosis portal |
| Tardías |
| Obstrucción intestinal |
| Disfunción del reservorio |
| - Causas mecánicas (obstrucción, estenosis) |
| - Reservoritis |
| - Cufitis |
| - Síndrome del reservorio irritable |
| Falla del reservorio |
| Displasia y/o malignidad |
| Infertilidad |
Modificada de4.
Presentación del caso
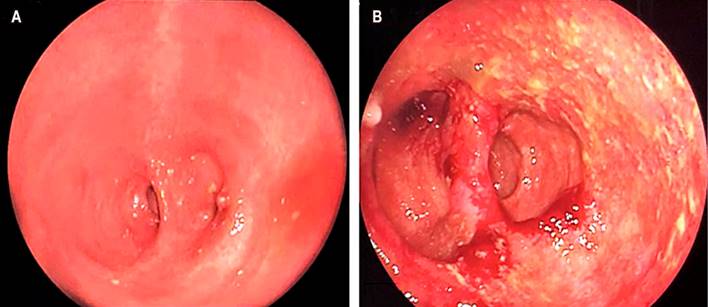
Paciente femenina de 32 años, con diagnóstico de colitis ulcerativa refractaria (CUR) desde los 18 años, quien requirió una proctocolectomía total con reservorio ileal en J y una ileostomía de protección en 2010 y se le realizó la restitución del tránsito intestinal a los 6 meses. Desde el primer año del procedimiento quirúrgico, la paciente presenta entre 2 y 3 episodios de reservoritis, para lo cual recibió tratamiento antibiótico (ciprofloxacina/metronidazol) que resolvió por completo los síntomas. En mayo de 2020, la paciente consulta nuevamente por un aumento en la frecuencia de las deposiciones (> 10 en 24 horas), dolor y distensión abdominal, sangrado rectal e incontinencia fecal. Se considera como un nuevo episodio de reservoritis, por lo que se inicia el tratamiento con ciprofloxacina a dosis de 500 mg cada 12 horas y se solicita evaluación endoscópica, procedimiento que se realiza 2 meses después con evidencia de múltiples úlceras cubiertas por fibrina y algunas elevaciones pustulosas con formación de seudomembranas. Se toman biopsias (Figura 2).
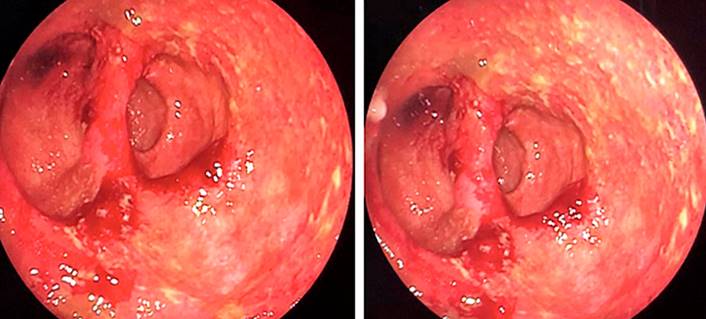
Figura 2 Hallazgos endoscópicos de reservoritis: edema, eritema, friabilidad de la mucosa, úlceras cubiertas por fibrina y elevaciones pustulosas. Fuente: archivo de los autores.
El reporte histopatológico informa: epitelio con cambios marcados por cronicidad que incluyen distorsión de la arquitectura, infiltrado linfoplasmocitario, cambios metaplásicos intestinales y disminución de la mucina intraglandular con extensa actividad de polimorfonucleares neutrófilos, abscesos crípticos y cambios citopáticos virales compatibles con citomegalovirus (CMV) (Figura 3).
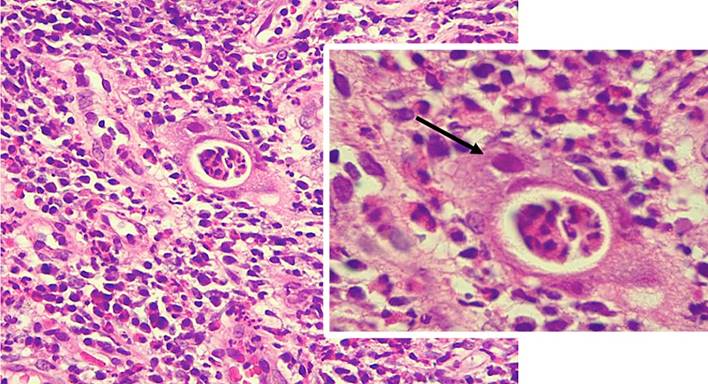
Figura 3 Hallazgos histológicos en reservoritis por citomegalovirus. Infiltrado inflamatorio mixto y célula citomegálica con aumento del tamaño del núcleo, sospechosa de una inclusión por citomegalovirus (flecha). Fuente: archivo de los autores.
La paciente persiste sintomática, no responde al tratamiento antibiótico administrado inicialmente y presenta una exacerbación de los síntomas, por lo que se decide iniciar el tratamiento antiviral con ganciclovir más ciprofloxacina endovenosa. Se completan 21 días de tratamiento con una respuesta clínica favorable y sin documentarse reacciones adversas a la administración del mismo. La paciente egresa debido a la resolución completa de los síntomas. El control endoscópico se realiza 3 meses después, en el que se encuentra una mejoría notoria con respecto al estudio inicial (Figura 4). Actualmente, la paciente permanece asintomática y en manejo con rifaximina por vía oral.
Discusión
La reservoritis es una inflamación inespecífica del reservorio ileal cuya patogenia no es del todo clara, pero que podría estar relacionada con alteraciones en la microbiota del reservorio como resultado de la estasis fecal en individuos genéticamente susceptibles y con una respuesta inmune alterada5. Los síntomas típicos son diarrea acuosa, dolor abdominal, tenesmo, urgencia, incontinencia fecal y, en menor frecuencia, sangrado rectal; sin embargo, este escenario clínico no es específico y el diagnóstico debe confirmarse con alteraciones endoscópicas e histológicas que permitan, además, descartar otras entidades como el síndrome de intestino irritable del reservorio o condiciones mecánicas asociadas al procedimiento quirúrgico6. Las principales características endoscópicas incluyen eritema, edema, friabilidad, hemorragia, pérdida del patrón vascular, erosiones y ulceraciones7 (Figura 2).
Se recomienda la toma de 4 a 6 biopsias del reservorio incluso si hay inflamación leve o ausente (en formas leves, la apariencia endoscópica puede ser normal) y 4 a 6 biopsias del asa aferente, esto permite detectar: granulomas, isquemia, inclusiones por CMV, displasia o isquemia8,9. Los hallazgos histológicos típicos son: inflamación aguda con infiltración de neutrófilos, abscesos crípticos o ulceración mucosa a menudo asociados a cambios crónicos como atrofia vellositaria, distorsión críptica e infiltrado inflamatorio crónico10 (Figura 3).
Una vez hecho el diagnóstico, se debe establecer el grado de actividad de la enfermedad empleando el índice de actividad de la reservoritis (Pouchitis Disease Activity Index, PDAI). Este índice consiste en una escala numérica que cuantifica la gravedad de la reservoritis y tiene en cuenta para su cálculo la clínica, los hallazgos endoscópicos e histológicos11. El diagnóstico requiere una puntuación ≥ 7. Dado que no siempre se cuenta con el reporte histológico, se ha diseñado el PDAI modificado que solo incluye criterios clínicos y endoscópicos; el diagnóstico en este caso requiere un puntaje ≥ 512 (Tabla 2).
Tabla 2 Índice PDAI. Reservoritis definida como PDAI ≥ 7 o PDAI modificado ≥ 5
| I. Criterios clínicos | |
|---|---|
| Número de deposiciones/día por encima de lo habitual | |
| - Igual | 0 |
| - 1-2 más | 1 |
| - 3 o más | 2 |
| Sangre en las heces | |
| - No/ocasional | 0 |
| - Diaria | 1 |
| Urgencia defecatoria o dolor tipo cólico | |
| - Ausente | 0 |
| - Ocasional | 1 |
| -Habitual | 2 |
| Fiebre > 38 ºC | |
| - No | 0 |
| - Sí | 1 |
| II. Criterios endoscópicos | |
| Edema | 1 |
| Granularidad | 1 |
| Friabilidad | 1 |
| Pérdida del patrón vascular | 1 |
| Exudado mucoso | 1 |
| Ulceración | 1 |
| Edema | 1 |
| III. Criterios histológicos | |
| Infitración de polimorfonuclerares | |
| - Leve | 1 |
| - Moderada + abscesos crípticos | 2 |
| - Severa + abscesos crípticos | 3 |
| Ulceración por campo de bajo poder (promedio) | |
| - < 25% | 1 |
| - 25%-50% | 2 |
| - > 50% | 3 |
Tomada de12.
La reservoritis se puede clasificar, de acuerdo con la duración de los síntomas, en aguda o crónica (mayor o menor de 4 semanas); según la respuesta a los antibióticos en respondedores, dependientes o refractarios; según la frecuencia de presentación en infrecuente, recurrente o continua (mayor o menor de 3 episodios al año); y según su etiología en idiopática (la mayoría de los casos) o secundaria, esta última incluye causas infecciosas (Clostridium difficile, CMV), complicaciones mecánicas relacionadas con el procedimiento quirúrgico (isquemia o estenosis), uso de antiinflamatorios no esteroideos o enfermedad de Crohn del reservorio6,10. La probabilidad de falla del reservorio es de 3%-15% principalmente en pacientes refractarios al tratamiento antibiótico; en este caso, se puede requerir un manejo quirúrgico con resección del reservorio, ileostomía definitiva o ambos6,13.
Los antibióticos son la primera línea de tratamiento con tasas de respuesta cercanas al 80%; tanto el metronidazol como la ciprofloxacina han demostrado ser efectivos14. La recaída después de un primer episodio de reservoritis es común y cerca del 20% van a desarrollar recaídas frecuentes o enfermedad refractaria2. Aquellos pacientes con tres o más episodios anuales a pesar del tratamiento antibiótico son considerados antibiótico-dependientes15, y los probióticos son una opción efectiva para mantener la remisión inducida por la terapia antibiótica16,17. Otras terapias de mantenimiento como la rifaximina y mesalazina oral o tópica también se han utilizado y podrían ser consideradas; sin embargo, la evidencia existente es de baja calidad para recomendar su uso generalizado18,19. En estos pacientes, al igual que en aquellos que no responden inicialmente al tratamiento antibiótico, se deben descartar siempre las causas secundarias y, en caso de documentarse, indicar el tratamiento específico2.
La infección por CMV es infrecuente como causa de reservoritis, sin embargo, debe considerarse en pacientes que no responden al tratamiento antibiótico inicial. El CMV es un virus ADN de doble cadena perteneciente a la familia Herpesviridae; los humanos son su único hospedero natural y es ubicuo en la población adulta. La infección primaria ocurre generalmente en la infancia y suele ser asintomática en pacientes inmunocompetentes, seguido de un período indefinido de permanencia en las células endoteliales, fibroblastos y células de linaje mieloide. La seroprevalencia varía dependiendo de la edad y la etnia con porcentajes cercanos al 90% en los adultos mayores20. Las lesiones por CMV se pueden dar por infección primaria o reactivación del virus latente. La reactivación se da principalmente en individuos con inmunidad celular comprometida; en pacientes con enfermedad inflamatoria intestinal, los factores de riesgo conocidos para la reactivación son: edad avanzada, sexo femenino, enfermedad grave y uso recurrente de corticoides21,22. La infección activa por CMV implica que este sea detectable en la sangre o en especímenes patológicos (biopsia), incluyendo histología, inmunohistoquímica (IHQ) o reacción en cadena de la polimerasa (RCP) en el tejido23.
Las pruebas diagnósticas incluyen pruebas serológicas como la medición de anticuerpos, antigenemia y proteína C-reactiva (PCR) en sangre. La inmunoglobulina G (IgG) diagnostica el contacto previo, mientras que la IgM es muy sensible y específica para detectar infección aguda o reactivación cuando se acompaña de viremia23. La PCR en sangre puede ser diagnóstica, pero no existe un punto de corte que diferencie la infección latente de la activa. La sensibilidad y especificidad de la antigenemia se han portado en 47% y 81%, respectivamente20,24. La coloración con hematoxilina/eosina ofrece una alta especificidad (92% a 100%), pero baja sensibilidad (10% a 87%); la IHQ aumenta la sensibilidad de 78% a 93%25.
La PCR en el tejido tiene una alta sensibilidad (92%-96%) y especificidad (93%-98%) y puede considerarse cuando la IHQ sea negativa en casos con alta sospecha de infección por CMV26. A pesar de la alta sensibilidad y especificidad del cultivo (45%-75% y 89%-100%, respectivamente), este carece de utilidad clínica, pues los resultados pueden tardar entre dos y cuatro semanas20.
El ganciclovir es el tratamiento de elección y debe administrarse en infusión endovenosa debido a su baja biodisponibilidad por vía oral, la dosis recomendada es 5 mg/kg dos veces al día durante 2 a 3 semanas; puede inducir complicaciones graves como: mielosupresión, neutropenia y trombocitopenia, así como cefalea, náusea, vómito e hipotensión, por lo que se recomienda monitorizar estos efectos con regularidad20,21. Este tratamiento usualmente requiere hospitalización, sin embargo, podría ser reemplazado por el valganciclovir oral aunque su eficacia es controversial20. Existen pocos datos en la literatura sobre el seguimiento posterior a la terapia antiviral, pero se sugiere considerar la evaluación endoscópica para asegurar la cicatrización mucosa, especialmente cuando hay sospecha de enfermedad de Crohn o compromiso del asa aferente en la endoscopia inicial20,21.
Conclusiones
La proctocolectomía total con reservorio ileal es el tratamiento de elección para la CUR, y la reservoritis es la complicación más frecuente en estos pacientes. La infección por CMV es infrecuente y se requiere un alto índice de sospecha para su diagnóstico; sin embargo, la presencia de síntomas en individuos inmunosuprimidos o que no responden al tratamiento convencional deben hacer sospechar siempre de esta condición.
REFERENCIAS
1. Parragi L, Fournier N, Zeitz J, Scharl M, Greuter T, Schreiner P, et al. Colectomy rates in ulcerative colitis are low and decreasing: 10-year follow-up data from the Swiss IBD cohort study. J Crohn’s Colitis. 2018;12(7):811-8. https://doi.org/10.1093/ecco-jcc/jjy040 [ Links ]
2. Sedano R, Nuñez P, Quera R. Diagnostic and management approach to pouchitis in inflammatory bowel disease. Arq Gastroenterol. 2020;57(1):100-6. https://doi.org/10.1590/s0004-2803.202000000-17 [ Links ]
3. Ferrante M, Declerck S, De Hertogh G, Van Assche G, Geboes K, Rutgeerts P, et al. Outcome after proctocolectomy with ileal pouch-anal anastomosis for ulcerative colitis. Inflamm Bowel Dis. 2008;14(1):20-8. https://doi.org/10.1002/ibd.20278 [ Links ]
4. Ng KS, Gonsalves SJ, Sagar PM. Ileal-anal pouches: A review of its history, indications, and complications. World J Gastroenterol. 2019;25(31):4320-42. https://doi.org/10.3748/wjg.v25.i31.4320 [ Links ]
5. Shen B. Acute and chronic pouchitis - Pathogenesis, diagnosis and treatment. Nat Rev Gastroenterol Hepatol. 2012;9(6):323-33. https://doi.org/10.1038/nrgastro.2012.58 [ Links ]
6. Barreiro-de Acosta M, Bastón-Rey I, Calviño-Suárez C, Enrique Domínguez-Muñoz J. Pouchitis: Treatment dilemmas at different stages of the disease. United Eur Gastroenterol J. 2020;8(3):256-62. https://doi.org/10.1177/2050640619900571 [ Links ]
7. Fukushima K, Fujii H, Yamamura T, Sugita A, Kameoka S, Nagawa H, et al. Pouchitis atlas for objective endoscopic diagnosis. J Gastroenterol. 2007;42(10):799-806. https://doi.org/10.1007/s00535-007-2083-3 [ Links ]
8. Shen B, Fleshner P, Shah SA. How Do I Diagnose and Manage Ileal Pouch Disorders? Am J Gastroenterol. 2021;116(4):621-4. https://doi.org/10.14309/ajg.0000000000001084 [ Links ]
9. Barreiro-de Acosta M, Gutierrez A, Rodríguez-Lago I, Espín E, Ferrer Bradley I, Marín-Jimenez I, et al. Recommendations of the Spanish Working Group on Crohn’s Disease and Ulcerative Colitis (GETECCU) on pouchitis in ulcerative colitis. Part 1: Epidemiology, diagnosis and prognosis. Gastroenterol Hepatol. 2019;42(9):568-78. https://doi.org/10.1016/j.gastrohep.2019.08.001 [ Links ]
10. Shen B. Pouchitis: What every gastroenterologist needs to know. Clin Gastroenterol Hepatol. 2013;11(12):1538-49. https://doi.org/10.1016/j.cgh.2013.03.033 [ Links ]
11. Sandborn WJ, Tremaine WJ, Batts KP, Pemberton JH, Phillips SF. Pouchitis After Ileal Pouch-Anal Anastomosis: A Pouchitis Disease Activity Index. Mayo Clin Proc. 1994;69(5):409-15. https://doi.org/10.1016/S0025-6196(12)61634-6 [ Links ]
12. Shen B, Achkar JP, Connor JT, Ormsby AH, Remzi FH, Bevins CL, et al. Modified pouchitis disease activity index: A simplified approach to the diagnosis of pouchitis. Dis Colon Rectum. 2003;46(6):748-53. https://doi.org/10.1007/s10350-004-6652-8 [ Links ]
13. Fazio VW, Tekkis PP, Remzi F, Lavery IC, Manilich E, Connor J, et al. Quantification of Risk for Pouch Failure after Ileal Pouch Anal Anastomosis Surgery. Ann Surg. 2003;238(4):605-17. https://doi.org/10.1097/01.sla.0000090940.39838.6a [ Links ]
14. Dalal RL, Shen B, Schwartz DA. Management of Pouchitis and Other Common Complications of the Pouch. Inflamm Bowel Dis. 2018;24(5):989-96. https://doi.org/10.1093/ibd/izy020 [ Links ]
15. Barreiro-de Acosta M, Marín-Jimenez I, Rodríguez-Lago I, Guarner F, Espín E, Ferrer Bradley I, et al. Recommendations of the Spanish Working Group on Crohn’s Disease and Ulcerative Colitis (GETECCU) on pouchitis in ulcerative colitis. Part 2: Treatment. Gastroenterol Hepatol. 2020;43(10):649-58. https://doi.org/10.1016/j.gastrohep.2020.04.004 [ Links ]
16. Lichtenstein L, Avni-Biron I, Ben-Bassat O. The current place of probiotics and prebiotics in the treatment of pouchitis. Best Pract Res Clin Gastroenterol. 2016;30(1):73-80. https://doi.org/10.1016/j.bpg.2016.02.003 [ Links ]
17. Shen J, Zuo ZX, Mao AP. Effect of probiotics on inducing remission and maintaining therapy in ulcerative colitis, Crohn’s disease, and pouchitis: Meta-analysis of randomized controlled trials. Inflamm Bowel Dis. 2014;20(1):21-35. https://doi.org/10.1097/01.MIB.0000437495.30052.be [ Links ]
18. Isaacs KL, Sandler RS, Abreu M, Picco MF, Hanauer SB, Bickston SJ, et al. Rifaximin for the treatment of active pouchitis: A randomized, double-blind, placebo-controlled pilot study. Inflamm Bowel Dis. 2007;13(10):1250-5. https://doi.org/10.1002/ibd.20187 [ Links ]
19. Belluzzi A, Serrani M, Roda G, Bianchi ML, Castellani L, Grazia M, et al. Pilot study: The use of sulfasalazine for the treatment of acute pouchitis. Aliment Pharmacol Ther. 2010;31(2):228-32. https://doi.org/10.1111/j.1365-2036.2009.04163.x [ Links ]
20. Park SC, Jeen YM, Jeen YT. Approach to cytomegalovirus infections in patients with ulcerative colitis. Korean J Intern Med. 2017;383-92. https://doi.org/10.3904/kjim.2017.087 [ Links ]
21. McCurdy JD, Loftus EV., Tremaine WJ, Smyrk TC, Bruining DH, Pardi DS, et al. Cytomegalovirus infection of the ileoanal pouch: Clinical characteristics and outcomes. Inflamm Bowel Dis. 2013;19(11):2394-9. https://doi.org/10.1097/MIB.0b013e3182a52553 [ Links ]
22. Kishore J, Ghoshal U, Ghoshal UC, Krishnani N, Kumar S, Singh M, et al. Infection with cytomegalovirus in patients with inflammatory bowel disease: Prevalence, clinical significance and outcome. J Med Microbiol. 2004;53(11):1155-60. https://doi.org/10.1099/jmm.0.45629-0 [ Links ]
23. Pillet S, Pozzetto B, Jarlot C, Paul S, Roblin X. Management of cytomegalovirus infection in inflammatory bowel diseases. Dig Liver Dis. 2012;44(7):541-8. https://doi.org/10.1016/j.dld.2012.03.018 [ Links ]
24. Kim JW, Boo SJ, Ye BD, Kim CL, Yang SK, Kim J, et al. Clinical utility of cytomegalovirus antigenemia assay and blood cytomegalovirus DNA PCR for cytomegaloviral colitis patients with moderate to severe ulcerative colitis. J Crohn’s Colitis. 2014;8(7):693-701. https://doi.org/10.1016/j.crohns.2013.12.014 [ Links ]
25. Kandiel A, Lashner B. Cytomegalovirus colitis complicating inflammatory bowel disease. Am J Gastroenterol. 2006;101(12):2857-65. https://doi.org/10.1111/j.1572-0241.2006.00869.x [ Links ]
26. McCoy MH, Post K, Sen JD, Chang HY, Zhao Z, Fan R, et al. QPCR increases sensitivity to detect cytomegalovirus in formalin-fixed, paraffin-embedded tissue of gastrointestinal biopsies. Hum Pathol. 2014;45(1):48-53. https://doi.org/10.1016/j.humpath.2013.07.040 [ Links ]
Citación: Jaramillo-Santos MA, Puentes-Manosalva FE, Bautista-Parada IR, Arango-Molano LA. Reservoritis secundaria a infección por citomegalovirus: reporte de caso y revisión de la literatura. Revista. colomb. Gastroenterol. 2022;37(4):495-501. https://doi.org/10.22516/25007440.837
Recibido: 08 de Octubre de 2021; Aprobado: 03 de Noviembre de 2021











 texto en
texto en