Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Iatreia
versión impresa ISSN 0121-0793
Iatreia v.20 n.3 Medellín jul./sep. 2007
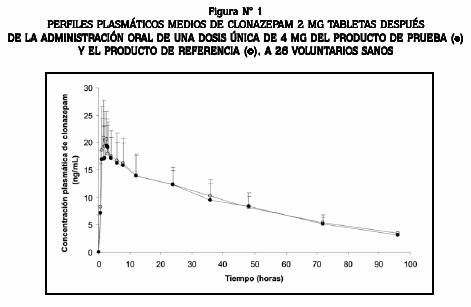
Estudio de bioequivalencia de clonazepam, tabletas de 2 mg, en voluntarios sanos colombianos
Bioequivalence study of clonazepam 2 mg tablets in colombian healthy volunteers
FANNY CUESTA GONZÁLEZ1,2, GLORIA HOLGUÍN MARTÍNEZ1,3, ROSENDO RICARDO ARCHBOLD JOSEPH1,4, SERGIO PARRA1,5, MARGARITA MARÍA RESTREPO GARAY1,6, LINA MARÍA PEÑA ACEVEDO1,7, BLANCA CECILIA MONTOYA BELTRÁN1,8, JUAN CARLOS RÍOS TORO1,9, VICTORIA EUGENIA TORO PAREJA1,10, OMAR DE JESÚS CORREA CANO1,11, ADRIANA MARÍA RUIZ CORREA1,12
- Grupo de Estudio e Investigaciones Biofarmacéuticas, Universidad de Antioquia, Medellín, Colombia.
- Ingeniera Química, Especialista en Farmacocinética.
- Química Farmacéutica, Especialista en Sistemas de calidad.
- Químico Farmacéutico, Magíster en Educación.
- Médico Cirujano, Magíster en Ciencias Básicas Biomédicas.
- Química Farmacéutica, Magíster en Ciencias Básicas Biomédicas.
- Médica Cirujana, Toxicóloga Clínica.
- Bacterióloga y Laboratorista clínica.
- Médico Cirujano, Magíster en Ciencias Básicas Biomédicas.
- Química Farmacéutica, Especialista en Atención Farmacéutica. Estudiante de Maestría en Ciencias Farmacéuticas.
- Químico Farmacéutico, Especialista en Atención Farmacéutica. Estudiante de Maestría en Ciencias Farmacéuticas.
- Química Farmacéutica, Magíster en Ciencias Básicas Biomédicas. Doctora en Ciencias Farmacéuticas.
Entidad patrocinadora: Tecnoquímicas S. A.
Recibido: marzo 24 de 2007
Aceptado: mayo 28 de 2007
RESUMEN
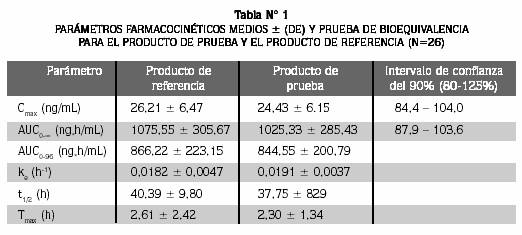
Con el fin de determinar la bioequivalencia de dos formulaciones de tabletas de 2 mg de clonazepam: Sedatril®/Clonazepam MK (Tecnoquímicas S. A., Cali, Colombia) como producto de prueba y Rivotril® (Roche Químicos e Farmacéuticas S. A., Río de Janeiro, Brasil), como producto de referencia, se realizó un estudio de bioequivalencia en 26 voluntarios sanos. Los productos de prueba y de referencia se administraron en condiciones de ayuno de acuerdo con un diseño cruzado aleatorio de dosis única, con dos secuencias, dos tratamientos y un período de lavado de 28 días. Las muestras de sangre se obtuvieron desde las 0 hasta las 96 horas después de la administración del medicamento. Los niveles plasmáticos de clonazepam se determinaron con un método validado por cromatografía líquida de alta eficiencia con detección ultravioleta (HPLC/UV, siglas en inglés). Los parámetros farmacocinéticos ABC 0-96, ABC 0-∞, Cmax, Tmax, t½, and ke se determinaron de los perfiles plasmáticos concentración-tiempo por el método no compartimental. El test de bioequivalencia se realizó con los datos transformados a logaritmo natural (ln) de ABC 0-∞ and Cmax. Los intervalos de confianza del 90% para la relación producto de prueba/producto de referencia fueron de 87,9% a 103,6% y 84,4% a 104,0%, respectivamente. Estos resultados estuvieron dentro de los rangos de aceptación del 80,0% al 125%, establecidos por la FDA y se concluyó que ambos productos son bioequivalentes.
PALABRAS CLAVE
BIODISPONIBILIDAD
CLONAZEPAM
FARMACOCINÉTICA
HPLC (del inglés High Perfomance Liquid Chromatography)
SUMMARY
In order to determine the bioequivalence of two formulations of clonazepam 2 mg tablets: Sedatril®/Clonazepam MK (Tecnoquímicas S. A., Cali, Colombia) as a test product and Rivotril® (Roche Químicos e Farmacêuticas S. A., Rio de Janeiro, Brazil) as a reference product, a bioavailability study was performed in 26 healthy volunteers. Test and reference products were administered under fasting conditions following a single dose, two-sequences, two treatments, crossover randomized design with a 28-day-washout period. Blood samples were obtained from 0 to 96 hours after dosing. Plasma clonazepam levels were determined by a validated high performance liquid chromatography with UV detection method (HPLC/UV). ABC 0-96, ABC 0-∞, Cmax, Tmax, t½, and ke, pharmacokinetic parameters were determined from plasma level-time profiles by a noncompartmental method. ln-trasformed ABC 0-∞ and Cmax were tested for bioequivalence. 90%-confidence intervals for test/reference ratio of these parameters were 87.9% to 103.6% and 84.4% to 104.0%, respectively. These results were within the FDA acceptance range of 80% to 125% and it was concluded that both products were bioequivalent.
KEY WORDS
BIOAVAILABILITY
CLONAZEPAM
HIGH PERFORMANCE LIQUID CHROMATOGRAPHY
PHARMACOKINETICS
INTRODUCCIÓN
El clonazepam es un derivado de las benzodiazepinas, utilizado para el tratamiento de la ansiedad, el trastorno de pánico y como coadyuvante en el control de varios tipos de ataques epilépticos (espasmos infantiles, epilepsias mioclónicas y crisis de ausencias).1,2 Este fármaco facilita la transmisión GABAérgica en el cerebro por un efecto directo sobre los receptores GABA A.1
Los parámetros farmacocinéticos del clonazepam muestran una alta variabilidad; después de la administración oral las concentraciones máximas se alcanzan dentro de 1 a 8 horas3 y su biodisponibilidad es alrededor del 90%. El clonazepam se une a las proteínas plasmáticas aproximadamente en un 85%4 y muestra un volumen de distribución entre 1,8 y 4,4 L/kg.5 Este fármaco se metaboliza en el hígado y las vías metabólicas incluyen oxidación, reducción y reacciones de fase II. La biotransformación produce cinco metabolitos inactivos. La depuración plasmática del clonazepam es alrededor de 1,55 mL/min/kg,1 mientras que su vida media de eliminación terminal varía de 19 a 39 horas,3 aunque algunos autores han publicado valores entre 24 y 60 horas.5
En el mercado colombiano se pueden encontrar clonazepam de la marca innovadora y formulaciones genéricas; esta últimas son asequibles a un mayor número de pacientes. Las autoridades colombianas aprueban la comercialización de las versiones genéricas con base en un estudio de bioequivalencia en seres humanos sanos. De este modo, se prueba que la calidad biofarmacéutica y las propiedades de la formulación genérica son similares a las del producto de referencia, lo que garantiza su intercambiabilidad. El objetivo de este estudio fue evaluar la bioequivalencia del producto de prueba Sedatril®/Clonazepam MK (Tecnoquímicas S. A., Cali, Colombia) y el producto de referencia Rivotril® (Roche Químicos e Farmacêuticas S. A., Río de Janeiro, Brasil).
MATERIALES Y MÉTODOS
Formulaciones de estudio
Producto de prueba: Sedatril®/Clonazepam MK, 2 mg tabletas.
Lote Nº EX3H17 (E), fecha de caducidad: 03/2006.
Fabricante: Tecnoquímicas S. A., Cali Colombia.
Producto de referencia: Rivotril®, 2 mg tabletas.
Lote Nº RJ0112, fecha de caducidad: 03/2008.
Fabricante: Roche Químicos e Farmacêuticas S. A.,
Río de Janeiro, Brasil para Productos Roche S.A.
Protocolo del estudio
Este estudio se llevó a cabo en 26 voluntarios (17 mujeres y 9 hombres), no fumadores. Todos ellos estuvieron dentro del peso ideal para su estatura de acuerdo con las tablas de la Metropolitan Life Insurance. Todos fueron seleccionados con base en su historia médica, examen físico y pruebas de función hepática, renal y hematológica. Todos fueron negativos para el antígeno de la hepatitis B y para VIH y las mujeres para la prueba de embarazo. Se les indicó que se abstuvieran de tomar bebidas alcohólicas, bebidas o alimentos con xantinas o cualquier tipo de medicamento desde dos semanas antes y durante el período del estudio. Para el desarrollo de la investigación se tuvieron en cuenta la declaración de Helsinki revisada con sus enmiendas, la resolución del Ministerio de Salud de Colombia 6 y las Buenas Prácticas Clínicas.7 El protocolo del estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Antioquia. Antes de ingresar al estudio, a los sujetos se les informó sobre su papel en la investigación y los posibles riesgos; finalmente, después de leer el protocolo, firmaron el consentimiento informado.
El estudio se llevó a cabo siguiendo un diseño cruzado aleatorio con dos tratamientos, dos secuencias y un período de lavado de 28 días. Los participantes en el estudio se distribuyeron al azar en ambas secuencias de administración de los productos. Una dosis única de 4 mg (2 tabletas) de cada formulación se administró con 240 mL de agua, después de un período de ayuno de 12 horas y de la determinación de ausencia de alcohol y sustancias psicoactivas en muestras de orina de cada uno de ellos. La alimentación fue estandarizada para los dos períodos. Se les suministraron desayuno, almuerzo, refrigerio y cena 2, 5, 8, y 11 horas después de la administración del medicamento. Estuvieron bajo supervisión médica continua y debieron permanecer en el sitio del estudio, en posición supina o en decúbito lateral izquierdo hasta las primeras 24 horas. Posteriormente, abandonaron el hospital y durante los tres días siguientes regresaron cada mañana para la recolección de las muestras de sangre; éstas se obtuvieron en tubos con heparina de 10 mL (Becton Dickinson, NY), a través de un catéter, antes de la administración del medicamento y ½, 1, 1½, 2, 2½, 3, 4, 6, 8, 12, 24, 36, 48, 72 y 96 horas después de la administración del mismo. Las muestras se centrifugaron a 2.500 rpm para obtener el plasma, que fue almacenado a -20 °C hasta el momento del análisis.
Determinación de los niveles plasmáticosde clonazepam
La separación del clonazepam del plasma se llevó a cabo por extracción líquido-líquido siguiendo el método propuesto por Robertson y Drummer.8 Un mL de la muestra de plasma se mezcló con 10 µL de estándar interno acuoso (lorazepam, 200 µg/mL), luego se alcalinizó con solución de carbonato de sodio 0,2M (pH 11,5) y se extrajo con 6 mL de n-butil acetato. La capa orgánica se separó y evaporó a sequedad a 60 °C. El residuo seco se reconstituyó en 300 µL de fase móvil y se inyectaron alícuotas de 100 µL al sistema cromatográfico.
La separación de los compuestos se hizo en una columna C18 y se llevó a cabo de acuerdo con el método reportado por Chauhan y col.9 Se utilizó un cromatógrafo de marca Agilent, modelo HP 1100 (California, USA). La fase móvil consistió en fosfato de potasio dibásico, 50 mM (pH 3.6) y acetonitrilo (32:68) y se bombeó a través del sistema a un flujo de 1.5 mL/min. El efluente de la columna se monitorizó a 330 nm. El método se validó siguiendo los criterios establecidos en la guía de la FDA.10
Análisis farmacocinético
El análisis farmacocinético se realizó mediante un modelo independiente utilizando el programa MS Excel y los resultados se comprobaron con el programa PK solutions 2.0TM. La concentración plasmática máxima (Cmax) y el tiempo para alcanzarla (Tmax) se determinaron por inspección de las curvas individuales de concentración plasmática-tiempo. La constante de velocidad de eliminación (ke) se obtuvo por regresión log-lineal de la fase de decaimiento terminal y el tiempo de vida media (t½) se calculó al dividir el ln de 2 por ke. El área bajo la curva de concentración plasmática-tiempo (ABC 0-96) se obtuvo por la regla de los trapecios y el área bajo la curva de cero a infinito (ABC 0-∞) se halló adicionando al ABC 0-96 el resultado de dividir la última concentración por ke.
Análisis estadístico
Para la evaluación estadística de los datos se aplicó el análisis de varianza (ANOVA) utilizando el programa Statistica 6.0 (Statsoft Inc., 2001) para un diseño cruzado. Se determinaron los efectos del tratamiento, período, secuencia y sujetos sobre los datos transformados a ln de ABC 0-∞ y Cmax y sobre los datos no transformados de Tmax. 11 Para evaluar la bioequivalencia entre las dos formulaciones se calcularon los intervalos de confianza del 90% con un nivel de significancia del 0,05 de la relación producto de prueba/producto de referencia, de ABC 0-∞ y Cmax, utilizando el enfoque propuesto por Schuirmann (prueba de hipótesis unilateral doble).12 Los datos se presentan como medias ± desviación estándar (DS).
RESULTADOS Y DISCUSIÓN
Análisis cromatográfico
El método analítico que se utilizó fue adecuado para la determinación de clonazepam en plasma. Los tiempos de retención para el lorazepam y el clonazepam fueron de 8,1 y 9,1 minutos, respectivamente. La relación entre la concentración y la proporción de áreas (clonazepam/lorazepam) fue lineal dentro del rango de 2,5 a 40,0 ng/mL (r > 0,998). Los coeficientes de variación intradía e interdía de la pendiente de la línea de regresión fueron 9,55% y 10,02%, respectivamente. La recuperación media de la extracción de clonazepam del plasma fue 79,7% y este fue estable al menos por 4 horas a temperatura ambiente y después de tres ciclos de congelación y descongelación cuando fue almacenado a -20 °C. La exactitud interdía varió de 0,38% a 13,01% mientras que la intradía varió de 0,52% a 12,62%. De otro lado, la precisión interdía varió de 9,53% a 17,54% y la intradía de 10,28% a 14,58%.
Análisis farmacocinético
Las edades de los participantes en el estudio estaban comprendidas entre 19 y 30 años (21,7 ± 2,4). Sus pesos variaron entre 47,1 y 77,1 kg (61,8 ± 7,2) y la media de su estatura fue 1,69 ± 0,07 (rango de 1,54 a 1,84 m). Todos los sujetos que iniciaron el estudio lo concluyeron en buen estado de salud. Durante la administración de los medicamentos, varios individuos reportaron efectos adversos con ambos productos que incluyeron: vómito, mareo, hipo, náuseas, ataxia, amnesia, mialgias y ardor ocular. En tres voluntarios ocurrieron episodios de vómito, dos horas después de la administración del medicamento por lo que es poco probable que la absorción del principio activo haya sido afectada por este efecto adverso. Generalmente un período de dos horas es suficiente para que un medicamento de liberación inmediata se desintegre en el tracto gastrointestinal y libere el principio activo.
El examen de los perfiles de cada voluntario mostró valores de Tmax entre 1 y 12 horas y de Cmax entre 11,8 y 42,42 ng/mL. También se observaron picos secundarios en los perfiles de 20 individuos. Algo similar a lo observado por Crevoisier y col.13 después de la administración intramuscular e intravenosa de una dosis única de 2 mg de clonazepam. Los autores postularon que la excreción biliar de una fracción de la dosis de clonazepam está sujeta a recirculación enterohepática; el glucurónido del clonazepam puede ser desconjugado por las glucuronidasas y reabsorbido desde el intestino en la forma de fármaco activo 13 y es posible que los resultados obtenidos en este estudio también se expliquen por este mismo mecanismo.
Los valores obtenidos por análisis farmacocinética para t½ mostraron mucha variabilidad (de 24 a 64 horas). Esta situación se ha descrito anteriormente 5,13,14 y justifica la individualización de la terapia con este principio activo. No obstante, los perfiles medios de concentración plasmática para las dos formulaciones fueron muy similares, como se puede observar en la Figura Nº 1.
Los parámetros farmacocinéticos medios ± (DS) y la prueba de bioequivalencia para el producto de prueba y el producto de referencia (n=26) se resumen en la Tabla 1.
El ajuste del ANOVA para éstos, después de la transformación ln de los datos, reveló que ninguno de los efectos examinados fue estadísticamente significativo excepto para la variabilidad intersujeto del ABC 0-8, lo que confirma la gran variabilidad observada. El intervalo de confianza del 90% para ABC 0-8 y Cmax (Tabla Nº 1) se encuentra dentro del rango de aceptación de bioequivalencia de 80,0 a 125%; esto sugiere que las dos formulaciones son similares.
CONCLUSIÓN
Basados en los resultados obtenidos se puede afirmar que el Sedatril®/Clonazepam MK 2 mg tabletas, fabricado por Tecnoquímicas S. A., Colombia es bioequivalente con el Rivotril® 2 mg tabletas, fabricado por Roche Químicos e Farmacêuticas S.A., Brasil y que puede ser considerado intercambiable.
AGRADECIMIENTOS
Este estudio fue patrocinado por Tecnoquímicas S. A., contrato 8716-003 de 2003. Los autores agradecen al profesor Abel Díaz C. por la asesoría estadística prestada y al estudiante de Química Farmacéutica Iván Darío Gómez, por la colaboración en la actividad clínica.
Los autores manifiestan no tener vínculos laborales ni afectivos con las empresas Tecnoquímicas S. A y Roche Químicos e Farmacêuticas S. A.
REFERENCIAS BIBLIOGRÁFICAS
1. Goodman and Gilman. Las bases farmacológicas de la terapéutica. 6ª edición. México: McGraw-Hill; 2006. p. 405. [ Links ]
2. Rosenbaum JF, Moroz G, Bowden CL. Clonazepam in the treatment of panic disorder with or without agoraphobia: a dose-response study of efficacy, safety, and discontinuance. J Clin Psychopharmacol 1997; 17: 390-400. [ Links ]
3. Kaplan SA, Alexander K, Jack ML, Puglisi CV, DE Silva JAF, Lee TL, Weinfeld RE. Pharmacokinetic profiles of clonazepam in dogs and humans and of flunitrazepam in dogs. J Pharm Sci 1974; 4: 527-532. [ Links ]
4. Drug information. Bethesda: American Society of Health- System Pharmacists (AHSF), 2001. [ Links ]
5. Berlin A, Dahlstrom H. Pharmacokinetics of the anticonvulsant drug clonazepam evaluated from single oral and intravenous doses and by repeated oral administration. Eur J Clin Pharmacol 1975; 19: 155-159. [ Links ]
6. Normas científicas, técnicas y administrativas para la investigación en salud. Resolución Nº 008430. Bogotá: Ministerio de Salud; 1993. [ Links ]
7. Guidelines for Good Trials on Pharmaceutical Products. (WHO Technical Report Series Nº 850, Annex 3). Geneva: World Health Organization; 1995. [ Links ]
8. Robertson MD, Drummer OH. High-performance liquid chromatographic procedure for the measurement of nitrobenzodiazepines and their 7- amino metabolites in blood. J Chromatogr B Biomed Appl 1995; 667: 179-184. [ Links ]
9. Chauhan BL, Sane SP, Revankar SN, Rammamurthy L, Doshi B, Bhatt AD, et al. Comparative bioavailability study of clonazepam after oral administration of two tablet formulations. J Assoc Physicians India 2000; 48: 985-987. [ Links ]
10. Guidance for industry. Bioanalytical Method Validation. Rockville: U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research. 2001. The FDA Website. http://www.fda.gov/cder/guidance/4252fnl.pdf [April 2001]. [ Links ]
11. Guidance for industry. Statistical approaches to establishing bioequivalence. Rockville: U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research. 2001. The FDA Website. http://www.fda.gov/cder/guidance/3616fnl.htm [June 2001]. [ Links ]
12. Schuirmann DJ. A comparison of the two-one sided tests procedure and the power approach for assessing the equivalence of average bioavailability. J Pharmacokinet Biopharm 1987; 15: 657-681. [ Links ]
13. Crevoisier C, Delisle MC, Joseph I, Foletti G. Comparative single-dosis pharmacokinetics of clonazepam following intravenous, intramuscular and oral administration to healthy volunteers. Eur Neurol 2003; 49: 173-177. [ Links ]
14. Yukawa E. Optimization of antiepileptic drug therapy. The importance of serum drug concentration monitoring. Clin Pharmacokinet 1996; 31: 120-130. [ Links ]