Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Vitae
versión impresa ISSN 0121-4004
Vitae v.18 n.2 Medellín mayo/ago. 2011
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
EFECTO DE LA HIDRATACIÓN Y LA COCCIÓN EN LAS PROPIEDADES FÍSICAS Y FUNCIONALES DE LA HARINA DE VITABOSA (Mucuna deeringiana)
EFFECT OF HYDRATION AND BAKING ON THE PHYSICAL AND FUNCTIONAL PROPERTIES OF VITABOSA FLOUR (Mucuna deeringiana)
Sandra P. CHAPARRO A.1, Jesús H. GIL G.2, Iván D. ARISTIZÁBAL T.2
1 Facultad de Ciencias. Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia. spchaparroa@hotmail.com.
2 Facultad de Ciencias Agropecuarias, Departamento de Ingeniería Agrícola y de Alimentos, Universidad Nacional de Colombia, sede Medellín, A.A.1779, Medellín, Colombia.
Recibido: Febrero 15 de 2010; Aceptado: Julio 18 de 2011
RESUMEN
En el presente trabajo se establece el efecto de la hidratación y la cocción sobre las características físicas y funcionales de la harina de vitabosa (Mucuna deeringiana). La capacidad de absorción de aceite es superior en la vitabosa sin tratamiento que en la sometida a hidratación y cocción (vitabosa sometida a hidratación y cocción), 2,12 mL/g y 1,89 mL/g respectivamente. La mayor capacidad de absorción de agua se da en la vitabosa sometida a hidratación y cocción y disminuye con el incremento de la fuerza iónica en el rango de 0,1-1 M de NaCl. La capacidad emulsificante se reduce con el aumento de la concentración de las harinas. Además, la actividad y la estabilidad emulsificantes se incrementan en un rango de fuerza iónica de 0,0 - 0,4 M, pero disminuyen con el aumento de las concentraciones de sal. Ambas harinas tienen capacidades espumantes bajas, alcanzando valores máximos en concentraciones 0,4 M de NaCl de 10,3% vitabosa sin tratar y 6,04% (vitabosa sometida a hidratación y cocción). La mejor capacidad de gelificación se observa a una concentración del 12% y en ausencia de cloruro de sodio, en tanto que el incremento de la fuerza iónica (0,1-1 M NaCl) tiene un efecto desfavorable en la capacidad de gelificación de ambas harinas.
Palabras clave: semillas, propiedades funcionales, características físicas, fuerza iónica.
ABSTRACT
The effect of soaking and cooking on physical characteristics and functional properties of vitabosa (Mucuna deeringiana) flour is investigated. Oil absorption capacity of vitabosa without treatment is higher than seed with soaking and cooking treatment, 2.12 mL/g and 1.89 mL/g, respectively. The best water absorption capacity is in vitabosa with soaking and cooking treatment and it decreases with the increase of ionic strength ranges of 0.1 - 1 M of NaCl. Emulsifying activity decreases as the concentration of flour in solution increased. Emulsifying activity and emulsifying stability of flours increase in the ionic strength range 0.0 - 0.4 M but reduced afterwards with further increase in NaCl concentration. Vitabosa without treatment and vitabosa with soaking and cooking treatment have low foam capacity, their best results are 10.3% vitabosa without treatment and 6.04% (vitabosa with soaking and cooking treatment) at 0.4 M of NaCl. The highest gelation capacity is at 12% concentration and without sodium chloride. At the same time the increase in ionic strength (0.1 - 1 M NaCl) has an unfavorable effect in the gelation capacity of flours.
Keywords: Seeds, functional properties, physical characteristics, ionic strength.
INTRODUCCIÓN
Las semillas de las leguminosas (Leguminosae) están ampliamente distribuidas por el mundo. Por su alto contenido de proteína (20-50%) tienen gran importancia en la alimentación humana y animal (1). La Mucuna deeringiana, conocida también como vitabosa, Stizolobium deeringianum o Mucuna enana es una planta originaria de la India y crece abundantemente en Asia, África y algunas regiones de Centroamérica. Esta semilla, de la familia del fríjol, es conocida por su gran capacidad de producir follaje de corte o abono verde, eliminar malezas, controlar la erosión y mejorar los suelos (2) y, al igual que otras leguminosas, es una fuente de proteínas, grasas, carbohidratos y minerales (3-5). Sin embargo, la digestibilidad y la utilización de la proteína de estas semillas están limitadas por la estructura de la proteína y por la presencia de algunos factores antinutricionales como L-Dopa, fenoles, taninos, inhibidores de tripsina, fitatos y lectinas, entre otros (6).
Tradicionalmente, los kanikkars, una tribu del sur de la India, consumen semillas de M. pruriens maduras luego de haberlas sometido a un tratamiento repetido de cocción (7), y ciertas preparaciones con esta semilla como ''ragout'', ''porridge'' y café forman parte de la tradición en algunos lugares de Sri Lanka (8). Sin embargo, el procesamiento de la Mucuna para consumo humano es aún muy lento (9), por lo cual prosiguen los esfuerzos para encontrar métodos más sencillos y eficaces. En un estudio previo de nuestro grupo de trabajo, se mostró que el proceso de hidratación reduce los niveles de antinutrientes de las leguminosas debido a su solubilidad en el agua (10). También los niveles de inhibidores de tripsina, taninos, ácido fítico y saponinas en fríjoles rojos se ven afectados por la hidratación en agua destilada (11). La cocción reduce, inactiva y/o destruye los factores antinutricionales de origen proteínico (inhibidores de tripsina, lectinas) y saponinas a niveles indetectables; además, mejora la digestibilidad de las proteínas en las leguminosas, aunque podría reducir la calidad de la proteína por pérdida de algunos aminoácidos esenciales (12).
Recientemente ha crecido el interés por encontrar fuentes de proteína vegetal de bajo costo para suplementar la dieta en humanos. No obstante, para una utilización eficiente y la aceptación por parte del consumidor de harinas proteicas se hace necesario estudiar sus propiedades funcionales. Generalmente, las proteínas vegetales requieren un procesamiento para obtener un material alimenticio con propiedades funcionales aceptables, como la capacidad de absorción de agua y de aceite, la capacidad espumante, emulsificante y de gelificació n (13). Estas propiedades se atribuyen principalmente a las características de las proteínas y la concentración de algunos ingredientes (sal, ácidos) en la formulación. El desempeño exitoso de las harinas de las leguminosas como ingredientes alimentarios depende de las características funcionales, que afectan las cualidades sensoriales del alimento y el comportamiento físico del producto o sus ingredientes durante su preparación, procesamiento y almacenamiento. En el presente artículo se reporta el efecto del proceso de la hidratación y la cocción sobre las propiedades funcionales de la harina de la semilla de vitabosa (Mucuna deeringiana).
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron semillas de vitabosa (Mucuna deeringiana) provenientes del Centro Agropecuario Cotové, de la Universidad Nacional de Colombia, ubicado en Santa Fe de Antioquia (Colombia), 6º33'32'' de latitud norte y 1º44'43'' de longitud oeste (bosque seco tropical, 550 msnm, 27,3ºC de temperatura promedio, 55,4% de humedad relativa y 1919,3 milímetros de precipitación promedio, suelo de origen aluvial proveniente de calizas y arcillas calcáreas). La leguminosa se recolectó cuatro meses después de la floración, cuando los granos se desarrollaron por completo en la vaina, de tal modo que se pudo desgranar fácilmente. El contenido promedio de proteína y fibra cruda en los granos fue 29,23 ± 0,46% y 7,32 ± 0,03%, respectivamente.
Propiedades físicas de las semillas
Las propiedades físicas se determinaron mediante los métodos usados por Adebowale et al., 2005 (3). Peso: se tomó un grano y se registró su peso (P) en gramos en una balanza analítica. Se hicieron 100 mediciones. Densidad absoluta: se pesaron 100 g de semilla y se transfirieron a una probeta de 200 mL, donde se adicionaron 100 mL de agua destilada. Las semillas fueron puestas en el agua para que se sumergieran y se determinó el volumen desplazado. La densidad (g/mL) se determinó a partir de la relación de la masa de las semillas y el volumen desplazado. Capacidad de hidratación: 100 g de semillas (PS) fueron contadas (NS) y transferidas a una probeta que contenía 100 mL de agua destilada. Este recipiente fue recubierto con una hoja de aluminio y se dejó reposar durante 15 horas a temperatura ambiente (25 ± 2°C). Luego, el líquido fue drenado, el agua superficial se eliminó con papel filtro y las semillas hidratadas se separaron y pesaron (PSH). La capacidad de hidratación (CHD) se calculó con la ecuación 1:

El índice de hidratación (IHD), definido como (g agua/g semilla) se calculó con la ecuación 2:

Capacidad de hinchamiento (mL agua/semilla): 100 g de semillas fueron contadas (NS) y su volumen registrado (VS). Se dejaron en agua destilada durante 15 horas y luego su volumen fue medido en una probeta (VSH). La capacidad de hinchamiento por semilla se determinó usando la ecuación 3.

El índice de hinchamiento (IHM), definido como (mL agua/mL semilla) se calculó con la ecuación 4, en la que V es el volumen de una semilla (mL).

Humedad: Para determinar la humedad de las semillas se utilizó el método oficial 945.09 B (14). En este análisis se taró la cápsula de porcelana a 105ºC durante una hora y se colocó en el desecador hasta peso constante. Luego se pesaron 5 g de las semillas y se pusieron en una estufa (Dies, Thermolab® TH240) a 105ºC durante dos horas. Se retiraron de la estufa, se llevaron al desecador hasta peso constante y se registró el peso final. El porcentaje de humedad se calculó en base húmeda.
Propiedades funcionales de las harinas
Obtención de las harinas
Para la preparación de las harinas de vitabosa sin tratamiento (VST) se tomaron 2 kg de semillas limpias y de tamaño similar y se secaron durante 48 horas a una temperatura media de 50°C. La harina de vitabosa sometida a tratamiento (VHYC) se elaboró tomando semillas limpias y de tamaño similar e hidratándolas en agua potable (1:10 g/100 mL) a 25 ± 2°C durante 24 horas. Se descartó el agua y las semillas se sometieron a cocción durante 60 minutos en un recipiente abierto con agua destilada (100°C), en proporción de 1:10 g/100 mL. Luego se lavaron y secaron a 55°C durante 48 horas. Finalmente, se redujo el tamaño de partícula de ambas harinas hasta 0,5 mm mediante un molino de martillos; las harinas obtenidas se almacenaron en bolsas plásticas con cierre hermético a temperatura ambiente (25°C) para su posterior análisis.
Capacidad de absorción de agua y aceite
Se empleó el método de Beuchat, 1977 (15) para la determinación de la capacidad de absorción de agua y aceite. Se tomó 1 g de harina y se mezcló con 10 mL de agua destilada durante 30 segundos. Las muestras se dejaron en reposo durante 30 minutos a temperatura ambiente (25 ± 2°C). Luego, se centrifugaron (MRC, LCEN-101) a 3000 rpm durante 30 minutos y se midió el volumen del sobrenadante obtenido en una probeta de 10 mL. Los resultados se obtuvieron restando los 10 mL iniciales de agua el volumen después de la centrifugación y se reportó la capacidad de absorción de agua en mL/g de muestra. Con el mismo procedimiento se determinó la capacidad de absorción de aceite. También se evaluó el efecto de la fuerza iónica sobre la capacidad de absorción de agua de las harinas, variando la concentración de los iones existentes en el medio mediante soluciones de NaCl en siete concentraciones diferentes (0 a 1,0 M). Las mediciones se practicaron por triplicado.
Propiedades emulsificantes
La actividad y la estabilidad emulsificantes se determinaron por el método de Neto et al., 2001 (16). Se tomaron 5 mL de una dispersión de harina en agua destilada (10 mg/mL) y se homogenizaron con 5 mL de aceite durante 1 minuto. Las emulsiones fueron centrifugadas a 1100 rpm durante 5 minutos. Se midió la altura (cm) de la capa emulsificada (ACE) y del contenido total del tubo (ACT). La capacidad emulsificante (CEM) se calculó mediante la ecuación 5.
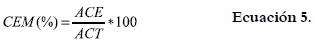
La estabilidad de la emulsión (EEM) fue determinada con base en el calentamiento a 80°C durante 30 minutos antes de centrifugar a 1100 rpm por 5 minutos, para obtener los resultados. Donde ACEC = altura de la capa emulsificada luego del calentamiento (cm), y ACTC = altura del contenido total del tubo luego del calentamiento (cm) se utilizó la ecuación 6.
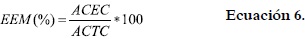
Para los dos tratamientos, ambas propiedades (CEM y EEM) fueron evaluadas en diferentes concentraciones (2 - 10% p/v) de la harina. Adicionalmente, se evaluó el efecto de la fuerza iónica sobre la capacidad y la estabilidad emulsificantes de las harinas, variando la concentración del medio con soluciones de NaCl entre 0,1 - 1,0 M. Las mediciones se practicaron por triplicado.
Propiedades espumantes
El método de Coffman y García, 1977 (17) fue el escogido para la determinación de la capacidad y la estabilidad espumante de las harinas analizadas. Una cantidad de 10 g de harina se dispersó en 100 mL de agua destilada y esta suspensión se batió fuertemente durante 2 minutos en una licuadora (Black & Decker®, modelo BI M6350P®) a velocidad constante. Se registraron los volúmenes (mL) antes (V1) y después (V2) del mezclado. La capacidad espumante (CES) fue calculada de acuerdo con la ecuación 7.
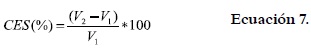
La estabilidad espumante (EES) fue determinada como el volumen de la espuma que permaneció luego de 8 horas de reposo y se expresó como un porcentaje del volumen inicial de espuma. Asimismo, se evaluó el efecto de la concentración de harina sobre las propiedades espumantes (CES y EES), utilizando concentraciones del 2 al 10 p/v en la dispersión. También se estimó la influencia de la fuerza iónica sobre la CES y EES dispersando 2 g de harina en 100 mL de soluciones de NaCl entre 0,1 y 1,0 M y mezclando fuertemente. Todas las mediciones se practicaron por triplicado.
Capacidad gelificante
La capacidad gelificante (CG) se determinó con el método de Coffman y García, 1977 (17). Se prepararon suspensiones de las harinas del 2 al 20% p/v en agua destilada. Se tomaron 10 mL de cada dispersión en tubos de ensayo y se sometieron a calentamiento durante 1 hora en un baño de agua en ebullición. Posteriormente, los tubos fueron templados con agua fría y enfriados a 4°C durante 2 horas. La capacidad gelificante corresponde a la mínima concentración donde se presentó gelificación de la mezcla, es decir, cuando el tubo se invirtió y su contenido no se vertió. También se evaluó el efecto de la fuerza iónica de harina sobre la capacidad gelificante utilizando concentraciones del 12 al 20% p/v de la dispersión y soluciones de NaCl entre 0,1 y 1,0 M. Para el control (fuerza iónica cero) se utilizaron las mismas concentraciones de harina pero usando agua destilada en lugar de las soluciones de cloruro de sodio. La mínima concentración de gelificación se determinó como ya se explicó.
Análisis estadístico
Todas las determinaciones de las características fisicoquímicas y las propiedades funcionales se obtuvieron por triplicado. Las diferencias significativas entre las medias de las propiedades físicas se calcularon mediante el análisis de varianza de una vía; las diferencias entre las medias de las propiedades funcionales se definieron mediante análisis de varianza de dos vías, y la prueba de comparación múltiple (diferencia mínima significativa de Fisher), con un nivel de significancia del 5%. Se utilizó el programa estadístico Statgraphics® Plus 5.1.
RESULTADOS Y DISCUSIÓN
Propiedades físicas
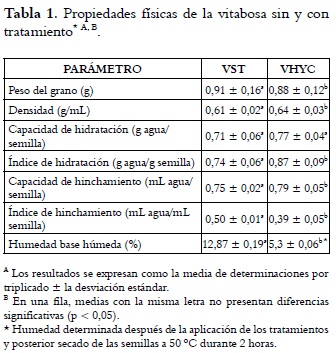
En la tabla 1 se presentan las propiedades físicas y la humedad de las semillas de vitabosa sin tratamiento (VST) y procesadas mediante hidratación y cocción (VHYC).
El análisis estadístico indicó una diferencia significativa entre el peso de las semillas control y el de las sometidas a tratamiento. La VST registró un peso promedio del grano mayor que la VHYC debido, posiblemente, a la pérdida de algunos componentes durante el tratamiento. Según Adebowaleb et al., 2005 (3), los pesos promedio de algunas especies de Mucuna son: M. pruriens, 0,92 g, M. conchinchinensis, 0,98 g, y M. veracruz, 0,86 g, similares a los obtenidos en este estudio.
En cuanto a la densidad, el análisis de varianza identificó diferencias significativas en esta característica entre las semillas con y sin tratamiento. Los valores obtenidos son más bajos que los obtenidos en M. rajada (0,65 g/mL), M. pruriens (0,89 g/mL), M. cochinchnensis (0,95 g/mL), y M. veracruz (0,82 g/mL) (3), pero superiores a los encontrados en Pisum sativum (0,55 g/mL), Cajanus cajan (0,46 g/mL) (18), Cicer arietinum (0,53 - 0,57g/mL) (19) y en otras leguminosas (20).
No se registraron diferencias significativas en la capacidad de hidratación de las semillas con y sin tratamiento. Los valores obtenidos son más altos que los hallados para otras especies, como el guisante verde (0,24 g/semilla), el guisante de campo (0,15 g/semilla) y el guisante de mar (0,005 g/semilla) (20). La M. deeringiana sometida a tratamiento marcó un índice de hidratación y una capacidad de hinchamiento mayores que la VST. Estos resultados son superiores a los reportados para Canavalia cathartica (0,15 mL/semilla) y C. marítima (0,05 mL/semilla) (21). Por el contrario, el índice de hinchamiento fue mayor en la vitabosa sin tratamiento. Estas características nos dan un indicio de la dureza relativa y la impermeabilidad de la semilla.
La VST presentó un porcentaje de humedad alto (12,87%), superior a los reportados para otras leguminosas como Cassia floribunda, 6,0% (22); Lathyrus martimus, 9,7% (20); lupino, 6,6% (23) y Vigna unguiculata, 8,9% (24). Esto indica que la M. deeringiana sin tratamiento requerirá un menor tiempo de germinación, hidratación o cocción, lo que puede constituir un factor favorable para su procesamiento (25), o desfavorable, por la reducción de su vida útil. La semilla sometida a hidratación, cocción y posterior secado controlado a 50°C por 48 horas registró un porcentaje de humedad bajo (5,3%), que representa una ventaja en relación con la estabilidad de la semilla. En síntesis, la hidratación y la cocción influyeron positivamente en las características físicas de la vitabosa.
Propiedades funcionales
Capacidad de absorción de agua y aceite
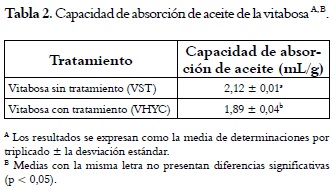
En la tabla 2 se puede observar que la mayor absorción de aceite se dio en VST (2,12 mL/g). Estos resultados sugieren que el tratamiento de hidratación y cocción disminuyó la capacidad de absorción de aceite de la harina debido, posiblemente, a una reducción de las interacciones hidrofóbicas superficiales de las proteínas ocasionada por el proceso térmico. Los valores obtenidos son más altos que los reportados por Adebowale y Lawal, 2004 (13) para harina de M. pruriens (1,70 mL/g). En comparación con otras leguminosas, estos resultados son mayores que los obtenidos por harinas de Cicer arietinum (1,33 - 1,47 mL/g) (19), y Glycine max (1,24 mL/g) (26). Kaur et al., 2007 (18) informan sobre una capacidad de absorción de aceite de 1,06 - 1,17 g/g para Pisum sativum y de 0,96 - 0,98 g/g para Cajanus cajan.
Algunos factores intrínsecos afectan la capacidad de retención de aceite incluyendo la composición de aminoácidos, la conformación de la proteína y la relación polaridad/hidrofobicidad de la superficie proteica (27). Las diferencias en la capacidad de retención de aceite por parte de las proteínas hidratadas dependen del número de regiones hidrofóbicas disponibles en la superficie proteica, y éstas podrían variar por efecto del proceso térmico, por cambios conformacionales o por una desnaturalización irreversible de la proteína. Las harinas son potencialmente útiles en la interacción estructural de los alimentos, especialmente en la retención del sabor, el mejoramiento de la palatibilidad y el aumento de la vida útil en productos de panadería o derivados cárnicos, donde la absorción de grasa es deseable (28, 29).
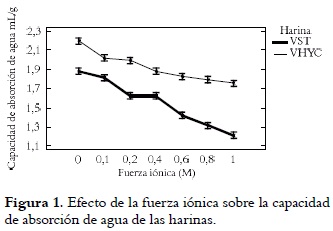
La capacidad de absorción de agua fue mayor en la vitabosa con tratamiento (VHYC) que en la VST, como se puede observar en la figura 1. Estos valores son más bajos que los reportados para Gevuina avellana (4,50 mL agua/g muestra) (30). Esta capacidad depende principalmente de la proteína y de algunos de sus parámetros, como tamaño, forma, factores estéricos y balance hidrofílico-hidrofóbico de los aminoácidos en las moléculas, como también de los lípidos y carbohidratos.
La cocción de la vitabosa pudo ocasionar una desnaturalización parcial de la proteína, afectando sus propiedades fisicoquímicas y funcionales. Los cambios conformacionales pueden incrementar aproximadamente un 10% la capacidad de absorción de agua de la proteína desnaturalizada, en comparación con la proteína nativa, debido al aumento del cociente área superficial/masa, producto de la exposición de algunos grupos hidrófobos previamente enterrados (28). Este hecho se evidenció en los resultados obtenidos para la absorción de agua y de aceite en la vitabosa sometida a hidratación y cocción. De manera similar, Yusuf et al., 2008 (31) observaron que el tratamiento térmico aplicado a semillas de sésamo y maní incrementó su capacidad de retención de agua.
El análisis estadístico señaló una diferencia significativa entre las harinas, la fuerza iónica y sus interacciones. En la figura 1 se observa una disminución de la capacidad de absorción de agua en ambas harinas, con el incremento de la fuerza iónica. De acuerdo con Moure et al., 2002 (30) la adición de sales afecta las propiedades nutricionales y funcionales de los productos que contienen gran cantidad de proteína (30). Los resultados sugieren que la harina VHYC podría ser utilizada con buenos resultados en la preparación de embutidos como salchichas, natillas y masas, ya que estas propiedades permitirían adicionar más agua a las masas, así como mejorar las características de manejo y mantenimiento de la frescura del pan. También se podría usar en formulaciones alimenticias como productos infantiles, mezclas en polvo y aderezos.
Propiedades emulsificantes
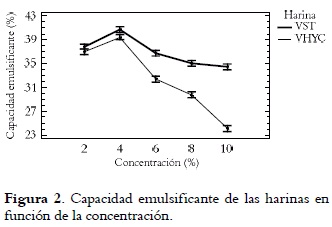
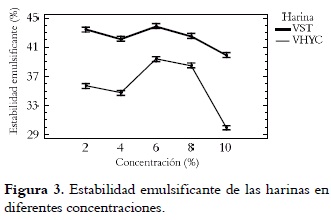
En las figuras 2 y 3 se puede observar que la capacidad CEM y la estabilidad emulsificante EEM de las harinas dependen de la concentración de harina.
El análisis de varianza mostró diferencias significativas de la CEM entre harinas. Tanto la VST como la VHYC registraron la mejor capacidad emulsificante a una concentración del 4%; estos valores son más bajos que los reportados para Brassica carinata (75,6%) (32), Sesamum indicum (83,0%) y Vigna subterranean (78,5%) (31), pero similares a los encontrados en sorgo (49%) (33). Se observó que la capacidad emulsificante disminuye a medida que la concentración aumenta por encima del 4%. Este hecho concuerda con el informe de Adebowale y Lawal, 2004 (13) sobre semillas de cacahuete, fríjol común y fríjol terciopelo.
La semilla sometida a hidratación y cocción demostró, para las concentraciones de 6, 8 y 10%, la menor capacidad emulsificante debido, posiblemente, a los cambios que sufren la estructura y la composición de la proteína luego de ser tratada la semilla. El papel de la concentración en la actividad emulsificante se ha explicado con base en la cinética de absorción. Cuando el nivel de proteína es bajo, la tasa de absorción está controlada por la difusión, pero a concentraciones altas de proteína, hay una activación de la barrera de absorción. En estas condiciones, la habilidad de la proteína para crear un espacio en la película existente, penetrar y reordenar la superficie está determinada por esta tasa (34). El despliegue de las proteínas en la interfase agua/ aceite juega un papel importante en la capacidad y estabilidad emulsificante debido al aumento de la hidrofobicidad (35).
El análisis estadístico reveló diferencias significativas de la EEM entre harinas. La EEM de las harinas aumenta progresivamente a medida que se incrementa la concentración hasta un 6%, valor a partir del cual se observa una declinación. Las harinas sin tratamiento presentaron la mejor EEM (44%) a una concentración de 6%. Estos datos son similares a los obtenidos para Brassica carinata (49,4%) (32), y más bajos que los reportados para Macadamia (53 - 54%) (36) y sorgo (47,2 - 52,1%) (33). La menor EEM (30%) se dio en la vitabosa sometida a hidratación y cocción a una concentración del 10%. La EEM aumenta hasta 6% y luego disminuye debido, posiblemente, a que la proteína absorbe agua, se despliega y se reordena en la interfase, pero hasta cierto nivel de saturación (37).
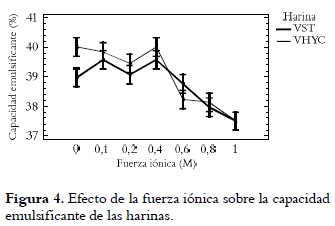
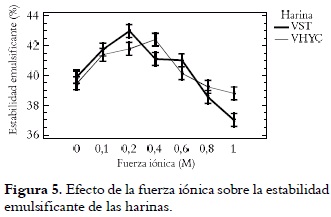
En las figuras 4 y 5 se puede observar que la presencia de sal es un factor importante en la actividad y estabilidad de las emulsiones.
El análisis estadístico demostró un efecto significativo entre las harinas y los niveles de fuerza iónica, pero no en sus interacciones (p < 0,05). La capacidad emulsificante varía progresivamente, alcanzando un valor máximo (VHYV > VST) a concentraciones iónicas de 0,4 M; incrementos adicionales de sal provocaron un descenso en esta propiedad. La consecuencia del NaCl en la CEM puede obedecer a los efectos causados por la absorción de la proteína en la interfase aceite/agua. Algunos autores han reportado la influencia de la fuerza iónica en las propiedades emulsificantes en proteína de fríjol caupí (38) y fríjol de playa (20).
La EEM, al igual que la CEM, es afectada por la fuerza iónica del medio, alcanzando valores máximos a concentraciones de 0,2 (VST) y 0,4 M (VHYC) de NaCl. La sal puede afectar las propiedades emulsificantes por dos mecanismos: a) el NaCl puede reducir la repulsión electrostática entre las gotas de la emulsión y b) los electrolitos, en altas concentraciones, pueden alterar la organización estructural de las moléculas de agua, lo que perturba la resistencia de las interacciones hidrofóbicas entre los grupos no polares (39). Con el incremento inicial de la fuerza iónica hasta 0,4 M se realza la formación de películas cargadas alrededor de los glóbulos de grasa, lo que ocasiona repulsión mutua. Además, a bajos niveles de fuerza iónica se podría formar una capa hidratada alrededor del material interfacial, que ocasiona disminución de la energía interfacial y retarda la coalescencia. A fuerzas iónicas altas (0,6 - 1,0 M) disminuye el despliegue de la proteína lo que limita, probablemente, la absorción de la proteína en la interfase aceite/agua. Por sus buenas propiedades emulsificantes, estas harinas podrían ser útiles en formulaciones alimenticias tipo leche y análogos de la carne.
Propiedades espumantes
En la tabla 3 se presenta el efecto de la concentración sobre la capacidad espumante (CES) de las harinas. El análisis estadístico mostró diferencias significativas entre las concentraciones y la interacción concentración-harina. Para la VST, la CES acrecentó paulatinamente con el incremento de la concentración hasta un máximo del 15% en una solución al 8% (p/v). A su vez, la muestra sometida a hidratación y cocción, obtuvo el valor más alto (10%) a una concentración del 6% (p/v); posteriormente, disminuyó a un valor mínimo de 5,6% en una solución al 10% (p/v).
Este resultado contradice los de Rahma y Mustafa, 1988 (40) en cernido de maní sometido a tratamiento térmico, donde la disminución de la capacidad espumante es ocasionada, según afirman estos autores, por la desnaturalización de la proteína. Los valores obtenidos en este estudio son menores que los reportados para Sesamum indicum (82%), Vigna subterranean (70%) (31), concentrados proteicos de maní (20 - 40%) (40), Pisum sativum (39 - 42%) y Cajanus cajan (34 - 37%) (18), pero semejantes al establecido en harinas de maní (10 - 13%) (41).
La buena capacidad espumante se ha relacionado con la flexibilidad de las moléculas de proteína, con la reducción de la tensión superficial y con una cantidad alta de proteína globular ordenada, lo cual dificulta relativamente la desnaturalización superficial, que es la que lleva a una baja formación de espuma (42). La razón por la cual las harinas son capaces de producir espuma es que las proteínas presentes tienen una superficie activa. Las proteínas solubles pueden reducir la tensión superficial en la interfase entre las burbujas de aire y el líquido que las rodea. De esta forma se obstruye la coalescencia. Además, las moléculas de las proteínas pueden desplegarse e interactuar entre ellas para formar una película o multicapa de proteína con un incremento de la flexibilidad de la interfase aire/líquido. En consecuencia, es más difícil para las burbujas romperse y la espuma es más estable (43).
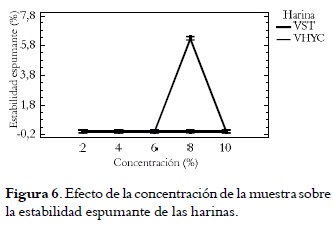
En la figura 6 se puede notar que la estabilidad espumante (EES) de la harina sin tratamiento logró un valor máximo en una solución al 8%. Este valor es sumamente bajo en comparación con los reportados para Sesamum indicum (80%), Vigna subterranean (83%) (31), y Macadamia (56 - 75%) (36). A otras concentraciones la espuma no alcanzó a durar las 8 horas.
Al incrementar la concentración de proteína se facilitan las interacciones proteína-proteína en la interfase agua/aire promoviendo la formación de una película multicapa altamente viscoelástica, que ofrece resistencia a la coalescencia de las burbujas. Esto aumenta la estabilidad espumante. Un aumento en la capacidad y la estabilidad espumantes con el incremento de la concentración ha sido reportado anteriormente (13, 43). La capacidad y la estabilidad espumante son adecuadas para los sistemas alimentarios que requieren una matriz de espuma, como las tortas y el helado (44). Así pues, las harinas analizadas no son útiles para estos fines. Se observó, además, que el tratamiento de hidratación y cocción reduce las propiedades espumantes de la vitabosa.
En la tabla 4 se puede observar que la CES fue afectada por la concentración de sal. Un incremento inicial en la fuerza iónica, de 0,0 hasta 0,4 M, mejoró la CES de VST y VHYC en un 45 y 29%, respectivamente. Sin embargo, incrementos adicionales en la fuerza iónica (0,6 - 1,0 M) declinan la CES a un valor mínimo de 5,69% (VST) y 3,01% (VHYC) en soluciones 1,0 M de NaCl. El análisis estadístico indicó diferencias significativas entre harinas, fuerza iónica y la interacción de estas dos.
De otro lado, experimentalmente se observó ausencia de espuma después de 8 horas de evaluación, en todo el rango de fuerza iónica evaluado (0,1 - 1,0 M de NaCl); esto indica que en ambas harinas la concentración de sal desfavoreció la estabilidad de la espuma.
Capacidad gelificante
El análisis estadístico mostró diferencias significativas entre las dos harinas en la estimación de la capacidad gelificante (CG), como se puede ver en la tabla 5. El incremento de la fuerza iónica en la solución redujo la CG de VST y VHYC, en comparación con el control. Un aumento inicial en la concentración de sal, de 0,0 hasta 0,8 M, disminuyó la CG de VST en un 67%. Un valor similar fue obtenido en VHYC con un cambio de fuerza iónica de 0,0 a 0,4 M. Adebowale y Lawal, 2004 (13) reportaron capacidades gelificantes entre 16 y 18% p/v para Canavalia ensiformis, Voandzeia subterranean y Mucuna pruriens. La mínima concentración de gelificación para Pisum sativum y Cajanus cajan fue de 12% (18).
La variación de las propiedades gelificantes puede atribuirse a los tamaños de los diferentes constituyentes, como proteínas, carbohidratos y lípidos, lo que sugiere que la interacción entre estos componentes también juega un papel importante en las propiedades funcionales (18). La gelificación de las proteínas es de gran importancia en la preparación y aceptabilidad de muchos alimentos, incluyendo vegetales y otros productos (45). Akintayo et al., 1999 (43) mostraron que las propiedades de gelificación dependen de la fuerza iónica en la proteína de Cajanus cajan; en su informe, la capacidad gelificante de la harina se mejora a concentraciones bajas de sal (0,5 M), mientras que se reduce con una fuerza iónica alta (1,0M). Los autores atribuyeron el mejoramiento de la capacidad gelificante a baja fuerza iónica y al aumento de la solubilización de la proteína en la solución salina, la cual creó un solapamiento de los grupos funcionales entre las moléculas de proteínas adyacentes, condición necesaria para la formación de la red de un gel. Adebowale y Adebowale, 2008 (46) encontraron que las características de gelificación mejoran a medida que aumenta la fuerza iónica hasta 0,4 M; por encima de este valor se afectan adversamente las propiedades de gelificación en harina y concentrados proteicos de Mucuna. Asimismo, Otte et al., 1999 (45) dieron cuenta de una reducción en la firmeza del gel a medida que se incrementa la concentración de sal en proteínas de trigo.
CONCLUSIONES
El tratamiento de hidratación y cocción afecta las características físicas y las propiedades funcionales de la harina de vitabosa. La harina procesada (VHYC) ofrece mejores propiedades físicas como humedad (5,3% base húmeda), capacidad de hidratación (0,77 g agua/g semilla) e hinchamiento (0,79 mL agua/semilla) que las semillas sin ningún tratamiento. En general, se observó un efecto de la concentración de harina y de la fuerza iónica sobre la capacidad y estabilidad emulsificantes, encontrando valores bajos para estas propiedades funcionales, y aceptables para la capacidad gelificante en ambas harinas.
AGRADECIMIENTOS
Los autores agradecen a la Dirección de Investigación de la Universidad Nacional de Colombia, sede Medellín, el apoyo financiero del proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Singh N, Kaur M, Sandhu KS, y Guraya HS. Physicochemical, thermal, morphological and pasting properties of starches from some Indian black gram (Phaseolus mungo L.) varieties. Starch. 2004 Nov 4; 56 (11): 535-544. [ Links ]
2. Echeverri C, Rodríguez H. La Vitabosa (Mucuna deeringiana). Antioquia, Colombia: Servicio Nacional de Aprendizaje SENA. Centro Multisectorial de Oriente. 1999, 108 p. [ Links ]
3. Adebowale Y, Adeyemi A, Oshodi A. Variability in the physicochemical, nutritional and antinutritional attributes of six Mucuna species. Food Chem. 2005 Jan; 89 (1): 37-48. [ Links ]
4. Valdivel V. Nutritional and anti-nutritional composition of velvet bean: an under-utilized food legume in South India. Int J Food Sci Nutr. 2000 Jul; 51 (4): 279-287. [ Links ]
5. Agdebe J, Aletor V. Studies of the chemical composition and protein quality evaluation of differently processed Canavalia ensiformis and Mucuna pruriens seed flours. J Food Comp Anal. 2005 Feb; 18 (1): 89-103. [ Links ]
6. Nielsen S. Digestibility of legume proteins. Food Technol. 1991; 45 (99): 112. [ Links ]
7. Gurumoorthi P, Janardhanan K, Myhrman R. Effect of differencial processing methods on L-Dopa and protein quality in velvet bean, an underutilized pulse. LWT. 2008 May; 41 (4): 588-596. [ Links ]
8. Janardhanan K, Gurumoorthi P, Pugalenthi M. Nutritional potential of five accessions of a South Indian tribal pulse, Mucuna pruriens var. utilis I. The effect of processing methods on the content of L-Dopa, phytic acid and oligosaccharides. Tropical and subtropical agroecosystems. 2003 Apr; 1 (2): 141-152. [ Links ]
9. Diallo O, Berhe T. Processing of mucuna for human food in the Republic of Guinea. Journal of Tropical and Subtropical Agroecosystems. 2003 Apr; 1 (2): 193-196. [ Links ]
10. Chaparro P. Efecto de diferentes procesos fisicoquímicos en la reducción de factores antinutricionales de la semilla de vitabosa (Mucuna deeringiana) [Tesis de grado]. [Medellín]: Universidad Nacional de Colombia; 2009. [ Links ]
11. Admassu E, Kumar S. Effect of processing on antinutrients and in vitro protein digestibility of kidney bean (Phaseolus vulgaris L.) varieties grown in East Africa. Food Chem. 2007; 103 (1): 161-172. [ Links ]
12. Khokar S, Chanhan BM. Effect of domestic processing and cooking on in vitro protein digestibility of the north bean. J Food Sci. 1986; 51 (1): 1083-1085. [ Links ]
13. Adebowale K, Lawal O. Comparative study of the functional properties of bambarra groundnut (Voandzeia subterranean) jack bean (Canavalia ensiformis) and Mucuna bean (Mucuna pruriens) f lours. Food Res Int. 2004 May; 37 (4): 355-365. [ Links ]
14. AOAC. Official methods of analysis. 15 ed. Washington, United States: Association of Official Analytical Chemists; 1990. 230 p. 15. Beuchat LR. Functional and electrophoretic characteristics of succinylated peanut flour protein. J Agricult Food Chem. 1977; 25 (1): 258-261. [ Links ] [ Links ]
16. Neto VQ, Narain N, Silvia JB, Bora PS. Functional properties of raw and heat-processed cashew nut (Anarcardium occidentale L.) kernel protein isolate. Nahrung. 2001 Aug; 45 (4): 258-262. [ Links ]
17. Coffman CW, García VV. Functional properties and amino acid content of protein isolate from mung bean f lour. Food Technol. 1977 (2); 12: 473-484. [ Links ]
18. Kaur M, Singh K, Singh N. Comparative study of the functional, thermal and pasting properties of f lours from different field pea (Pisum sativum L.) and pigeon pea (Cajanus cajan L.) cultivars. Food Chem. 2007 Jan 5; 104 (1): 259-267. [ Links ]
19. Kaur M, Singh N. Studies on functional, thermal and pasting properties of f lours from different Chickpea (Cicer arietinum L.) cultivars. Food Chem. 2005; 91 (3): 403-411. [ Links ]
20. Chavan U, McKenzie D, Shhidi F. Functional properties of protein isolates from beach pea (Lathyrus maritimus L.). Food Chem. 2001 Aug 1; 74 (2): 177-187. 143 [ Links ]
21. Seena S, Sridhar K. Physicochemical, functional and cooking properties of under explored legumes, Canavalia of the southwest coast of India. Food Res Int. 2005 Aug; 38 (7): 803-814. [ Links ]
22. Vidivel V, Janardhanen K. Nutritional and antinutrient attributes of the underutilized legume Cassia floribunda car. Food Chem. 2001; 73 (2): 209-215. [ Links ]
23. Ruiz-López MA, García-López PM, Castañeda-Vázquez H, Zamora NJF, Garzón-de la M ora P, Bañuelos Pineda J, et al. Chemical composition and antinutrient content of three lupin species from Jalisco, Mexico. J Food Comp Anal. 2000 Jun; 13 (3): 193-199. [ Links ]
24. Aletor V, Aladetimi O. Compositional evaluation of some cowpea varieties and some underutilised legumes in Nigeria. Nahrung. 1989; 33 (10): 999-1007. [ Links ]
25. Bishnoi S, Khetarpaul N. Variability in physicochemical properties and nutrient composition of different pea cultivars. Food Chem. 1993; 47 (4): 371-373. [ Links ]
26. Redondo-Cuenca A, Villanueva-Suárez M, Rodríguez-Sevilla M, Mateos-Aparicio I. Chemical composition and dietary fibre of yellow and green commercial soybeans (Glycine max). Food Chem. 2007; 101 (3): 1216-1222. [ Links ]
27. Yu J, Ahmedna M, Goktepe I. Peanut protein concentrate: Production and functional properties as affected by processing. Food Chem. 2007; 103 (1): 121-129. [ Links ]
28. Fennema O. Química de los alimentos. España: Acribia; 2000. p. 434-444. [ Links ]
29. McWatters KH, Heaton K. Quality characteristics of ground beef patties extended with moist-heated and unheated seed meals. JAOCS. 1979; 56 (1): 86-90. [ Links ]
30. Moure A, Rua M, Sineiro J, Domínguez H. Aqueous extraction and membrane isolation of protein from defatted Gevuina avellana. J Food Sci. 2002 Mar; 67 (2): 688-696. [ Links ]
31. Yusuf A, Ayedun H, Sanni L. Chemical composition and functional properties of raw and roasted Nigerian benniseed (Sesamum indicum) and bambara groundnut (Vigna subterranean). Food Chem. 2008 Nov 15; 111 (2): 277-282. [ Links ]
32. Pedroche J, Yust MM, Lqari H, Girón-Calle J, Alaiz M, Vioque J, et al. Brassica carinata protein isolates: chemical composition, protein character ization and improvement of functional properties by protein hydrolysis. Food Chem. 2004 Dec; 88 (3): 337-346. [ Links ]
33. Elkhalifa AEO, Schiff ler B, Bernhardt R. Effect of fermentation on the functional properties of sorghum flour. Food Chem. 2005 Aug; 92 (1): 1-5. [ Links ]
34. Phillips M. Protein conformation at liquid interfaces and its role in stabilizing emulsions and foams. Food Technol. 1981; 35 (2): 50. [ Links ]
35. Jayaprakasha H, Brueckner H. Whey protein concentrate: A potential functional ingredient for food industry. Int J Food Sci Technol. 1999. 36 (3): 189-204. [ Links ]
36. Jitngarmkusol S, Hongsuwankul J, Tananuwong K. Chemical compositions, functional properties, and microstructure of defatted macadamia flours. Food Chem. 2008 Sep 1; 110 (1): 23-30. [ Links ]
37. Oshodi A, Ojokan E. Effect of salts on some of the functional properties of bovine plasma protein concentrate. Food Chem. 1997; 59 (3): 333-338. [ Links ]
38. Aluko R, Yada R. Structure, function relationships of cowpea (Vigna unguiculata) globulin isolate: Influence of pH and NaCl concentration on physicochemical and functional properties. Food Chem. 1995; 53 (3): 259-265. [ Links ]
39. McClements DJ. Food emulsions: Principles, practice, and techniques. Boca Raton (Fl): CRC Press; 1999. McClements DJ. Emulsion stability. [ Links ]
40. Rahma FH, Mustafa MM. Functional properties of peanut flour as affected by different heat treatments. Int J Food Sci Tech. 1988; 25 (1): 11-15. [ Links ]
41. Wu H, Wang Q, Ma T, Ren J. Comparative studies on the functional properties of various protein concentrate preparations of peanut protein. Food Res Int. 2009 Apr; 42 (1): 343-348. [ Links ]
42. Mizubuti IY, Biondo Júnior O, Souza LW, da Silva RS, Ida EI. Functional properties of pigeon pea (Cajanus cajan (L.) Millsp) f lour and protein concentrate. Arch Latinoam Nutr. 2000 Sept; 50 (3): 274-280. [ Links ]
43. Akintayo E, Oshodi A, Esuoso K. Effects of NaCl, ionic strength and pH on the foaming and gelation of pigeon pea (Cajanus cajan) protein concentrates. Food Chem. 1999 Jul; 66 (1): 51-56. [ Links ]
44. Adebowale K, Lawal O. Foaming, gelation and electrophoretic characteristics of mucuna bean (Mucuna pruriens) protein concentrates. Food Chem. 2003 Nov 1; 83 (2): 237-246. [ Links ]
45. Otte J, Schumacher E, Ipsen R, Ju Z, Qvist KB. Protease induced gelation of unheated and heated whey proteins: Effects of pH, temperature and concentration of proteins, enzyme and salts. Intern Dairy J. 1999 Nov; 9 (11): 801-812. [ Links ]
46. Adebowale Y, Adebowale K. Evaluation of the gelation characteristics of the mucuna bean f lour and protein isolate. Electronic journal of environmental, agricultural and food chemistry. 2008; 7 (1): 3206-3222. [ Links ]