Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Vitae
versión impresa ISSN 0121-4004
Vitae vol.21 no.3 Medellín sep./dic. 2014
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
INHIBICIÓN DEL CRECIMIENTO DE Aspergillus ochraceus MEDIANTE PANELA FERMENTADA CON GRÁNULOS DE KEFIR DE AGUA
FUNGAL GROWTH INHIBITION OF Aspergillus ochraceus WITH PANELAFERMENTED WITH WATER KEFIR GRAINS
Carlos Andrés CARO VÉLEZ1,3*, Ángela M. LEÓN PELÁEZ, PhD.2
1 Corporación Académica Ambiental, Universidad de Antioquia. Calle 67 No 53-108. Medellín, Colombia. 2 Cátedra de Microbiología, Facultad de Ciencias Exactas, Universidad Nacional de La Plata. Calle 47 y 115. (1900). La Plata, Argentina. 3 Grupo BIOALI, Departamento de Alimentos, Universidad de Antioquia. Calle 67 No 53-108. A.A 1226 Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: carlos.caro@udea.edu.co.
Recibido: Enero 26 de 2014
Aceptado: Septiembre 26 de 2014
RESUMEN
Antecedentes: El kefir de agua (KA) es una bebida producida con soluciones azucaradas fermentadas con gránulos constituidos por bacterias ácido lácticas (BAL) y levaduras embebidas en una matriz de polisacárido. Aspergillus ochraceus es un hongo filamentoso micotoxigénico, contaminante frecuente y productor de ocratoxina en café, uvas y vino. Se ha estudiado la actividad antifúngica de productos fermentados por BAL pero hasta ahora no se conocen estudios sobre la capacidad antifúngica del KA. Objetivos: Evaluar la capacidad antifúngica de soluciones de panela fermentadas a diferentes tiempos y temperaturas con KA sobre A. ochraceus. Métodos: Se inocularon 10 μL de una suspensión (3x107 conidios. ml-1) de A. ochraceus en agar malta mezclado con sobrenadantes libres de células (SLC) de los productos fermentados, incubando a 25°C y midiendo diariamente el diámetro del micelio, con lo cual se determinó el efecto antifúngico sobre la tasa de crecimiento y la fase de latencia. Se determinó la concentración de ácidos orgánicos (AO) en los SLC mediante HPLC. Resultados: Los productos fermentados por mayor tiempo y temperatura tuvieron mayor concentración de (AO) y mayor descenso de pH siendo el SLC8 (pH: 2,8) el más inhibitorio. Conclusiones: La solución de panela en agua fue adecuada para fermentación con gránulos de KA, obteniéndose metabolitos con propiedades antifúngicas como los AO.
Palabras clave: kefir, ácidos orgánicos, antifúngico, Aspergillus ochraceus.
ABSTRACT
Background: Water kefir (WK) is a drink, from sugary solutions fermented with kefir grains, which contain lactic acid bacteria (LAB) and yeasts. A. ochraceus is a mycotoxigenic filamentous mold that contaminates and produces ochratoxin in coffee grains, grapes and wine. The antifungal activity of LAB fermented products has been studied, but there is no evidence yet of the antifungal activity of WK. Objectives: The objective of this work was to assess the inhibitory power of the panela solutions fermented with WK at different times and temperatures on Aspergillus ochraceus. Methods: 10 μL of a solution containing 3x107 conidia.ml-1 of A. ochraceus were inoculated in malt extract agar, mixed with cell free supernatants (CFS), obtained from the fermented products, incubated at 25°C and taking four daily mycelium diameter measures, in order to calculate the growth rate and Lag phase. The organic acids (OA) concentration in the CFS was determined by HPLC. Results: The CFS fermented for a longer time and higher temperature than the others presented the upper concentration of OA, and also the main decrease of the pH, being the CFS8 (pH: 2.8) the most inhibitory. Conclusions: The Panela solution was suitable for the fermentation with WK, obtaining metabolites like organic acids with antifungal properties.
Keywords: Kefir, organic acids, antifungal, Aspergillus ochraceus.
INTRODUCCIÓN
Los hongos filamentosos son alteradores comunes de semillas y alimentos, causan reducciones significativas de la producción, al disminuir la capacidad germinativa de los granos, afectando su calidad nutricional (1) conllevando pérdidas económicas y produciendo micotoxinas. El consumo de micotoxinas por el hombre y animales a través de los alimentos está asociado a intoxicaciones alimentarias y micotoxicosis, resultando en algunos casos en la muerte (2). Aspergillus ochraceus produce Ocratoxina A (OTA), que es una micotoxina nefrotóxica (3), y ha sido aislado principalmente de muestras de café (4-8), siendo considerado como la mayor causa de la presencia de OTA en dicho producto (9). No obstante también se ha aislado de un amplio rango de alimentos, que incluyen frutos secos, semillas oleaginosas, vino, pimienta, etc. (10). Se ha estudiado con amplitud la capacidad antifúngica de las BAL, de los productos fermentados y los metabolitos ácidos producidos. Se ha determinado que los ácidos con mayor actividad contra Aspergillus fumigatus y A. nidulans, son el propiónico y el acético y el de menor capacidad antifúngica es el láctico (11 ). También se ha determinado el efecto combinado que ejerce la temperatura y el ácido propiónico comercial empleado en panificación, inhibiendo el crecimiento de A. parasiticus (12). Otros autores han demostrado que el ácido láctico en concentraciones entre 0,2 y 2,5 % puede inhibir bacterias y hongos (13). Se ha determinado la concentración inhibitoria mínima (CIM) para A. flavus de 0,24% de ácido acético y de 3,00% de ácido láctico y la disminución de ambas concentraciones por el efecto sinérgico llegando a una concentración inhibitoria fraccionaria de 0,1% ácido láctico:0,18% ácido acético (14). También se ha descrito la actividad antifúngica de otros metabolitos producidos por las BAL como el peróxido de hidrógeno, el diacetilo (15), el ácido fenil-láctico (16-17) y dipéptidos cíclicos como ciclo (Gly-L-Leu), ciclo (L-Phe-L-Pro), ciclo (Phe-trans- 4-OH-L-Pro) (18-20).
Entre los productos fermentados naturalmente que presentan un potencial antifúngico se encuentra el kefir de agua (KA), bebida fermentada medianamente ácida, que entre otros compuestos contiene CO2 y etanol. Para su elaboración se emplea el gránulo de kefir el cual consiste en un consorcio de microorganismos embebidos en una matriz de dextrano (21), de forma irregular (5-20 mm), apariencia translúcida y estructura elástica; que incrementa su tamaño y peso a través de repiques sucesivos (22, 23). El consorcio microbiano está conformado por levaduras, bacterias ácido acéticas (BAA), pero mayoritariamente por bacterias ácido lácticas (BAL) (21, 24). Las BAL emplean la sacarosa para sintetizar el gránulo mediante enzimas glucosiltransferasas (23) o la fermentan junto a otros carbohidratos (fructosa y glucosa) sintetizando productos de bajo peso molecular, principalmente ácidos orgánicos (AO), que pueden exhibir propiedades antimicrobianas, ya que en su forma protonada difunden libremente a través de la membrana celular y disminuyen el pH intracelular al ionizar en su interior (14, 25). Adicionalmente a los estudios de capacidad antifúngica con BAL, se ha demostrado la capacidad fungicida de los productos fermentados con gránulos de kefir de leche sobre A. flavus en concentraciones al 10% v/v en el medio de cultivo (26) y del suero fermentado con gránulos de kefir sobre A. fumigatus, A. parasiticus, A. flavus, A. terreus, Rhizopus sp y Trichoderma longibrachiatum (27).
Con el fin de obtener productos de kefir económicos, se requiere el uso de sustratos de bajo costo. Uno de ellos es la panela, edulcorante obtenido de la caña de azúcar (Saccharum officinarum L), de alto consumo en América latina usado para endulzar zumos, té, infusiones, refrescos, mermeladas, galletas, etc. En Colombia es una bebida popular conocida como ''agua de panela'' o ''aguadulce'', (mezcla de agua y panela). Aún cuando es un sustrato rico en azúcares fermentables, hasta el momento no se ha reportado su empleo como sustrato para la fermentación con gránulos de kefir. El uso de un sustrato de panela fermentada con gránulos de KA, que contenga algunos de los metabolitos descritos, podría aportar a la industria de alimentos en la demanda por la biopreservación de alimentos, disminuyendo el uso de preservantes de origen químico que podrían alterar la calidad de éstos. El objetivo de este trabajo fue evaluar la capacidad antifúngica de 8 sobrenadantes libres de células, obtenidos por la fermentación de una solución de panela en agua (41,5 g.L-1) con gránulos de KA (10% m/v) a 3 diferentes temperaturas (25, 30 y 37°C), contra el crecimiento in vitro de Aspergillus ochraceus AFUNL9.
MATERIALES Y MÉTODOS
Preparación del sustrato de fermentación
El sustrato fue preparado con 41,5 g.L-1 de panela en polvo (Exito®), obtenida en un supermercado de la ciudad de Medellín (Colombia), disuelta en agua de grifo y sometida a ebullición por 1 minuto.
Cultivo de los gránulos de kefir de agua
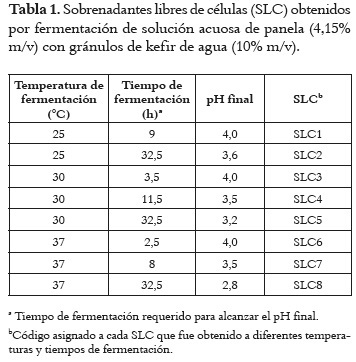
Los gránulos de KA fueron cedidos por la Cátedra de Microbiología de la Facultad de Ciencias Exactas de la Universidad Nacional de La Plata (La Plata, Provincia de Buenos Aires, Argentina). El producto se fermentó a tres diferentes temperaturas (25, 30 y 37°C) adicionando 10% m/v de gránulos de KA a una solución acuosa de panela (4,15% m/v), previa ebullición, hasta alcanzar el pH deseado (tabla 1) y por un tiempo máximo de 32,5 h.
Recuento de microorganismos en el producto fermentado
El recuento de los microorganismos se realizó en los productos que se dejaron más tiempo en fermentación (32,5 h; Tabla 1). Finalizado este periodo, se separaron de los gránulos mediante un tamiz con un tamaño de malla de 1 mm2. Las BAL, BAA y levaduras fueron enumeradas por la siembra de 100 μl de cada dilución en superficie (28) empleando tres diferentes medios de cultivo: Man Rogosa y Sharpe (MRS) (Merck®, Darmstadt, Alemania) para el crecimiento de BAL, Agar-Oxitetraciclinaglucosa- extracto de levadura (OGY) (Merck®, Alemania) para las levaduras, y para el recuento de las BAA se usó un medio compuesto de D-manitol (Sigma-Aldrich®, St. Louis, MO. USA), Extracto de levadura (Oxoid®, Cambridge, Inglaterra), Peptona (Dibico®, México D.F. México), y Agar (Merck®, Alemania) (29). Además como diluyente para los recuentos, se usó agua de peptona al 0,01% m/v (Merck®, Alemania) fraccionados en frascos que contenían 90 ml y en tubos de ensayo tapa rosca que contenían 9 ml. Todos los medios fueron esterilizados en autoclave a 121°C y 1054 kg.cm2 por 15 minutos. Los agares una vez estériles fueron vertidos (15 ml) en cajas de petri plásticas, dentro de una cabina de flujo laminar, donde se dejaron hasta su enfriamiento y posterior empleo. Para determinar el recuento de bacterias, las placas fueron incubadas a 37°C por un periodo de 48 h, mientras que para determinar el recuento de levaduras se incubó a 25°C por un periodo de 5 días; posteriormente se cuantificaron las unidades formadoras de colonia (UFC.ml-1) (28).
Obtención de los sobrenadantes libres de células(SLC)
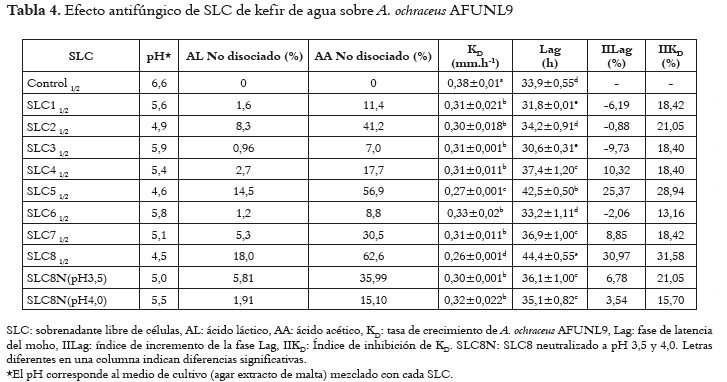
Los productos fermentados se separaron de los gránulos y se centrifugaron a 3500 x g por 15 minutos (Hettich®, Tuttlingen, Alemania), para precipitar los microorganismos. Los sobrenadantes obtenidos se filtraron mediante membrana estéril con poros de 0,45 μm (Advantec MFS®, Dublin, CA, USA). Los 8 sobrenadantes libres de células (SLC) obtenidos se almacenaron a -20°C hasta su posterior empleo y se clasificaron según la tabla 1. Una vez se determinó cual era el SLC con mayor actividad antifúngica se procedió a alcalinizarlo con NaOH 0,1 N hasta pHs superiores al suyo (3,5 y 4,0).
Preparación del inóculo de Aspergillus ochraceus
Aspergillus ochraceus AFUNL9, aislado de muestras de cereales, proveniente de la cátedra de microbiología de la Universidad Nacional de la Plata (La Plata, Provincia de Buenos Aires, Argentina). Cultivado en tubos con agar Sabouraud inclinado 194 Vitae j.p. Rojas-Llanes. et al. (Merck®, Alemania) a 25°C hasta su esporulación. El inóculo de esporas fue preparado por lavado de la superficie del agar con una solución estéril de lauril sulfato de sodio (Merck®, Alemania) al 0,01% m/v en solución de glucosa al 1% m/v (Carlo Erba®, Milán, Italia). Se adicionaron 10 ml de la solución sobre el cultivo, se rasparon los conidios suavemente con espátula estéril y se realizaron diluciones seriadas. El número de conidios se determinó por recuento en cámara de Neubauer.
Determinación de la actividad antifúngica (ensayo de difusión en agar)
Los SLC se usaron como compuesto antifúngico in vitro contra el crecimiento del moho toxigénico A. ochraceus AFUNL9, cultivado en agar extracto de malta (EM) preparado con extracto de malta 1% (Oxoid®, Hampshire, Inglaterra), extracto de levadura 2% (Merck®, Alemania) y agar 2% (Merck®, Alemania). Cada SLC fue mezclado con agar EM a una temperatura aproximada de 40°C y vertido en cajas de petri plásticas, dejándose secar en cabina de flujo laminar. Tres concentraciones de los SLC en el agar EM fueron probadas: 1/2, 1/10 y 1/100; para la concentración 1/2 se usó agar EM doblemente concentrado. Una alícuota de 10 μl de la solución de esporas que contenía 3x107 conidios.ml-1 de A. ochraceus AFUNL9, fue inoculada en el centro del agar EM con una micropipeta (Brand®, Wertheim, Alemania) tomándose como diámetro inicial el correspondiente al inóculo (11, 12, 14, 25). Las cajas de petri se incubaron a 25°C en aerobiosis. Dado que los mohos filamentosos crecen de forma circular en medios sólidos, se tomaron cuatro medidas diarias del diámetro del micelio en ángulo recto desde el centro de cada colonia al colocarlas sobre una caja milimetrada e iluminada. Las lecturas se realizaron hasta que el moho alcanzara el diámetro completo de la caja de petri (85 mm). Se empleó un control positivo al que se le adicionó solución acuosa de panela (41,5 g.L-1) sin fermentar y esterilizado por filtración, tal como ya fue descrito. Todo el experimento fue realizado por triplicado.
Determinación de los parámetros cinéticos del crecimiento de A. ochraceus AFUNL9
La velocidad de crecimiento diametral (KD), expresado en mm.h-1 fue calculada por la regresión lineal del diámetro del moho contra el tiempo en la fase de crecimiento, empleando el programa SigmaPlot 9,0® (Systat Software, Inc., Chicago, IL, USA). La fase de latencia (fase Lag) expresado en h, correspondió al tiempo en el que el moho logró superar el diámetro inicial del inóculo y se calculó mediante la ecuación 1 (11, 12, 14, 25).
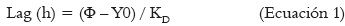
Donde:
Φ= Diámetro inicial del inóculo.
Y0= Punto de corte de la recta de la regresión lineal en el eje Y.
KD= pendiente de la recta de la regresión lineal del crecimiento fúngico.
Determinación del Índice de Inhibición de la tasa de crecimiento del moho (IIKD) y el Índice de Incremento de la fase Lag (IILag)
Ya que se asume que la presencia del SLC en el medio de cultivo disminuirá la velocidad de crecimiento (KD) del moho y aumentará el tiempo necesario de adaptación, se calcularon los índices que relacionan la tasa de crecimiento y la fase de latencia de los tratamientos con los del control. Por lo anterior, se consideraron los índices de inhibición de la tasa de crecimiento (IIKD) y el índice de incremento para la fase Lag (IILag); empleando la ecuación 2; y la ecuación 3, respectivamente.

Cuantificación de ácidos orgánicos, determinación de la proporción no disociada y pH final del medio de cultivo
Se cuantificó por HPLC el contenido de ácido láctico y ácido acético en los 8 SLC y en el sustrato sin fermentar (SSF). Luego, se determinó la fracción no disociada de dichos ácidos en cada SLC empleando la ecuación 4 (11, 14, 30).

Donde:
HA: Concentración no disociada del ácido (mM).
[Ca]: Concentración total del ácido (mM).
Ka: Constante de equilibrio (Ácido láctico: pka= 3,86; Ácido acético: pka= 4,75).
[H+]: Concentración de protones.
El pH final de todas diluciones empleadas de cada SLC mezclado en el medio de cultivo (EM) se determinó con un medidor de pH (Thermo Electron Corp®, Beverly, MA. USA).
Análisis estadístico
Se analizaron las diferencias significativas entre los resultados obtenidos con cada tratamiento en los crecimientos fúngicos y los recuentos obtenidos, mediante prueba de análisis de varianza (ANOVA) y prueba de rango múltiple a un nivel de significancia del 5% (p<0,05) usando el programa Statgraphics Centurion XV.II®. Todos los experimentos se hicieron por triplicado excepto el análisis por HPLC el cual se hizo por duplicado.
RESULTADOS
Recuento de los microorganismos
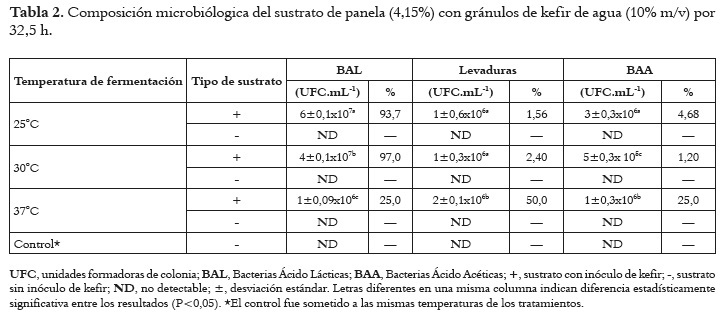
En la tabla 2 se presentan los recuentos de las BAL, levaduras y BAA en los productos fermentados por 32,5 h a 25, 30 y 37°C. Los recuentos varían de acuerdo a la temperatura de incubación. Mientras que los más altos para las BAL y levaduras se obtuvieron a 25 y 30°C, los de BAA se encontraron a 25 y 37°C indicando que estos grupos responden de manera diferente a la temperatura de incubación.
Determinación de ácidos orgánicos
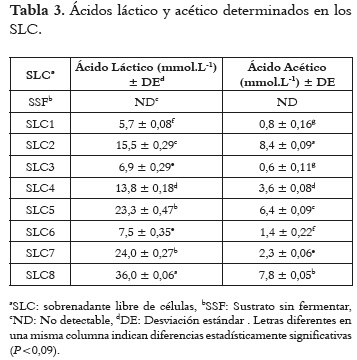
La concentración de los ácidos acético y láctico determinada mediante HPLC en todos los SLC (incluido el control) se presentan en la tabla 3.
En todos los SLC la concentración de ácido láctico fue superior a la del ácido acético y las mayores concentraciones de ambos ácidos se obtuvieron cuando las fermentaciones se realizaron por mayor tiempo (32,5 h) y a la más alta temperatura, lo que evidenció mayor actividad metabólica. La mayor concentración de ácido láctico se cuantificó en el SLC8 y la mayor concentración de ácido acético en el SLC2, posiblemente debido a que a esta temperatura de fermentación (25°C) fue donde se determinó una mayor concentración de BAA (Tabla 2).
En todos los SLC se detectó la presencia de ácidos láctico y acético, excepto en el sustrato sin fermentar. Igualmente en todos fue superior la concentración de ácido láctico, aunque la relación entre ambos ácidos no fue constante. Se encontraron diferencias significativas entre los diferentes SLC, siendo el SLC8 el que contenía mayor concentración de ácido láctico y el SLC2 la mayor concentración de ácido acético. La mayor concentración de ácidos totales (43,8 mmol.L-1) la presentó el SLC8 (que a la vez tuvo el menor valor de pH de 2,8).
Inhibición fúngica
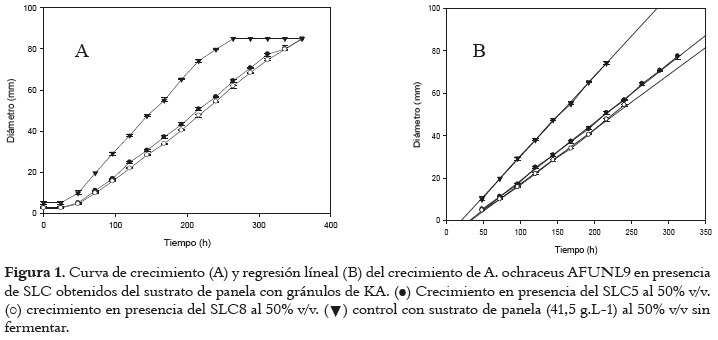
En la figura 1A se presenta la curva de crecimiento y en la figura 1B la regresión lineal del desarrollo de A. ochraceus AFUNL9 en presencia de los dos sobrenadantes más efectivos en retrasar su crecimiento.
La fase lineal de la curva de crecimiento de A. ochraceus AFUNL9 (fig. 1B) se empleó para determinar la tasa de crecimiento (KD) mediante el cálculo de la regresión lineal de la recta. A partir de estos resultados se calculó el índice de inhibición de la tasa de crecimiento (IIKD) y el índice de incremento de la fase Lag (IILag).
En la figura 1A se observa que el hongo cultivado en el medio control (que contenía el sustrato de panela sin fermentar), alcanzó antes que el cultivado en presencia del SLC5 y SLC8, el diámetro total de la caja de petri. La menor fase de latencia y la mayor velocidad de crecimiento pudieron deberse al aporte de nutrientes que ofreció el sustrato en ausencia de metabolitos inhibitorios.
En la tabla 4 se presenta la inhibición fúngica obtenida con cada SLC, además de los índices de inhibición y la concentración de ácido no disociado. Ocho SLC fueron probados en su capacidad antifúngica contra A. ochraceus AFUNL9. Todos los SLC en la concentración 1/2 redujeron la tasa de crecimiento (KD), mientras que ninguna de las demás concentraciones (1/10 y 1/100) fueron inhibitorias y fueron equiparables al control. La mayor inhibición se obtuvo con el SLC8 que disminuyó la tasa de crecimiento (KD) de A. ochraceus AFUNL9 en 32% e incrementó la fase Lag en 31%, con respecto al control. El segundo mejor resultado se presentó en el SLC5, que disminuyó la KD en 29% y aumentó la fase Lag en 25%. A su vez estos dos SLC fueron los únicos que disminuyeron el pH del agar EM por debajo del pKa del ácido acético (4,75) y por tanto contenían la mayor concentración de ácido acético y ácido láctico no disociado, pudiendo ejercer mayor efecto antifúngico. Los sobrenadantes con menor acción antifúngica fueron aquellos con un pH por encima del valor del pKa de ambos AO, lo que correspondió a una menor concentración de AO no disociados.
Una vez establecido que el SLC8 generaba la mayor inhibición fúngica, se evaluó si dicho efecto se debía exclusivamente a la concentración de ácidos no disociados junto con el descenso de pH. Para ello se alcalinizó el SLC8 (pH 2,8) hasta pH 3,5 y 4,0, para conservar la concentración total de los ácidos orgánicos en el SLC pero disminuir su concentración en estado no disociado. En la tabla 4 se observa que el aumento del pH condujo a una disminución fuerte en el porcentaje de ácidos no disociados. La tasa de crecimiento del hongo en presencia del SLC8 neutralizado no presentó diferencia significativa con la correspondiente a los demás SLC a mayor pH, excepto el SLC5. La fase de latencia de los SLC neutralizados también disminuyeron con respecto al SLC8, pero siguieron siendo superiores significativamente (P<0,05) a la correspondiente al control. Esto último permite considerar que la inhibición fúngica si se debe a la presencia de ácidos orgánicos pero que deben estar presentes otros metabolitos que aportan a la inhibición fúngica.
DISCUSIÓN
El estudio sobre el efecto antifúngico de los productos fermentados con gránulos de kefir es aun reciente, teniéndose algunas nuevas publicaciones sobre gránulos de kefir de leche fermentados en leche o suero de quesería (26, 27). En esta investigación se pudo establecer la capacidad fermentativa del kefir de agua en un sustrato económico y de fácil acceso, que además se puede preparar sin necesidad de esterilización, tal como es la panela, y que los sobrenadantes provenientes de este producto tienen actividad antifúngica contra un hongo de interés en la industria del café tal como es A. ochraceus.
El estudio de las capacidades fermentativas del kefir de agua en un sustrato como la solución de panela, requirió un acercamiento desde diferentes aspectos básicos. En primer lugar se hicieron recuentos de los microorganismos presentes en el producto fermentado bajo diferentes condiciones de temperatura y tiempo. A partir de los recuentos obtenidos de los SLC, se determinó que las BAL fueron el grupo de microorganismos más numeroso en los SLC2 y SLC5, en un orden de 107 UFC. ml-1; lo cual coincide con los resultados obtenidos por otros investigadores que han hallado a las BAL como el grupo dominante a estas temperaturas de 25 y 30°C (28, 31). No obstante en los SLC obtenidos a 37°C el recuento descendió significativamente (P<0,05) hasta 1±0,09x106 UFC.ml-1, mientras que el recuento de levaduras aumentó hasta 2±0,1x106 UFC.ml-1, pasando a ser el grupo de microorganismos más numeroso en el SLC8. Posiblemente a esta temperatura de fermentación, se estimuló una mayor actividad metabólica, mayor consumo de azúcares y mayor acidificación del medio, afectando el crecimiento de BAL, pero favoreciendo el medio para el crecimiento de las levaduras. De otro lado las BAA se encontraron en un orden de 106 a 25 y 37°C y descendieron significativamente (P<0,05) a un orden de 105 a 30°C, Estos resultados concuerdan con lo reportado por otros investigadores, quienes también encontraron órdenes de 105 y 106 UFC.ml-1 en una bebida azucarada fermentada con gránulos de KA (28). Lo anterior permite concluir que la temperatura y el periodo de incubación son factores que modulan significativamente el crecimiento de los microorganismos inmersos en el KA, especialmente las BAL (32).
Las BAL se han considerado las principales productoras de metabolitos antibacterianos, entre éstos los ácidos orgánicos (AO), los cuales se determinaron en los SLC mediante HPLC. En todos los SLC fue dominante la concentración de ácido láctico, lo cual se atribuye a que en el KA, las BAL homofermentativas son más numerosas que las heterófermentativas y que las BAA (28). Previamente se han reportado concentraciones de AO producidos por la fermentación con gránulos de KA (11% m/v) de un sustrato elaborado con azúcar morena (5% m/v) por un periodo de 24 h a temperatura ambiente (25°C); hallando concentraciones de 19,42 mmol.L-1 de ácido láctico y 23,31 mmol.L-1 de ácido acético (28). En nuestras fermentaciones a la misma temperatura, pero por un periodo de tiempo de 32,5 h (aproximadamente 8 h más), la concentración de ácido láctico es inferior (15,5 mmol.L-1 y la concentración de ácido acético es casi dos veces menor (8,4 mmol.L-1). Pero además, también se diferencia en que todas las concentraciones de ácido acético en el anterior estudio eran mayores a las del ácido láctico, esto puede ser debido a la cantidad y a la relación de microorganismos que conforman el gránulo (33) o al tipo de sustrato empleado. En nuestra investigación, la relación de microorganismos cuando la fermentación se realizó a 25°C correspondió a 93,75% de BAL, 1,56% de levaduras y 4,68% de BAA, pero en el estudio anteriormente citado, las BAL correspondían sólo al 57,65%, mientras que las levaduras correspondían al 30,86% y las BAA con 11,48% (28). Estas diferencias en las cantidades de microorganismos, derivó en las diferentes concentraciones de AO encontradas en las bebidas fermentadas con los gránulos de KA.
Los estudios sobre la capacidad antifúngica del kefir de agua se realizaron con todos los SLC obtenidos. En primer lugar, el SLC del producto no fermentado adicionado al medio de cultivo en el control, favoreció el crecimiento al aportar nutrientes y carbohidratos sin la presencia de ácidos. Los productos fermentados con mayor capacidad inhibitoria (SLC8 y SLC5), produjeron un descenso del pH en el medio de cultivo por debajo del pKa del ácido acético (4,75) y por tanto contenían la mayor concentración de ácido acético y ácido láctico no disociado, permeables por la membrana celular y con capacidad de actuar de manera sinérgica (14). En relación a esto, es conocido que un ácido es más fuerte cuanto menor es su pKa ; en este sentido, el ácido láctico (pKa 3,86) es más acidificante que el ácido acético (pKa 4,75). Además, el ácido láctico es el principal producto metabólico producido por las BAL, que disminuye el pH y que es capaz de inhibir muchos microorganismos (18). De forma similar, el ácido acético interactúa con la membrana celular para neutralizar el gradiente electroquímico de protones, e incluso puede llegar a inhibir la captación de aminoácidos (18), disminuyendo la viabilidad fúngica. Se ha descrito que el efecto antifúngico del ácido acético a menudo es dependiente de la disminución del pH por parte del ácido láctico (19).
En un estudio reciente, se evaluó la capacidad antifúngica del SLC de la leche fermentada con gránulos de kefir, adicionada en concentraciones de 0,5 a 10% en caldo Czapek-Dox, estableciendo la concentración fungicida mínima en un 10%, mientras que al 9%, la producción de micelio seco era un 18,77% con respecto al control, obteniendo una reducción del crecimiento del 81,23% (26). El anterior estudio coincidió con el nuestro en que se demostró la capacidad del kefir, fermentando otro sustrato, en reducir el crecimiento fúngico. No obstante, ambos difieren en los porcentajes de inhibición fúngica. En el estudio anterior, al emplear un 10% de kefir en el medio de cultivo, se obtuvo inhibición total del crecimiento, mientras que en nuestra investigación, a la máxima concentración de 50%, no se inhibió totalmente el desarrollo fúngico sino que se aumentó la fase de latencia en un 31,6% y se redujo la tasa de crecimiento en un 31,0%.
Otros investigadores han estudiado la influencia del pH en la inhibición fúngica, encontrando que a un pH bajo (2,6) lograban una buena capacidad antifúngica, mientras que a un pH más alto (4,0) se observaba solo ligeras inhibiciones (32); tal como ocurrió en nuestros experimentos. La presencia de los AO débiles (láctico y acético) en los sustratos fermentados, se consideraron como los principales responsables de la reducción del crecimiento (34). Este efecto fue más pronunciado cuando los valores de pH se situaron por debajo del valor del pKa de los AO (35), es decir cuando los AO estaban en su forma no disociada, colapsando el gradiente electroquímico de protones causando una detención de las actividades vitales (Fungistasis o bacteriostasis) y una eventual muerte celular para los organismos susceptibles (36). Por lo anterior, los AO y demás productos metabólicos producidos durante la fermentación con gránulos de KA, podrían tener un efecto inhibitorio sobre el crecimiento de microorganismos patógenos y un potencial biopreservante que sirva a la industria de alimentos a mejorar la seguridad alimentaria. Los resultados obtenidos con los sobrenadantes neutralizados permitieron corroborar que el efecto antifúngico está relacionado con la presencia de ácidos no disociados, lo cual se ha estudiado previamente con sobrenadantes de leche y suero de quesería fermentados con gránulos de kefir contra bacterias como E. coli (27, 33, 37, 38). No obstante lo anterior, se observó que la fase de latencia de los SLC neutralizados siguió siendo superior al control, lo cual permitió observar que parte de la inhibición fúngica puede deberse al efecto de otros metabolitos presentes en el SLC. Al respecto, recientemente se ha destacado la producción de ácido fenil láctico por lactobacilos, el cual ha demostrado acción antifúngica y se ha resaltado la interacción con los otros ácidos presentes en los productos fermentados (16, 17, 39).
El estudio de la inhibición del crecimiento de mohos filamentosos no ha recibido tanta atención como lo ha sido el del crecimiento bacteriano, tal vez debido a la complejidad inherente que se asocia con la cuantificación del crecimiento fúngico. La medición de la velocidad de extensión de las hifas, usualmente reportado como tasa de crecimiento radial (KD), es probablemente el método más simple y directo, pero no necesariamente representa la verdadera naturaleza del crecimiento fúngico (40). El requisito previo para la producción de un modelo útil y confiable debe ser una base de datos que contenga gran cantidad de datos relevantes, preferiblemente como lo son las curvas de crecimiento (12). Pero una de las dificultades de este método se asocia a la recolección de los datos originados en la curva de crecimiento del moho. Tales problemas en obtener curvas de crecimiento reproducibles y de calidades similares, son más complicados para los mohos filamentosos que para otros microorganismos (12).
CONCLUSIONES
La reducción del crecimiento de mohos toxigénicos en alimentos tanto de consumo humano como animal, en sus diferentes etapas de elaboración y almacenamiento, es tema de estudio prioritario y de interés creciente dentro de la comunidad científica y la industria de alimentos dedicada al desarrollo de estrategias seguras y eficientes para estos propósitos.
Los SLC obtenidos de la panela fermentada con gránulos de KA demostraron propiedades antifúngicas sobre A. ochraceus AFUNL9, causando una reducción en las tasas de crecimiento (KD) y aumentando la fase Lag. Esto fue atribuido principalmente a la combinación del descenso del pH y los productos metabólicos de la fermentación, especialmente los ácidos láctico y acético en su forma no disociada. Aunque no se puede descartar el hecho de que otras sustancias no cuantificadas hayan tenido algún efecto.
El KA podría tener un importante uso dentro de la industria de los alimentos como medio para el biocontrol de mohos filamentosos. Deben realizarse más estudios al KA y su capacidad antifúngica, pudiendo con esto conllevar al uso de sistemas de biopreservación, previniendo el deterioro por mohos y la formación de micotoxinas en matrices alimentarias.
AGRADECIMIENTOS
Los autores le expresan sus sinceros agradecimientos al laboratorio de salud pública de la Universidad de Antioquia y a la facultad de Ciencias Exactas de la Universidad Nacional de La plata, Argentina, por hacer posible el desarrollo de esta investigación.
Conflicto de Intereses
Los autores declaran que no existe conflicto de interés en esta investigación.
REFERENCIAS
1. Ramos AJ, Labernia N, Marín S, Sanchis V, Magan N. Effect of water activity and temperature on growth and ochratoxin production by three strains of Aspergillus ochraceus on a barley extract medium and on barley grains. Int J Food Microbiol. 1998; (44): 133-140. [ Links ]
2. Ström K, Sjögren J, Borberg A, Schnürer J. Lactobacillus plantarum MiLAB 393 produces antifungal cyclic dipeptides cyclo(L-Phe- L-Pro) and ciclo(Phe-trans-4-OH-L-Pro) and 3-phenyllactic acid. Appl Environ Microb. 2002; (68): 4322-4327. [ Links ]
3. O'Callaghan J, Stapleton PC, Dobson ADW. Ochratoxyn A biosynthetic genes in Aspergillus ochraceus are differentially regulated by a pH and nutritional stimuli. Fungal Genet Biol. 2006; (43): 213-221. [ Links ]
4. Urbano GR, Taniwaki MH, Leitao MF, Vicentini MC. Occurrence of Ochratoxin A producing fungi in raw Brazilian coffee. J Food Protect. 2001; (64): 1226-1230. [ Links ]
5. Taniwaki MH, Pitt JI, Teixeira AA, Lamanaka BT. The source of ochratoxin A in Brazilian coffee and its formation in relation to processing methods. Int J Food Microbiol. 2003; (82): 173-179. [ Links ]
6. Martins ML, Martins HM, Gimeno A. Incidence of microflora and of ochratoxin A in green coffee beans (coffee Arabica). Food Addit Contam. 2003; (20): 1127-1131. [ Links ]
7. Batista LR, Chalfoun SM, Prado G, Schwan RF, Wheals AE. Toxigenic fungi associated with processed (green) coffee beans (Coffee arabica L.). Int J Food Microbiol. 2003; (85): 293-300. [ Links ]
8. Suárez-Quiroz M, Gozález-Rios O, Barel M, Guyot B, Schorr- Galindo S, Guiraud JP. Effect of chemical and environmental factors on Aspergillus ochraceus growth and toxigenesis in green coffee. Food Microbiol. 2004; (21): 629-634. [ Links ]
9. Frank JM. HACCP and its mycotoxin control potential: Ochratoxin A (OTA) in coffee production. Proc. 7th International Committee Food Microbiology Hygiene. The Netherlands, Veldhoven. 1999. p. 1222-1225. [ Links ]
10. Suárez-Quiroz ML, Alonso Campos A, Valerio Alfaro G, González-Ríos O, Villeneuve P, Figueroa-Espinoza MC. Anti- Aspergillus activity of green coffee 5-O-caffeoyl quinic acid and its alkyl esters. Microb Pathogenesis. 2013; (61-62): 51-56. [ Links ]
11. Lind H, Jonsson H, Schnürer J. Antifungal effect of dairy propionibacteria- contribution of organic acids. Int J Food Microbiol. 2005; (98): 157-165. [ Links ]
12. Molina M, Giannuzzi L. Combined effect of temperature and propionic acid concentration on the growth of Aspergillus parasiticus. Food Res Int. 1999; (32): 677-682. [ Links ]
13. Davidson P. Chemical preservatives and natural antimicrobial compounds. En: Food microbiology: Fundamentals and frontiers. Doyle MP, Beuchat LR, & Montville TJ. Editores. (Washington, DC): 2001. ASM Press, Cap. 29; p. 593-627. [ Links ]
14. León AM, Serna CA, Quintero EA, Gamba RR, De Antoni GL, Giannuzzi L. Inhibitory activity of lactic and acetic acid on Aspergillus flavus growth for food preservation. Food Control. 2012; (24): 177-183. [ Links ]
15. Magnusson J, Ström K, Roos S, Sjögren J, Schnürer J. Broad and complex antifungal activity among environmental isolates of lactic acid bacteria. FEMS Microbiol lett. 2003; (219): 129-135. [ Links ]
16. Gerez CL, Torino MI, Rollán G, Font de Valdez G. Prevention of bread mould spoilage by using lactic acid bacteria with antifungal properties. Food control. 2009; (20):144-148. [ Links ]
17. Gerez CL, Torres MJ, Font de Valdez G, Rollán G. Control of spoilage fungi by lactic acid bacteria. Biol Control. 2013; (64): 231-237. [ Links ]
18. Eklund T. Organic acids and esters. En: Mechanism of action of food preservation procedures. Gould GW, editor (New York, NY): 1989. p. 161-200. [ Links ]
19. Schnürer J, Magnusson J. Antifungal lactic acid bacteria as biopreservatives. Trends Food Sci Tech. 2005; 16: 70-78. [ Links ]
20. Niku-paavola ML, Laitila A, Mattila-Sandholm T, Haikara A. New types of antimicrobial compounds produced by Lactobacillus plantarum. Appl Microbiol. 1999; (86): 29-35. [ Links ]
21. Waldherr F, Doll VK, Meißner D, Vogel RF. Identification and characterization of a glucan-producing enzyme from a Lactobacillus hilgardii TMW 1.828 involved in granule formation of water kefir. Food Microbiol. 2010; vol.27 (5): 672-8. [ Links ]
22. Pidoux M. The microflora of sugary kefir grain (the gingerbeer plant): Biosynthesis of the grain from Lactobacillus hilgardii producing a polysaccharide gel. MIRCEN J Appl Microb. 1989; (5): 223-238. [ Links ]
23. Pidoux M, Brillouet JM, Quemener B. Characterization of the polysaccharides from a Lactobacillus brevis and from sugary kefir grains. Biotechnol Lett. 1988; (10): 415-420. [ Links ]
24. Diniz RO, Garla LK, Scheneedorf JM, Carvalho JCT. Study of anti-inflammatory activity of Tibetan mushroom, a symbiotic culture of bacteria and fungi encapsulated into a polysaccharide matrix. Pharmacol Res. 2003; (47): 49-52. [ Links ]
25. Bogaert JC, Naidu AS. Lactic acid. En: Natural Food Antimicrobial Systems. Naidu AS, editor. CRC Press (Boca Raton, Florida): 2000. p. 613-635. [ Links ]
26. Ismaiel AA, Ghaly MF, El-Naggar AK. Milk kefir: ultrastructure, antimicrobial activity and efficacy on aflatoxin B1 production by Aspergillus flavus. Curr Microbiol. 2011; (62): 1602-1609. [ Links ]
27. Londero A, León Peláez A, Diosma G, De Antoni GL, Abraham AG, Garrote GL. Fermented whey as poultry feed additive to prevent fungal contamination. J Sci. Food Agric. 2014; doi: 10.1002/ jsfa.6669. [ Links ]
28. Teixeira KM, Pereira G, Dias D, Schwan R. Microbial communities and chemical changes during fermentation of sugary Brazilian kefir. World J Microb Biot. 2010; (26): 1241-1250. [ Links ]
29. Hernández I, Barbero F. Bacterias Acéticas: Técnicas de detección y eliminación. Vino teQ. 2008; (Noviembre-diciembre): 12-16 Disponible en línea: http://www.guserbiot.com/20-24%20 viticul.pdf/. Consultado el 15 de Enero de 2011. [ Links ]
30. Pellicer K, Copes J, Gianuzzi L, Zaritzky N. Behavior of Listeria monocytogenes type1 355/98 (85) in meat emulsions as affected by temperature, pH, water activity, fat and microbial preservatives. Food control. 2011; (22): 1573-1581. [ Links ]
31. Simova E, Beshkova D, Angelov A, Hristozova T, Frengova G, Spasov Z. Lactic Acid Bacteria and yeast in kefir grains and kefir made from them. J Ind Microbiol. Biotechnol. 2002; (28): 1-6. [ Links ]
32. Dalié DKD, Deschamps AM, Richard-Forget F. Lactic acid bacteria - Potential for control of mould growth and mycotoxins: A review. Food Control. 2010; (21): 370-380. [ Links ]
33. Garrote GL. Bacterias Lácticas y Levaduras para la Industria Alimentaria: Kefir. [Tesis Doctoral]. [La Plata, Argentina]: Universidad Nacional de la Plata, Facultad de Ciencias exactas, Departamento de química y Ciencias Biológicas: 1999. p. 168. [ Links ]
34. Silva KR, Rodrigues SA, Filho LX. Antimicrobial Activity of Broth Fermented with Kefir Grains. Appl Biochem Biotech. 2009; (152): 316-325. [ Links ]
35. Piard JC, Desmazeaud M. Inhibiting factors produced by lactic acid bacteria. 1. Oxigen metabolites and catabolism end-products. Lait. 1991; (71): 525-541. [ Links ]
36. Magnusson J. Antifungal activity of lactic acid bacteria. [Doctor's dissertation], [Uppsala, Suiza] Swedish University of Agricultural Sciences 2003. p. 38. [ Links ]
37. Garrote GL, Abraham AG, De Antoni GL. Chemical and microbiological characterisation of kefir grains. J Dairy Res. 2001; (68): 639-652. [ Links ]
38. Garrote GL, Abraham AG, De Antoni GL. Inhibitory power of kefir: The role of the organic acids. J food protect. 2000; (63): 364-369. [ Links ]
39. Cortés-Zavaleta O, López-Malo A, Hernández-Mendoza A, García H. Antifungal activity of lactobacilli and its relationship with 3-phenyllactic acid production. Int J Food Microbiol. 2014: (173) 30-35. [ Links ]
40. Gibson AM, Hocking AD. Advances in the predictive modeling of fungal growth in food. Trends Food Sci Tech. 1997; 8(11): 353- 358. [ Links ]