Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Reumatología
versión impresa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.20 no.1 Bogotá ene./jun. 2013
REPORTE DE CASO
Nasser Abdel Polanco Flores1, María Virgilia Soto Abraham2, Francisco Eugenio Rodríguez Castellanos1
1 Servicio de Nefrología, Instituto Nacional de Cardiología Dr. Ignacio Chávez, México D.F.
2 Servicio de Patología, Instituto Nacional de Cardiología Dr. Ignacio Chávez, México D.F.
Correspondencia: Nasser Abdel Polanco: nasser_abdel2000@yahoo.com
Los autores declaran no presentar ningún conflicto de interés al momento de la redacción del manuscrito.
Recibido: 15 de enero de 2013 Aceptado: 20 de febrero de 2013
RESUMEN
Presentamos el caso de una mujer de 30 años, mexicana, que luego de permanecer sin datos de actividad lúpica renal por 13 años, desde su diagnóstico, sin inmunosupresión crónica, experimenta un deterioro general por un estado autoinmune severo desencadenado tras un embarazo a término sin complicaciones, presentando, incluso, hemorragia alveolar difusa en 2 ocasiones, durante 12 meses, en el contexto de anticuerpos anti citoplasma de neutrófilos ANCA (+), volviendo su manejo difícil desde el punto de vista terapéutico con esquemas de inmunosupresión triple y cuádruple. Durante su evolución ha desarrollado microangiopatía cerebral y laringitis, por lo que se plantea la posibilidad de un síndrome de sobreposición lupus eritematoso sistémico - vasculitis pauciinmune, una entidad no bien descrita en la literatura, cuyo diagnóstico está plagado de dificultades al no existir criterios definidos, ni la verdadera implicación de los ANCA en un paciente con lupus.
Palabras clave: Lupus, nefritis lúpica, vasculitis, hemorragia pulmonar, ANCA, síndrome de sobreposición.
SUMMARY
We report the case of a woman of 30 years, Mexican, who after spending without renal lupus activity data for 13 years after diagnosis, without chronic immunosuppression, experienced a general decline for severe autoimmune condition triggered after an uncomplicated term pregnancy presenting even diffuse alveolar hemorrhage in 2 occasions within 12 months, in the context of Anti neutrophil cytoplasmic ANCA (+), becoming its handling difficult from the point of view of therapeutic immunosuppression regimens triple and quadruple. During its evolution has developed cerebral microangiopathy and laryngitis which raises the possibility of an overlap syndrome lupuserythematosus - ANCA associated vasculitis, an entity not well described in the literature, whose diagnosis is fraught with difficulties in the absence of defined criteria or true ANCA involvement in a patient with lupus.
Key words: Lupus nephritis, vasculitis, pulmonary hemorrhage, ANCA, overlap syndrome.
Introducción
Las complicaciones pulmonares en lupus eritematoso sistémico (LES) pueden ocurrir hasta en el 70% de los individuos afectados durante el curso de la enfermedad, sin embargo, la hemorragia alveolar difusa (HAD) con una frecuencia reportada hasta en 5%, principalmente mujeres, en la tercera década de la vida, constituyendo una manifestación rara pero potencialmente catastrófica que le confiere una alta tasa de mortalidad que supera el 85% en algunos casos en que no existe un diagnóstico y tratamiento de forma oportuna1-4. En la actualidad, si bien la mortalidad aún persiste alta, somos conscientes que se ha reducido a lo largo de las últimas 2 décadas, lo cual se ha atribuido a la mejoría en el diagnóstico y tratamiento intensivo de forma oportuna.
Es conocido que la HAD complica las enfermedades vasculares de la colágena, su ocurrencia es rara, siendo más frecuente en pacientes con LES y vasculitis sistémica. La hemorragia alveolar podría ocurrir a pesar del tratamiento con terapia inmunosupresora, sin embargo, se ha descrito la recurrencia de ésta en pacientes pobremente controlados o en quienes coexiste vasculitis pauciinmune1-4. Si bien, se han encontrado vasculitis de pequeños vasos o capilaritis, con o sin depósitos de inmunocomplejos en biopsias pulmonares de pacientes con LES y HAD, se desconoce hasta qué punto pueden ser atribuidas a una actividad pulmonar lúpica únicamente5. Extensas series de casos y datos provenientes de registros nacionales de vasculitis, sugieren que la HAD ocurre en 12-15% de los pacientes con granulomatosis de Wegener (GW) o poliangeítis microscópica (PAM), y menos del 3% en síndrome de Churg-Strauss (SCS)6.
Presentamos el caso de una paciente con HAD recurrente, en el contexto de actividad lúpica y hallazgos compatibles con una vasculitis pauciinmune, sin embargo, bajo la disyuntiva diagnóstica por ser un tema muy poco explorado en estudios, se han recopilado los datos más importantes para considerar un síndrome de sobreposición.
Presentación de caso
Se trata de una paciente femenina de 30 años de edad, procedente del Estado de México, sin antecedentes familiares relevantes, se destacan en sus antecedentes patológicos el diagnóstico de LES, con 13 años de evolución, e hipertensión arterial sistémica, de 1 año de diagnóstico. El comportamiento del lupus durante los últimos 11 años se caracterizó por actividad articular y cutánea leve esporádica, cefalea vascular y crisis convulsivas esporádicas, que en su seguimiento nunca se atribuyeron a actividad lúpica neurológica por reumatología y neurología. Hace 2 años, la paciente durante su gestación inicia con proteinuria e hipocomplementemia a las 24 semanas e incrementa de forma progresiva hasta 0.9 g/g a las 38.5 semanas de gestación, cuando se realiza la cesárea programada, sin complicaciones.
Es importante mencionar que la función renal se mantuvo normal, con creatinina promedio de 0.6 mg/ dl, sin ascenso en niveles de ácido úrico, ni cifras de presión arterial. La proteinuria persiste posparto y se adiciona un ascenso en las cifras de creatinina hasta 1.2 mg/dl, por lo cual se solicitó valoración por nefrología que decide internar para realizar biopsia renal.
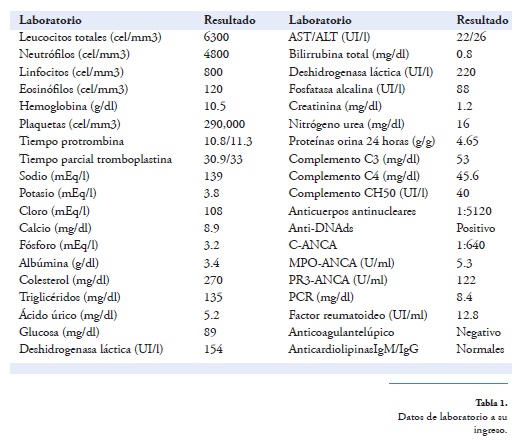
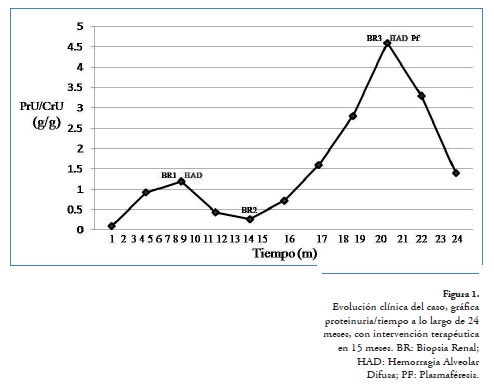
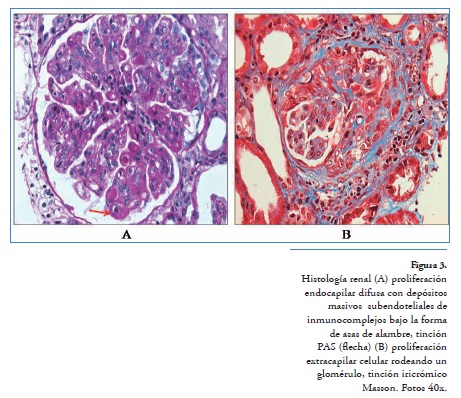
A su ingreso refiriendo únicamente fatiga en los últimos 2 meses, con presión arterial de 124/74 mmHg, frecuencia cardíaca de 85 latidos/minuto, frecuencia respiratoria de 16 ciclos/minuto y temperatura de 36°C, sus laboratorios de ingreso reportaron anemia, linfocitopenia e hipocomplementemia (Tabla 1, Figura 1). Se realiza biopsia renal que reportó glomerulonefritis lúpica difusa clase IV-S (A/C) con proliferación extracapilar, con fibrosis intersticial grado I, arteriolonefroesclerosis moderada, 4 semilunas celulares, 1 fibrosa, por lo que se decidió dar manejo a base de pulsos de metilprednisolona1g por 3 días, 1 g ciclofosfamida, sin embargo, en 72 horas la paciente inicia con hemoptisis que incrementa de forma progresiva hasta requerir ventilación no invasiva, se adicionan 2 pulsos de metilprednisolona y mofetilmicofenolato 2 g/día, con lo cual remite hemorragia pulmonar, se miden niveles de anticuerpos anticitoplasma de neutrófilo (ANCA), resultando positivos contra proteinasa-3 en título 1:640, por lo que se decide egreso para seguimiento por consulta externa con triple esquema inmunosupresor (corticosteroides, ciclofosfamida y micofenolato).
Con dicho esquema se logra remisión completa de la proteinuria, normocomplementemia, corrección de linfocitopenia y con una biopsia control, a los 6 meses, sin datos de actividad lúpica renal reportada como glomerulonefritis lúpica con cambios postratamiento de tipo cicatricial + arteriolonefroesclerosis moderada + arteriopatía temprana + fibrosis intersticial grado I, por lo que se reduce inmunosupresión a doble esquema (corticosteroides y micofenolato).
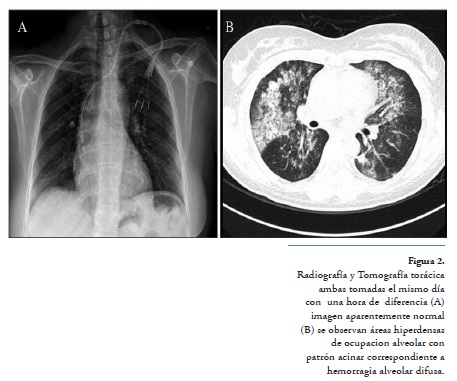
A 4 meses de dicho cambio, inicia nuevamente con fatiga, sedimento urinario activo, hipocomplementemia e incremento en proteinuria hasta 4.65 g/g, por lo que se decide nuevamente su hospitalización. A su ingreso, refería 2 meses de disfonía y tos persistente con escasa expectoración blanquecina, cefalea moderada holocraneal con patrón intermitente, con presión arterial 112/85 mmHg, frecuencia cardíaca 74 latidos/minuto, frecuencia respiratoria 16 ciclos/ minuto, temperatura 36.8°C, sus laboratorios mostraban hallazgos que sugerían actividad lúpica con hipocomplementemia y linfocitopenia leve (Figura 2), por lo que se realiza biopsia renal y se inicia tratamiento con pulsos de metilprednisolona y ciclofosfamida de forma similar al ingreso previo, a 48 horas inicia con hemoptisis y descenso de hemoglobina de 12.4 g/dl hasta 7 g/dl, que requirió apoyo transfusional con paquetes eritrocitarios, teniendo radiografía de tórax normal se realiza tomografía torácica en la que se demuestran áreas de ocupación alveolar con patrón acinar, que en el contexto de la paciente sugieren hemorragia alveolar difusa (Figura 2), se decide adicionar 3 pulsos de metilprednisolona (1g/día) y 3 sesiones de plasmaféresis, con lo cual se controla la hemorragia pulmonar.
La biopsia renal reportó glomerulonefritislúpica proliferativa difusa IV-G (A) con proliferación extracapilar, arteriolonefroesclerosis moderada y arteriolopatía leve, sin encontrar hallazgos que sugieran vasculitis (Figura 3).
Se realizó valoración por otorrinolaringología encontrando hiperemia mucosa nasal, leve desviación de septum, úlceras en faringe, cuerdas vocales con base inflamatoria y laringitis, no siendo posible realizar biopsia de las lesiones, las cuales remitieron con el tratamiento instaurado, mejorando el tono de voz.
Por el antecedente de cefalea y convulsiones, se realizó resonancia magnética en la que se encontró microangiopatía frontal izquierda por enfermedad de pequeño vaso, disminución significativa en el calibre de la luz de la carótida interna en su porción cavernosa y desviación del septum nasal. Se solicitó opinión a reumatología que, ante la mejoría de toda su sintomatología y ausencia de hallazgos contundentes de otra enfermedad autoinmune asociada, cataloga manifestaciones asociadas a lupus, decide seguimiento por consulta externa egresándola con cuádruple esquema inmunosupresor (corticosteroides, ciclofosfamida, micofenolato y tacrolimus), a 3 meses del evento se encuentra asintomática, hipocomplementemia leve, con remisión parcial de la proteinuria (1 g/g, creatinina 0.9 mg/dl).
Discusión
Presentamos el caso de una paciente con LES, conocido y diagnosticado a sus 17 años, en quien debutó con manifestaciones cutáneas y articulares, caracterizada por mantenerse en remisión hasta experimentar activación de su enfermedad por la gestación, en los últimos 2 años. A partir de entonces, en su evolución que se expone, ha sido manifiesta su severidad en la presentación clínica, desarrollando hemorragia pulmonar en 2 ocasiones en el contexto de nefritis lúpica, bajo la forma de un síndrome pulmón-riñón.
De todas las más de 100 causas de HAD, conocidas y estudiadas en publicaciones médicas, los pacientes con etiología autoinmune tienen con mayor frecuencia síndrome pulmón-riñón, síntomas extra-pulmonares y más bajos niveles de hemoglobina que otras7. Curiosamente, nuestro caso presentó estas manifestaciones con la presencia de c-ANCA positivos, que si bien, han sido reportados hasta en 37.3% de los casos de pacientes con LES activa, y siendo más manifiestos en los que poseen simultáneamente nefritis lúpica, su implicación clínica siempre ha sido una materia de debate entre los expertos, atribuyéndoles a estos pacientes mayor severidad en su glomerulopatía, mayor correlación con títulos de anti-DNAds, llegando, incluso, a proponer los ANCA como un marcador serológico para diferenciar la presencia o no de crescencias y nefritis lúpica entre los pacientes con LES8-10; otros como Spronk, et al, han demostrado que la prevalencia de ANCA es más alta entre los pacientes con LES que desarrollan recaídas en comparación con los que no lo hacen, aunque los niveles de ANCA no fluctúen en el período precedente a la recaída, sugiriendo su participación en la expresión de la enfermedad11.
Aunque los pacientes con enfermedades del tejido conectivo diferentes a lupus, también, es conocido que desarrollan autoanticuerpos múltiples, entre ellos ANCA en un rango menor a 5% en comparación con LES, se sugiere la búsqueda intencionada de vasculitis no lúpica relacionada en los casos con mayor severidad12. Fue esto precisamente lo que nos motivó a buscar una vasculitis pauciinmune asociada, considerando la persistencia de proliferación extracapilar en sus biopsias renales, la hemorragia pulmonar recurrente, la microangiopatía cerebral con repercusión por el síndrome convulsivo, y cefaleas asociadas y recientemente por un episodio de laringitis no infecciosa.
En un amplio estudio llevado a cabo en Barcelona, por Ramos - Casals y colaboradores, de 670 pacientes con LES solamente el 11% tenía vasculitis, con una relación mujer-hombre de 8.5:1 y edad promedio de 37.8 años; con respecto al tamaño de los vasos involucrados, el 86%, de los pacientes, tenía vasculitis de pequeños vasos con las manifestaciones cutáneas como principal hallazgo y 14% vasculitis de mediano calibre13. Dicha información no dista de la presentada en un estudio Mexicano con 540 pacientes con LES, con 10% de ellos con diagnóstico de vasculitis asociada, siendo más manifiesto en estos una duración más larga de la enfermedad, edad más joven de inicio y su asociación con miocarditis, psicosis, fenómeno de Raynaud, serositis, leucopenia, linfocitopenia, pleuritis y síndrome antifosfolípido14, lamentablemente, en ninguno de ellos fue posible medir ANCA, los cuales han sido implicados en la patogénesis de la vasculitis lúpica, lo que nuevamente trae a discusión su importancia como parte del mismo lupus o como entidad independiente y asociada.
Ha sido demostrado que los ANCA inducen daño a la célula endotelial, por estimulación de liberación de gránulos con enzimas citolíticas y generar especies reactivas de oxígeno en neutrófilos y monocitos, ocasionando una capilaritis alveolar, mecanismo similar en vasculitis pulmonar ANCA-asociada15. De igual forma, las células endoteliales circulantes (CEC) han sido estudiadas como un marcador de disfunción endotelial en pacientes lúpicos con microangiopatía inflamatoria, demostrándose su incremento relacionado a la actividad de la enfermedad, alcanzando valores máximos en los estadios de complicaciones relacionadas al mecanismo de vasculitis tisular, como la hemorragia pulmonar, renal y manifestaciones del sistema nervioso central16,17.
Debido a la disyuntiva en dilucidar su asociación, en nuestro caso recopilamos los hallazgos encontrados al momento para definir un diagnóstico posible de granulomatosis de Wegener, basados en los criterios diagnósticos publicados por el Research Group of Intractable Vasculitis, Ministry of Health, Labor, and Welfare (MHLW) de Japón18, un país con alta incidencia de vasculitis asociada a ANCA, de los cuales se destacan los síntomas E (ronquera, ulceras faríngeas y laríngeas, rinorrea mucopurulenta, los síntomas L (tos, disnea y esputo sanguinolento), síntomas K (hematuria, proteinuria) y hallazgos de laboratorio (PR3 - ANCA positivo). Lamentablemente, la obtención de un tejido extrarrenal en búsqueda de una vasculitis no ha sido posible por la condición crítica de la paciente en su momento agudo, únicamente existe el estudio imagenológico que lo sugiere a nivel cerebral, y considerando que pueden presentarse manifestaciones neurológicas hasta en el 50% de los pacientes con G W, principalmente, bajo la forma de síntomas que simulan un stroke con déficit motor-sensitivo, afección nervio craneal, meningitis, disfunción cognitiva y epilepsia19,20, aunque estos 2 últimos estén presentes en la paciente, únicamente puede establecerse, por el momento, un diagnóstico probable.
Por otro lado, si bien los hallazgos renales se han catalogado como derivados de actividad lúpica, por no encontrar hallazgos contundentes de vasculitis, no puede descartarse una vasculitis asociada a ANCA sin compromiso renal, aun cuando las manifestaciones pulmonares y cerebrales podrían explicarse por actividad lúpica, la presencia de autoanticuerpos ANCA en el contexto de una evolución mórbida, y manifestaciones severas que ponen en peligro la vida de la paciente, nos hemos planteado la posibilidad de un síndrome de sobreposición de lupus eritematoso sistémico - vasculitis asociada a ANCA.
Dicho síndrome ha sido recientemente descrito, en una serie de 4 casos, todos ellos caracterizados por su severidad en las manifestaciones clínicas, especificidad contra mieloperoxidasa (MPO-ANCA) aunque existe predilección por este antígeno en neutrófilos, también existen casos contra proteinasa 3 (PR3-ANCA)8,9,12,21.
Es de destacar que al realizar una revisión de las publicaciones médicas, las primeras correlaciones entre vasculitis y lupus fueron descritas en 1995, con un síndrome similar a lupus (Lupus-like) y vasculitis asociada a ANCA, en una paciente que consumía metimazol por enfermedad de Graves, dicho cuadro remitió de forma completa al suspender el fármaco22. Luego, ya se demostraba en 1998 por Galeazzi,et al, la presencia de ANCA en el suero de los pacientes con LES y su correlación con algunos hallazgos clínicos, en su amplia revisión de 566 pacientes de 11 diferentes centros hospitalarios europeos, a los cuales se les tomó una muestra sanguínea en búsqueda de ANCA por inmunofluorescencia indirecta y sus especificidades por ELISA para lactoferrina (LF), mieloperoxidasa (MPO), proteinasa3 (PR3) y lisozima (LZ), encontrando una prevalencia de ANCA de 16.4%, con una prevalencia en las especificidades de LF 14.3%, LZ 4.6%, MPO9.3% y PR3 1.7%, siendo manifiesta la correlación positiva de estos con serositis, livedoreticularis, trombosis venosa y artritis (p <0.05)23.
En otro estudio,tres años más tarde, en 42 pacientes, se demostró que la ocurrencia y el título de ambos tipos principales de ANCA fueron similares entre pacientes con LES sin actividad y controles sanos, concluyendo que la medición de ANCA no provee un dato diagnóstico o pronóstico adicional en LES24. Sin embargo, en el contexto de actividad lúpica la cascada de numerosos mecanismos autoinmunes, muchos de ellos desconocidos a la fecha, llevan a la formación de anticuerpos antineutrófilos, principalmente, cuando existe compromiso renal y pulmonar, tal como lo describe Chin, et al, al encontrar una fuerte correlación entre la actividad proliferativa difusa glomerular y títulos de p-ANCA, en comparación a pacientes con LES sin nefritis (p<0.05)8.
Por otro lado, el curso patológico de la nefritis lúpica crescéntica, en el contexto de ANCA positivos, ha sido demostrado en una cohorte de 152 pacientes con nefropatía lúpica clase IV-G, 33 de los cuales con crescencias, quienes han cursado con un mayor índice de actividad y una mayor cronicidad histológica en biopsias subsecuentes, así como mayor frecuencia de recaídas en nefritis lúpica, además de tasas de remisiones completas más pobres al seguimiento a 4 años25.
Recientemente, se ha encontrado una asociación más entre vasculitis asociada a ANCA y LES activa, al demostrarse la presencia predominante de anticuerpos anti-progranulina y la coincidente reducción de niveles séricos de ésta en sangre periférica, actuando como un bloqueador de mecanismo autoinmune inflamatorio vascular al unirse a los receptores del factor de necrosis tumoral (TNF), por lo que se ha propuesto la idea de que sirva como un marcador de actividad vascular inflamatoria de la enfermedad26.
Es conocida la asociación genética de HLA-DRB1*09:01 con múltiples enfermedades autoinmunes, entre ellas LES. Curiosamente, este mismo gen ha sido encontrado en poblaciones asiáticas con vasculitis asociada a ANCA tipo poliangeítis microscópica (PAM) (P=0.0087, odds ratio (OR) 1.90, 95% intervalo de confianza (CI) 1.17-3.08), la que representa la forma más frecuente de vasculitis de pequeños vasos en Japón, en comparación a controles sanos, constituyendo un factor de riesgo, de igual forma se encontró en los que tenían otra vasculitis de pequeños vasos diferente a PAM pero con positividad para mieloperoxidasa (MPO-ANCA) (P=0.0016, OR 2.05, 95% CI 1.31-3.23), por lo que se ha llegado a pensar, de forma hipotética, que el lupus tiene el potencial de desarrollar una vasculitis asociada a ANCA, en cualquier momento de su evolución en que predomine una alta respuesta autoinmune, como es el caso del contexto de una actividad lúpica severa como la nefritis y la hemorragia pulmonar27.
En la actualidad, a pesar de los recientes hallazgos que establecen un vínculo entre ellas, no ha sido posible dilucidar el papel patogénico directo de los ANCA en el daño vascular de LES o si solamente representa un epifenómeno o un marcador más de actividad de la enfermedad, su significado diagnóstico sigue siendo limitado y el papel preciso de los ANCA sigue sin ser definido, constituyendo un área que requiere mayor investigación en la actualidad.
Referencias
1. M. R. Zamora, M. L. Warner, R. Tuder, and M. I. Schwarz, "Diffuse alveolar hemorrhage and systemic lupus erythematosus: clinical presentation, histology, survival, and outcome", Medicine, 1997;76(3):192-202. [ Links ]
2. Santos-Ocampo AS, Mandell BF, Fessler BJ. Alveolar hemorrhage in systemic lupus erythematosus: presentation and management. Chest 2000; 118:1083-1090. [ Links ]
3. Chang MY, Fang JT, Chen YC, Huang CC. Diffuse alveolar hemorrhage in systemic lupus erythematosus: a single center retrospective study in Taiwan. Ren Fail 2002; 24:791-802. [ Links ]
4. Badsha H, Teh CL, Kong KO, Lian TY, Chng HH. Pulmonary hemorrhage in systemic lupus erythematosus. Semin Arthritis Rheum 2004; 33: 414-421. [ Links ]
5. Myers JL, Katzenstein AA. Microangiitis in lupus-induced pulmonary hemorrhage. Am J Clin Pathol 1986; 85:552-556. [ Links ]
6. Ulrich Specks. Difuse alveolar hemorrhage syndromes. Rheumatol 2001; 13:12-17. [ Links ]
7. De Prost N, Parrot A, Cuquemelle E, Picard C, Antoine M, Fleury J, et al. Diffuse alveolar hemorrhage in immunocompetent patients: etiologies and prognosis revisited. Respir Med. 2012; 106(7):1021-32. [ Links ]
8. Chin HJ, Ahn C, Lim CS, Chung HK, Lee JG, Song YW, et al. Clinical implications of anti-neutrophil cytoplasmic antibody test in lupus nephritis. Am J Nephrol 2000;20(1):57-63. [ Links ]
9. Pradhan VD, Badakere SS, Bichile LS, Almeida AF. Anti-neutrophil cytoplasmic antibodies (ANCA) in systemic lupus erythematosus: prevalence, clinical associations and correlation with other autoantibodies. J Assoc Physicians India, 2004;52:533-7. [ Links ]
10. Pan HF, Fang XH, Wu GC, Li WX, Zhao XF, Li X P, et al. Anti-neutrophil cytoplasmic antibodies in new-onset systemic lupus erythematosus and lupus nephritis. Inflammation, 2008;31(4):260-5. [ Links ]
11. Spronk PE, Bootsma H, Horst G, Huitema MG, Limburg PC, Tervaert JW, et al. Anti-neutrophil cytoplasmic antibodies in systemic lupus erythematosus. Br J Rheumatol, 1996;35(7):625-31. [ Links ]
12. Merkel PA, Polisson R P, Chang Y, Skates SJ, Niles JL. Prevalence of anti-neutrophil cytoplasmic antibodies in a large inception cohort of patients with connective tissue disease. Ann Intern Med. 1997;126(11):866-73. [ Links ]
13. Ramos-Casals M, Nardi N, Lagrutta M, Brito-Zerón P, Bové A, Delgado G, et al. Vasculitis in systemic lupus erythematosus: prevalence and clinical characteristics in 670 patients. Medicine, 2006;85(2):95-104. [ Links ]
14. Drenkard C, Villa AR, Reyes E, Abello M, Alarcón D. Vasculitis in systemic lupus erythematosus. Lupus, 1997;6(3):235-42. [ Links ]
15. Ewert BH, Falk RJ. The pathogenetic role of anti-neutrophil cytoplasmic autoantibodies. Am J Kidney Dis 1991; 18: 188-195. [ Links ]
16. Kluz J, Kopec W, Jakobsche-Policht U, Adamiec R. Circulating endothelial cells, endothelial apoptosis and soluble markers of endothelial dysfunction in patients with systemic lupus erythematosus-related vasculitis. Int Angiol. 2009;28(3):192-201. [ Links ]
17. Elshal M, Abdelaziz A, Abbas A, Mahmoud K, Fathy H, El Mongy S, et al. Quantification of circulating endothelial cells in peripheral blood of systemic lupus erythematosus patients: a simple and reproducible method of assessing endothelial injury and repair. Nephrol Dial Transplant, 2009;24(5):1495-9. [ Links ]
18. Shoichi Ozaki. ANCA - associated vasculitis: Diagnostic and Terapeutic Strategy. Allergol Int. 2007;56:87-96. [ Links ]
19. Floege and Johnson. Renal and Systemic Vasculitis. J. Charles Jennette, Ronald J. Falk. Comprehensive Clinical Nephrology. St. Louis Missouri. Elsevier Saunders. 2010. P.292-307. [ Links ]
20. Angelo L. Gafo. Diagnostic Approach to ANCA - associated Vasculitides. Rheum Dis Clin N Am, 2010; 36:491-506. [ Links ]
21. Hervier B, Hamidou M, Haroche J, Durant C, Mathian A, Amoura Z. Systemic lupus erythematosus associated with ANCA-associated vasculitis: an overlapping syndrome?. Rheumatol Int. 2012;32(10):3285-90. [ Links ]
22. Kawachi Y, Nukaga H, Hoshino M, Iwata M, Otsuka F. ANCA-associated vasculitis and lupus-like syndrome caused by methimazole. Clin Exp Dermatol. 1995;20(4):345-7. [ Links ]
23. Galeazzi M, Morozzi G, Sebastiani GD, Bellisai F, Marcolongo R, Cervera R, et al. Anti-neutrophil cytoplasmic antibodies in 566 European patients with systemic lupus erythematosus: prevalence, clinical associations and correlation with other autoantibodies. European Concerted Action on the Immunogenetics of SLE. Clin Exp Rheumatol. 1998;16(5):541-6. [ Links ]
24. Molnár K, Kovács L, Kiss M, Husz S, Dobozy A, Pokorny G. Anti-neutrophil cytoplasmic antibodies in patients with systemic lupus erythematosus. Clin Exp Dermatol. 2002;27(1):59-61. [ Links ]
25. Yu F, Tan Y, Liu G, Wang SX, Zou WZ, Zhao MH. Clinico-pathological characteristics and outcomes of patients with crescenticlupus nephritis. Kidney Int. 2009; 76(3):307-17. [ Links ]
26. Turner L, Preuss KD, Fadle N, Regitz E, Klemm P, Zaks M, et al. Progranulin antibodies in autoimmune diseases. J autoimmun 2012 pii: S0896-8411(12)00130-8. doi: 10.1016/j.jaut.2012.10.003. [ Links ]
27. Tsuchiya N. Genetics of ANCA-associatedvasculitis in Japan: a role for HLA-DRB1*09:01 haplotype. Clin Exp-Nephrol. 2012 nov 23. [ Links ]