Introducción
El 31 de diciembre del 2019, la Organización Mundial de la Salud fue notificada de un caso de neumonía de origen desconocido, identificada en un mercado de mariscos en la ciudad de Wuhan, China. Según los hallazgos de laboratorio, relacionados con el síndrome respiratorio agudo severo (SARS) y el coronavirus del síndrome respiratorio de Oriente Medio, la causa se le atribuyó a un nuevo coronavirus. En poco tiempo, se pasó de casos aislados de neumonía en Wuhan a una pandemia. La situación escaló desde ser una epidemia, declarada por la Organización Mundial de la Salud el 30 de enero del 2020, a una emergencia de salud pública de alerta mundial, por lo cual se enfatizó en la necesidad de acción global, cooperación internacional, unidad y coordinación para contener el brote. Con posterioridad, en febrero del 2020, la Organización Mundial de la Salud le dio un nombre a la nueva enfermedad por coronavirus: COVID-19. Finalmente, el 11 de marzo del 2020 se determinó que la COVID-19 se clasificaría como una pandemia1.
Dada la propagación exponencial del virus y las modalidades terapéuticas alternativas que se han considerado, la prioridad principal de la comunidad científica ha sido la reutilización de medicamentos convencionales, cuya eficacia se ha evaluado. En la actualidad, se realizan muchos estudios para identificar el más revolucionario. Las estrategias de manejo farmacológico para COVID-19 utilizadas habitualmente durante el 2020 fueron: (cloroquina/hidroxicloroquina, azitromicina, remdesivir, lopinavir/ritonavir, ribavirina, ivermectina, corticosteroides, tocilizumab, interferón y tofacitinib. Este último ha tenido un gran auge debido a su gran acción antiinflamatoria selectiva1.
El tofacitinib es un inhibidor activo y selectivo de las Janus cinasas (JAK), el cual bloquea la JAK1 y la JAK3 de forma preferencial2. Así, ha demostrado inhibición de la señalización mediada por JAK1/JAK3 de las IL-2, IL-4, IL-6, IL-7, IL-15 e IL-21, como también de IFN-a e IFN--y, en ensayos preclínicos de ratas con artritis llevados a cabo por Meyer et al.3, que dieron como resultado la modulación de las respuestas inmunes e inflamatorias. El tofacitinib, a su vez, bloqueó el desarrollo de IL-17 e IFN--y, así como la proliferación de células T CD4+ de sangre periférica y tejido sinovial, dependiendo de la dosis, lo cual ocasionó la inhibición de la producción de IL-6 en fibroblastos sinoviales, la inhibición de IL-8, la producción en monocitos CD14 y la reducción de la degradación del cartílago in vitro e in vivo de muestras de pacientes con artritis reumatoide4. Por estas propiedades inmunomoduladoras comprobadas, se ha defendido su instauración dentro de las medidas terapéuticas para tratar la enfermedad por COVID-19.
De manera general, se ha confirmado que los inhibidores de las JAK, como el tofacitinib, influyen en la reducción de la morbimortalidad por COVID-19, como se estudió en un metaanálisis efectuado por Walz et al.5, quienes incluyeron 15 ensayos aleatorios y no aleatorios, y describieron el desenlace clínico de los pacientes. Los pacientes que recibieron inhibidores de las JAK experimentaron una disminución significativa de la mortalidad (OR = 0,12; IC 95% = 0,03-0,39, p< 0,001) y del ingreso a unidades de cuidados intensivos (UCI) (OR = 0,05; IC 95% = 0,01-0,26, p < 0,001). A su vez, tuvieron mayor probabilidad de alta médica (OR = 22,76; IC 95% = 10,6848,54, p< 0,00001).
El objetivo general del presente estudio consiste en caracterizar y comparar la población que recibió tofacitinib con aquella que no recibió este fármaco como parte del tratamiento contra la COVID-19 en la Clínica Unión Médica del Norte, durante el anno 2020. Asimismo, busca evaluar el efecto del fármaco tofacitinib sobre los diversos parámetros serológicos en los pacientes infectados.
Métodos
Diseño del estudio
Se llevó a cabo una investigación observacional, retrospectiva transversal de tipo exploratoria y de fuente secundaria, que busca caracterizar y comparar la población que recibió tofacitinib con aquella que no recibió este tratamiento como parte del manejo de la COVID-19 en la Clínica Unión Médica del Norte, ubicada en la ciudad de Santiago de los Caballeros, República Dominicana, durante el periodo comprendido entre marzo y diciembre del anno 2020.
Población de estudio
La población de estudio engloba las historias clínicas de todos los pacientes que fueron hospitalizados en la Clínica Unión Médica del Norte con diagnóstico presuntivo o confirmado por RT-PCR para SARS-CoV-2 entre marzo y diciembre del 2020. Se consideraron criterios de inclusión tener más de 18 anos y poseer al menos un informe de imagen y un hemograma en su historial médico relacionado con COVID-19, en tanto que se definió como criterio de exclusión el caso de aquellos pacientes que presentaron registros incompletos o no verificables. Ningún paciente fue excluido del estudio.
Variables clínicas
Esta investigación analizó variables sociodemográficas y clínicas registradas en los historiales médicos de cada paciente, incluyendo la edad y el género entre las primeras; entre las variables clínicas se encuentra el tratamiento administrado. Además, se valoró el soporte respiratorio que utilizó el paciente, su ingreso a la UCI y las complicaciones respiratorias que presentó durante la estancia hospitalaria. También se tomó en cuenta si el paciente había fallecido.
Por otro lado, se consideraron los resultados de exámenes de laboratorio, como el recuento de glóbulos blancos (WBC) (K/µL), la hemoglobina (HGB) (g/dL), los neutrófilos (NEU) (%), los linfocitos (LYM) (%), las plaquetas (PLT) (K/µL), la creatinina (mg/dL), la albúmina (mg/dL) y los marcadores inflamatorios ferritina (µg/L), dímero D (ng/ml), proteína C reactiva (PCR) (mg/L), aspartato aminotransferasa (SGOT) (UI/L), alanina aminotransferasa (SGPT) (UI/L), relación SGOT/SGPT (SGOT/SGPT) (UI/L) y lactato deshidrogenasa (LDH) (mg/dL) a la llegada y al egreso del paciente.
Análisis estadístico
Se utilizó el programa Microsoft Excel (2016) para elaborar una base de datos, mientras que a fin de realizar el análisis estadístico se empleó el programa Stata 16.1. A partir de esto, se describieron las características de la población utilizando medianas y rango intercuartílico para las variables numéricas y frecuencias absolutas y relativas para las variables categóricas. La normalidad de las variables se valoró con la prueba de Shapiro-Wilk. Se utilizó la prueba exacta de Fisher para comparar las variables categóricas y la prueba U de Mann-Whitney a fin de comparar las variables continuas. Consideramos un valor de p < 0,05 como estadísticamente significativo para todos los análisis e intervalos de confianza de un 95%.
Resultados
El total de los participantes del estudio fue de 407 pacientes ingresados a la unidad de COVID-19 de la Clínica Unión Médica del Norte. Entre todos los pacientes, la mediana de la edad fue de 54 anos, mientras que la de los pacientes tratados con tofacitinib fue de 62 anos, y la de los no medicados con tofacitinib fue de 54 anos. Por otro lado, la mayor parte de los participantes de manera global fueron masculinos, quienes correspondieron al 65,6% de ellos; de igual forma, dentro del grupo medicado con tofacitinib (80,65%) y del grupo con medicación diferente a tofacitinib (64,36%) la población fue mayormente masculina (tabla 1).
Tabla 1 Características demográficas y clínicas
| Participantes N = 407 | Uso de tofacitinib n = 31 | Control n = 376 | p | |
|---|---|---|---|---|
| Características sociodemográficas | ||||
| Género, n (%) | ||||
| Masculino | 267 (65,60) | 25 (80,65) | 242 (64,36) | 0,077 |
| Femenino | 140 (34,40) | 6 (19,35) | 134 (35,64) | |
| Edad (años), mediana (rango) | 54 (43-68) | 62 (52-71) | 54 (42-67,50) | 0,080 |
| Características clínicas | ||||
| Fallecido, n (%) | 39 (9,68) | 2 (6,45) | 37 (9,84) | 0,755 |
| Complicaciones respiratorias, n (%) | 80 (19,85) | 5 (15,13) | 75 (19,94) | 0,829 |
| Ingreso UCI, n (%) | 105 (26,05) | 9 (29,03) | 96 (25,53) | 0,674 |
| Soporte respiratorio de mayor nivel, n (%) | ||||
| Mascarilla de reservorio | 78 (19,40) | 8 (25,81) | 70 (18,61) | 0,749 |
| Punta nasa | 264 (65,67) | 20 (64,51) | 244 (64,89) | |
| Ventilación mecánica | 46 (11,44) | 3 (9,67) | 43 (11,44) | |
| UCI: Unidad de Cuidados Intensivos. Tabla creada por los autores. | ||||
Se estudiaron las características clínicas de la población y se determinó que las defunciones fueron menores en el grupo que se medicó con tofacitinib (6,45%), en comparación con las defunciones en el grupo que no utilizó dicho fármaco (9,84%). No obstante, esta diferencia no tuvo significación estadística (p = 0,755). Por otro lado, a pesar de que fueron más los medicados con tofacitinib ingresados en UCI (29,03%), las complicaciones respiratorias fueron menos frecuentes en los pacientes medicados con tofacitinib (15,13%) que en los que solo utilizaron la terapia estándar (19,94%). Asimismo, el soporte respiratorio más utilizado en ambos grupos fue la punta nasal. El uso de ventilación mecánica fue más común en las personas que no fueron medicadas con tofacitinib (11,44%) que en los que sí fueron tratados con este medicamento (9,67%).
Con respecto a los pacientes medicados con tofacitinib, se obtuvieron valores más altos al egreso en los siguientes parámetros del hemograma: WBC, PLT, LDH, ferritina y dímero D. En contraste, los valores de los parámetros SGOT, SGOT/SGPT, PCR, NEU, LYM, HGB, glucemia y LDH resultaron menores al egreso, en comparación con los valores del ingreso (tabla 2). Por otro lado, en cuanto a los pacientes que no fueron medicados con tofacitinib, los valores de WBC, SGOT, PLT, NEU, ferritina y glucemia resultaron mayores al egreso, en comparación con los niveles al ingreso. Los valores de SGOT/SGPT, PCR, LYM, LDH, HGB y dímero D fueron menores al egreso.
Tabla 2 Parámetros de laboratorio al ingreso y al egreso
| Participantes N = 407 | Medicados con Tofacitinib | No medicados con tofacitinib | p | |
|---|---|---|---|---|
| Características de pruebas de laboratorio al ingreso, mediana(RIC) | ||||
| WBC, K/µI | 7,20 (5,50-10,63) | 7,8 (5,9-10,65) | 7,17 (5,4-10,63) | 0,764 |
| SGOT, UI/L | 45 (29-90) | 229,5 (40-262) | 43 (27-70) | 0,029 |
| SGOT/SGPT | 1,15 (0,90-1,53) | 1,04 (0,82-1,14) | 1,19 (0,91-1,55) | 0,252 |
| PLT, K/µI | 206,50 (163,50-281,50) | 214 (162,7-263) | 205 (163,5-283) | 0,989 |
| PCR, mg/L | 64,15 (28-128) | 84,5 (46,25-168) | 59 (26-127) | 0,139 |
| NEU, % | 70 (59,5-80,9) | 75,7 (62,3-82,55) | 69,7 (59,5-80,8) | 0,494 |
| LYM, % | 15,95 (8,5-25,2) | 14,2 (10,4-23,6) | 16,45 (8,1-25,2) | 0,901 |
| HGB, g/dL | 13,8 (12,4-14,9) | 13,8 (13-14,6) | 13,8 (12-15,01) | 0,562 |
| Ferritina, µ g/L | 526 (252-925) | 680,5 (420-1.108) | 506 (235-924,5) | 0,359 |
| Dímero D, ng/ml | 599 (289-1.463) | 677 (541-948) | 560 (286-1.500) | 0,628 |
| Glucemia, mmol/L | 127 (105-192) | 147,5 (108,5-219) | 126 (104-192) | 0,402 |
| LDH, mg/dL | 298 (231-407) | 338 (288-407) | 292 (228-415) | 0,472 |
| Características de pruebas de laboratorio al egreso, mediana (RIC) | ||||
| WBC, K/µL | 9,90 (7,40-13,55) | 10,40 (9,50-11,80) | 9,7 (7,21-13,8) | 0,492 |
| SGOT, UI/L | 62 (35-123) | 186,5 (80-342) | 51 (34-110) | 0,014 |
| SGOT/SGPT | 0,77 (0,55-1,10) | 0,57 (0,55-0,75) | 0,82 (0,55-1,11) | 0,445 |
| PLT, K/µL | 272 (205-374) | 341 (224-425) | 271,5 (203,5-362) | 0,463 |
| PCR, mg/L | 2,60 (1,60-10,50) | 11 (1,3-14) | 2,5 (1,6-6,7) | 0,325 |
| NEU, % | 74,5 (52,90-85) | 74 (34,5-85,7) | 74,95 (53,2-84,9) | 0,949 |
| LYM, % | 11,3 (6,3-22) | 10,7 (4,9-36,3) | 11,5 (6,3-21,2) | 0,979 |
| HGB, g/dL | 13,45 (12-14,7) | 13,3 (12,5-13,75) | 13,5 (11,95-14,8) | 0,467 |
| Ferritina, µg/L | 652 (291-1.090) | 925 (504-2.245) | 643,5 (280-1.078) | 0,128 |
| Dímero D, ng/ml | 508 (233-1.386) | 1.032 (334,5-2.423,5) | 479 (231,41-1.076) | 0,324 |
| Glucemia, mmol/L | 124 (85-212) | 123 (85-220) | 202 (192-212) | 0,269 |
| LDH, mg/dL | 321,5 (262,5-450) | 373,5 (278-791,5) | 244 (223-278,5) | 0,493 |
| HGB: hemoglobina; LDH: lactato deshidrogenasa; LYM: linfocitos; NEU: neutrófilos; PCR: proteína C reactiva; PLT: plaquetas; RIC: rango intercuartílico; SGOT: aspartato aminotransferasa; SGOT/SGPT: relación SGOT y SGPT; SGPT: alanina aminotransferasa; WBC: glóbulos blancos. | Tabla creada por los autores. | |||
Dentro de los parámetros de laboratorio al egreso de estos pacientes, se evaluaron las diferencias entre el grupo de pacientes medicados con tofacitinib y el grupo no medicado con este fármaco. En este sentido, los niveles de WBC de los pacientes medicados con tofacitinib fueron mayores, con una media de 10,40 con relación al grupo no medicado con tofacitinib, el cual resultó con una mediana de 9,7. Se encontró una diferencia importante entre los valores de SGOT al ingreso (p = 0,029) y al egreso (p = 0,014) en los pacientes medicados con tofacitinib y el resto, siendo estos niveles mayores en las personas tratadas con este fármaco, con una mediana de 186,5, en relación con aquellas que no lo utilizaron, quienes presentaron una mediana de 51.
Asimismo, se identificaron menores niveles de SGOT/SGPT y glucemia en las personas medicadas con tofacitinib, en comparación con aquellas que no utilizaron este fármaco. Se registraron datos similares en cuanto a los valores de NEU, LYM y HGB, con niveles de mediana de 74, 10,7 y 13,3, respectivamente, para el grupo medicado con tofacitinib, y de 74,95, 11,5 y 13,5 para el grupo no medicado con tofacitinib.
Al realizar una regresión logística exploratoria sobre la mortalidad, los pacientes con complicaciones respiratorias tuvieron más tendencia a morir (OR = 3,56; IC 95% = 1,49-8,53; p = 0,004). Lo mismo pasa con aquellos ingresados en UCI (OR = 7,53; IC 95% = 2,86-19,81; p = 0,000). Sin embargo, el uso de tofacitinib no se vio relacionado con la muerte de los pacientes (OR = 0,54; p = 0,453) (fig. 1).
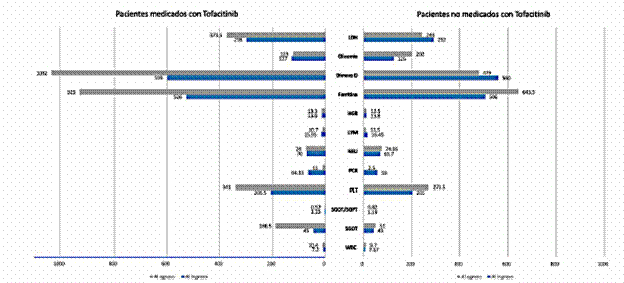
HGB: hemoglobina; LDH: lactato deshidrogenasa; LYM: linfocitos; NEU: neutrófilos; PCR: proteína C reactiva; PLT: plaquetas; SGOT: aspartato aminotransferasa; SGOT/SGPT: relación SGOT y SGPT; SGPT: alanina aminotransferasa; WBC: glóbulos blancos. Figura creada por los autores.
Figura 1 Pacientes medicados y no medicados con tofacitinib.
Discusión
Uno de los retos actuales de la comunidad científica es la búsqueda de terapias farmacológicas que detengan la progresión de la enfermedad provocada por la COVID-19 y sobre todo evitar la enfermedad severa. Varios autores han expuesto hallazgos prometedores en cuanto al uso de tofacitinib en estos pacientes, ya que este fármaco tiene como diana la inhibición de los receptores JAK, los cuales están relacionados con la tormenta de citocinas proinflamatorias6,7. El efecto subsecuente de esta acción farmacológica da como resultado una supresión de la cascada inflamatoria que desencadena el SARS-CoV-2 a nivel pulmonar y sistémico8.
Sin embargo, según nuestro conocimiento, es escasa la información sobre esta terapia en Latinoamérica y el Caribe. En este sentido, el presente estudio busca describir las características de los pacientes tratados con tofacitinib, y compararlas con las de aquellos que no han sido medicados con este.
Nuestros resultados muestran que el porcentaje de defunciones fue menor en los pacientes medicados con tofacitinib que en aquellos que no lo utilizaron. Sin embargo, este resultado no fue estadísticamente significativo, debido quizá a la falta de balance entre los grupos incluidos en nuestro estudio. Este hallazgo es semejante a lo descrito por Maslennikov et al., quienes afirman que el uso de este fármaco reduce las muertes en comparación con el tratamiento convencional9. De igual forma, concluyen que el uso de esta terapia farmacológica reduce el ingreso a UCI. No obstante, en nuestro estudio resultó lo contrario, relacionado justamente con la diferencia entre la cantidad de personas medicadas con tofacitinib en comparación con las que no han sido medicadas con este fármaco. Además, el criterio clínico de admisión a UCI puede variar entre las características de los pacientes y sus comorbilidades, conllevando variaciones en las decisiones de ingresar o no a UCI. A raíz de esto, se realizó una regresión logística en la que se pudo observar que el uso de tofacitinib no tiene relación con la evolución negativa de los pacientes, sino que aquellos tratados con tofacitinib se encontraban en peores condiciones a la hora de ser medicados.
Por otro lado, la necesidad de ventilación mecánica fue mayor en los pacientes que no fueron medicados con tofacitinib, lo que concuerda con los hallazgos del estudio arriba mencionado9, en el cual la terapia farmacológica con tofacitinib se relaciona con una menor frecuencia de ventilación mecánica. Sin embargo, nuestros resultados no fueron estadísticamente significativos, posiblemente por el desequilibrio de pacientes en cada grupo de terapia.
En cuanto a los efectos metabólicos del fármaco tofacitinib, destaca su neutralidad, la cual induce un estado catabólico y contribuye a la reducción de la glucemia10. Esta relación es sumamente importante para los pacientes con comorbilidades asociadas como la obesidad, lo que se evidenció en nuestro estudio, en el cual los pacientes que utilizaron este fármaco resultaron con niveles más bajos de glucemia a su egreso que aquellos que no lo usaron.
De igual manera, otros parámetros utilizados para evaluar la progresión de un paciente con COVID-19 son la ferritina y el dímero D, que hacen referencia al estado de hipercoagulabilidad y al estado inflamatorio del paciente10. Nuestros resultados concluyen que el uso de tofacitinib no beneficia al paciente en relación con estos parámetros, pues los niveles de ferritina y dímero D fueron mayores en los pacientes que consumieron este fármaco. Sin embargo, estos resultados pueden verse influidos por la falta de homogeneidad entre las características de cada grupo, ya que la población que se medicó con tofacitinib es considerablemente menor que aquella que no usó este medicamento.
Limitaciones
Entre los retos que enfrentamos en este estudio, se encuentra el desbalance entre la cantidad de participantes de cada grupo terapéutico y la falta de homogeneidad en cuanto a las características de la población de estudio. Asimismo, este estudio fue retrospectivo y no aleatorizado, lo cual podría relacionarse con un sesgo de selección. Adicionalmente, las comorbilidades de los pacientes no fueron tomadas en cuenta, lo que pudo haber influido en los resultados obtenidos. Además, los criterios de inclusión y exclusión fueron poco restrictivos. Todo esto afecta la validez interna.
Se recomienda realizar un estudio prospectivo, de tipo ensayo clínico multicéntrico, aleatorizado, doble ciego, para obtener mejores resultados en la región. De esta forma, es posible evaluar la eficacia en cuanto a la recuperación de los pacientes utilizando esta terapia farmacológica.
Conclusión
El tofacitinib es un fármaco esperanzador para tratar la COVID-19 y evitar sus complicaciones. Este estudio muestra que podría actuar de manera beneficiosa en relación con la mortalidad y la reducción del uso de ventilación mecánica, así como el ingreso a UCI. Además, puede favorecer la evolución de los pacientes con comorbilidades importantes como la obesidad. Sin embargo, nuestra investigación no es concluyente. Es necesario realizar nuevos estudios para confirmar la eficacia del tratamiento con tofacitinib para los pacientes con COVID-19.














