Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista MVZ Córdoba
versión impresa ISSN 0122-0268
Rev.MVZ Cordoba vol.18 supl.1 Córdoba dic. 2013
ORIGINAL
Identificación de un polimorfismo del gen Est9 relacionado con resistencia a piretroides en Rhipicephalus (Boophilus) microplus
Identification of a gene polymorphism Est9 associated with resistance to pyrethroids in Rhipicephalus (Boophilus) microplus
Edgar Diaz R,1* M.Sc., Gustavo Vallejo,2 Ph.D.
1Universidad del Tolima, Facultad de Medicina Veterinaria y Zootecnia, Laboratorio de Parasitología Veterinaria, Ibagué, Colombia.
2Universidad del Tolima, Facultad de Ciencias, Laboratorio de Investigaciones en Parasitología Tropical, Ibagué, Colombia.
*Correspondencia: ediazr@ut.edu.co
Recibido: Septiembre de 2012; Aceptado: Octubre de 2013.
RESUMEN
Objetivo. Mediante procedimientos de PCR-RFLP, detectar un polimorfismo en el gen Est9 de garrapatas Rhipicephalus (Boophilus) microplus resistentes a piretroides en Ibagué, Colombia, determinando el grado de asociación entre los fenotipos y los genotipos resultantes. Materiales y métodos. El ADN de 30 teleoginas R. (Boophilus) microplus fenotípicamente susceptibles, resistentes o medianamente resistentes a piretroides en una prueba de Drummond modificada, fue amplificado por PCR con cebadores específicos para obtener un fragmento de 372 pb del gen Est9, que fue sometido a digestión con la enzima EcoRI para estudiar los RFLPs generados y poder diferenciar los respectivos genotipos. El grado de asociación entre los fenotipos y los genotipos resultantes se determinó mediante la prueba exacta de Fisher. Resultados. Luego de digerir el fragmento con la endonucleasa, se generaron dos segmentos en teleoginas con algún nivel de resistencia, mientras en las teleoginas susceptibles no hubo división del fragmento de 372 pb, demostrándose así la presencia de una mutación puntual y los genotipos homocigoto natural, homocigoto mutante y heterocigoto. Las diferencias altamente significativas (p<0.01) entre teleoginas susceptibles y aquellas con algún nivel de resistencia, mostraron una relación directa entre el genotipo y el fenotipo con un nivel de confianza de p=0.0009852. Conclusiones. Se comprobó, por primera vez en Colombia, la presencia de una mutación puntual en el gen Est9 de garrapatas R. (Boophilus) microplus resistentes a piretroides, sugiriendo la necesidad de realizar estudios para detectar alteraciones moleculares en otros genes relacionados con quimioresistencia.
Palabras clave: Carboxilesterasa, garrapata, mutaciones, reacción de cadena de polimerasa, resistencia a acaricidas (Fuente: CAB).
ABSTRACT
Objective. Using PCR-RFLP procedures, to detect a polymorphism of the Est9 gene in Rhipicephalus (Boophilus) microplus ticks resistant to pyrethroids in Ibague, Colombia, determining the degree of association between phenotypes and resulting genotypes. Materials and methods. The DNA of 30 engorged R. (Boohilus) microplus phenotypically susceptible females, resistant or moderately resistant to pyrethroids in a modified Drummond test was amplified by PCR with specific primers. We obtained a 372 bp fragment of the Est9 gene which was digested with the EcoRI enzyme to study RFLPs generated in order to differentiate the respective genotypes. The degree of association between phenotypes and resulting genotypes was determined by Fisher’s exact test. Results. After digesting the fragment with the endonuclease, two segments were generated in engorged females with some level of resistance, while, in those susceptible, there was no fragment division. The presence of a mutation of 372 pb was demonstrated, as well as the natural homozygous genotypes, mutant homozygous and heterozygous. The highly significant differences (p<0.01) between engorged susceptible females and those with some level of resistance, revealed a direct relationship between genotype and phenotype with a confidence level of p = 0.0009852. Conclusions. For the first time in Colombia, the presence of a mutation in the Est9 gene of R. (B.) microplus tick resistant to pyrethroids was found, suggesting the need for studies to detect molecular alterations in other genes associated with chemical resistance.
Key words: Acaricide resistance, carboxylesterase, mutations, tick, polymerase chain reaction (Source: CAB).
INTRODUCCIÓN
En agroecosistemas tropicales del mundo, la garrapata común del ganado, Rhipicephalus (Boophilus) microplus (1) es considerada como el principal problema parasitario que afecta las explotaciones bovinas debido a su capacidad de transmitir microorganismos altamente patógenos como los protozoarios Babesia bigemina, causante de la piroplasmosis o ranilla roja, Babesia bovis y la rickettsia Anaplasma marginale, causante de la anaplasmosis o ranilla blanca, lo cual junto al frecuente desarrollo de resistencia a plaguicidas y a su alta capacidad reproductiva, afecta negativamente la rentabilidad de la producción ganadera (2-4).
Para controlar las altas poblaciones de R. (B.) microplus sobre los bovinos se emplean principalmente acaricidas formulados a base de compuestos organofosforados, piretroides, amidinas o carbamatos entre otros, aplicados a intervalos específicos mediante baños de aspersión sobre el cuerpo del animal (5,6). Sin embargo el uso inadecuado de esta estrategia, con altas frecuencias de aplicación, preparación de soluciones sub o sobre dosificadas, aplicación incorrecta a los animales o uso de mezclas inapropiadas de plaguicidas, ha llevado al desarrollo de cepas de campo resistentes al efecto de estos compuestos químicos, configurando un fenómeno presente y creciente a escala mundial (6,7).
Un estudio realizado por la Organización Mundial de Sanidad Animal, oficina adscrita a la FAO, revela como entre 151 países incluidos en el trabajo, el 50% presenta diagnóstico de quimioresistencia en garrapatas, con lo que la resistencia se convierte en uno de los mayores problemas debido a que la disponibilidad de nuevos antiparasitarios es cada vez más escasa (7,8). En Colombia, diversos autores reportan variados niveles de resistencia a organofosforados, piretroides y carbamatos, encontrando en el departamento del Tolima que el 30% de ganaderos incluidos en una encuesta sobre uso de antiparasitarios, manifestó problemas de baja efectividad de acaricidas para control de R. (B.) microplus (9).
Tratando de entender los mecanismos de resistencia y de configurar el mapa genético responsable de la situación en esta especie de garrapata, muchas investigaciones han apuntado a identificar cambios moleculares en genes relacionados con resistencia acaricida. De igual manera, se trabaja en la determinación de marcadores de ADN con los cuales se puedan desarrollar pruebas rápidas y precisas que detecten tempranamente la resistencia a través de las frecuencias alélicas y genotípicas de los genes comprometidos (3,10-14). De esta forma, estudios desarrollados en EEUU, Brasil y México han demostrado que el fenómeno puede originarse en esta garrapata a partir de mutaciones puntuales en genes codificantes de enzimas, las cuales se traducen en un aumento del metabolismo de degradación de acaricidas organofosforados y piretroides principalmente (3,6,15-17).
Es así como a través de técnicas moleculares de PCR-RFLP y secuenciamiento, se encontró que en el gen codificador de la carboxilesterasa Est9, metabolizante de piretroides y organofosforados en R. (B.) microplus, existen dos alelos que difieren entre sí por la sustitución de un nucleótido, guanina por adenina, en un punto específico de su ADN, configurando individuos con algún nivel de resistencia a los acaricidas cuando se presenta el alelo con adenina o individuos susceptibles cuando presentan el alelo con guanina (13, 18,19).
El objetivo principal de la presente investigación se enfocó en la detección de un polimorfismo en el gen Est9 de una carboxilesterasa de garrapatas R. (B.) microplus presentes en una explotación ganadera con historial de resistencia hacia piretroides en el municipio de Ibagué, mediante procedimientos de PCR (Reacción en cadena de la polimerasa) y RFLP (Polimorfismos en la longitud de fragmentos de restricción), determinando el grado de asociación entre los fenotipos y los genotipos resultantes.
MATERIALES Y MÉTODOS
Sitio y toma de muestras. Se emplearon teleoginas (hembras repletas de sangre) de R. (B.) microplus colectadas al azar de bovinos mestizos pertenecientes a una finca lechera con historial de resistencia a acaricidas, ubicada en el municipio de Ibagué, Tolima, a una altura de 1250 msnm, con temperatura promedio de 26°C y humedad relativa del 70%. Los productos químicos empleados en la finca para controlar las poblaciones de estos ácaros correspondían a organofosforados, piretroides y formamidinas, reportándose muy poca efectividad y una frecuencia en la aplicación de baños de aspersión de entre 10 y 15 días.
Los especímenes se colectaron en forma manual, desprendiéndolos cuidadosamente de la piel para evitar la separación de sus piezas bucales, colocándolos en un recipiente con trozos de papel absorbente en el fondo. Luego, fueron transportados al Laboratorio de Investigaciones en Parasitología Tropical de la Universidad del Tolima, Colombia.
Prueba biológica para detección de quimioresistencia. El mismo día de la captura, las teleoginas fueron sometidas a la prueba in vitro de inmersión de hembras repletas o prueba de Drummond modificada, para detección de resistencia (13,20). Se empleó un acaricida piretroide comercial bastante usado en la región, cipermetrina, en concentración de 150 g/L, diluyéndolo en 200 ml de agua destilada según la dosis recomendada por el fabricante para uso en campo, sumergiendo un grupo de las garrapatas durante tres minutos en la solución, empleando como control otro grupo de teleoginas que fueron sumergidas en agua destilada.
Posteriormente, las garrapatas se depositaron en una caja de petri, fijando cada individuo por el dorso con cinta doble faz, y se colocaron en una estufa de incubación a 27°C y 80% de humedad relativa, procediendo a observarlas diariamente para verificar el grado de oviposición o la muerte de la teleogina. Así, se formaron grupos de garrapatas sensibles (garrapatas que murieron las primeras 24 horas post-inmersión), resistentes (garrapatas con oviposición completa a los 14 días) y moderadamente resistentes (garrapatas que sobrevivieron pero no ovipositaron o con oviposición incompleta a los 14 días) (13). Al término de la prueba, a los especímenes se les practicó una incisión a lo largo del cuerpo a fin de lavar el exceso de sangre bovina con agua desionizada, depositando cada muestra en tubos Eppendorf con etanol al 70%, almacenando a -20°C hasta su procesamiento.
Obtención de ADN y selección de cebadores. El ADN se aisló siguiendo el protocolo descrito por Diaz (21), mediante el método de fenol-cloroformo-alcohol isoamílico (FCAI). Para amplificar un fragmento del gen Est9, se emplearon los cebadores descritos por Baffi et al (13), para el derecho 5’-AGC ATC GAC CTC TCG TCC AAC-3’ y para el izquierdo 5’-GTC GGC ATA CTT GTC TTC GAT G-3’, con los cuales se pudo reconocer el segmento de 372 pb.
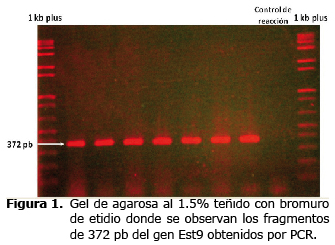
Reacción en cadena de la polimerasa (PCR). Las reacciones se procesaron en un termociclador PTC-100 usando una mezcla de 4 pmol de cada cebador, 200 µM de cada dNTP, 1.5 mM de MgCl2, 1 unidad de Taq DNA polimerasa, 1X de buffer PCR, 100 ng de ADN y agua ultrapura para un volumen final de 20 µl por reacción. Se incluyó además un control de reacción, consistente en una mezcla sin ADN. El perfil térmico consistió de una desnaturación previa a 95°C por 5 minutos, seguida de 38 ciclos con periodos de desnaturación a 95°C por 1 minuto, anillamiento a 60°C por 1 minuto y extensión a 72°C por 1 minuto, con una extensión final a 72°C por 5 min (13). La detección de los amplicones generados se hizo por electroforesis en gel de agarosa al 1.5%, durante una hora y media a 80 voltios en TBE 0.5X, tiñendo luego con bromuro de etídio.
Polimorfismos de longitud de fragmentos de restricción. El fragmento de 372 pb obtenido por el procedimiento de PCR, se sometió a corte con la enzima de restricción EcoRI, que tiene como sitio de reconocimiento la secuencia GAATTC. Para digerir la muestra, se adicionaron 10 µl del producto de PCR a una mezcla compuesta por buffer de reacción 1X, 5 unidades de la enzima EcoRI y agua desionizada suficiente para completar un volumen de 10 µl. La digestión se realizó durante tres horas a una temperatura de 37°C.
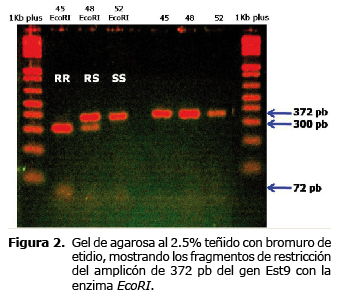
Los fragmentos resultantes, se visualizaron en geles de agarosa al 2.5%, corriendo la electroforesis durante una hora y cuarenta y cinco minutos en TBE 0.5X a 80 voltios, tiñendo con bromuro de etidio y visualizando con luz ultravioleta.
Análisis estadístico. En el análisis de los resultados obtenidos se utilizó la prueba exacta de Fischer para comparación de proporciones independientes, tomando como nivel de significancia para el análisis un error alfa inferior al 1% (p<0.01).
RESULTADOS
Bioensayo para detección de quimiorresistencia. Se sometieron a la prueba de inmersión en el acaricida piretroide (cipermetrina) 38 teleoginas, de las cuales ocho (21.1%) fueron resistentes, 27 (71%) fueron moderadamente resistentes y solamente tres (7.9%) fueron sensibles al acaricida, con lo que se determinó un nivel de resistencia hacia piretroides del 92.1% en la finca objeto de estudio.
Amplificación por PCR. Luego de los procedimientos de extracción, se aisló suficiente ADN de 31 muestras, verificando en ellas la amplificación del fragmento de 372 pb del gen Est9, como se observa en la figura 1.
Digestión para RFLP. La utilización de la enzima de restricción EcoRI permitió determinar polimorfismos de longitud en 30 de las muestras, identificando claramente los genotipos correspondientes a individuos susceptibles, donde no hubo división del fragmento de 372 pb y se observa solamente una banda luego de la electroforesis, correspondiendo a un genotipo homocigoto natural (SS); individuos resistentes, donde se formaron dos fragmentos, uno de 300 pb y otro de 72 pb, indicando la presencia de una mutación que permite a la enzima reconocer un sitio para su corte formando dos bandas como resultado de la electroforesis, correspondiendo a un genotipo homocigoto mutante (RR); e individuos moderadamente resistentes, donde se forman tres bandas de 372, 300 y 72 pb, debido a la presencia de los dos alelos del gen, uno correspondiente al genotipo natural que no es digerido por la enzima y otro al genotipo mutante que genera dos fragmentos luego de la digestión con la enzima EcoRI, configurando el genotipo heterocigoto (RS), como se muestra en la figura 2.
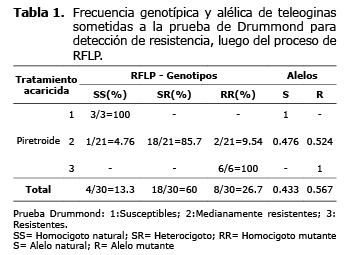
De acuerdo con los resultados obtenidos en la prueba de RFLP, se calcularon las frecuencias genotípicas y alélicas para los 30 individuos tratados con el acaricida piretroide que fueron analizados por esta técnica (Tabla 1). El genotipo homocigoto natural (SS) presenta alta frecuencia dentro de las teleoginas susceptibles y muy baja en las teleoginas medianamente resistentes. El genotipo heterocigoto (SR) es el de mayor frecuencia en individuos medianamente resistentes, mientras que el genotipo homocigoto mutante (RR) se encontró en todas las garrapatas resistentes; en las teleoginas medianamente resistentes su frecuencia es superior a la observada en el genotipo susceptible.
La alta tasa del alelo natural (S) que se encontró en los individuos susceptibles (100%) y la alta tasa del alelo mutante (R) encontrada en las garrapatas resistentes (100%), indican una posible asociación entre el alelo mutante y el fenotipo de resistencia. La información analizada mostró un desequilibrio en las frecuencias genotípicas y alélicas, denotando una selección de los individuos que portan el alelo mutante (R), conduciendo al aumento de la población de garrapatas resistentes y moderadamente resistentes al compuesto piretroide (cipermetrina).
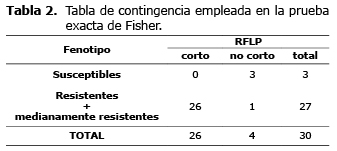
Al analizar la asociación entre fenotipo y genotipo, se observa como de 27 muestras pertenecientes a teleoginas con algún nivel de resistencia solo una no fue digerida por la endonucleasa, en tanto que las tres muestras de individuos susceptibles correspondieron a lo esperado al no ser digeridas por la enzima, mostrando diferencias altamente significativas (p<0.01) entre individuos con algún nivel de resistencia y susceptibles, así como una relación directa entre el genotipo y el fenotipo con un nivel de confianza de p=0.0009852 mediante la prueba exacta de Fisher (Tabla 2).
DISCUSIÓN
La presente investigación, utilizando las herramientas moleculares de PCR y RFLP, informa por primera vez en Colombia acerca de la presencia de un polimorfismo en el gen Est9 codificante de una carboxilesterasa en la garrapata Rhipicephalus (B.) microplus y sus alelos relacionados con resistencia a piretroides en individuos colectados en campo.
La identificación del gen Est9 a través de PCR fue posible en el 81.6% de las muestras procesadas para extracción de ADN. El fracaso en la amplificación de las muestras restantes podría deberse a inhibidores de la polimerasa que no se removieron durante la extracción con fenol-cloroformo o a la baja concentración de ADN obtenida. Al respecto, diversos autores mencionan que las garrapatas poseen un exoesqueleto quitinoso, bastante duro, que debe ser roto apropiadamente antes de la extracción, asimismo que el ADN extraído es altamente susceptible de degradación por razones aun no establecidas y que estos ácaros posiblemente presentan inhibidores de la Taq-polimerasa, como ciertos polisacáridos co-purificados con el ADN, que disminuyen la eficiencia y sensibilidad del proceso de amplificación (22-24).
La técnica de PCR reveló la presencia de un fragmento de ADN de 372 pb, similar al obtenido en cepas de R. (B.) microplus mexicanas, texanas y brasileras (13,19,25), asimilado en dichos trabajos a una esterasa altamente conservada en esta especie de garrapatas, así como al grupo de las acetilcolinesterasas y que fue identificado como perteneciente al gen Est9 codificador de una carboxilesterasa en R. microplus (18).
El análisis de los RFLP del fragmento digerido con EcoRI, reveló unos patrones de bandeo para cada genotipo similares a los mostrados por Baffi et al (13) en trabajos con poblaciones de garrapatas en Brasil, siendo claramente diferenciables los genotipos natural, mutante y heterocigoto a través del número de bandas generadas en la digestión con la enzima. Mediante esta técnica, en el presente estudio se encontró una asociación altamente significativa entre el genotipo natural y el fenotipo susceptible, con 100% de los individuos susceptibles a piretroides presentando el genotipo SS (susceptible), lo mismo que en los individuos resistentes al acaricida, donde el 100% presentó el genotipo RR (mutante). Con relación a los individuos medianamente resistentes también hubo asociación altamente significativa, observando que el 85.7% presentó el genotipo SR (heterocigoto). Baffi et al (13) y Hernández et al (19) encontraron también, usando la técnica de RFLP, asociaciones significativas entre el genotipo y el fenotipo en cepas brasileras y mexicanas respectivamente.
De igual manera, de acuerdo con los resultados mostrados en la tabla 1, el bajo porcentaje (13.3%) de individuos portadores del genotipo natural (SS) de resistencia a acaricidas piretroides y el alto porcentaje (86.7%) de individuos portadores del genotipo asociado con resistencia en garrapatas resistentes y moderadamente resistentes, es un indicativo del intenso proceso de selección que se está dando en la población de R. (B.) microplus de la finca estudiada, hacia garrapatas portadoras del alelo mutante (R) relacionado con resistencia a piretroides mediante un mecanismo de detoxificación enzimática aumentada por esterasas.
Los resultados permiten concluir que en poblaciones de la garrapata R. (B.) microplus en Ibagué y seguramente en el resto de Colombia, se dan procesos de selección hacia individuos portadores del alelo mutante del gen Est9, lo que contribuye a generar resistencia hacia acaricidas piretroides. Sin embargo, dada la presencia de alteraciones moleculares en otros genes relacionados con el fenómeno de quimiorresistencia, es necesario continuar con su evaluación para tener una visión más cercana de la extensión del problema y poder establecer programas de control que respondan a la situación presente.
Agradecimientos
Al Comité Central de Investigaciones de la Universidad del Tolima por financiar la presente investigación. Al Dr. Julio Cesar Carranza Martínez, investigador del LIPT, por sus aportes al diseño del estudio.
REFERENCIAS
1. Murrell A, Barker S. Synonymy of Boophilus Curtice, 1891 with Rhipicephalus Koch, 1844 (Acari: Ixodidae). Syst Parasitol 2003; 56(3):169-172. [ Links ]
2. Wang M, Guerrero F, Pertea G, Nene V. Global comparative analysis of EST's from the southern cattle tick, Rhipicephalus (Boophilus) microplus. BMC Genomics 2007; 8:368. [ Links ]
3. Chevillon CH, Basile B, Barré N, Durand P, Aranthau C, Meeus T. Direct and indirect inferences on parasite mating and gene transmission patterns Pangamy in the cattle tick Rhipicephalus microplus. Infect Genet Evol 2007; 7:298-304. [ Links ]
4. Foil L, Coleman P, Eisler M, Fragoso H, García Z, Guerrero F et al. Factors that influence the prevalence of acaricide resistance and tick-borne diseases. Vet Parasitol 2004; 125:163-181. [ Links ]
5. Peter R, Van den Bossche P, Penzhorn B, Sharp B. Tick, fly and mosquito control - lessons from the past, solutions for the future. Vet Parasitol 2005; 132:205-215. [ Links ]
6. CONACYT - SAGARPA. Resistencia de la garrapata Boophilus microplus a los ixodicidas en el sureste de México. Folleto técnico No. 1. Mérida, México: Conacyt; 2005. [ Links ]
7. Nari A. Towards sustainable parasite control practices in livestock production with emphasis in Latin America. Vet Parasitol 2011; 180:2-11. [ Links ]
8. FAO. Guidelines resistance management and integrated parasite control in ruminants. Roma: FAO; 2004. URL disponible en: ftp://ftp.fao.org/docrep/fao/010/ag014e/ag014e00.pdf [ Links ]
9. Diaz E, Benavides E, Parra M, Arcos J, Riveros E, Jaramillo F et al. Investigación epidemiológica de las principales limitantes parasitarias en explotaciones ganaderas del Tolima, Huila y sur occidente de Cundinamarca. Informe final de proyecto. Ibagué: CORPOICA - PRONATTA; 2000. [ Links ]
10. Rodriguez R, Hodgkinson J, Rosado J, Villegas S, Trees A. The prevalence of pyrethroid resistance phenotype and genotype in Rhipicephalus (Boophilus) microplus in Yucatan, Mexico. Vet Parasitol 2012; 184:221-229. [ Links ]
11. Baffi M, Donizete C, Lino G, Boneti A, Ceron C, Gourlart L. Esterase profile in a pyrethroid-resistant Brazilian strain of the cattle tick Boophilus microplus. Int J Genet Mol Biol 2005; 28(4):749-753. [ Links ]
12. Jabbar A, Iqbal Z, Muhammad G, Nisar M, Zahid R, Sandhu Z et al. The interplay of molecular biology and veterinary parasitology: A need of the time. Int J Agric Biol 2005; 7(5):845-852. [ Links ]
13. Baffi M, Rocha G, Ueira C, Soares C, Ricardo L. Bonetti A. Identification of point mutations in a putative carboxylesterase and their association with acaricide resistance in Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Vet Parasitol 2007; 148:301-309. [ Links ]
14. Chen A, He H, Davey R. Mutations in a putative octopamine receptor gene in amitraz-resistant cattle ticks. Vet Parasitol 2007; 148:379-383. [ Links ]
15. Rodriguez R, Trees A, Rosado J, Villegas S, Hodgkinson J. Evolution of acaricide resistance: Phenotypic and genotypic changes in field populations of Rhipicephalus (B.) microplus in response to pyrethroid selection pressure. Int J Parasitol 2011; 41:895-903. [ Links ]
16. Dominguez D, Rosario R, Almazan C, Saltijeral J, De la Fuente J. Boophilus microplus: Biological and molecular aspects of acaricide resistance and their impact on animal health. Trop Subtrop Agroecosyt 2010; 12:181-192. [ Links ]
17. Baffi M, Rocha G, Ueira C, Soares C, Ceron C, Bonetti A. Esterase enzymes involved in pyrethroid and organophospate resistance in a Brazilian population of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Mol Biochem Parasitol 2008; 160:70-73. [ Links ]
18. Guerrero F, Nene V. Gene structure and expresión of a pyrethroid-metabolizing esterase, CzEst9, from a pyrethroid resistant Mexican population of Rhipicephalus (Boophilus) microplus. J Med Entomol 2008; 45(4):677-685. [ Links ]
19. Hernandez R, Guerrero F, George J, Wagner G. Allele frequency and gene expression of a putative carboxylesterase-encoding gene in a pyrethroid resistant strain of the tick Boophilus microplus. Insect Biochem Mol Biol 2002; 32:1009-1016. [ Links ]
20. FAO. Curso - Taller sobre diagnóstico de resistencia a ixodicidas en garrapatas Boophilus microplus. Jiutepec, México: Inifap; 2000. [ Links ]
21. Diaz E. Estudio molecular del gen de una carboxilesterasa relacionada con quimiorresistencia en la garrapata Rhipicephalus (Boophilus) microplus. [Tesis de Maestría]. Ibagué, Colombia: Universidad del Tolima, Facultad de Ciencias; 2012. [ Links ]
22. Halos L, Jamal T, Vial L, Maillars R, Suau A, Le Menach A et al. Determination of an efficient and reliable method for DNA extraction from ticks. Vet Res 2004; 35:709-713. [ Links ]
23. Hunt P. Molecular diagnosis of infections and resistance in veterinary and human parasites. Vet Parasitol 2011; 180:12-46. [ Links ]
24. Rodríguez I, Gern L, Rais O, Fuentes O, González R, Fernández C. Detección molecular de patógenos emergentes de importancia médica y veterinaria en garrapatas capturadas sobre caballos domésticos. Rev Cubana Med Trop 2009; 61(1):57-62. [ Links ]
25. Chen A, He H, Temeyer K, Jones S, Green P, Barker S. A survey of Rhipicephalus microplus populations for mutations associated with pyrethroid resistance. J Econ Entomol 2009; 102(1):373-380. [ Links ]