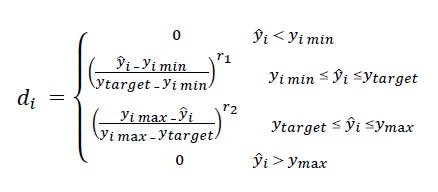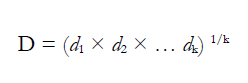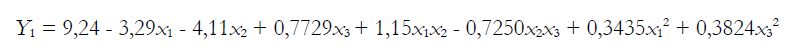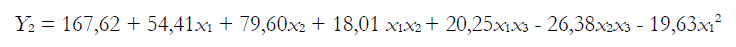Introducción
Las películas comestibles son materiales similares al plástico pero de naturaleza biodegradable y se obtienen de diversas fuentes poliméricas como proteínas, polisacáridos, gomas, ceras, etc. La utilización de materiales formadores de película a partir de fuentes de proteínas se ha informado a través de numerosos estudios (Chiou et al., 2009; Fan et al., 2020; Hoque et al., 2011; Ma et al., 2019; Zhang et al., 2020). Estos materiales generalmente tienen una menor resistencia a la tracción que los plásticos comunes, mientras que su elongación al corte varía ampliamente (Fan et al., 2020; Hoque et al., 2010; Krochta, 2002). Además, estas películas son endebles y rígidas debido a las extensas interacciones entre polímeros, por lo que es necesario agregar agentes plastificantes. Por ello, las características de estos materiales dependen de su formulación y de los parámetros de obtención como la temperatura de proceso, la concentración del plastificante y la temperatura de secado, tal como se ha demostrado en diversos estudios (Chiou et al., 2009; Hoque et al., 2010, 2011).
El agente plastificante, glicerol, forma enlaces de hidrógeno mediante sus grupos hidroxilo con los biopolímeros (Han, 2014), mejorando con ello su flexibilidad (Krochta, 2002) y modificando las propiedades mecánicas de las películas obtenidas. Muchos de estos agentes son de naturaleza hidrófila e higroscópica, por ello también influyen en la resistencia de las películas a la permeación de vapores y gases como el oxígeno. La permeabilidad al vapor de agua de la mayoría de las películas comestibles es generalmente mayor que la del plástico común, debido a su carácter hidrófilo, a excepción de las películas a base de lípidos (Han, 2014), mientras que la permeabilidad al oxígeno es menor.
La incorporación de extractos naturales a las películas comestibles sirve para otorgar propiedades bioactivas por sus efectos antioxidantes y antimicrobianos (Han, 2005). Uno de los extractos que exhibe una alta capacidad antioxidante y antimicrobiana es el orégano (Hajivand et al., 2020; Wu et al., 2014). La aplicación de estos materiales en la industria alimentaria se centra en su uso como empaque alternativo a las bolsas de plástico en productos secos, tal como lo han reportado Liu et al. (2020), quienes obtuvieron películas comestibles termosellables a base de una mezcla de soya y gelatina para envasar polvo de café instantáneo y de coco. Por otro lado, Ma et al. (2019) elaboraron películas a base de proteína de soya y extracto de corteza de Phellodendri para envasar sebo de res.
El mahi-mahi (Coryphaena hippurus) es una especie de pez marino que se distribuye en las aguas tropicales y subtropicales de los océanos Atlántico, Índico y Pacífico. Hay muchos estudios sobre la obtención de películas comestibles a partir de gelatina de bovino y porcino y de pieles de peces de aguas frías y cálidas. Estos últimos tienen una fuerza de gel mayor que las especies de aguas frías y, por ende, mayor estabilidad, aunque la piel del mahi-mahi es muy resistente y alcanza grandes tamaños, así, su gelatina obtenida bajo condiciones óptimas presentó un alto valor de fuerza gel de 386 g y también un alto rendimiento.
La utilización de la gelatina de la piel del mahi-mahi junto con el extracto de orégano para la elaboración de películas comestibles aún no se ha estudiado, por ello, el objetivo de este estudio fue evaluar las condiciones óptimas del proceso de obtención de la película comestible elaborada a partir de esta gelatina, utilizando la metodología de superficie de respuesta (MSR) con incorporación de cuatro concentraciones de extracto de orégano para la evaluación de sus propiedades mecánicas, fisicoquímicas, antioxidantes y de barrera, con la finalidad de mejorar la funcionalidad de las películas obtenidas para su potencial aplicación en la industria alimentaria.
Materiales y métodos
Materiales
Las películas comestibles se elaboraron a partir de gelatina de piel de mahi-mahi (Coryphaena hippurus) con 386 g. Las pieles se trataron con ácido cítrico de 0,025 M durante 60-70 min con agitación constante a una temperatura de ~8 ± 1 °C en una relación piel/solución de 1:5 (p/v). Posteriormente, se enjuagaron con agua hasta alcanzar un pH cercano a la neutralidad. La extracción de gelatina se realizó con una relación piel/solución de 1:3 (p/v) y con una temperatura de extracción (X1) de 56,8 °C, tiempo de extracción (X2) de 331 min y concentración de ácido cítrico (X3) de 0,26 % (datos no publicados). El extracto etanólico de orégano, variedad “zambito” (Origanum vulgare ssp. vulgare) se obtuvo por maceración pasiva. Las hojas se lavaron con abundante agua e hipoclorito de sodio y posteriormente fueron secadas a 20 °C durante 40 h. Luego se molieron hasta obtener un polvo de 0,25 mm que se mezcló con etanol al 85 % (1/10 p/v) y se agitó a 70 rpm durante 16 h en oscuridad y posteriormente se centrifugó (Termo Electrón Corporation. Iec Centra CL2) a 3000 rpm durante 15 min. El sobrenadante se separó y el precipitado se mezcló nuevamente con etanol al 85 % para una segunda extracción. Ambos sobrenadantes se mezclaron y filtraron (papel Whatman n.° 1) y el extracto se concentró por evaporación al vacío y se almacenó en refrigeración y oscuridad.
Elaboración de la película comestible de origen marino
Las películas comestibles de gelatina de piel de mahi-mahi (PGPM) se prepararon siguiendo la metodología de Gómez-Estaca et al. (2009) con algunas modificaciones. Las soluciones formadoras de película (SFP) se prepararon a partir de gelatina en polvo a una concentración de 4,0 % (p/v), donde la gelatina se disolvió en agua destilada a 60 °C mediante agitación mecánica en un baño de agua (WNB29, Memmert, Schwabach, Alemania) y la solución se calentó a una temperatura de proceso (X1) de 40,0-70,0 °C. Posteriormente, se añadió el plastificante glicerol (X2) a una concentración de 0,1098-0,1602 g de glicerol /g de gelatina con agitación constante a 400 rpm (RT 10, IKA, Staufen, Alemania) durante 20 min. Las SFP se colocaron en placas de Petri (Venticell 222, MMM Group, Planegg, Munich, Alemania) a temperaturas de secado (X3) de 36,6-53,4 °C durante 20 h y, luego, las películas se acondicionaron en un recipiente con HR controlada del 58 % durante 48 h. Con los parámetros de optimización se prepararon formulaciones a las cuales se les incorporó 2,5 %, 5,0 %, 7,5 % y 10,0 % (v/v) de extracto de orégano (EO).
Diseño experimental y análisis estadístico
Las variables independientes fueron: temperatura de proceso (X1), concentración de glicerol (X2) y temperatura de secado (X3), y su influencia sobre las variables de respuesta fueron: resistencia a la tracción (Y1) y elongación al corte (Y2), las cuales se evaluaron mediante la metodología de superficie de respuesta (MSR) a través de un diseño compuesto central de 20 tratamientos: 23 puntos factoriales, 6 puntos axiales y 6 puntos centrales. La optimización simultánea se realizó utilizando el método de deseabilidad (Derringer & Suich, 1980), el cual consiste en la transformación de cada respuesta yi en una deseabilidad individual según la ecuación 1, donde si una respuesta es del tipo “el objetivo es el mejor”, entonces su función de deseabilidad individual es:
Donde los valores 𝑦𝑖 𝑚𝑖𝑛 y 𝑦𝑖 𝑚a𝑥 son los valores mínimos y máximos aceptables de 𝑦̂𝑖 (cada respuesta), respectivamente, mientras que r1 y r2 son los exponentes que por omisión toman el valor de 1. Los valores de divarían en el intervalo de 0 ≤ di ≤ 1 y k indica el número de respuestas. La deseabilidad global (D) es definida como:
Los datos experimentales fueron analizados por el software Design Expert® (versión 12.0, StatEase Inc., Minneapolis, Estados Unidos).
Caracterización de la película
Espesor
El espesor de cada tira de película se midió utilizando un micrómetro digital (Mitutoyo serie 700, modelo MFG Co. Ltd., Kawasaki, Japón) con una precisión de 0,01 mm.
Propiedades mecánicas
Las películas se cortaron en tiras rectangulares de 20 mm × 70 mm. La separación inicial de agarre y la velocidad de la cruceta mecánica se establecieron en 20 mm y 1 mm/s, respectivamente, para cuantificar su resistencia a la tracción (RT) y la elongación al corte (EAC), utilizando un analizador de textura (Brookfield Engineering Laboratories Inc. Middleboro, Estados Unidos) operado según el método D882-97 (ASTM, 2001) según lo reportado por Wu et al. (2014), con ligeras modificaciones.
Color
Las películas se cortaron en discos de 2 cm de diámetro colocados en la celda del colorímetro (Nippon Denshoku ZE 2000, Osaka, Japón), registrándose los valores de L*, a* y b*.
Solubilidad
La solubilidad se determinó siguiendo la metodología de Wu et al. (2014) con una ligera modificación.
Polifenoles
Los polifenoles sacados del extracto de orégano y de las películas comestibles se determinaron utilizando el reactivo de Folin-Ciocalteau (Singleton et al., 1999), con ligeras modificaciones y las lecturas se realizaron utilizando ácido gálico como estándar de 750 nm (Lambda 950 UV/Vis, PerkinElmer Inc., Waltham, Estados Unidos).
Actividad antioxidante
La actividad antioxidante de las películas se determinó por su capacidad reductora de iones férricos (ensayo FRAP) y su capacidad de captación de radicales (ensayo ABTS) (Gómez-Estaca et al., 2009). La capacidad de barrido del radical superóxido en medio lipofílico (ACL) se realizó según lo descrito por Salgado et al. (2012).
Permeabilidad al vapor de agua
La permeabilidad al vapor de agua se midió usando un sistema de prueba Permatran-W 3/33 (Modern Control Inc., Minneapolis, Estados Unidos) acoplado con un sensor infrarrojo modulado a 38 °C y 90 % de HR de acuerdo con el método ASTM F-1249 (ASTM, 2013).
Permeabilidad al oxígeno
La permeabilidad al oxígeno se midió utilizando un sistema modular Ox-Tran 2/20 (Modern Control Inc., Minneapolis, Estados Unidos) de acuerdo con la norma ASTM D-3985 (ASTM, 1995), exponiendo la película a un flujo de N2/H2 (98 %/ 2%) por un lado y un flujo de O2 (100 %) por el otro. La película se dejó equilibrar durante 10 h antes del registro.
Permeabilidad al aceite
La permeabilidad al aceite se determinó mediante un método gravimétrico descrito por Wang et al. (2007) con ligeras modificaciones. Se cortó un disco de película, se pesó, se colocó en un papel de filtro individual y se agregaron 25 gotas de aceite vegetal de manera uniforme. El aceite y la película de prueba se quitaron del papel de filtro y el papel de filtro se volvió a pesar. La permeabilidad al aceite se expresó como el peso ganado del papel de filtro.
Resultados y discusión
Análisis de varianza
La significancia de la ecuación del modelo polinomial cuadrático se evaluó mediante el análisis de varianza (tabla 3). Ambos modelos fueron significativos con una “falta de ajuste” no significativa para ambas respuestas y todos los coeficientes lineales fueron significativos (p < 0,05) en ambos modelos, con excepción del término x3 para Y2 (elongación al corte). Además, todos los coeficientes de interacción fueron significativos con excepción de los términos x1x3 para Y1 (resistencia a la tracción) y los términos cuadráticos x2 para ambos modelos y el término x3 para Y2 (elongación al corte) no fueron significativos. Así, las ecuaciones del modelo de superficie de respuesta ajustado son:
Gráficos de superficie de respuesta
La temperatura del proceso, la concentración de glicerol y la temperatura de secado son algunos de los factores que influyen sobre la resistencia a la tracción (RT) y la elongación al corte (EAC) de una película comestible. Los efectos de estas variables independientes sobre RT (Y1) se muestran en las figuras 1a y 1b. Cuando la temperatura del proceso y el contenido de glicerol aumentaron de 40 a 70 °C y de 0,109 a 0,160 g de glicerol/ g de gelatina, respectivamente, la RT disminuyó y el aumento de la temperatura del proceso causó la degradación de las proteínas con la consecuente generación de cadenas más cortas de gelatina.
Tabla 2. Diseño compuesto central para optimizar la obtención de películas comestibles de piel de mahi-mahi en unidades codificadas junto con datos experimentales, según los modelos de superficie de respuesta de segundo orden
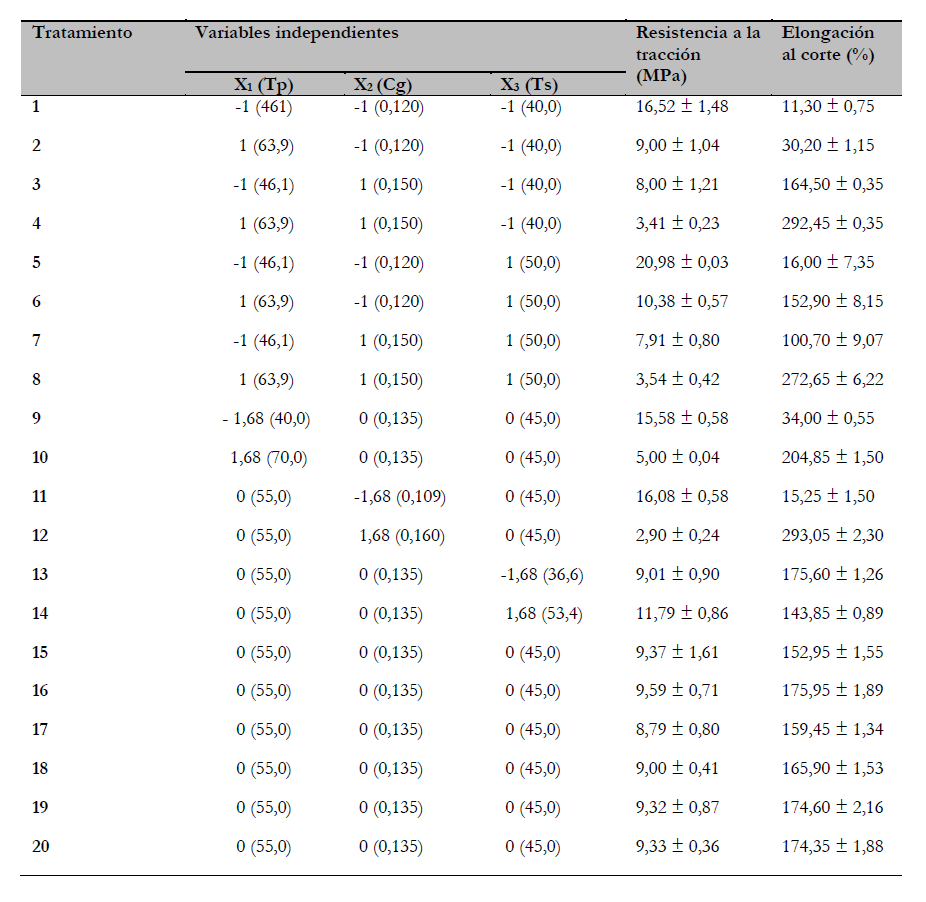
Fuente: Elaboración propia
Los valores de R2 para Y1 y Y2 fueron 0,9941 y 0,9822, respectivamente, lo que indica que los modelos fueron adecuados para representar las relaciones reales entre los parámetros estudiados. Ambos modelos fueron altamente significativos (p < 0,05) a un nivel de probabilidad del 95 %.
Tabla 3. Análisis de varianza (Anova) para el modelo de superficie de respuesta de segundo orden de resistencia a la tracción y elongación al corte
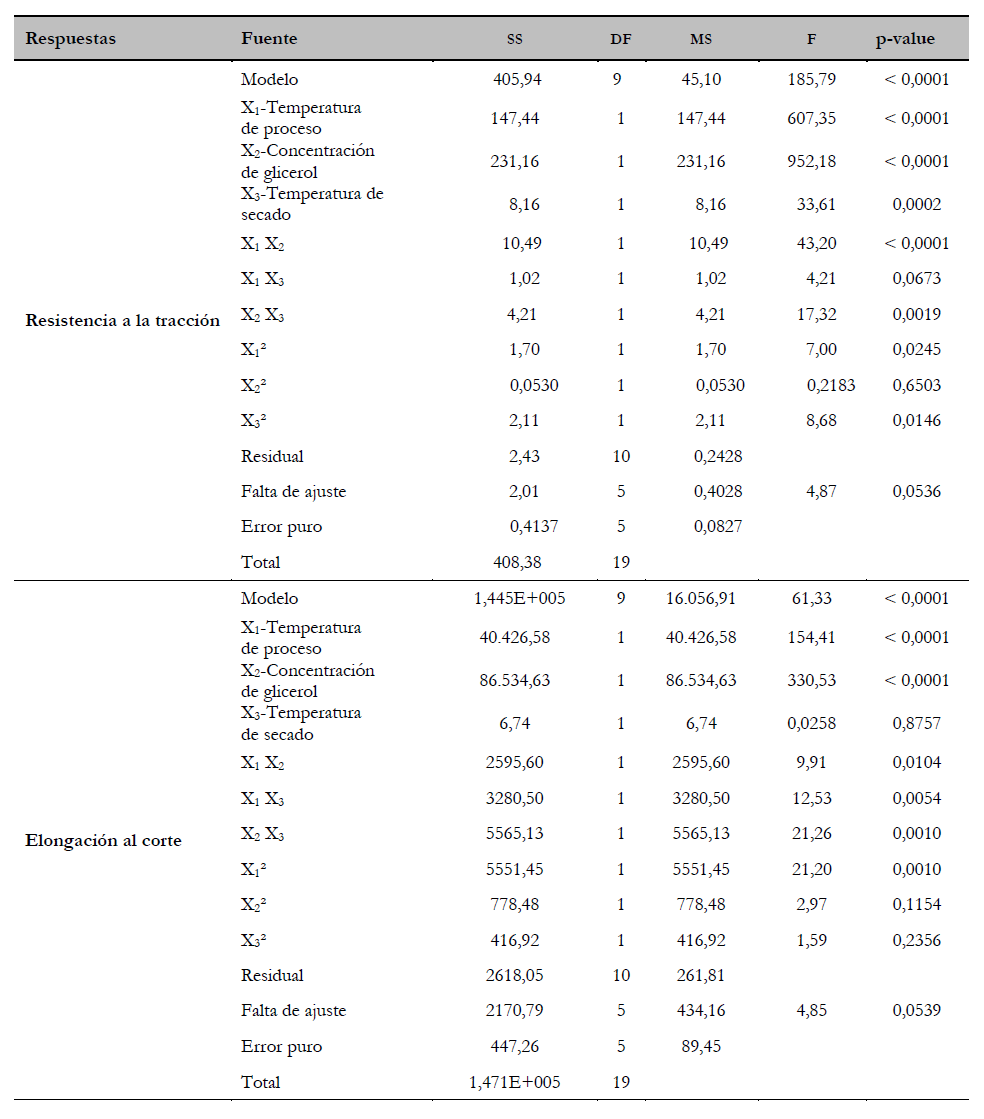
Fuente: Elaboración propia
Según Hoque et al. (2010), se generan interacciones cadena-cadena más débiles y un aumento de extremos de cadena, lo cual aumenta su movilidad molecular. Estos autores reportaron que un aumento de temperatura de proceso de 70-90 °C provocó la disminución de RT de 4,9 a 5,0 MPa en películas de gelatina de piel de calamar. El uso de gelatina de otras especies como tilapia, cerdo y mamíferos en concentraciones similares en películas, mostraron valores de RT más bajos (3,42-4,46 MPa) (Nur Hanani et al., 2012), pero también se han reportado valores de RT más altos en películas de gelatina de especies de aguas frías (43,5-50,4 MPa) (Chiou et al., 2009). La disminución de RT con respecto a un aumento de glicerol se debe a una reducción en las interacciones proteína-proteína, debido a que las moléculas de glicerol entran en contacto directo con los grupos funcionales de gelatina a través de enlaces de hidrógeno (Cuq et al., 1997), lo que provoca una disminución en la temperatura de transición vítrea de las proteínas, resultando en una mayor flexibilidad de la película (Limpisophon et al., 2009). Además, el aumento de glicerol en la SFP favorece la absorción del contenido de humedad, esto contribuye a la reducción de las fuerzas entre las macromoléculas adyacentes que conducen a valores de RT más bajos (Sobral et al., 2001).
Un ligero aumento de glicerol (0,109-0,160) provocó una disminución de 16,08-2,90 MPa en la RT de las películas (tabla 2) y, de manera similar, Thomazine et al. (2005) informaron que un aumento de glicerol de 0,25-0,55 g de plastificante/g de gelatina en películas con 2 % de gelatina provocó una reducción de RT de 21,14 a 7,21 MPa.
El efecto de la variación conjunta de la concentración de proteína y el plastificante sobre la RT y la EAC fue estudiado por Fan et al. (2020), quienes informaron que un aumento en la concentración de gelatina y una disminución en el contenido de glicerol causaron el aumento de RT y la disminución de EAC de las películas obtenidas, por lo que el aumento de la temperatura de secado provocó un aumento de RT de las películas debido a una menor distribución de agua en la película. La relación entre la temperatura de secado y la temperatura de gelificación de la proteína influye en los valores de RT de las películas (Chiou et al., 2009), debido al cambio en el estado conformacional de las moléculas de gelatina. Chiou et al. (2009) reportaron valores de RT más altos en las películas que fueron secadas a temperaturas más altas que la de gelificación de la gelatina de piel de salmón y abadejo de Alaska. Tanto el salmón como el abadejo de Alaska son especies de aguas frías, mientras que el mahi-mahi es de aguas cálidas y requiere de temperaturas de gelificación más altas que las especies de aguas frías. Varios autores han informado la relación inversa entre RT y EAC en películas de piel de pescado (Hoque et al., 2010; Limpisophon et al., 2009; Nur-Hanani et al., 2012). Los efectos de las variables independientes sobre la elongación al corte se muestran en las figuras 1c y 1d. Cuando la temperatura del proceso y el contenido de glicerol aumentaron de 40-70 °C y de 0,109-0,160 g de glicerol/g de gelatina, respectivamente, la EAC aumentó.
La formación de una red de película con menor rigidez se debe a la degradación de las moléculas de gelatina que reflejan la escasa interacción dentro de la molécula (Hoque et al., 2010), donde un pequeño rango de variación en la concentración de glicerol provocó grandes variaciones de EAC (11,30-292,45 %). Limpisophon et al. (2009) reportaron similares resultados en películas elaboradas con 2 % de gelatina de piel de tiburón, donde el aumento de 0-0,5 % de glicerol causó un incremento de 1,57-80,40 % de EAC.
Optimización de múltiples respuestas
La optimización de respuestas múltiples se realizó siguiendo la función de deseabilidad con las condiciones target u objetivo, definidas según la ecuación 1: resistencia a la tracción = 8,50 MPa, elongación al corte = 200,00 %.
Las soluciones de optimización fueron: temperatura de proceso X1 = 60,3 °C, concentración de glicerol X2 = 0,134 g de glicerol/g gelatina y temperatura de secado X3 = 50,0 °C y los valores experimentales fueron 8,64 ± 0,424 MPa de RT y 198,60 ± 2,40 % de EAC con una deseabilidad de 0,991.
Extracto de orégano
El contenido de polifenoles extraíbles en el EO fue de 86,6 ± 3,261 mg, equivalentes de ácido gálico/ml, estos compuestos contribuyen significativamente a su capacidad antioxidante (Cai et al., 2004). Se han reportado cantidades variables en el contenido de polifenoles del EO, el cual difiere según el tipo de extracción.
Gómez-Estaca et al. (2009) reportaron alrededor de 2000 µg de ácido cafeico/ml en extracto acuoso, Amarowicz et al. (2009) y Teixeira et al. (2013) reportaron 13,5 mg de ácido gálico/g de muestra y 288 mg de ácido sinápico/g de extracto, en extractos etanólicos de orégano, respectivamente. La capacidad antioxidante del EO, medida por el ensayo FRAP, fue de 1251,8 ± 8,925 mM equivalentes de extracto de FeSO4.7H2O/ml medido a los 30 min, la capacidad de captación de radicales medida por el método ABTS fue de 53,8 ± 2,067 mg, equivalentes de ácido ascórbico/ml de extracto y la capacidad antioxidante en medio lipófilo medida por el ensayo de ACL fue de 2762,0 ± 1,33 µg, equivalentes de trolox/µl de extracto. Gómez-Estaca et al. (2009) reportaron 92,9 equivalente mM de FeSO4.7H2O y 1,048 equivalentes de ácido ascórbico/ml de extracto en extracto acuoso de orégano, obtenido por calentamiento en agua. La capacidad antioxidante de los compuestos liposolubles (ACL) del EO, medida por la prueba de PCL, fue de 2762,04 µg de equivalentes de trolox/mg de muestra, valor superior a 1,36 µg de equivalentes de trolox/g de muestra en extracto etanólico de orégano (Miron et al., 2010).
Caracterización de las películas comestibles de origen marino – PGPM
Propiedades mecánicas
En la tabla 4 se observa que todas las películas tuvieron diferentes valores de espesor (p < 0,05) con excepción de las películas con 0 % y 7,5 % de EO. El espesor de las películas aumentó con la adición del EO (el espesor influye en las propiedades mecánicas y de barrera de las películas) y la RT de las películas disminuyó con la incorporación de EO y se observó una diferencia (p < 0,05) entre todos los tratamientos.
La adición de EO, de naturaleza parcialmente lipídica, provocó un cambio conformacional de la red compacta que se hizo más dispersa. Sobre esto, Wang et al. (2011) sostienen que la pérdida de resistencia mecánica puede atribuirse a la ruptura de la red de película microestructurada causada por los aceites añadidos, ocasionando la discontinuidad de la película y produciendo una pérdida de equilibrio y, en consecuencia, una disminución en la RT. Limpisophon et al. (2009) refieren que la incorporación de lípidos en películas a base de proteínas puede interferir con las interacciones de cadena a cadena del polímero y proporcionar dominios flexibles al interior, resultando en un efecto plastificante.
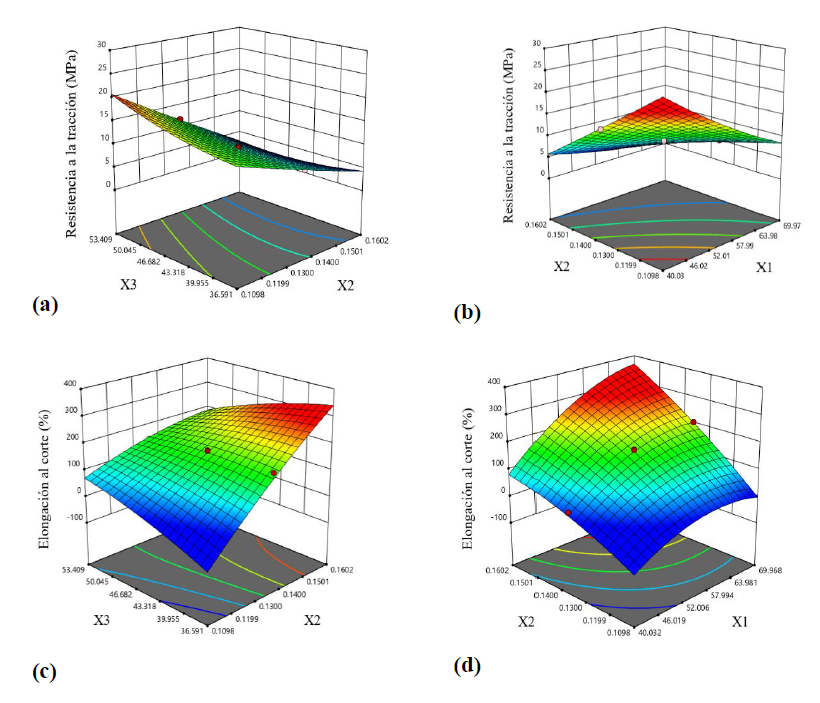
Figura 1. Superficies de respuesta para la resistencia a la tracción (MPa) como una función de (a) concentración de glicerol (g glicerol/g gelatina, X2) y temperatura de secado (°C, X3), (b) temperatura de proceso (°C, X1) y temperatura de secado (°C, X3); superficies de respuesta para la elongación al corte (%) como una función de (c) concentración de glicerol (g glicerol/g gelatina, X2) y temperatura de secado (°C, X3) y (d) temperatura de proceso (°C, X1) y temperatura de secado (°C, X3).
Tabla 4. Propiedades mecánicas y de barrera de las películas comestibles con extracto de orégano (EO)
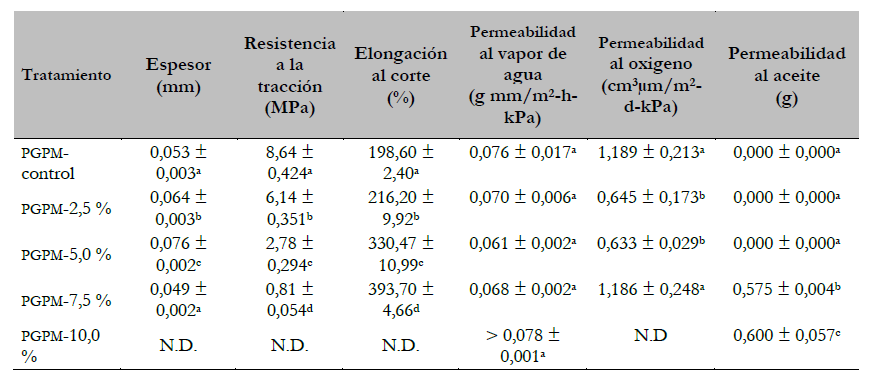
Nota:Los valores medios con letras diferentes dentro de una columna muestran una diferencia significativa (p < 0,05). Las determinaciones se realizaron por triplicado y los resultados son los valores promedios (desviación estándar).
Fuente: Elaboración propia
La unión entre el polifenol del EO y la gelatina se produce a través de las interacciones hidrofóbicas entre el grupo fenólico del polifenol y la gelatina, los cuales están unidos por enlaces de hidrógeno entre el grupo hidroxilo del polifenol y la gelatina (Hoque et al., 2011). También se observa la relación inversa entre la RT y la EAC con la incorporación del EO. Hajivand et al. (2020) obtuvieron películas a partir de mucílagos de semillas de psyllium con extracto de orégano, donde la incorporación de 0,5 %, 1 % y 1,5 % de EO provocó una disminución en la RT de 19,14 a 14,44 MPa y un aumento en EAC de 32,64 % a 37,88 % .
Propiedades de barrera
Los valores de permeabilidad al vapor de agua (PVA) de todos los tratamientos fueron menores que los reportados por otros autores y no se observaron diferencias significativas (p > 0,05) en los valores de PVA, además, la transferencia de vapor de agua ocurrió a través de la porción hidrófila de la red de película y dependió de la relación hidrófila/hidrófoba de sus componentes (Pellissari et al., 2009 citado por Wu et al., 2014). McHugh et al. (1993) mencionan que el aumento de la concentración de proteínas y el espesor de las películas de gelatina provocan una mayor absorción de agua del ambiente debido a la presencia de aminoácidos hidrófilos en su estructura. Los valores encontrados en este trabajo fueron inferiores a 2,5, 3,3 y 4,6 g mm/m2 - h-kPa reportados por Nur-Hanani et al. (2012) en películas con 4 %, 6 % y 8 % de gelatina de pescado, mientras que Chiou et al. (2008) informaron rangos de valores de 0,857-0,728 y 1,084- 0,848 g mm/m2 -h-kPa en películas de gelatina de abadejo de Alaska y salmón, respectivamente.
La incorporación de EO disminuyó la permeabilidad al oxígeno (PO) de las películas hasta el tratamiento con 5 % de EO. Las películas con 2,5 % y 5 % de eoexhibieron excelentes propiedades de barrera al oxígeno (0,6 cm3 µm/m2 -d-kPa) y la adición de EO causó la disminución de PO en las películas debido a la formación de una red entre la gelatina y los polifenoles que impidieron el paso del oxígeno, sin embargo, luego se observó un aumento de PO en la película con 7,5 % de EO. Esto podría deberse a la formación de una red inestable, debido a una cantidad insuficiente de gelatina para interactuar con los fenoles en la película.
Nuestros hallazgos concuerdan con Nur-Hanani et al. (2012), quienes reportaron valores de PO alrededor de 0,5 cm3 µm/m2 -d-kPa en películas de gelatina de piel de tilapia con 4 % de gelatina de 240 bloom, mientras que Chiou et al. (2008) reportaron valores más altos en películas con 5 % de gelatina de piel de abadejo de Alaska, siendo el valor más bajo de po de 2,398 cm3 µm/ m2 -d-kPa. De Carvalho y Grosso (2004) reportaron valores de 23 ml-µm/ m2 -d-kPa, de po en películas nativas y modificadas elaboradas con 10 % de gelatina de piel de bovino. La mayor incorporación de EO en la SFP dio películas más flexibles y con mayor permeabilidad al aceite, debido a la disminución gradual de la estructura compacta de la película. Por último, Wang et al. (2007) reportaron que las películas elaboradas con 4 % y 8 % de gelatina de bovino que mostraron permeabilidad al aceite.
Propiedades fisicoquímicas
La tabla 5 muestra la disminución del parámetro L* respecto a la adición de EO. PGPM-control fue transparente con un valor de L* de 23,61 cercano a 34,04 reportado por Núñez-Flores et al. (2013) en películas de gelatina de pescado, Teixeira et al. (2013) reportaron valores de L* de 93,6 en películas de proteína de merluza y Hoque et al. (2011) reportaron 96,0 en películas de piel de sepia. El parámetro a* disminuyó con la adición de EO y el parámetro b* aumentó con el color amarillo de las películas y el EO. Teixeira et al. (2013) reportaron un valor b* de 5,8 en películas con aceite esencial de orégano. PGPM-control mostró un valor de solubilidad cercano al 100 %, similar a la película de gelatina de piel de salmón (90 %) extraída enzimáticamente (Fan et al., 2020). La presencia de aminoácidos hidrófilos que se rehidratan en contacto con el agua contribuye a la alta solubilidad de la película de gelatina (Hoque et al., 2011), la cual disminuyó con la incorporación de EO.
Tabla 5. Polifenoles extraíbles (equivalentes mg ácido gálico/g película), capacidad reductora (método FRAP, expresado como mM equivalentes de FeSO4.7H2O/mg de película), capacidad secuestradora de radicales libres (método ABTS, expresado como mg equivalentes de ácido ascórbico/g película), actividad ACL (µg equivalentes trolox/mg película) y propiedades físicas de las películas comestibles con extracto de orégano (EO).
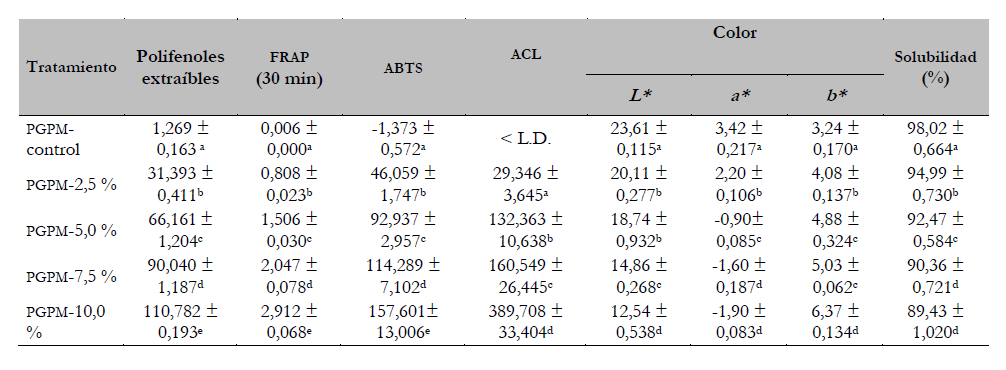
Nota:Los valores medios con letras diferentes dentro de una columna muestran una diferencia significativa (p < 0,05) y los resultados son los valores promedios (desviación estándar).
Fuente: Elaboración propia
Propiedades antioxidantes
La cantidad de polifenoles extraíbles presentes en una película depende de los aminoácidos prolina e hidroxiprolina de la cadena de gelatina que establecen interacciones proteína-proteína, lo cual afecta el número de interacciones con los polifenoles del extracto, incidiendo sobre el contenido de fenoles libres en las películas (Gómez-Estaca et al., 2009).
La incorporación de cantidades incrementales de EO junto con la disminución de gelatina en las formulaciones dio lugar a una mayor interacción entre la proteína y los polifenoles del eo, por ello, la actividad antioxidante de las películas medida por los métodos FRAP, ABTSy ACL se incrementó con la incorporación de EO. Los valores de ACL fueron superiores a lo reportado por Salgado et al. (2012), quienes elaboraron películas comestibles a partir de concentrados proteicos de girasol con valores máximos de ACL de 160,10 µmol /mg de película.
Conclusiones
Las variables de temperatura de proceso y concentración de glicerol tuvieron un efecto significativo sobre la resistencia a la tracción y la elongación al corte de las películas. La temperatura de secado ejerció un efecto significativo sobre la resistencia a la tracción y la solución de optimización fue: temperatura de proceso de 60,3 °C, concentración de glicerol de 0,134 g de glicerol/g de gelatina y temperatura de secado de 50,0 °C para obtener películas con 8,64 MPa de RT y 198,60 % de EAC, con una deseabilidad de 0,991. Así, estas películas tienen un gran potencial de aplicabilidad en la conservación de alimentos.
Contribución de los autores
Contribución de los autores: Silvia Pandia-Estrada: construcción de diseños estadísticos, análisis de datos e información y elaboración de manuscrito; Renzo Romero-Santivañez: registro de información, análisis de datos y elaboración de manuscrito.
Implicaciones éticas
El presente artículo cuenta con el aval 09-2021 radicado el 23 de noviembre del 2021 del comité de ética de investigación de la Universidad Escuela Colombiana de Ingeniería. También se obtuvo el consentimiento de los colaboradores para usar la información suministrada en la documentación del proceso presentado en el artículo.