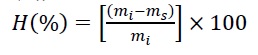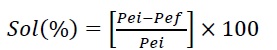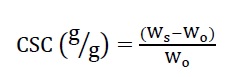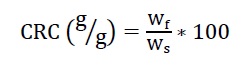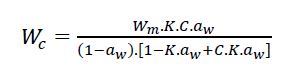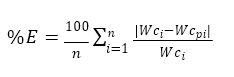Introducción
A nivel mundial, el sector avícola presenta una tendencia de crecimiento sostenida, impulsada por el crecimiento demográfico y los procesos de urbanización. Durante 2019, la producción mundial de carne de pollo alcanzó los 99 millones de toneladas, con un incremento del 3,6% respecto al año anterior. Estados Unidos, Brasil, China, la Unión Europea (UE), India, Rusia y México se ubicaron en los primeros lugares de producción, mientras que Argentina ocupó el lugar #10 (Ministerio de Agricultura, Ganadería y Pesca de Argentina, 2020), aunque este crecimiento viene acompañado de los residuos altamente contaminantes que se generan en las diferentes etapas de la cadena de producción avícola. La mayoría de estos subproductos pueden ser valiosos si se manejan de manera adecuada y pueden ser fuentes de nutrientes orgánicos e inorgánicos de gran valor.
Las plumas de pollo son una biomasa abundante generada por la industria avícola y están compuestas principalmente por una proteína fibrosa llamada queratina; este biopolímero tiene un gran potencial para su aplicación en diferentes campos como las industrias agrícola, agroindustrial, médica, farmacéutica y cosmética. El alto contenido de enlaces disulfuro presentes en la queratina le convierte en un biopolímero interesante para la fabricación de materiales con resistencia mecánica (Esparza, 2017) y a partir de su transformación, la queratina puede originar biomateriales en formato de esponjas, recubrimientos, microfibras, geles, etc. Las esponjas son estructuras porosas que poseen ciertas propiedades mecánicas, morfológicas y de biodegradabilidad que pueden soportar la formación 3D de tejidos, favorecen la migración, la adhesión y la proliferación celular, permitiendo la difusión de nutrientes y metabolitos en las células (Sánchez Ramírez et al., 2017).
Los biopolímeros proteicos tienen un rol central en la producción de esponjas, el colágeno, la elastina, la fibronectina y la laminina han sido ampliamente usados en la generación de esponjas (Malafaya et al., 2007; Madaghiele et al., 2014). La queratina ha ganado un gran interés en la fabricación de esponjas debido principalmente a su biocompatibilidad, biodegradabilidad, resistencia mecánica y abundancia en la naturaleza (Rouse & Van Dyke, 2010). Se puede ordenar en forma de hidrogel, red 3D similar a la esponja, formada por cadenas poliméricas en presencia de poros interconectados, donde estos hidrogeles se pueden obtener mediante métodos de solubilización por reducción u oxidación (Cardamone et al., 2013). La sulfitólisis es uno de los métodos de solubilización empleados para la generación de esponjas de queratina a partir de biomasas como las plumas y consiste en emplear iones sulfito (SO −2), bisulfito (HSO .) y disulfito o pirosulfito (S2O5−2) con capacidad reductora de los enlaces disulfuro de la cistina presente en la queratina, formando un grupo tiol y tiosulfato (-S-SO3), también denominado sal de Bunte (Shavandi et al., 2017; Vineis et al., 2019).
A valores de pH superiores a 9, el proceso de sulfitólisis de la cistina es incompleto y reversible, dado que la velocidad de reacción es menor por la repulsión entre los aniones carboxílicos de la proteína y los iones de sulfito (Vineis et al., 2019). Esto puede ser compensado con la adición de otros agentes desnaturalizantes como la urea y el SDS se pueden romper todos los enlaces disulfuro, mejorando el rendimiento de extracción (Shavandi et al., 2017; Vineis et al., 2019).
Tonin et al. (2010) realizaron la solubilización de lana para obtener queratina, aplicando metabisulfito de sodio como agente reductor, urea como agente desnaturalizante e hidróxido de sodio para regular el valor de pH a 6,5; Sinkiewicz et al. (2016) reportaron buenos porcentajes de extracción de queratina a partir de plumas de pollo mediante el método de sulfitólisis y los autores mostraron que esta con metabisulfito y bisulfito de sodio en concentraciones de 0,5 M incrementó el rendimiento de extracción entre un 63% y un 82%. Para la formación de las esponjas de queratina, el método de secado más apropiado fue la liofilización, debido a la capacidad de autoensamblaje 3D de la queratina (Vasconcelos & Cavaco-Paulo, 2013).
Las esponjas de queratina obtenidas de cabello y lana han demostrado buena compatibilidad para aplicaciones en ingeniería de tejidos (Tachibana et al., 2002; Aboushwareb et al., 2009; Hill et al., 2010). Balaji et al. (2012) obtuvieron esponjas porosas a partir de queratina de lana para su utilización como andamio celular en ingeniería de tejidos, mientras que Wan et al. (2017) estudiaron las aplicaciones médicas de las esponjas de la queratina, principalmente en la medicina regenerativa de tejidos; Tachibana et al. (2002) obtuvieron esponjas de queratina mediante liofilización para uso en cultivo celular y Zhou et al. (2014) utilizaron esponjas de queratina altamente porosas como posible sorbente en el manejo de derrames de petróleo.
El empleo de esponjas como biomateriales sorbentes, en el caso de derrames de crudo o aceite, es de gran importancia, debido al fuerte impacto negativo que generan sobre el ecosistema. Los materiales sorbentes son usados para remover o recuperar el contaminante, ya sea por adsorción como un recubrimiento externo del crudo sobre la superficie material, mediante la absorción, donde el crudo es incorporado internamente en los poros o por la combinación de ambos mecanismos (Karan et al., 2011; Ifelebuegu & Johnson, 2017).
Los biomateriales obtenidos a base de queratina tienen la capacidad de sorción de diferentes contaminantes, incluidos el crudo y el aceite, mediante la combinación de mecanismos de sorción físicos donde el crudo se ubica en los poros o en la superficie del material y químicos donde se presenta una interacción con los grupos funcionales de la queratina (Ifelebuegu & Momoh, 2015). Esta capacidad de sorción de crudo o aceite en los biopolímeros puede verse afectada por diferentes factores, tales como la densidad, la porosidad y la morfología de la superficie propia del material, así como por la presencia de grupos funcionales y aminoácidos que afectan las propiedades de sorción (Abdel-Moghny & Keshawy, 2014; Ifelebuegu & Momoh, 2015; Ifelebuegu & Johnson, 2017).
El propósito de esta investigación es estudiar la potencial reutilización de los residuos de la industria avícola y su aplicación ambiental en la mitigación de la contaminación generada por la industria petroquímica. Debido a la considerable cantidad de queratina presente en las plumas de pollo y a la abundancia y disponibilidad de esta biomasa, ello hace de este residuo una opción deseable para la producción de biomateriales porosos que puedan ser aplicables en el manejo y el control de derrames de crudo.
El objetivo del presente trabajo fue desarrollar biomateriales porosos en formato de esponjas mediante el autoensamblado de la queratina y lograr que presenten buenas características sorbentes para emplearse en el control de derrames de crudo. Al ser la queratina el componente principal de las plumas y contener enlaces disulfuro, los procesos de extracción deben incluir reactivos que actúen como agentes reductores y desnaturalizantes, para esto se aplicaron diferentes metodologías en el medio alcalino o en el ligeramente ácido que incluyen reactivos como sulfito de sodio, hidróxido de sodio, urea y SDS; además de modificar las condiciones de procesamiento para crear estructuras porosas de queratina que al ser hidrofóbicas pueden ser potencialmente usadas en la remoción de crudo. Para ello, se estudiaron las propiedades de sorción de agua, sorción y retención de crudo, se analizaron las propiedades fisicoquímicas de las matrices porosas obtenidas a través de técnicas de calorimetría diferencial de barrido (DSC) y espectroscopia infrarroja con transformada de Fourier (FTIR).
Materiales y métodos
Adecuación de plumas de pollo
Se utilizaron plumas de pollos parrilleros de las líneas Cobb y Ross, las cuales fueron provistas por Domvil SA - Frigorífico Aveguay de Entre Ríos, Argentina. Se inició con lavados consecutivos de agua corriente a 40 °C y detergente común con agitación constante, retirando el material extraño (palos, piedras, restos de tejidos, picos, fibras, etc.). A continuación, las plumas se sumergieron en una mezcla de agua destilada-etanol 96% (50:50 v/v), se filtraron, escurrieron y se secaron en estufa de convección forzada por 24 h a 30 °C. Seguidamente, las plumas se cortaron y se desengrasaron usando 100 mL de éter de petróleo (Anedra) por cada 10 g de pluma seca, durante 4 h con agitación constante. Se filtró y se removió el exceso de solvente y las plumas se secaron bajo campana a temperatura ambiente por 2 h y luego en estufa a 30 °C por 24 h. Finalmente, las plumas adecuadas fueron almacenadas a 20 °C hasta el proceso de extracción.
Obtención de esponjas a partir de plumas de pollo
Se aplicaron dos metodologías de extracción de queratina a partir de plumas de pollo para la formación de los materiales porosos. Cada metodología incluyó una etapa de secado por liofilización del material obtenido, ya que este es uno de los métodos más apropiados para la formación de esponjas debido a la capacidad de autoensamblaje 3D de la queratina.
Metodología de formación de esponjas 1 (E1)
La metodología E1 consistió en la extracción de la queratina presente en las plumas de pollo basada en el protocolo propuesto por Zhou et al. (2014) con modificaciones. Se usó sulfito de sodio (Na2SO3) como agente reductor para escindir los enlaces disulfuro, urea como agente desnaturalizante que rompe los puentes de hidrógeno y dodecilsulfato de sodio SDS como agente tensioactivo para estabilizar la solución, minimizando la reformación de los enlaces disulfuro y contribuyendo a un mejor rendimiento de extracción de la proteína sin dañar la cadena polipeptídica. En esta metodología, los enlaces disulfuro (-S-S-) se convierten en grupos tioles (- SH) y sal de Bunte (S-sulfo), obteniendo como producto S-sulfo-queratina (Katoh et al., 2004).
Las plumas previamente acondicionadas se mezclaron en relación 1:10 m/v con una solución que contenía 0,125M de sulfito de sodio (Na2SO3), 0,05M SDS y 2M de urea a pH = 9. La mezcla se calentó a 90 ºC con agitación constante por 30 min. La dispersión obtenida se diluyó en relación de 1:4 v/v con agua Milli Q y los residuos de pluma sin disolver fueron filtrados, posteriormente, la solución se dializó (peso molecular (PM) ≥ 12000 Da D9777, Sigma-Aldrich Co, St. Louis MO, Estados Unidos) con cambios de agua durante un periodo de tiempo de 72 h. Finalmente, las soluciones dializadas se almacenaron a -40 °C por 48 h y se liofilizaron en un equipo Heto modelo FD 4. Las esponjas obtenidas se almacenaron a 4 ºC hasta el momento de su caracterización.
Método de formación de esponjas 2 (E2)
La metodología E2 se basó en la extracción de queratina a partir de plumas de pollo con sulfito de sodio (Na2SO3) mediante sulfitólisis a pH 6,5, rompiendo los enlaces disulfuro, obteniendo tioles y S-sulfonatos, y formando la sal de Bunte, además se empleó urea para escindir los puentes de hidrógeno presentes en la proteína (Tonin et al., 2010) y se aplicó el protocolo propuesto por Tonin et al. (2010) con modificaciones.
Las plumas de pollo previamente acondicionadas se mezclaron en relación 1:20 m/v con una solución que contenía 7,75 M de urea y 0,48M de sulfito de sodio, el pH se ajustó a 6,5 con NaOH 5M. La mezcla se calentó a 65 ºC con agitación constante por 2 h y la dispersión se filtró para retirar los residuos de pluma sin disolver. Posteriormente, se dializó (PM ≥ 12000 Da D9777, Sigma-Aldrich Co, St. Louis MO, Estados Unidos) con cambios de agua durante un periodo de 72 h. Finalmente, las soluciones dializadas se almacenaron a -40 °C por 48 h y se liofilizaron en un equipo Heto Modelo FD 4. Las esponjas obtenidas se almacenaron en cajas de Petri cerradas a 4 ºC hasta el momento de su caracterización.
Caracterización de las matrices porosas
Actividad acuosa (aw) y contenido de humedad
La actividad acuosa (aw) de las esponjas se midió con un equipo Aqualab serie 4 ST (Decagon Device, Pullman, Washington, Estados Unidos), previamente calibrado con soluciones salinas saturadas con actividades acuosas en el rango de interés.
El contenido de humedad se determinó gravimétricamente, donde fragmentos de 1,5 × 2 cm se pesaron y llevaron a estufa (Sanjor serie SL DB; Buenos Aires, Argentina) a 105 ± 1 ºC hasta alcanzar un peso constante. Todas las determinaciones se hicieron por triplicado y el porcentaje de humedad (H(%)) se calculó mediante la ecuación (1):
donde, mi es el peso inicial de la esponja (g) y ms es el peso seco final (g).
Solubilidad de las esponjas y liberación de proteína al medio acuoso
La solubilidad en medio acuoso se determinó utilizando fragmentos rectangulares de las esponjas de queratina E1 y E2. Se pesó 0,1 g de cada muestra y se sumergió en 25 mL de agua destilada a pH = 6 con agitación por 24 h a 20 ºC. Los fragmentos remanentes se filtraron y se secaron en una estufa con circulación forzada de aire a 105 ºC hasta alcanzar un peso constante. El porcentaje de solubilidad (% S) se calculó por medio de la ecuación 2:
donde Pei es el peso seco inicial y Pef es el peso seco final.
Para determinar si las esponjas obtenidas liberaban proteína en medio acuoso (pH = 6), se midió la concentración de proteína soluble presente en la fase acuosa obtenida mediante el método de Biuret. La absorbancia se leyó en un espectrofotómetro UV mini-1240 UV-Vis (Shimadzu Scientific Instruments, Japón) a una longitud de onda λ = 550 nm y las determinaciones se hicieron por duplicado.
Capacidad de sorción (CSC) y de retención (CRC) de crudo de las esponjas de queratina
En este ensayo se determinó la capacidad de sorción de crudo de las esponjas de queratina mediante el protocolo propuesto por Zhou et al. (2014) con modificaciones. Para este ensayo, se eligió crudo (ρ = 0,885 g/mL) provisto por la refinería YPF de la ciudad de La Plata en la provincia de Buenos Aires, Argentina. Se cortaron fragmentos rectangulares de 1,5 × 2 cm de las esponjas E1 y E2 de masa = 0,1 g y cada fragmento se sumergió en 10 mL de crudo. Después de 5 minutos de sorción, se retiró el fragmento y se drenó por 30 segundos hasta que no quedaran gotas residuales de crudo sobre la superficie. La capacidad de sorción fue calculada a partir de la ecuación 3:
donde, Ws es el peso del material sorbente después de la sorción (g) y Wo es el peso inicial de la esponja (g).
Una vez finalizada la etapa de sorción, se prosiguió a determinar la capacidad de retención del material. La capacidad de retención del aceite captado fue determinada de la siguiente manera: después de 5 minutos de sorción, la esponja con el crudo fue drenada 30 s y luego centrifugada a 500 rpm y se registró el peso de la esponja después de la centrifugación (Wf). Los ensayos se realizaron por duplicado y la capacidad de retención de aceite se calculó mediante la ecuación 4:
donde Ws es el peso del sorbente después de la sorción de aceite y Wf el peso restante de la esponja después de la centrifugación.
Propiedades de sorción de agua de las esponjas
Las isotermas de sorción de las esponjas obtenidas a partir de plumas con los tratamientos E1 y E2 fueron determinadas por el método estático gravimétrico a 20 ºC (Rahman & Sablani, 2008). Las muestras de E1 y E2 de 1,5 g se almacenaron en un rango de humedad relativa (HR) entre 11,3% y 97%, usando soluciones salinas saturadas de cloruro de litio (LiCl 11,3%); acetato de potasio (CH3COOK 23,4%); cloruro de magnesio (MgCl2 33%); carbonato de potasio (K2CO3 43,2%); nitrato de magnesio (Mg(NO3)2 54,4%); cloruro de sodio (NaCl 76%); cloruro de potasio (KCl 82%) y sulfato de potasio (K2SO4 98%). Se registró el peso hasta alcanzar un valor constante, donde cada punto de la isoterma se hizo por triplicado.
El modelado matemático de las isotermas de sorción de agua de la relación entre el contenido de humedad de equilibrio (Wc) y aw de los derivados de queratina, se predijo mediante la ecuación 5 de tres parámetros (Guggenheim-Yerson-de Boer, GAB).
donde Wm es la humedad del material que corresponde a la situación en que los puntos de sorción primarios están saturados por moléculas de agua. C es la constante de Guggenheim, característica del alimento y relacionada al calor de sorción de la monocapa y K es el factor de corrección relacionado con el calor de sorción de la multicapa.
Los parámetros se estimaron mediante una regresión no lineal de los datos experimentales con los programas Origin Pro v 8.0 (OriginLab Corp., Northhampton, MA, Estados Unidos).
Se evaluó la bondad de ajuste del modelo aplicado mediante el porcentaje de error medio relativo (% E) que expresa la diferencia entre los datos predichos y los experimentales (ecuación 6):
dónde “n” es el número de datos experimentales, Wci y Wcp son los valores de humedad experimentales y predichos, respectivamente.
Espectroscopia infrarroja por transformada de Fourier (FTIR) con reflectancia total atenuada (ATR)
Los espectros infrarrojos por transformada de Fourier (FTIR) en el rango de números de onda de 4000 a 400 cm-1 de las esponjas de queratina se obtuvieron con un espectrómetro, equipo Nicolet IS10 (Thermo Fisher Scientific Inc., Rockford, Estados Unidos) con accesorio de reflectancia total atenuada (ATR de diamante). Para cada muestra se colectaron 60 barridos con una resolución de 4 cm-1 que fueron acumulados y los datos obtenidos se procesaron mediante el software Omnic TM de Thermo Scientific TM.
Análisis de la Amida I
Las bandas de sorción Amida I presentes en el espectro infrarrojo son de gran importancia para la caracterización de las proteínas, estas pueden ser analizadas individualmente para identificar los componentes de absorción atribuidos a las estructuras secundarias, como α˗hélice, hoja β˗plana y microestructuras desordenadas presentes en la queratina (Cardamone et al., 2010). Para realizar el tipo de análisis, se procedió con la deconvolución de la Amida I; el método consiste en aplicar la transformación gaussiana/lorentzian para la descomposición de la curva original de Amida I en una serie de curvas gaussianas, las cuales se obtuvieron con el software Omnic TM de Thermo Scientific TM, dichas curvas proporcionan información del tipo de estructura secundaria encontrado en la muestra analizada y se puede calcular el porcentaje relativo de cada tipo de estructura (Byler & Susi, 1986; Cortez, 2020).
A partir de las áreas de las curvas gaussianas obtenidas y seleccionadas, se determinó el porcentaje correspondiente a cada tipo de estructura secundaria sumando las áreas bajo la curva de cada pico individual y expresado como fracción del área total. Algunas asignaciones se presentan en la tabla 1.
Tabla 1. Asignaciones de las estructuras secundarias correspondientes a distintos componentes que conforman la banda de Amida I de las proteínas.

Fuente: Torii., and Tasumi (1996)
Calorimetría diferencial de barrido
Se realizó el análisis del comportamiento térmico de las esponjas de queratina mediante un equipo de calorimetría diferencial de barrido DSC Q-100 (ta Instruments, Estados Unidos). Se pesaron entre 1 y 3 mg de las esponjas obtenidas E1 y E2 en cápsulas de aluminio y se sellaron herméticamente y como referencia se utilizó una cápsula vacía. Se usó el método de análisis térmico modulado a ± 0,5 ºC cada 40 segundos, la rampa de calentamiento fue de 10 ºC/min hasta 280 ºC. y todas las determinaciones se hicieron por duplicado.
Análisis estadístico
Para el análisis estadístico de los resultados se utilizó el software Infostat v. 2013, Grupo InfoStat, FCA, Argentina (Di Rienzo et al., 2020). La prueba t se aplicó para determinar diferencias estadísticamente significativas entre los valores medios de los resultados usando un nivel de significancia p < 0,05. Los parámetros del modelo de GAB se estimaron por regresiones no lineales de los datos experimentales mediante el software Origin Pro v 8.0 (OriginLab Corp., Northhampton, MA, Estados Unidos).
Resultados y discusión
Caracterización de las esponjas de queratina
Se obtuvieron esponjas de queratina mediante dos metodologías de extracción por sulfitólisis con sulfito de sodio, el cual cumple la función de reducir la queratina presente en las plumas de pollo cortando los enlaces disulfuro (-S-S-) y permitiendo así una extracción sin dañar la cadena polipeptídica. Las metodologías aplicadas fueron E1, que corresponde a la adaptación del protocolo de Zhou et al. (2014) (SDS, Na2SO3 y urea; T = 90 °C y t extracción = 30 min) y E2 que es una adaptación del protocolo propuesto por Tonin et al. (2010) (Na2SO3 y urea, T = 65 °C yt extracción = 120 min), con las que se generaron esponjas de queratina tras el proceso de liofilización debido a su capacidad de autoensamblado (figura 1).

Fuente: Elaboración propia
Figura 1. Esponjas obtenidas mediante A) Metodología E1 (SDS, Na2SO3 y urea, T = 90 °C y textracción = 30 min) y B) Metodología E2 (Na2SO3 y urea T = 65 °C textracción = 120 min)
En la tabla 2 se presentan los resultados obtenidos de los ensayos de solubilidad por el método gravimétrico, proteína liberada al medio y los ensayos de captación y retención de crudo para las esponjas de queratina. La solubilidad de las esponjas obtenidas se evaluó en medio acuoso a pH = 6 mediante el método gravimétrico, con el fin de evaluar la resistencia del material en medio acuoso, asimismo, se midió la proteína soluble en el medio para determinar si hay liberación de proteína por parte de las esponjas. Los fragmentos de las esponjas E1 y E2 no se disgregaron ni perdieron su forma cuando se sumergieron en agua destilada a pH = 6, indicando que los materiales obtenidos son hidrofóbicos; asimismo, los porcentajes de solubilidad en agua de las esponjas de queratina fueron bajos y se encuentran entre un 4,8% y un 5,8% (tabla 2).
La esponja E1 presentó un valor ligeramente mayor de solubilidad que el presentado por la esponja obtenida por la metodología E2 (p < 0,05). Por otra parte, no se reportaron diferencias significativas en la proteína soluble (< 0,0125 g queratina/g de esponja), indicando que la queratina presente en las esponjas es prácticamente insoluble en agua.
Tabla 2. Porcentaje de solubilidad, proteína liberada al medio, capacidad de sorción de crudo (CSC) y retención de crudo (CRC) de las esponjas de queratina

Notas aclaratorias:*Los resultados son presentados como el promedio ± desviación estándar de las muestras por duplicado; los valores con diferentes superíndices (a, b) presentan diferencias significativas mediante la prueba de t de student (α = 0,05).
Fuente: Elaboración propia
Los derrames de crudo debido a la exploración de recursos, transporte, almacenaje, entre otras actividades, causan un daño considerable generando un impacto negativo en el medioambiente. El crudo derramado no desaparece del ecosistema a menos que sea removido mediante un proceso adecuado, es por esa razón que surge el interés por la utilización de esponjas de queratina como biomateriales seguros y amigables con el ambiente para la correcta remoción y recuperación del crudo derramado en la superficie.
Se evaluó para las esponjas de queratina E1 y E2 (figura 2), la capacidad de sorción de crudo (δ= 0,885 g/L) (CSC; g crudo/g queratina) y el porcentaje de retención de crudo (% CRC). La esponja E2 presentó un mejor desempeño como biomaterial sorbente de crudo en comparación con E1, captando 21,22 g de crudo/g de esponja y reteniendo un 78% del crudo captado (p < 0,05; tabla 2).
La captación de crudo de E1 (tabla 2) fue similar al reportado por Ifelebuegu and Chinonyere (2016) para plumas de pollo en mezclas de crudo/agua (CSC = 6,1 g de crudo/g de pluma). Por otra parte, Zhou et al. (2014) reportaron para las esponjas de queratina, obtenidas mediante sulfitólisis, capacidades máximas de sorción de 38,66 y 35,33 g de crudo/g de sorbente para parafinas y aceite de soya, respectivamente; asimismo, indicaron que estas capacidades disminuyeron significativamente cuando el estudio se realizó en mezclas de aceite/agua. Las esponjas de queratina tras su uso como sorbentes de crudo podrían ser reutilizadas en varios ciclos y, finalmente, usadas como material combustible.

Fuente: Elaboración propia
Figura 2. Capacidad de sorción (CSC) y de retención de crudo (% CRC) de las esponjas de queratina (A) E1 y (B) E2
Se ha reportado la capacidad de sorción de crudo para biomateriales sorbentes, entre ellos se encuentra el quitosano, con uno de los mejores sorbentes captando 84 g de crudo/g sorbente a pH > 7 y 90 g de crudo/g sorbente a pH < 5 después de 1 h de sorción (Srinivasan & Viraraghavan, 2010; Wolok et al., 2020). Otro caso es el de la fibra de Kapok (Ceiba pentandra), que para el mismo tiempo de sorción captan entre 23 y 25 g de crudo/g de sorbente y un 90% de retención (Cao et al., 2017; Wolok et al., 2020). Adicionalmente, el algodón también es utilizado como sorbente de crudo con CSC de 15 g de crudo/g algodón.
En comparación a los datos reportados para estos materiales sorbentes, las esponjas de queratina E2 con CSC de 21,22 g de crudo/g sorbente medido a los 5 minutos de sorción, pueden ser un biomaterial competitivo en el control de derrames de crudo. Este buen desempeño de las esponjas de queratina como elemento de sorción podría ser explicado por el carácter hidrofóbico y la insolubilidad en agua propia de las queratinas, siendo afín químicamente con los hidrocarburos. Por otra parte, el área específica del biopolímero puede influir debido a los espacios intersticiales formados por la red de fibras de queratina (Ramírez-Paredes et al., 2013).
Propiedades de sorción de agua de las esponjas
Se realizaron las isotermas de sorción de agua para las esponjas de queratina en un rango de aw = 0,11 a 0,98 a 20 °C. Las humedades iniciales de las esponjas E1 y E2 fueron de 3,50 ± 0,10 y 3,41 ± 0,62 g/g b.h (base húmeda) respectivamente.
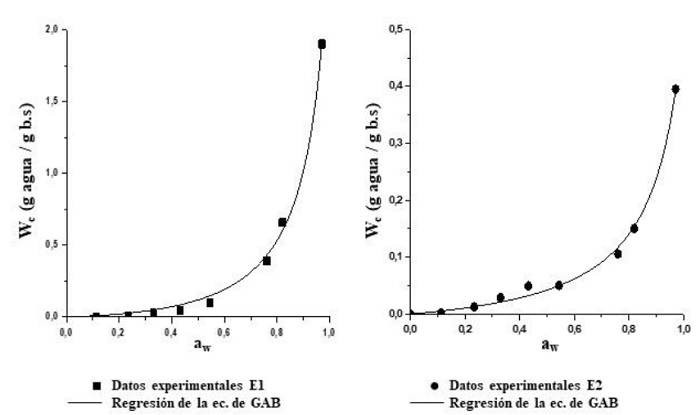
Los resultados experimentales de los contenidos de agua de equilibrio en función de la aw a 20 °C y el ajuste de los datos con la ecuación de GAB (ecuación 5) por regresión no lineal, obtenidos para las esponjas de queratina E1 y E2 a 20 ºC, se presentan en la figura 4. Ambas isotermas siguieron el modelo sigmoidal característico de los materiales a base de queratina e indican que el agua sería captada en multicapas (Martelli et al., 2006), sin embargo, exhibieron comportamientos diferentes para valores de aw mayores a 0,33.
Fuente: Elaboración propia
Figura 3. Isotermas de sorción de las esponjas de queratina E1 y E2 a 20 °C. Rango de aw evaluado = 0,11 a 0,98
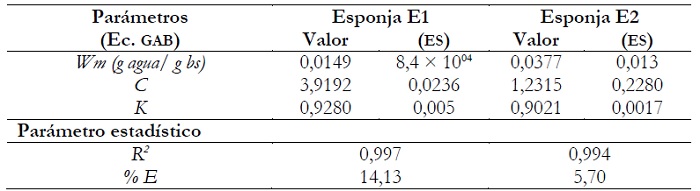
La tabla 3 muestra los parámetros de la ecuación de GAB, el coeficiente de determinación (R2) y el porcentaje de error medio relativo (% E).
El modelo GAB mostró un buen ajuste a los datos experimentales de contenido de agua de equilibrio para un amplio rango de valores de aw, presentando valores muy cercanos a 1 para el coeficiente de correlación y % E cercanos al 10 % (tabla 3). La esponja E2 exhibió un valor de Wm significativamente mayor que la esponja E1, donde el tratamiento E1 genera esponjas con mayor contenido de agua de equilibrio y mayor capacidad de sorción de agua en el rango de aw evaluado.
Espectroscopia infrarroja por transformada de Fourier (FTIR-ATR)
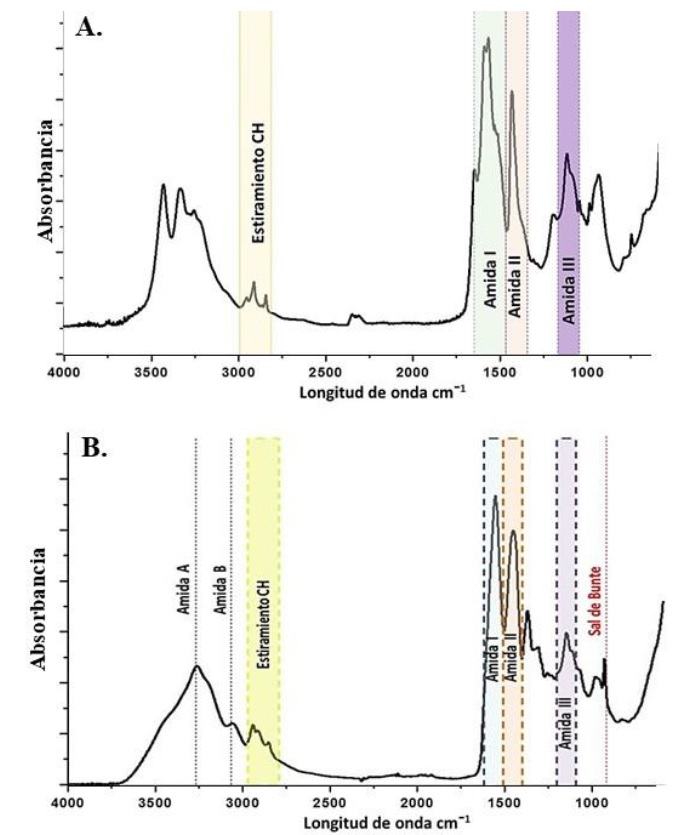
Se analizaron los espectros FTIR con ATR para las esponjas de queratina obtenidas mediante las metodologías E1 y E2. Ambos tipos de esponjas presentan señales encontradas en las plumas de pollo y características de la queratina, dicho espectro presenta un gran número de bandas vibracionales, especialmente en la Amida I (1690 a 1600 cm-1), Amida II (1575 a 1480 cm-1) y la región de oxidación de la cisteína (1200 a 1040 cm-1), la cual está solapada y proporciona información poco cualitativa (Barton, 2011). El espectro FTIR-ATR de la esponja de queratina E1 se presenta en las figuras 4A y 4B.
En el espectro E1 (figura 4A) se observaron los picos de 3300 cm-1 y 3417 cm-1; la Amida A se ha reportado a 3330 cm-1 y está asociada a la conformación α-hélice. Martínez-Hernández et al. (2005) informaron la presencia de esta señal en fibras de queratina obtenidas a partir de lana asociadas con su conformación α-hélice y, asimismo, coincide con la vibración de estiramiento del grupo ˗OH (Zhou et al., 2014). Además, se observaron las bandas de Amida B (3056-3075 cm-1) y un pico a 2930 cm-1 asociado a la vibración CH3 de las cadenas de acilo en las queratinas (Martínez-Hernández et al., 2005).
Se observan señales en la región de 1700 a 1600 cm-1, correspondientes a la Amida I y vinculados con las vibraciones del enlace C=O de los grupos carbonilo para la conformación beta plana de la molécula de queratina (Wojciechowska et al., 2002; Martínez-Hernández et al., 2005). Martínez-Hernández et al. (2005) reportaron que el pico a 1666 cm-1 corresponde a esa vibración C=O para la conformación beta. Por otra parte, Takahashi et al. (2004) reportaron un pico a 1656 cm-1 asociado a la conformación helicoidal de la Amida I; en el espectro de E1 se encontró un pico a 1615 cm˗1 (figura 4A), coincidente con lo reportado por Takahashi et al. (2004) para la Amida I.
Fuente: Elaboración propia
Figura 4. Espectro FTIR-ATR de (4A) esponja de queratina E1 y (4B) esponja de queratina E2
Se observa también un pico a 1470 cm-1 en el espectro E1 (figura 4A) vinculado con la Amida II. Zhou et al. (2014) reportaron en espectros de plumas de pollo y esponjas de queratina los picos a 1450 cm-1 y a 1540 cm-1 asociados a la vibración del grupo C-H que conecta con el átomo de N de la Amida y la vibración N-H y C-N, respectivamente. Wojciechowska et al. (2002) reportaron para fibras de queratina, obtenidas a partir de lana, señales a 1480 y a 1580 cm-1 correspondientes a las vibraciones de los enlaces N-H y C-N de la Amida II. A su vez, los picos encontrados en la zona a 1531 cm-1 pueden estar relacionados con la vibración N-H de una conformación beta para fibras de queratina obtenidas a partir de plumas de pollo (Martínez-Hernández et al., 2005).
Por otra parte, se observa la presencia de la Amida II (1230 y 1240 cm-1) correspondientes a la conformación hoja beta plana (Martínez-Hernández et al., 2005). Los picos cercanos a la zona a 1174 cm-1 pueden vincularse con los enlaces C-C de aminoácidos de cadena lateral (Akhtar & Edwards, 1997). En los espectros de E1, el pico que se encuentra a 1020 cm-1 se asoció a la sal de Bunte (enlace S=O), formada a partir de queratina regenerada según lo estudiado por Zhou et al. (2014). Esta característica resulta común, ya que la reacción de extracción implica un proceso de sulfitólisis donde los iones de sulfito rompen los puentes disulfuro en tioles y aniones S-sulfonato, sin embargo, al ser un proceso reversible mediante la extracción del sulfito, valores altos de sal de Bunte, ello podría indicar un remanente del reactivo a pesar de la etapa de diálisis. En el espectro FTIR de la muestra E2 (figura 5B), se observan todas las señales características de la queratina, así como la presencia de la sal de Bunte (vS=O). En comparación con las esponjas obtenidas mediante la metodología E1, no se observaron los picos a 3300 cm-1 y a 3417 cm-1, vistos en dichos espectros FTIR, siendo visible la única banda de la Amida A en la longitud de onda a 3271 cm-1. Por otro lado, se observó un pico marcado en la región a 1521 cm-1, correspondiente a la flexión N-H para la conformación beta.
Análisis de las Amida I
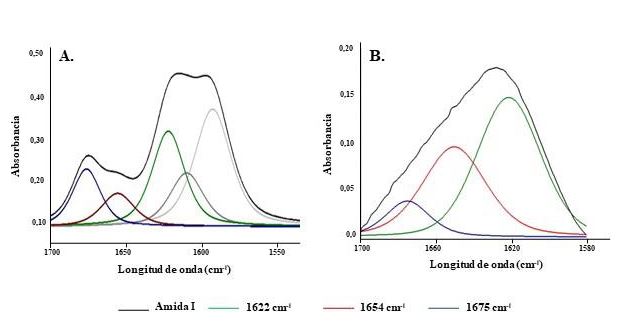
Se realizó el análisis de las Amida I mediante la deconvolución de la zona comprendida entre 1700 a 1550 cm-1, con el fin de identificar y determinar la proporción de las estructuras secundarias αhélice y hoja βplana en las esponjas de queratina E1e y E2. En la figura 5A y 5B se presentan los componentes deconvolucionados de la región Amida I, los cuales representan α-hélice, hoja β-plana y estructuras desordenadas.
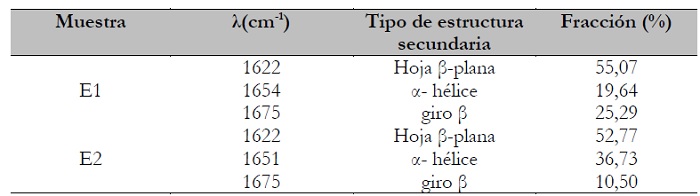
Se identificaron para ambas esponjas (E1 y E2) tres componentes correspondientes a las estructuras α-hélice (1657-1651 cm-1), hoja β-plana (1631-1621 cm-1) y microestructuras desordenadas (1697-1670 cm-1). Estos resultados concuerdan con los presentados por Cardamone et al., (2010), quienes informaron la segunda derivada de los espectros infrarrojos para hidrolizados de queratina de lana; mientras que Isarankura Na Ayutthaya et al. (2015) analizaron la banda Amida I para películas de queratina, encontrando curvas localizadas a 1650 cm-1 y de 1610 a 1633 cm-1 correspondientes a las estructuras α-hélice y hoja β-plana, respectivamente. Se determinó el porcentaje relativo de las estructuras secundarias presentes en las esponjas E1 y E2, analizadas mediante la deconvolución de Amida I. En la esponja E1, los porcentajes relativos para las estructuras identificadas fueron del 55,1% para hoja-plegada-β, 19,64% de α-hélice y el 25,3% de giro β; mientras que para la esponja E2 fueron 52,1%, 36,7% y 10,5%, respectivamente (tabla 4). El mayor contenido de estructura α- hélice (estructura menos rígida que la hoja β˗plana) que posee E2 en comparación con E1, podría atribuirle mayor elasticidad y flexibilidad al material.
Fuente: Elaboración propia
Figura 5. Banda Amida I y curvas gaussianas obtenidas mediante la deconvolución del espectro FTIR-ATR para: (5A) la esponja de queratina E1 y (5B) la esponja de queratina E2
Tabla 4. Porcentaje relativo de las estructuras secundarias calculadas mediante la deconvolución del espectro FTIR-ATR de la Amida I de esponjas de queratina
Fuente: Elaboración propia
En ambas muestras se evidencia una mayor proporción de estructuras tipo β (una estructura más rígida que la α), esto pudo deberse a una mayor proporción de raquis en las plumas usadas para la extracción de la queratina en el presente trabajo. Diferentes autores han reportado que la fracción del raquis está compuesta en mayor proporción de estructuras tipo β que α, mientras que la fracción de barbas posee una mayor proporción de estructuras tipo α que β. Sharma et al. (2018) analizaron mediante FTIR-ATR la estructura de las plumas y la queratina extraída de ellas, observando que poseen un mayor contenido de estructuras hoja β-plana.
Calorimetría diferencial de barrido (DSC)
Se analizó el comportamiento térmico de las esponjas de queratina obtenidas por las metodologías E1 y E2, los termogramas de calentamiento obtenidos se presentan en las figuras 6A y 6B.
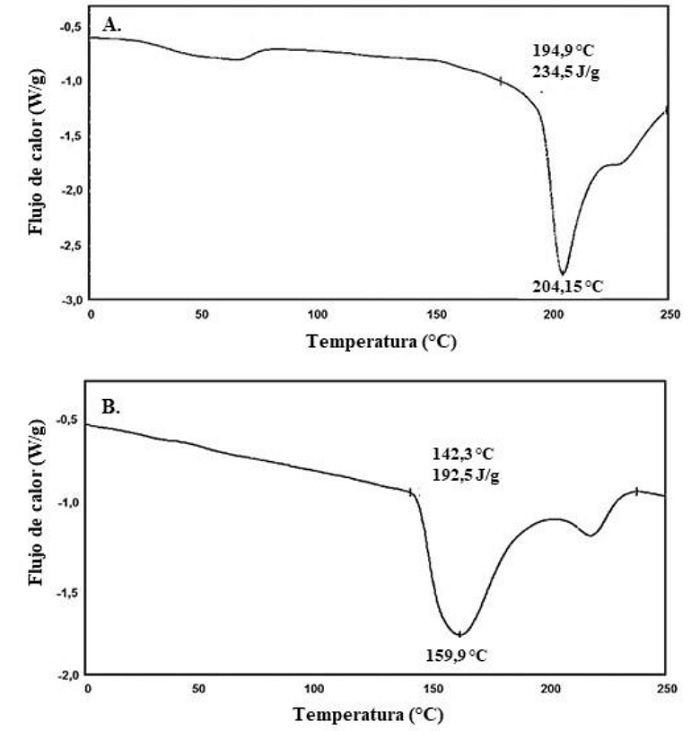
Figuras 6. (6A) Termograma de calentamiento de la esponja de queratina E1 (sulfitólisis oxidativa T = 90 °C y t = 30 minutos) y (6B) termograma de calentamiento de la esponja de queratina E2 (sulfitólisis T = 65 °C y t = 120 minutos).
En el termograma de la esponja de queratina E1 (figura 6A) se observa un pico endotérmico pronunciado a una temperatura de pico (Tp) de 204,2 °C con un valor de entalpía (ΔH) de 234,5 J/g; para la esponja de queratina E2 dicha transición se presenta a 160 °C y con un ΔH de 192,4 J/g. La transición endotérmica indicada en ambos casos corresponde a la desnaturalización de la queratina, indicando que estos materiales presentan una alta estabilidad térmica. Las temperaturas de desnaturalización de las esponjas están dentro de los rangos reportados para la desnaturalización de queratina en plumas de pollo secas (de 170 °C a 200 °C) reportado por Takahashi et al. (2004).
Patrucco et al. (2016) reportaron resultados similares a los obtenidos en el presente estudio para esponjas de queratina obtenidas a partir de lana, cuyo pico de desnaturalización se encuentra entre 230 °C y 240 °C. En el termograma de E2 (figura 6B) se observa un pequeño pico endotérmico a mayor temperatura de Tdesnaturalización y podría ser atribuido a diferentes ΔH de transición de estructuras cristalinas de tipo α-helicoidal (Patrucco et al., 2016)
Conclusiones
Se desarrollaron biomateriales porosos en formato de esponjas de queratina como una opción de revalorización de los residuos de la industria avícola. Estas esponjas presentaron un excelente desempeño como biomateriales sorbentes competitivos en la captación y retención de derrames de crudo, los cuales generan un importante impacto ambiental con buenas capacidades de sorción y retención. Las esponjas sintetizadas con el método E2 presentaron valores más altos de CSC = 21,22 g de crudo/g de sorbente y CRC (78%) que E1 con CSC = 5,7 g de crudo/g de sorbente y CRC = 47%, siendo una alternativa para el control de derrames de crudo. Para su formación, se emplearon agentes desnaturalizantes menos contaminantes y agresivos para el operador como bisulfito de sodio, SDS y urea, en comparación con el 2˗mercaptoetanol o ditiotreitol (DTT C₄H₁₀O₂S₂). El proceso aplicado incluyó una etapa de diálisis y secado por liofilización que permite la formación mediante autoensamblado 3D de la queratina que conlleva a la formación de las matrices porosas.
Otras características destacables de estas esponjas son su baja solubilidad en agua a un pH cercano a la neutralidad y una alta estabilidad térmica, ya que su estructura conserva los principales grupos funcionales característicos de la queratina y la presencia de los grupos SH y S-sulfo (sal de Bunte) y una alta proporción de estructuras del tipo β, probablemente debido a un mayor contenido de raquis en las plumas de partida.
Las metodologías estudiadas permiten la extracción de la queratina y la formación de las esponjas, por lo que es pertinente continuar mejorando las etapas del proceso para lograr una metodología más económica y de viable escalado. Los materiales porosos a base de queratina, generados en el presente trabajo como una opción de revalorización de los residuos de la industria avícola, se destacan por su aplicación ambiental en la sorción de hidrocarburos y podrían ser utilizados en el tratamiento de fuentes hídricas afectadas por derrames de crudo; además, es de interés la evaluación de su potencial aplicación en el tratamiento y la recuperación de otros agentes contaminantes como metales pesados.
Contribución de los autores
Orjuela-Palacio, Juliana: diseño y elaboración del proyecto, metodología, recopilación y análisis de datos, escritura del manuscrito, edición. Zaritzky Noemí: diseño y elaboración del proyecto, metodología, análisis de datos, escritura del manuscrito y edición. Directora del proyecto y financiación.