Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Biotecnología
versión impresa ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.2 Bogotá jul./dic. 2015 Epub 11-Ago-2021
https://doi.org/10.15446/rev.colomb.biote.v17n2.54294
Bionotas
Establecimiento in vitro de Hypericum goyanesii Cuatrec. E Hypericum juniperinum Kunth, a partir del cultivo de semillas
* Ing. de Producción Biotecnológica. Profesional de investigación líder en propagación in vitro. Subdirección Científica. Jardín Botánico de Bogotá José Celestino Mutis. baperez@jbb.gov.co
El propósito de este estudio fue evaluar medios de cultivo de germinación para el establecimiento in vitro de Hypericum goyanesii e Hypericum juniperinum como estrategia de conservación ex situ, por medios biotecnológicos de especies vegetales pertenecientes al ecosistema alto-andino. Las semillas se desinfectaron con hipoclorito de sodio y se sembraron en seis tratamientos basados en los medios de cultivo Murashige & Skoog (MS) y MS con reducción del 50% de sus macro y microsales y vitaminas, con y sin la adición de carbón activado y pulpa de banano. La germinación se favoreció por el empleo de pulpa de banano en el medio MS con reducción de sales y suplementado con carbón activado. Fue posible evidenciar que los explantes sexuales de H. goyanesii e H. juniperinum estuvieron influenciados positivamente en la variable porcentaje de germinación, por el empleo de sustancias orgánicas en reemplazo de reguladores de crecimiento.
Palabras clave: Hypericaceae; cultivo in vitro; germinación; desinfección; medios de cultivo
The purpose of this study was to evaluate germination culture media for the in vitro establishment Hyperi-cum goyanesii e Hypericum juniperinum as ex situ conservation strategy for biotechnology of plant species belonging to the high-Andean ecosystem. The seeds were disinfected with sodium hypochlorite and seeded into six treatments MS and MS with 50% reduction of its macro and microsales and vitaminas, with and without the addition of activated charcoal and pulp banana. Germination is favored by the use of banana pulp in MS medium with reducing salts and supplemented with activated charcoal. It was possible to show that sexual explants and H. goyanesii e H. goyanesii juniperinum were influenced positively variable germination percentage, by the use of organic substances to replace growth regulators.
Key words: Hypericaceae; in vitro culture; germination; disinfection; culture medio
Introducción
A nivel mundial son serias las amenazas que presentan los ecosistemas de montaña, representando los daños más extremos y significativos los Andes (Okada, 2001), que es la cadena montañosa más extensa del mundo y de la cual hace parte el páramo, considerado como uno de los ecosistemas con mayor afectación antrópica del continente (Morales y Estévez, 2006). Colombia no ha sido ajena a ésta problemática, ya que los páramos vienen sufriendo serios procesos de transformación, alteración y degradación, debido a acciones antrópicas como la quema; el empleo de elementos leñosos para combustible y cercas vivas; actividades agrícolas como pastoreo y pisoteo, residuos agropecuarios, corrimiento de límites agrícolas; actividades agrícolas y las obras de urbanismo y civiles, entre otros (Contraloría General de la República, 2012). De ésta forma, se hace necesario generar conocimiento e investigación científica, como elementos fundamentales para asegurar la conservación de la biodiversidad (Josse C. et al., 2009).
Bajo éste concepto, el Jardín Botánico de Bogotá José Celestino Mutis - JBB emplea el Cultivo de tejidos vegetales como una estrategia de conservación ex situ de especies nativas promisorias altoandinas y de páramo. Dos de las especies priorizadas, dentro de ésta línea de investigación, corresponden a H. goyanesii e H. juniperinum, debido a su potencial para la conservación, reintroducción o restauración ecológica.
Teniendo en cuenta que para éstas dos especies se hace necesario desarrollar estudios que determinen los aspectos que influyen en la germinación de sus semillas y que a su vez den lineamientos para un manejo y aprovechamiento adecuados de las mismas, se planteó la presente investigación que tuvo como objetivo evaluar las respuestas germinativas in vitro, en seis medios de cultivo. Se busca que con la metodología aquí expuesta se generen plántulas completas que sean utilizadas como fuente de explantes para los estudios de micropropagación.
Materiales y métodos
Las salidas de campo para la colecta de material vegetal se realizaron en el departamento de Cun-dinamarca: los frutos de H. goyanesii fueron colectados en la reserva El Tablazo, vía al municipio de Subachoque (N 5° 0CT56.5" - W 74° 12'34.0" con una altitud de 3437 m.s.n.m.). El material vegetal de H. juniperinum fue colectado en el páramo de Sumapáz a 3690 m.s.n.m., bajo el siguiente registro geográfico: N 4° 17'24.2" - W 74° 12'28.9". Los frutos colectados fueron transportados en bolsas plásticas al laboratorio de cultivo de tejidos vegetales de la Subdirección Científica del JBB, dónde las semillas fueron recuperadas, limpiadas y almacenadas durante 2 meses a 4 °C.
Las semillas maduras fueron sometidas a un proceso de desinfección superficial, sumergiéndolas durante 10 minutos en agitación constante, en una solución de hipoclorito de sodio al 5% con dos gotas de tween 20. Posteriormente, se enjuagaron tres veces con agua microfiltrada estéril y se depositaron en tubos eppendorf con el fin de llevar a cabo una nueva desinfección empleando la centrífuga. En el proceso de centrifugado se realizó un enjuague con hipoclorito de sodio al 5%, seguido de tres enjuagues con agua microfiltrada estéril. Para cada uno de los enjuagues se manejó un tiempo de 5 minutos y una rotación de 5000 rpm (Pérez-M, 2014).
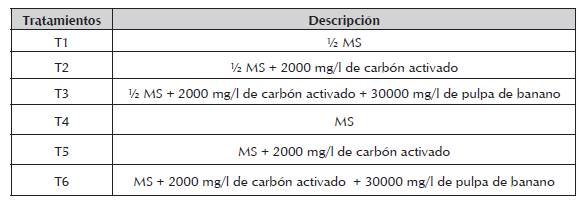
Se elaboraron seis tratamientos de germinación basados en las sales minerales y vitaminas del medio MS (Murashige y Skoog, 1962) al 100% (MS) y al 50% (½ MS) (tabla 1). El empleo de la pulpa de banano y del carbón activado en los tratamientos T2, T3, T5 y T6, se realizó con la finalidad de evaluar su influencia en la germinación de las especies en estudio, teniendo en cuenta los resultados que éstas sustancias han proporcionado en la germinación in vitro de otras especies, especialmente pertenecientes a la familia Orchidaceae. Los suplementos empleados en todos los tratamientos fueron sacarosa (15000 mg/l) y agar (5000 mg/l).
Los nutrientes del medio de cultivo fueron pesados en una balanza analítica de precisión y disueltos en agua microfiltrada. Se emplearon recipientes de vidrio con una capacidad de 100 ml para la distribución de 20 ml de medio en cada uno de ellos. El pH del medio fue ajustado a 5,8 y la esterilización se realizó en una autoclave a 15 libras de presión por pulgada cuadrada (15 lb/in2) durante 15 minutos, con una temperatura de vapor aproximada de 121.5 °C.
Las semillas una vez desinfectadas, fueron sembradas en los seis tratamientos de germinación ya descritos. Se sembraron cuatro semillas por frasco de vidrio con medio de cultivo. Se manejaron para H. goyanesii cinco repeticiones, por tratamiento de germinación. El total de semillas evaluadas para ésta especie fue 120. Para H. juniperinum se sembraron tres repeticiones, con un total de 72 semillas evaluadas. Los frascos se mantuvieron en la sala de incubación durante 18 y 12 semanas, respectivamente, tiempo en el cual se llevó a cabo el registro de la variable germinación. Se manejó un fotoperiodo natural (12/12), con un rango de temperatura entre 19 °C y 27 °C y humedad del 60 % al 80 %. La intensidad lumínica estuvo comprendida entre 1500 lux y 5000 lux.
Análisis estadístico. Se aplicó un diseño experimental completamente al azar para cada una de las dos especies priorizadas. La variable registrada fue el porcentaje de germinación. Los resultados de ésta variable fueron sometidos, por medio del programa estadístico SAS, a un análisis de varianza (ANOVA) y se aplicó la prueba de comparación Múltiple Duncan, con un nivel de confiabilidad del 95%.
Resultados y discusión
El esquema de desinfección brindó una contaminación del 0% en las semillas. Éste esquema fue comparado por Pérez-M, 2014, con otras dos metodologías de desinfección, en las cuales la contaminación promedio registrada en las semillas de H. goyanesii e H. juniperinum fue del 47,5 %.
Se puede determinar que los frutos colectados en su medio natural contaban con buenas condiciones sanitarias que facilitaron la desinfección completa con el empleo del hipoclorito de sodio, el cual es una de las sustancias comúnmente recomendadas para la desinfección superficial de materiales a introducir al cultivo in vitro (Abdelnour y Muñoz, 2005), es útil como germicida y agente oxidante y presenta las ventajas de ser muy eficiente para éste propósito, de ser enjuagado fácilmente y de ser muy económico (Suárez, 1997).
Los porcentajes de germinación obtenidos se dan a continuación para cada especie evaluada:
Hypericum goyanesii. El seguimiento a la variable germinación se realizó durante 18 semanas. Los porcentajes fueron nulos (0%) para todos los tratamientos, excepto para el T3 (V MS suplementado con 2000 mg/L de carbón activado y 30000 mg/L de pulpa de banano), en donde se registró una germinación del 20% al término del tiempo total de evaluación. De ésta forma, se observa que la curva de germinación (figura 1), quedó representada por el único tratamiento que brindó condiciones óptimas para la germinación. Al realizar ANOVA se encontraron diferencias significativas entre los tratamientos evaluados (P= 0.0471). La prueba de comparación múltiple Duncan indicó que el tratamiento que era estadísticamente diferente a los demás, por producir el único efecto en la variable germinación, fue el T3.
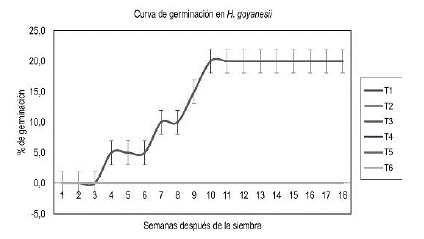
Figura 1 Seguimiento, durante 18 semanas después de la siembra, a la variable porcentaje de germinación en H. goyanesii.
Hypericum juniperinum. Durante las 12 semanas de seguimiento al material sexual de H. juniperinum, la variable germinación fue del 0% para los medios de cultivo T1: ½ MS, T2: ½ MS+ 2000 mg/L de carbón activado, T4: MS y T5: MS + 2000 mg/L de carbón activado y T5: MS + 2000 mg/L de carbón activado.
Para el medio T6: MS suplementado con 2000 mg/L de carbón activado y 30000 mg/L de pulpa de banano, los procesos germinativos iniciaron en la tercera semana de evaluación con un porcentaje del 5%, el cual se incrementó hasta el 41,6% en la décima semana de seguimiento. Con el medio T3: ½ MS suplementado con 2000 mg/L de carbón activado y 30000 mg/L de pulpa de banano, las semillas iniciaron su germinación en un 25% en la tercera semana de evaluación, siendo ésta del 100% en la sexta semana de seguimiento. En la figura 2, se representa la curva de germinación para H. juniperinum, en donde sólo es posible apreciar la respuesta germinativa en los tratamientos T3 y T6, ya que en los demás ésta fue nula (0%). Al realizar la prueba ANOVA se encontraron diferencias significativas entre los tratamientos evaluados (P<0.001). La prueba de comparación múltiple de Duncan determinó que bajo el T3 se obtuvo el mayor valor de la media (100) para la variable evaluada.
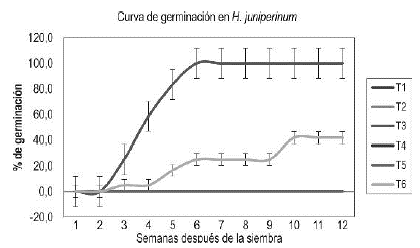
Figura 2 Seguimiento, durante 12 semanas después de la siembra, a la variable porcentaje de germinación en H. juniperinum.
Las semillas de H. goyanesii e H. juniperinum, mostraron un requerimiento específico de reducción en un 50% de las concentraciones de sales minerales y vitaminas presentes en el medio MS. Resultados similares fueron obtenidos por Pérez-M, 2012, quien reportó que el mayor porcentaje de germinación in vitro (62,5%) para Hypericum mexicanum L., en un tiempo de evaluación de 15 semanas, se registró con el medio V MS suplementado con 2000 mg/L de carbón activado.
Cuando ésta composición nutritiva del medio MS unida al carbón activado, fue suplementada con pulpa de banano, se pudo favorecer los porcentajes de germinación en H. goyanesii e H. juniperinum. El carbón activado, se usa para absorber sustancias tóxicas de la microatmósfera gaseosa, generadas durante la incubación in vitro (Arditti y Ernst, 1993; Pedroza et al., 2010). El banano, posee un alto contenido de azúcares, vitaminas, aminoácidos, antioxidantes, minerales, ácidos orgánicos y agentes promotores del crecimiento (Arditti, 1993; Kitsaki et al., 2004; Moreno y Menchaca, 2007; Yam y Arditti, 2009; Yong et al., 2009).
Conclusiones
Considerando que un factor clave en los procesos de propagación in vitro es el lograr la desinfección de explantes, en algunas ocasiones alcanzar este objetivo se convierte en un problema al no disponer de material vegetativo o disponer de él pero en un alto grado de contaminación al colectarlo en condiciones naturales, se plantea que el uso de semillas, como material de partida, es una muy buena alternativa en la obtención de explantes en condiciones asépticas, al inducir su germinación in vitro.
Se determinaron los requerimientos nutricionales para la germinación de las especies. La pulpa de banano mejoró las condiciones nutritivas del medio V2 MS y permitió, junto al carbón activado, la germinación completa en un tiempo de seis semanas para H. juniperinum. Las mismas condiciones nutritivas fueron las únicas que brindaron una germinación total del 20%, al término de 18 semanas para la especie H. goyanesii.
Para ambas especies, son necesarios mas estudios para dilucidar aspectos como germinación por métodos tradicionales o convencionales, la naturaleza y concentración de sustancias inhibitorias de la germinación, requerimientos de luz y pretratamientos de germinación. Sin embargo, se considera que los resultados aquí presentados pueden servir para el desarrollo de un sistema de producción in vitro que posibilite la obtención de plantas completas, a partir de semillas, para ser reintroducidas en su hábitat natural.
Agradecimientos
Al Jardín Botánico de Bogotá José Celestino Mutis-JBB, bajo la dirección del Dr. Luisz Olmedo Martínez Zamora; al Subdirector Científico Mauricio Díazgranados y a la Coordinadora del programa 2, Sandra Liliana Castañeda Garzón, por haberme brindado la oportunidad de conformar el equipo de la Subdirección Científica.
REFERENCIAS
Abdelnour, A., Muñoz, A. (2005). Micropropagación de teca (Tectona grandis L.f). Kurú: Revista Forestal, 2(5), 11 p. [ Links ]
Arditti, J., Ernst, R. (1993). Micropropagation of orchids. John Wiley & Sons, Inc., Nueva York. 1-25. [ Links ]
Contraloría General de la República. (2012). Informe del estado de los Recurso Naturales y del ambiente 2012 y 2013. Recuperado de http://www.contraloriagen.gov.co/documents/10136/76600464/INFORME_MEDIO_AMBIENTE_2012_2013_def_web.pdf. [ Links ]
Josse C., Cuesta F., Navarro G., Barrena V., Cabrera E., Chacón-Moreno E., Ferreira W., Peralvo M., Saito J., Tovar A. (2009). Ecosistemas de los Andes del Norte y Centro. Bolivia, Colombia, Ecuador, Perú y Venezuela. Secretaría General de la Comunidad Andina, Programa Regional ECOBONA-Intercooperation, CONDESAN-Proyecto Páramo Andino, Programa BioAndes, EcoCiencia, NatureServe, IAvH, LTA-UNALM, ICAE-ULA, CDC-UNALM, RUMBOL SRL. Lima. [ Links ]
Kitsaki, C., Zygouraki, S., Ziobora, M., Chintziest, S. (2004). In vitro germination, protocorm formation and plantlet development of mature versus immature seeds from several Ophrys species (Orchidaceae). Plant Cell Reports, 23, 284-290. [ Links ]
Morales-Betancourt, J. A., Estévez-Varón, J. V. (2006). El Páramo:¿Ecosistema en vía de extinción? Revista Luna Azul, 22, 39-51. [ Links ]
Moreno-Martínez, D; Menchaca-García, R. (2007). Efecto de los compuestos orgánicos en la propagación in vitro de Stanho-pea trigina Bateman (Orchiadeace). Foresta Veracruzana, 9(2), 27-32. [ Links ]
Murashige, T., Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco cultures. Physiologia Plantarum, 15, 473-497. [ Links ]
Okada-Katsuo, A. (2001). La biodiversidad y los peligros que la amenazan. En: Perea Dallos Margarita (ed). Biotecnología agrícola: Un enfoque hacia el mejoramiento de plantas. Bogotá: Editora Guadalupe, pp. 29 - 41. [ Links ]
Pedroza-Manrique, J.A., Serrato-Muñoz, L.C., Castaño-Robayo, M. (2010). Efecto del carbón activado y ácido indol acético en el desarrollo de protocormos de Masdevallia coccinea Linden ex Lindl. y Maxillaria nutans Lindl. in vitro. Revista Colombiana de Biotecnología, 12 (2), 86-102. [ Links ]
Pérez-Martínez, B.A. (2014). Protocolos de propagación por técnicas biotecnológicas de dos (2) especies priorizadas (Hypericum goyanesii Cuatrec. e Hypericum juniperinum Kunth) para la conservación, reintroducción, restauración y ecología urbana y su validación masiva. Informe técnico inédito contrato 600-2013. Jardín Botánico José Celestino Mutis-Subdirección Científica. Bogotá D.C. [ Links ]
Pérez-Martínez, B.A. (2012). Protocolos de propagación por técnicas biotecnológicas de dos especies priorizadas en el proyecto 318 (Hypericum mexicanum y Diplostephium rosmarinifolium) y apoyo en actividades de transferencia de información a la comunidad. Informe técnico inédito contrato 209-2012. Jardín Botánico José Celestino Mutis-Subdirección Científica. Bogotá D.C. [ Links ]
Suárez, A. E. (1997). Métodos de asepsia y esterilización. En: M. Perea y J. Cedeño (Eds.). Cultivo de Tejidos Vegetales y sus Aplicaciones en la Agricultura. Curso: UDO-OIEA, Maturín, Venezuela. Pp. 33-40. [ Links ]
Yam, Tim., Arditti, J. (2009). History of orchid propagation: a mirror of the history of biotechnology. Plant Biotechnology Reports, 3 (1), 1-56. [ Links ]
Yong, J., Ge, L., Yan, F., Ngin, S. (2009). The chemical composition and biological properties of coconut (Cocos nucifera L.) water. Molecules, 14, 5144-5164. [ Links ]
Recibido: 15 de Marzo de 2015; Aprobado: 16 de Octubre de 2015











 texto en
texto en