Introducción
La detección de metales pesados en fuentes hídricas (mercurio, plomo, cadmio, y níquel, entre otros) ha generado una gran problemática ambiental, la cual se debe principalmente al aumento de procesos industriales que envuelven el uso de esos materiales sin seguir las regulaciones legales vigentes 1,3. Los metales pesados tienden a persistir en el ambiente por largos períodos de tiempo, son altamente tóxicos, y están asociados al desarrollo de enfermedades en los seres humanos 4,6. Debido al impacto ambiental causado por los metales pesados, se han elaborado diversas metodologías para el tratamiento de aguas residuales industriales, entre las cuales se encuentran: precipitación, intercambio iónico, oxido-reducción, tratamiento electroquímico, filtración, entre otras; sin embargo, estos métodos han resultado costosos e ineficientes, especialmente cuando se trata de remover bajas concentraciones de los metales pesados, y por el problema de la generación de residuos contaminados 7,8.
En este contexto surge la bioadsorción como una alternativa para la remoción de metales pesados, dándole así utilidad a desechos agroindustriales como adsorbentes potenciales de materiales tóxicos presentes en efluentes acuosos 9,10. La capacidad de adsorción de los residuos sólidos provenientes de la agricultura se debe a su estructura lignocelulósica y grupos químicos funcionales (aminas, carboxílicos, etc), que se encuentran presentes en su superficie y que son afines para interactuar químicamente con las especies iónicas contaminantes 7,8.
Además, estos residuos agroindustriales se pueden obtener a muy bajo costo, comparado a otros adsorbentes como el carbón activado 11.
En la literatura se reportan diversos trabajos donde las biomasas residuales son usadas para reducir la presencia de contaminantes en solución; sin embargo son pocos los trabajos que han estudiado la remoción de dos o más contaminantes simultáneamente, siendo esta una materia de gran interés por cuanto la mayoría de contaminantes no se encuentran solos en soluciones reales. En general, rara vez existen especies individuales de metales tóxicos en arroyos naturales o efluentes residuales 12.
Se destaca el estudio realizado por Hossain y colaboradores, referente a la capacidad de adsorción de residuos de col como biosorbente en sistemas de sorción ternarios y cuaternarios con los iones metálicos de Cu (II), Pb (II), Zn (II) y Cd (II). A partir de este estudio se concluyó que la mayor cantidad de metal removido se da solo con el plomo, mientras que la adsorción de los otros metales fue suprimida por la presencia de los mismos 13. Además, cuando se experimentó en sistemas ternarios, se observó una competencia antagónica de los metales, con una dependencia lineal inversa entre las capacidades de sorción y el número de diferentes tipos de iones metálicos competitivos 13. Así mismo se realizó un estudio utilizando quitosano modificado magnéticamente y se encontró que la adsorción metálica fue antagónica, y solo el plomo presentó resultados constantes en todas las mezclas metálicas 13,14.
En el proceso de bioadsorción se distinguen dos componentes, el "adsórbate" que es la especie que se concentra en la superficie de la biomasa y el "biosorbente" que sería el mismo material lignocelulósico. Para que la remoción pueda llevarse a cabo, se necesita que haya afinidad entre el biosorbente y los adsorbatos, ya sea a través de mecanismos fisicoquímicos o el intercambio iónico 15.
Para la fijación de metales pesados en la bioadsorción, se han sugerido una serie de mecanismos que explican cómo puede darse la retención del metal en el biosorbente, entre los cuales se encuentran 16:
Complejación o quelación: el metal se une a los centros activos de la pared celular de la biomasa mediante enlaces químicos, formando determinados complejos.
Adsorción física: se incluyen aquí los fenómenos asociados a fuerzas de Van der Waals. En este caso la bioadsorción es rápida y reversible.
Intercambio iónico: propio de los iones metálicos divalentes que se intercambian con iones propios de los polisacáridos presentes en la biomasa. El proceso también es rápido y reversible.
Precipitación: el mecanismo está asociado a la formación de un complejo en la pared celular que posteriormente es hidrolizado.
En cuanto al tipo de biomasa utilizada, la biomasa muerta (residuos agroindustriales como cáscaras, fibras y cortezas) tienen ventajas sobre el uso de biomasas microbianas (hongos, algas y bacterias), ya que no es necesario adicionar nutrientes, el adsorbente resulta inmune a la toxicidad, no hay limitaciones biológicas, y la recuperación de los metales pesados (desorción) resulta más fácil, comportándose la biomasa como un intercambiador de iones. No obstante lo anterior, se han reportado algunas desventajas con el uso de biomasas lignocelulósicas, tales como una rápida saturación del sólido y alta sensibilidad hacia los cambios de pH, entre otros 15.
En general se define a la biomasa lignocelulósica, como el conjunto de materia vegetal compuesta de lignina, hemicelulosa y celulosa; estructuras que le confieren a estas biomasas la capacidad de retener metales pesados, por cuanto tienen grupos químicos funcionales. La lignocelulosa se encuentra en las paredes celulares de las plantas y su porcentaje/ composición varía respecto a la especie de las mismas 17.
En este trabajo se presenta un estudio tipo batch de la adsorción de Pb (II) y Ni (II) en solución binaria utilizando tusa de maíz y cáscara de naranja, con el fin de evaluar el uso de materiales de desecho en procesos de descontaminación de efluentes. Las condiciones de trabajo fueron pH 6,0 y tamaño de biomasa de 0,5 mm. Las concentraciones iniciales de cada metal se variaron en un rango de 25, 50, 75 y 100 ppm. Las mediciones de concentración residual de los metales se realizaron por absorción atómica, con el propósito de determinar el efecto que tiene la concentración inicial de cada metal y las soluciones binarias en el porcentaje de remoción de los contaminantes. Además, se presenta el ajuste de los datos experimentales con los modelos de isotermas de Freundlich y Langmuir, consiguiendo así determinar la acción antagonista de cada metal respecto a la biomasa utilizada.
Materiales y métodos
Preparación de bioadsorbentes: las cáscaras de naranja y tusa de maíz fueron obtenidas como parte de los residuos de empresas de alimentos ubicadas en la ciudad de Cartagena, Colombia. Estas fueron inicialmente lavadas con agua destilada para eliminar impurezas y compuestos solubles. Luego se sometieron a un proceso de secado bajo una temperatura de 90°C durante 24h. Posterior al proceso de secado, el tamaño de los materiales bioadsorbentes fue reducido mediante un molino de rodillo, por 20 min hasta obtener partículas pequeñas de biomasa. La clasificación se llevó a cabo en una tamizadora tipo shaker a través una serie de tamices, del cual se escogió el tamaño de 0,5 mm para ambas biomasas. Los grupos químicos funcionales presentes en ambas biomasas, fueron determinados por espectroscopia de infrarrojo de transformada de Fourrier FTIR, utilizando un equipo NICOLET 6700.
La preparación de las soluciones de Ni (II) y Pb (II) se realizó tomando la cantidad necesaria de sulfato de níquel y nitrato de plomo a 1000 ppm, diluyendo hasta llevar a la concentración necesaria. Inicialmente se estudió la cinética de cada metal para determinar el tiempo óptimo de contacto. Todos los experimentos fueron llevados a cabo a temperatura ambiente (25°C) a pH 6,0 en un shaker a 150 rpm. La cinética del proceso se efectuó con cada biomasa en estudio, empleando 100 mL de solución metálica a 100 ppm. Luego se investigó el comportamiento del sistema binario a diferente concentración inicial de los metales estudiados: 25, 50, 75, y 100 ppm, ajustando el proceso a las isotermas de adsorción de Langmuir y Freundlich utilizadas para describir las propiedades superficiales y los mecanismos de adsorción que toman lugar.
La isoterma de adsorción Langmuir, tradicionalmente se ha utilizado para cuantificar y comparar el desempeño de diferentes biosorbentes. En su formulación, este modelo empírico asume una monocapa de adsorción, donde esta solo puede producirse en un número finito de áreas definidas localizadas, que son idénticas y equivalentes. Gráficamente, se caracteriza por una meseta, un punto de saturación de equilibrio en el que una vez que una molécula se encuentra en un sitio, no se da más el proceso de adsorción 13.
El modelo de Langmuir puede expresarse como:
Donde q e es la concentración del metal adsorbido en el bioadsorbente, C f es la concentración residual del metal en solución, q max es la adsorción máxima correspondiente a los sitios de saturación, y K es la relación entre la tasas de adsorción/desorción 18.
El modelo de Freundlich, es la primera relación conocida que describe la no idealidad y la adsorción reversible, el cual no se limita a la formación de una monocapa. Este modelo empírico se puede aplicar a múltiples capas de adsorción, con una distribución no uniforme de calor y afinidades de adsorción sobre la superficie heterogénea 19. En la actualidad la isoterma de Freundlich se aplica ampliamente en sistemas heterogéneos, especialmente para compuestos orgánicos o especies altamente interactivas sobre carbón activado. Este se representa como:
Donde K f es la constante de Freundlich, n representa la intensidad de adsorción, q e es la cantidad de metal adsorbido en el equilibrio, y C eq es la concentración residual del metal en solución 19.
El análisis de Ni (II) y Pb (II) en solución, se realizó mediante espectroscopia de absorción atómica de la solución al final del proceso. El análisis estadístico y ajuste de los datos a los modelos trabajados, se realizó haciendo uso de la herramienta Solver de Excel.
Resultados
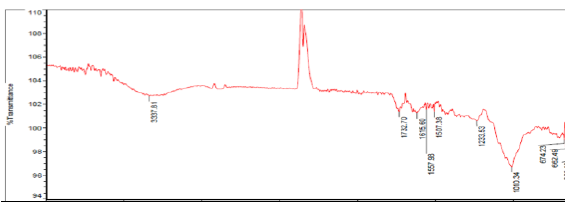
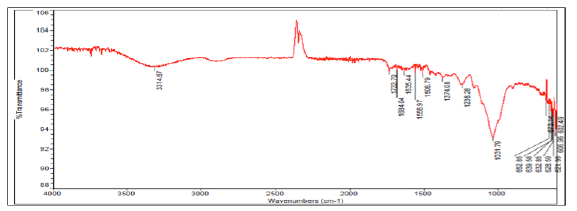
En la Figura 1 y2se muestran los espectros de infrarrojo obtenidos para la cáscara de naranja y la tusa de maíz antes del proceso de adsorción de los iones metálicos. En ambos espectros se exponen picos muy anchos, lo cual indica la compleja naturaleza de estos materiales lignocelulósicos. En la Figura 1 se observa para la cáscara de naranja un pico ancho e intenso en la longitud de onda de 3337,81 cm-1, el cual puede deberse al estiramiento de los grupos hidroxilo presentes en esta biomasa, los cuales de acuerdo a la literatura se encuentran en el rango de 3300-3600 cm-1. Por su parte la tusa de maíz, también presentó grupos hidroxilos en su estructura molecular de acuerdo al pico observado en la Figura 2 a 3314,61 cm-1. Los picos alrededor de 1732,70 cm-1 y 1733,70 cm-1 en el espectro de la cáscara de naranja y la tusa de maíz, respectivamente, corresponden al estiramiento del grupo carbonilo C=O, lo cual puede deberse a la vibración de los grupos carboxilo de pectina, hemicelulosa y lignina presentes en las biomasas estudiadas 14. En adición, el estiramiento del grupo funcional C=C observado en los picos 1615,60 cm-1 y 1684,04 cm-1 de la cáscara de naranja y la tusa de maíz respectivamente, puede atribuirse a la presencia de benceno o anillos aromáticos en la lignina de estas biomasas 13.
El pico mostrado alrededor de 1557,98 cm-1 en el espectro de la cáscara de naranja (Figura 1) puede deberse a la presencia de (C-H) alifáticos, grupos aromáticos y las vibraciones de metilo, metileno y grupos metoxi. Mientras que la intensa banda que comprende desde los picos 1233,54 cm-1 hasta 608,76 cm-1 puede corresponder al grupo C-O de alcoholes y ácidos carboxílicos. En el espectro de la tusa de maíz (Figura 2), se puede observar a 1558,97 cm-1 la presencia de grupos (C-H) alifáticos, grupos aromáticos y las vibraciones de metilo, metileno y grupos metoxi. Adicionalmente, la intensa banda comprendida entre los picos 1238,28 cm-1 hasta 602,49 cm-1 puede indicar la presencia de alcoholes y ácidos carboxílicos en la estructura de esta biomasa. (Figuras 1 y 2)
Al realizar el estudio cinético de la adsorción de los iones metálicos níquel y plomo con las biomasas de tusa de maíz (Figura 3) y cáscara de naranja (Fig. 4), se observó un rápido equilibrio en la capacidad de adsorción de ambos metales con las dos biomasas estudiadas.
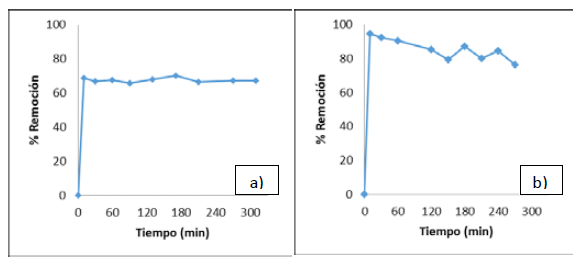
Figura 3 Cinética de adsorción usando la biomasa de tusa de maíz para (a) ion metálico Ni (II) y (b) ion metálico Pb (II)
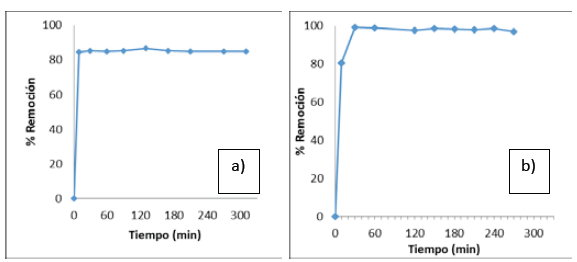
Figura 4 Cinética de adsorción usando la biomasa de cáscara de naranja para (a) ion metálico Ni (II) y (b) ion metálico Pb (II).
En el caso del níquel, se evidenció un aumento de casi el 20% en la capacidad de adsorción, aprovechando la biomasa de cáscara de naranja, por cuanto se alcanzó un porcentaje de remoción del 85% con esta biomasa (Figura 4a). En cuanto al plomo, a pesar de que se observó una mejora en el porciento de remoción manejando la biomasa de cáscara de naranja, este aumento fue solo del 13%, obteniéndose una remoción del 98% con este biomaterial (Figura 4b).
En la tabla 1 se muestran los resultados del estudio de la concentración inicial del metal sobre la adsorción para cada contaminante y en sistema binario. A partir de estos resultados, se estableció que en términos de eficiencia, esta no se ve influenciada por la cantidad de metal presente en la solución inicial, pues se conservó la tendencia de los porcentajes de remoción del contaminante. Así mismo la competencia metálica no afectó en gran medida la adsorción de los metales; por tanto hay igual disponibilidad de sitios activos en las biomasas para ambos contaminantes. (Tabla 1)
Tabla 1 Eficiencia de remoción en sistemas individuales y binarios
| Concentración inicial (mg/L) | Plomo % de remoción | Níquel % de remoción | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tusa | Tusa binario | DS | Naranja | Naranja binario | DS | Tus | Tusa binario | DS | Naranja | Naranja binario | DS | |
| 25 | 92,9 | 88,8 | 0,003 | 99,0 | 89,46 | 0,004 | 70,9 | 70,5 | 0,001 | 80,4 | 93,4 | 0,003 |
| 50 | 93,8 | 93,5 | 0,002 | 99,1 | 92,03 | 0,004 | 70,7 | 67,5 | 0,002 | 86,8 | 88,4 | 0,004 |
| 75 | 94,3 | 94,3 | 0,001 | 99,2 | 91,33 | 0,001 | 66,8 | 70,5 | 0,005 | 83,4 | 87,3 | 0,001 |
| 100 | 94,5 | 94,2 | 0,001 | 99,2 | 93,50 | 0,001 | 68,7 | 71,9 | 0,007 | 84,9 | 82,3 | 0,006 |
DS: Desviación Estándar (cada medición fue realizada por triplicado).
Además, en las Figuras 5 y 6 se estableció la alta correlación de los datos experimentales con los modelos de Langmuir y Freundlich tanto en los sistemas binarios como individuales, por lo cual puede explicarse la adsorción por estos materiales satisfactoriamente.
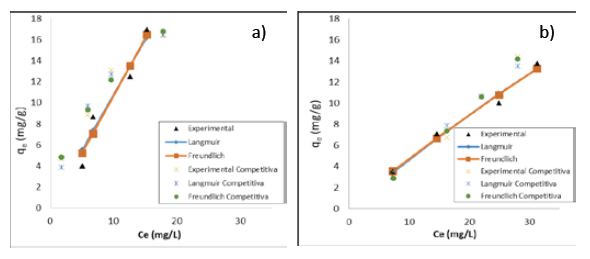
Figura 5 Ajuste de los modelos de isotermas de adsorción para Ni (II) sobre (a) cáscaras de naranja y (b) tusa de maíz
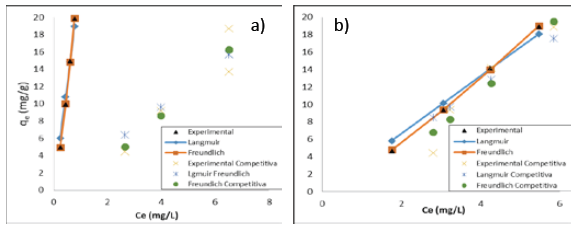
Figura 6 Ajuste de los modelos de isotermas de adsorción para Pb (II) sobre (a) cáscaras de naranja y (b) tusa de maíz
En cuanto a los parámetros calculados a partir de los modelos cinéticos, estos se muestran en las Tablas 2 y 3. Lo primero que se pudo establecer es que al darse el contacto bimetálico, la capacidad de adsorción del níquel en la tusa de maíz se vio notablemente mejorada, caso contrario a lo que sucede con el plomo en el mismo biomaterial. Mientras que sobre las cáscaras de naranja la adsorción de plomo se vio ligeramente mejorada, en contraste con la adsorción de níquel que disminuyó cerca de un 90%. Del parámetro b de la isoterma de Langmuir que es un indicativo de la energía de enlace entre el metal y el ion metálico, se concluyó que conforme aumenta la capacidad de adsorción, esta energía disminuye; mientras que el valor de 1/n que en todos los casos es cercano a 1,0, indica que la isoterma de Freundlich se puede aproximar a la de Langmuir. Así se pudo concluir que el enlace se dio principalmente por fuerzas físicas, limitadas a la formación de una monocapa, además que inicialmente todos los sitios están disponibles, y las especies adsorbidas no exceden estos espacios; asimismo no se consideró ninguna reacción de desorción que pueda tener lugar durante el proceso de remoción 20 (Tabla 2).
Tabla 2 Parámetros para la adsorción de Pb (II) en sistemas binarios e individuales
| Modelo | Tusa de maíz | Cáscaras de naranja | |||
|---|---|---|---|---|---|
| Isoterma | Parámetros | Pb (II) | Pb (II) | Pb (II) | Pb (II) |
| competitiva | competitiva | ||||
| qmax | 2687,74 | 1413,72 | 3171,86 | 3224,07 | |
| Langmuir | b | 0,0012 | 0,0021 | 0,0077 | 0,0007 |
| Suma | 2,66 | 19,67 | 2,70 | 16,79 | |
| Kf | 2,41 | 1,55 | 27,00 | 1,43 | |
| 1/n | 1,21 | 1,43 | 1,21 | 1,30 | |
| Freundlich | Suma | 0,0793 | 10,10 | 0,0187 | 13,14 |
En general se estableció que la superficie de las biomasas es heterogénea y además durante el proceso de adsorción los sitios activos de sorción son ocupados primero por enlaces fuertes y dicha fuerza va decreciendo a medida que estos son ocupados por los iones de Ni (II). (Tabla 3)
Tabla 3 Parámetros para la adsorción de Ni (II) en sistemas binarios e individuales
| Modelo | Tusa de maíz | Cáscaras de naranja | |||
|---|---|---|---|---|---|
| Isoterma | Parámetros | Ni (II) competitiva | Ni (II) | Ni (II) competitiva | Ni (II) |
| qmax | 103,61 | 1016,9 | 390,59 | 24,76 | |
| Langmuir | b | 0,0047 | 0,0005 | 0,0029 | 0,1114 |
| Suma | 1,08 | 1,9956 | 5,49 | 1,56 | |
| Freundlich | Kf | 0,5906 | 0,2606 | 1,0233 | 3,71 |
| 1/n | 0,9039 | 1,1979 | 1,0236 | 0,5262 | |
| Suma | 0,9737 | 0,8583 | 5,35 | 1,32 | |
Se dedujo una capacidad máxima de adsorción de 2687 mg/g para el plomo y 1016,9 mg/g para el níquel, utilizando la biomasa de tusa de maíz. En el caso de la biomasa de cáscara de naranja, se determinó una adsorción de 3224,07 mg/g para el plomo y 390,59 mg/g para el níquel, mostrando que son materiales que podrían ser usados para la remoción de estos metales, aun cuando estén en solución binaria, pues se siguen obteniendo altas capacidades de sorción, cuando se compara con otros trabajos como el reportado por Kumar y colaboradores, quienes emplearon cáscaras de nueces para adsorción de níquel (II) obteniendo una capacidad de adsorción de 18,86 mg/g 21, la cual es ampliamente superada por la capacidad de las biomasas utilizadas en este estudio.
En futuros trabajos se recomienda evaluar la desorción de los materiales en estudio mediante el uso de diversos agentes eluyentes, tales como buffers antiquelantes, que permitan la recuperación de los metales. Además, referente a la reutilización de las biomasas, se exhorta experimentar con más ciclos de remoción, para determinar la saturación de estos biomateriales y posterior recuperación de los metales pesados por mecanismos de desorción controlada.