INTRODUCCIÓN
Los bioestimulantes en el contexto de la agricultura son definidos como un grupo de sustancias o microorganismos benéficos que inducen respuestas fisiológicas en las plantas, especialmente bajo condiciones desfavorables, y conducen a mejorar su desempeño coadyuvando a la tolerancia frente al estrés (Shah et al., 2021), intervienen positivamente en la regulación del metabolismo primario y secundario, modifican la arquitectura del sistema radical, mejoran las habilidades nutricionales (Rouphael and Colla, 2020a) y favorecen el crecimiento y desarrollo de las plantas cultivadas (Nardi et al., 2021). Los bioestimulantes vegetales comprenden ácidos húmicos y fúlvicos, hidrolizados de proteínas, aminoácidos y otros compuestos nitrogenados, oligosacáridos, compuestos inorgánicos, extractos de algas y productos botánicos, además de los insumos a base de microorganismos (Bhupenchandra et al., 2020; Du Jardin et al, 2020, Shahrajabian et al, 2021).
Las chalconas son compuestos fenólicos que se encuentran de manera natural en las plantas, se pueden encontrar en forma de agliconas y O-glucósidos de chalcona en diferentes familias botánicas, con especial distribución en la familia Leguminosae. Se consideran moléculas multifuncionales, puesto que una estructura en particular puede mostrar múltiples actividades biológicas (Aljamali et al., 2020); están involucradas en procesos del metabolismo vegetal primario y secundario (Yingjia et al., 2022) y presentan propiedades bioactivas en organismos procariotas y algunos eucariotas (Cadena, 2018), entre ellas esta su actividad antioxidante (Goyal et al., 2021), antimicrobiana (Vasquez-Martinez et al., 2019) y anticancerígena (Constantinescu and Lungu, 2021). Se considera que la presencia de dobles enlaces en conjugación con el grupo carbonilo le confiere a las chalconas la funcionalidad que ocasiona las actividades biológicas, puesto que la eliminación de estas características las hace inactivas (Singh et al., 2014).
Hasta el momento, las chalconas no se han incluido dentro de la categoría de los bioestimulantes vegetales, sin embargo, estos compuestos podrían considerarse dentro de esta definición, tras comprobar sus aplicaciones en la agricultura. Esto puede ser factible dado que están involucradas en una variedad de funciones metabólicas vegetales como la actividad antioxidante, la capacidad para inducir la respuesta de defensa frente al ataque por patógenos (Aljamali et al., 2020), además de favorecen la comunicación entre la raíz y los microorganismos benéficos. Se ha encontrado que pueden estimular la reproducción, el crecimiento y favorecer la adaptación vegetal ante factores de estrés (Rai et al., 2021) como las infecciones fúngicas o bacterianas y la radiación UV (Jayaraman et al., 2021). En algunas plantas leguminosas las chalconas se han relacionado con la inducción de la expresión de los genes nod, responsables de la formación de nódulos fijadores de nitrógeno por bacterias del género Rhizobium (Stambulska et al., 2020), dado que después de la biosíntesis de las chalconas ocurre una isomerización que da origen a los flavonoides (Zhou et al., 2021), estos compuestos son intermediarios de la comunicación planta-bacteria, lo cual es un requisito necesario para la formación de la simbiosis (Mathesius, 2019; Rosa et al., 2021).
Las chalconas se pueden extraer a partir de los tejidos vegetales, sin embargo, la extracción con fines tecnológicos y comerciales para aplicaciones de uso masivo no es totalmente factible, debido a la baja concentración y dificultad de purificación, por lo cual se ha investigado la producción de chalconas sintéticas en mayores cantidades y a bajo costo, para diferentes propósitos industriales (Ibarra y Gutierrez, 2016). Algunos estudios de chalconas sintéticas han mostrado su capacidad para promover el crecimiento en diferentes plantas medicinales como Albahaca, menta y flor de Jamaica (Hassan et al., 2020) y leguminosas como soya, maní y garbanzo (Kalambe, 2017)
Las zonas áridas y semiáridas de La Guajira son afectadas por problemas de seguridad alimentaria y este es uno de los cultivos de subsistencia de mayor importancia, dado que reúne características favorables para su producción agroecológica (Valero et al., 2021), de tal forma que es conveniente estudiar estrategias para incrementar su producción, para ello es necesario desarrollar y evaluar tecnologías pertinentes para mejorar la adaptación y el desempeño de las plantas bajo las condiciones climáticas y edáficas limitantes en esta zona.
Así, en este trabajo se estudiaron algunos efectos de la aplicación de la chalcona sintética 3-(4-nitrofenil)-1-(piridin-2-il)-prop-2-en-1-ona sobre aspectos relacionados con el crecimiento temprano y la formación de nódulos fijadores de nitrógeno bajo condiciones controladas, con el propósito de aportar evidencia sobre el posible uso de esta chalcona como un agente bioestimulante para el frijol guajiro.
MÉTODO
Síntesis de la chalcona
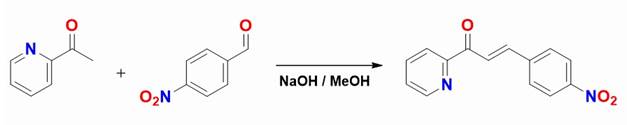
El compuesto 3-(4-nitrofenil)-1-(piridin-2-il)-prop-2-en-1-ona que en adelante se denominará (CHSNPP) (figura 1) fue preparada siguiendo la metodología descrita por Liu et al. (2013) con pequeñas adaptaciones. Se preparó una suspensión en agua de la piridina (1 mmol) y el aldehído correspondiente (1,05 mmol), se tomaron 10 ml de dicha suspensión y se adicionaron 10 ml de NaOH en solución (1,0 mmol), esta mezcla fue agitada durante 12 horas a temperatura ambiente, el precipitado resultante se separó por filtración y se recristalizó en metanol para generar un polvo amarillo claro. El rendimiento fue del 86 %, el compuesto resultante presenta un punto de fusión de 157 ºC y las siguientes bandas características del espectro Infrarrojo (ATR, cm-1): 1668 (banda C=O), 1606 (banda C=N), 1577 (banda C=C).
Evaluación del efecto de la chalcona sobre el crecimiento temprano y formación de nódulos por rizobios
El experimento fue desarrollado en el laboratorio de ciencias ambientales de la Universidad de La Guajira (ciudad de Riohacha, Colombia). Las semillas de frijol guajiro utilizadas en los experimentos se compraron a cultivadores locales en el mercado público de la ciudad de Riohacha. Para los ensayos se utilizó suelo fresco colectado en los primeros 20 cm del horizonte superficial, en un predio rural cultivado con V. unguiculta localizado en la localidad de Uribia (11°35'38,8'' N, y 72°19'28,5'' W), en una zona semiárida de la media Guajira, cuyas características son: textura arenosa franca (arena 84 %, limo 10 %, arcilla 6 %), pH alcalino (8), alta salinidad (conductividad eléctrica de 17,8 dSm), contenido limitante de N (0,25 %), contenido medio de fósforo disponible (124 ppm) baja capacidad de intercambio de cationes (9,2 cmol (c) Kg-1), bajo contenido de materia orgánica (0,67 %), baja saturación de bases ( contenido de K, Mg, Ca y Na es de 0,44, 1,6, 6,7 y 0,45 cmolc*kg-1).
Para evaluar el efecto sobre el crecimiento temprano y formación de nódulos por rizóbios, en plantas de frijol guajiro (Vigna unguiculata L. Walp), se realizó por duplicado un experimento en macetas, bajo condiciones controladas en una cámara de crecimiento vegetal. Se evaluó el efecto de tres concentraciones de CHSNPP (25, 50, 100 y 150 ppm) y dos formas de aplicación: 1) inmersión (IM) completa de plántulas tras 24 horas después de la germinación, en las soluciones de CHSNPP, y 2) aspersión foliar (AF) de las soluciones sobre plántulas.
Se tomaron semillas de V. unguiculta y se lavaron con solución de detergente al 1 % durante 10 minutos, posteriormente se enjuagaron con agua potable y se sumergieron en una solución de hipoclorito de sodio al 2,5 % por 15 minutos, luego se enjuagaron tres veces con agua estéril y se llevaron a germinación in vitro en cámara de humedad, después de la germinación se tomaron grupos de 20 plántulas con tamaño de radícula homogéneo y se sumergieron por tres horas en cada una de las cuatro soluciones de CHSNPP y en agua destilada para el tratamiento control; las soluciones se prepararon en agua estéril desionizada a partir de una solución stock de CHSNPP utilizando acetona al 20 % como diluyente. Cada plántula tratada se sembró en una maceta con 500 g de suelo, en las muestras de suelo utilizado previamente se confirmó la presencia de una población basal de rizobios con capacidad para nodular esta leguminosa (Valero et al., 2021).
Las macetas con las plántulas tratadas se llevaron a una cámara de crecimiento vegetal SANYO MLR-351 bajo un fotoperíodo de 12 horas, humedad relativa entre 60 y 80 %, temperatura entre 26 y 29 °C y riego por capilaridad con agua potable, tres veces por semana. Para la aplicación por aspersión foliar se tomaron grupos de 20 plántulas con tamaño de radícula homogéneo, obtenidas como se describió previamente, se sembraron en las macetas con suelo y 7 días después de la aparición de las primeras hojas se asperjaron 5 ml de las soluciones de 25, 50, 100 y 150 ppm de de CHSNPP sobre el haz y envés de todas las hojas, la aplicación se llevó a cabo una hora después de concluido el período de iluminación, en el tratamiento control se asperjaron las plantas con agua destilada; las plantas se mantuvieron bajo las mismas condiciones descritas previamente.
A los 21 y 28 días después de la emergencia de las plantas se determinó el índice relativo de contenido de clorofila (ICC), utilizando un medidor de clorofila digital SPAD-502 marca Minolta, se tomó el valor ICC calculado por el equipo tras el registro de la transmitancia de la luz a 650 y 940 nm en todos los foliolos de 3 hojas ubicadas en la parte media de la planta. Después de 30 días se desenterraron las plantas, se lavaron minuciosamente y se determinaron las siguientes variables: área foliar, número de raíces, biomasa seca de raíz y follaje tras secado en horno a 70 °C hasta peso constante. Adicionalmente se determinó el número de nódulos radicales fijadores de nitrógeno activos por planta, para ello de contaron los nódulos y tras hacer un corte por mitad de cada nódulo severificó la coloración roja brillante en el interior dada por la presencia de leghemoglobina; este dato se tomó como indicador del desarrollo de la simbiosis Rhizobium-leguminosa, a causa de la población nativa de rizóbios que estaba presente en el suelo utilizado para el ensayo. A partir de secciones desinfectadas de nódulos activos se procedió a hacer un aislamiento de rizóbios en medio selectivo YMA con adición de Rojo Congo, siguiendo la metodología descrita por Cubillos-Hinojosa et al. (2021), esto para confirmar que los nódulos formados corresponden efectivamente a la simbiosis con Rhizobium.
Los datos de cada variable fueron sometidos a verificación de los parámetros de normalidad y homogeneidad de varianza. Se realizó un análisis de varianza bajo un diseño en bloques, por cada variable, utilizando el paquete de análisis estadístico SAS® versión University Edition. Se realizaron pruebas de comparación de medias de cada variable mediante el test de Duncan (p= 0,05) para establecer el mejor tratamiento en cada una de las variables analizadas.
RESULTADOS
Efectos de la aplicación de chalcona sintética en el crecimiento de V. unguiculta
Los dos métodos de aplicación de CHSNPP, por inmersión (IM) y aspersión foliar (AF) ocasionaron un efecto positivo con respecto a las plantas no tratadas, en relación al área foliar, número de raíces, la biomasa del follaje y raíces, además de la formación de nódulos fijadores de nitrógeno en las raíces; pero no se encontró diferencia significativa que indique que una forma de aplicación presenta mejores resultados que la otra. En la figura 2A se observa que todas las concentraciones de CHSNPP utilizadas ocasionan incrementos en el área foliar, con un mejor efecto ocasionado por las concentraciones de 100 y 150 ppm en aplicación por AF. También se observa una tendencia al incremento en el número de raíces (figura 2B) por planta en respuesta al tratamiento con todas las concentraciones en las dos formas de aplicación, pero solamente el tratamiento a 150 ppm en aplicación por IM presentó diferencia significativa en esta variable. Igualmente, los tratamientos con 50 ppm por IM, 100 y 150 ppm por AF ocasionaron diferencias significativas en la biomasa del follaje (figura 2C), mientras que las demás concentraciones en los dos métodos de aplicación mostraron tendencias al incremento en esta variable.
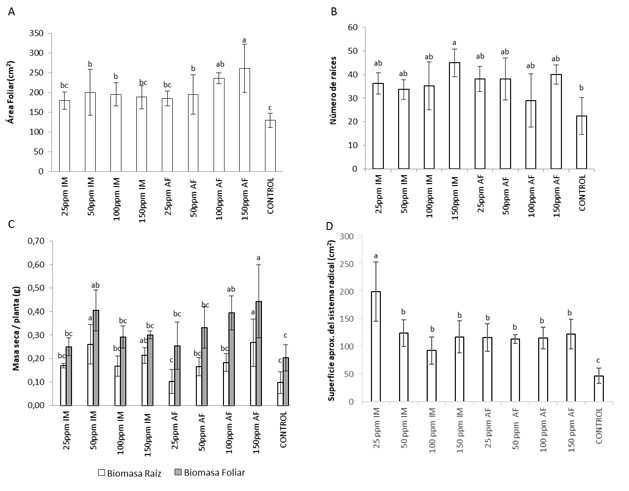
Figura 2 Parámetros de crecimiento en plantas de frijol guajiro tratadas con CHSNPP mediante aplicación por inmersión de las plántulas (IM) en la solución de chalcona y aspersión foliar (AF) A. Area Foliar B. Número de raíces C. Masa seca D. Superficie del sistema radical, comparaciones con el test de Duncan (p= 0,05).
En complemento al anterior resultado, las observaciones del sistema radical (figura 3) muestran algunos cambios cualitativos en la arquitectura de las raíces de plantas tratadas con diferentes concentraciones de CHSNPP mediante las dos formas de aplicación probadas, mientras que en las raíces de las plantas control se observan raíces más cortas y apariencia menos ramificada, en las raíces de las plantas tratadas se observa proliferación de raíces y mayor longitud de las raíces principales, así como mayor desarrollo de raíces secundarias y raicillas finas. En concordancia con estas observaciones, la determinación de biomasa de las raíces mostró que algunas concentraciones de CHSNPP aplicadas por los dos métodos ocasiona mayor ganancia de biomasa (figura 2C), los mayores valores se presentaron para las plantas tratadas con 50 ppm por inmersión de las plántulas en solución de CHSNPP y 150 ppm por aspersión foliar (P<0,05). Todos los tratamientos también ocasionaron aumento significativo en la superficie estimada del sistema radical, con diferencias muy marcadas con respecto al tratamiento control (Figura 2D).
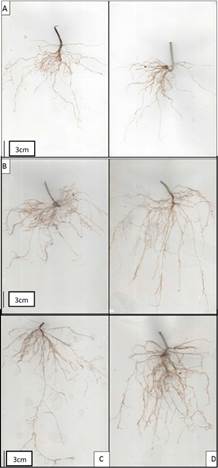
Figura 3 Arquitectura del sistema radical de plantas de frijol guajiro tratadas con CHSNPP: A) control, B) 150 ppm -AF, C) 25 ppm-IM y D) 50 ppm - IM.
Los resultados descritos aportan evidencia de efectos estimuladores del crecimiento vegetal por parte de CHSNPP sobre las plantas de V. unguiculata. Se pudieron identificar claramente tres respuestas, en primer lugar, un incremento en el área foliar y en consecuencia en la acumulación de biomasa, en segundo lugar, cambios en el sistema radical conducentes la proliferación de raíces y ganancia de biomasa y en tercer lugar una aparente estimulación del proceso de nodulación de las raíces por los rizóbios del suelo. Estas tres respuestas se pueden relacionar con los mecanismos de estimulación del crecimiento y desarrollo vegetal descritos para la mayoría de agentes bioestimulantes, como la estimulación del metabolismo primario (Gupta et al., 2021), la modulación de rutas biosintéticas de las principales fitohormonas (Canellas et al., 2020), el efecto tipo auxina responsable por la proliferación de raíces (Baia et al., 2020), y la estimulación en la producción de exudados radicales y cambios en su composición (Canellas et al., 2019; Pereira et al., 2019).
Con respecto a la inducción de cambios sobre el sistema radicular, se ha documentado ampliamente el efecto de las sustancias bioestimulantes sobre la cantidad y actividad de las bombas H+ATPasas en la membrana de las células de la raíz, lo que conduce a una mayor acidificación del apoplasto y la pared celular, para permitir el crecimiento de las células, por otra parte, se estimula la actividad auxínica responsable de la expresión de genes involucrados en la activación de la mitosis para inducir la proliferación de nuevas raíces (De Azevedo et al., 2019; Pizzeghello et al., 2020; Wong et al., 2020.), en consecuencia de esta actividad se consigue un mayor número de raíces por planta, el alargamiento individual de las raíces y la formación de numerosas raíces secundarias y pelos radicales. Además, el incremento en el gradiente electroquímico de la membrana de las células de la corteza radical también conduce al mejoramiento de la absorción y transporte de iones celulares por medio de sistemas de trasporte secundarios (Nunes et al., 2019). En los resultados de este trabajo se puede observar que el tratamiento de las plantas con CHSNPP ocasionó proliferación de raíces e incremento en la biomasa del sistema radicular (figura 2), además de modificaciones en la arquitectura radical (figura 3).
Los cambios en el sistema radicular, podrían incidir en la capacidad de la planta para explorar mayor volumen de suelo y por consiguiente mejorar la absorción de agua y nutrientes, por otra parte una mayor superficie de raíces, también implica una mayor superficie de colonización por microorganismos benéficos de la rizósfera; adicionalmente, también supone la posibilidad de mayor liberación de exudados radiculares para potenciar la comunicación e interacción para establecer relaciones simbióticas y asociativas, e incluso propiciar la colonización endófita por microorganismos promotores del crecimiento vegetal (Muscolo et al., 2020), este fenómeno también conduce al incremento de la diversidad microbiana en el suelo influenciado por las raíces y estimulación de los procesos mediados por dichos microrganismos, lo que se ha denominado “bucle microbiano” (Stambulska et al., 2020), modificando positivamente para la planta las propiedades químicas y físicas del suelo.
La respuesta observada en el desarrollo del sistema radical toma importancia al considerar las características limitantes del suelo empleado para el ensayo; el valor alto de salinidad, el pHalcalino, la baja CIC, el bajo contenido en nitrógeno y materia orgánica generan condiciones causantes de estrés vegetal. Entonces, bajo estas condiciones las respuestas positivas de las plantas tratadas con bioestimulantes resultan importantes para mejorar la adaptación de la planta y su desempeño bajo las condiciones adversas.
Efectos de la aplicación la chalcona sintética sobre la simbiosis con Rhizobium y el índice de contenido de clorofila
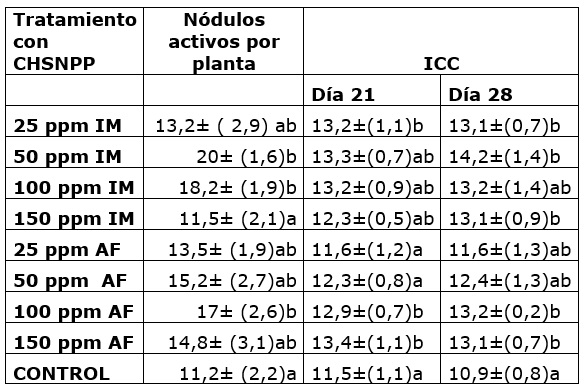
Para el número de nódulos de la simbiosis Rhizobium-leguminosa (Cuadro 1) en varios tratamientos con CHSNPP hubo mayor formación de nódulos con respecto a las plantas control. A partir de las secciones de nódulos inoculadas en medio de cultivo YMA se desarrollaron colonias cuyas características morfológicas y bioquímicas corresponden a las descritas para el género Rhizobium aisladas previamente de muestras del mismo suelo utilizado en este ensayo (Valero et al., 2021). Las chalconas naturales pueden actuar en el establecimiento de señales químicas en la rizosfera entre la planta y bacterias de la familia Rhizobiaceae, para promover la infección de los pelos radicales, de esta manera se incrementa la probabilidad de establecer la simbiosis efectiva (Dong and Song, 2020), provocando además la activación de enzimas involucradas en la expresión de los genes nod de Rhizobium (Ahmad et al., 2021). La quimiotaxis de los rizóbios también depende de los compuestos flavonoides presentes en los exudados de las leguminosas (Bosse et al., 2021). Por lo anterior, es posible que la aplicación exógena de la chalcona CHNSPP haya tenido influencia en el establecimiento de la dinámica planta-bacteria, que junto con una mayor superficie de contacto por el incremento de pelos radicales conllevó a un mayor número de nódulos establecidos en las plantas tratadas.
En cuanto al valor del índice de contenido de clorofila (ICC) registrado a las tres y cuatro semanas de crecimiento (Cuadro 1), refleja que algunos tratamientos con CHSNPP (25 ppm por IM y 100 y 150 ppm AF) ocasionan incrementos significativos a los 21 días, para el día 28 se observa que se mantiene el incremento en el ICC para los mismos tratamientos del día 21 además de para los tratamientos de 50 ppm y 150 ppm IM, la mayoría de los tratamientos ocasionaron valores por encima del tratamiento control y se hizo evidente que el tratamiento de 50 ppm por IM ocasionó mayor incremento en el ICC a los 28 días. También se encontró incremento en el número de nódulos radicales fijadores de nitrógeno formados por planta en respuesta al tratamiento con CHSNPP, hubo diferencia significativa en las plantas bajo los tratamientos con concentraciones de 50 y 100 ppm IM y 100 ppm AF; por otra parte, la concentración más baja y la más alta no ocasionaron efecto sobre esta variable.
Cuadro 1 Nodulación por rizóbios e índice de contenido de clorofila -ICC ( X̅± DE) de plantas de frijol guajiro tratadas con CHSNPP, diferencias calculadas con el test de Duncan (p= 0,05).
Específicamente, los bioestimulantes a base de sustancias húmicas, hidrolizados de proteínas y carbohidratos, son capaces de estimular la actividad de las enzimas malato deshidrogenasa, isocitrato deshidrogenasa y citrato sintasa, que funcionan en el ciclo del ácido tricarboxílico, además incrementan la actividad de cinco enzimas (nitrato reductasa, nitrito reductasa, glutamina sintetasa, glutamato sintasa y aspartato aminotransferasa) involucradas en la reducción y asimilación de N (Bulgari et al., 2019; Ertani et al., 2020; Nardi et al., 2021). Algunas sustancias bioestimulantes también promueven la síntesis de la clorofila y la enzima ribulosa-1,5-bisfosfato carboxilasa/oxigenasa e inducen el retraso de la senescencia foliar a través de la reducción en la degradación de la clorofila, con lo cual favorece de manera integral el proceso de fotosíntesis (Lotfi et al., 2018; Ali et al., 2020), en este sentido los resultados encontrados en este trabajo muestran efectos que podrían estar relacionados con aumento de la actividad fotosintética; así se encontró aumento en el área y biomasa foliar (figura 2) lo que podría ser consecuencia de mayor actividad fotosintética y activación del metabolismo primario, por otra parte en el cuadro 1 se muestran incrementos hasta del 27 % en el ICC (tratamiento con 50 ppm de CHSNPP), lo cual no solamente supone una mayor capacidad fotosintética, sino también la disponibilidad de N para la síntesis de clorofila, dado que en numerosos estudios se ha encontrado una alta correlación entre el índice SPAD obtenido con el clorofilómetro, la cantidad de clorofila y el contenido de nitrógeno foliar (Macías-Duarte et al., 2021); el mejor desempeño en la asimilación de N y síntesis de Clorofila ha sido confirmado como un mecanismo de acción de algunos bioestimulantes (Bhupenchandra et al., 2020). Por otra parte, la expansión de la lámina foliar también se relaciona con la modulación de la actividad y balance de citoquininas, auxinas y giberelinas, aspecto en el cual se ha visto involucrada de manera positiva la actividad de los ácidos húmicos y otros bioestimulantes (Rouphael et al., 2020b).
CONCLUSIONES
Se demostró que la chalcona sintética 3-(4-nitrofenil)-1-(piridin-2-il)-prop-2-en-1-ona (CHSNPP) puede ser aplicada en frijol guajiro en soluciones a concentraciones entre 50 y 150 ppm por aspersión foliar o por inmersión de plántulas, pero la aplicación por aspersión foliar resulta más efectiva para algunas variables, así se sugiere una concentración a 100 ppm para generar una respuesta promedio superior.
El uso de la chalcona sintética sobre frijol guajiro ocasiona el incremento significativo del área foliar, estimula la acumulación de biomasa y proliferación de raíces, además favorece el contenido de clorofila (ICC) lo que se relaciona con el incremento de nódulos fijadores de nitrógeno por la simbiosis Rhizobium-leguminosa. Los efectos descritos aportan evidencia sobre un posible uso de la chalcona CHNSPP como un bioestimulante, con perspectivas de aplicaciones futuras en agricultura, para lo cual es necesario desarrollar estudios adicionales sobre el impacto en la productividad, descartar efectos adversos y estimar los costos de producción y aplicación.