Introdução
O trauma cerebral-craniano é considerado a causa mais comum de dano cerebral adquirido 1. Na prática neurológica e neuropsicológica, a condição é que desempenha o maior número de intervenções devido aos danos que causa 1. Caracteriza-se por uma alteração na atividade cerebral secundária a uma lesão traumática que exerce um passo de energia que gera danos e compromete estruturas como tecido cerebral e vasos sanguíneos 2.
A presença de um dos seguintes sinais define uma alteração na atividade cerebral 2: perda ou diminuição da consciência; perda de memória antes ou após o evento ter ocorrido; fraqueza, perda de equilíbrio, paralisia ou perda de visão e, alteração mental no momento da lesão.
Os homens são 1,4 vezes mais propensos do que as mulheres a sofrer trauma en-céfalo-craniano. Maior prevalência foi encontrada na primeira infância (0 a 4 anos), adolescência (15 a 19 anos) e adultos mais velhos (mais de 75 anos) 3.
A primeira causa pela qual ocorre devido a quedas de altura própria, o que ocorrem mais frequentemente na primeira infância e em adultos mais velhos de 75 anos. A segunda causa são acidentes de trânsito, onde há maior ocorrência. A mortalidade (31%) e a população adolescente estão mais comprometidas 3. De acordo com a Organização Mundial da Saúde, o trauma encéfalo-craniano será um dos principais causas de morte e incapacidade funcional no ano 2020 4.
Este artigo pretende descrever uma revisão de considerações fisiopatológicas encontradas na literatura científica, que se desenvolve em pacientes com trauma encéfalo-craniano, especificamente na fisiopatologia da lesão axonal difusa.
Lesões focais
Lesões cerebrais primárias em trauma craniano
As lesões primárias causadas pelo trauma craniano são manifestadas por duas formas: focal e difusa. Os focos são produzidos principalmente por traumatismo direto no crânio e inclui contusões, lacerações corticais ou subcorticais, hematomas (subdural e peridural) e hemorragias intracranianas (subaracnócidas e intraparen-quimatosas) 5. Lesões difusas são causadas por esticão, esmagamento ou efeito direto no tecido cerebral. Este tipo de lesão inclui lesão axonal difusa, lesão hipóxico--isquêmica e alterações na permeabilidade vascular (hemorragia, edema e ruptura da barreira hematoencefálica) 6.
Lesões difusas
A lesão axonal difusa surgiu nos últimos 70 anos como característica patológica a traumatismo cérebro-cérebro mais comum e importante 4 e ocorre mais frequentemente em adultos (42%) do que em crianças (22%). Entre aqueles que sofrem desta alteração, 43% não sobrevivem, 9% culminam em estado vegetativo e menos de 50% são capazes de levar uma vida independente 7.
A lesão axonal difusa refere-se a um processo de dano axonal generalizado, secundário aos mecanismos de rotação, aceleração e desaceleração da cabeça, bem como a propagação da força através do cérebro após um trauma agudo ou repetitivo.
A lesão axonal difusa refere-se a um processo de dano axonal generalizado, secundário aos mecanismos de rotação, aceleração e desaceleração da cabeça, bem como a propagação da força através do cérebro após um trauma agudo ou repetitivo 7.
É considerada uma doença estrutural na qual a arquitetura básica do cérebro é irreversivelmente interrompido em escala microscópica. Aparecem aparências nas vias eletroquímica, metabólica e inflamatória, bem como no corte e redução da substância branca 7. O cisalhamento neuronal produz um segmento axonal proximal que permanece conectado ao soma neuronal e um segmento distal que avança para a degeneração de Waller 8.
Devido à lesão axonal difusa, há proteólise, desgaste dos pequenos vasos sanguíneos, acumulação de remanescentes de mielina e agregação de proteína beta-amilóide e proteína TAU cronicamente 9. O dano induzido diminui a plasticidade axonal e evita a recuperação em sua forma original 10. As áreas mais afetadas são o tronco encefálico, a substância branca do córtex cerebral e o corpo caloso. O compromisso deste último é um indicador de mau prognóstico 8.
Dependendo da gravidade e extensão da lesão, pode manifestar-se agudo com confusão ou perda imediata de consciência e em casos mais graves, persistir ao coma ou disfunção cognitiva (tabela 1) 8.
Diferentes tipos de histopatologia são evidenciados pós-morte para confirmar o diagnóstico de lesão axonal difusa. Essas lesões podem ser observadas microscopicamente como varizes, edema axonal, bulbos terminais ou presença de proteína precursora beta-amilóide sob a forma de “salsicha” 11. Varicosidades e edema axonal são caracterizados por inflamações interligadas por um axônio de maneira contígua na substância branca. A presença de bulbos terminais está rela cionada à interrupção do transporte axonal devido à força repentina nas interfaces de substância cinza e branca 8.
A detecção histopatológica da proteína precursora beta-amilóide na forma de "salsicha" é devida a um padrão de deposição dispersa e difusa de grupos individuais ou pequenos de proteína precursora beta-amilóide nos axônios. Se forem observados focos circunscritos na forma de "ziguezague" ou "Z", não sugere que a lesão axonal difusa seja de origem traumática, mas de origem isquêmica 12.
Fisiopatologia de lesões cerebrais secundarias em trauma craniano
A apoptose e necrose são dois mecanismos de morte celular que se distinguiram pelas diferenças em seus mecanismos patológicos e foram observados no sistema nervoso após lesão traumática 13. A apoptose é um processo ativo que requer energia, enquanto a necrose é um evento passivo que resulta de uma falha de energia e alteração na homeostase iónica 13. Evidências recentes mostram que necrose e apoptose podem evoluir em paralelo no mesmo tecido danificado 13. Esta forma híbrida de morte celular é chamada de aponecrose e reflete o fato de que essas células apresentam as características morfológicas de ambos os tipos de morte celular 13,14. Em seguida, são mencionados mecanismos diferentes que facilitam a apoptose e a necrose nos neurônios como mecanismos secundários.
Alteração da homeostase de cálcio
A resposta secundária à lesão axonal é observada com o aumento nos níveis de cálcio intracelular. A alteração física direta da membrana celular é a maneira mais comum de alterar a homeostase do cálcio; no entanto, as alterações nos níveis de cálcio podem ocorrer mesmo quando a membrana não é interrompida 15. Geralmente, a alteração na homeostase de cálcio produz mudanças iónicas que precipitam a deformação axonal, axotomia secundária e degeneração walleriana 8.
A deformação axonal inicia a abertura de canais de sódio sensíveis a mecânicos, reverte os transportadores de sódio-cálcio e ativa os canais de cálcio dependentes de tensão; Além disso, a ruptura mecânica cria lacunas no axolema que culminam continuamente no influxo extracelular de cálcio 11. Os canais do tipo de cálcio L e T dependentes da tensão também foram associados à deformação axonal 16.
Por outro lado, há um aumento inicial de cálcio a partir de fontes intraaxonaiscomo as mitocôndrias e o retículo sarcoplásmico, bem como a falha nos mecanismos de reparo intracelular 17. Portanto, a elevação intracelular do cálcio contribui para um aumento do cálcio axoplasmático que prejudica os axônios de neurônios através da destruição do citoesqueleto, disfunção mitocondrial e ativação de proteases, como calpains (figura 1) 13,18.
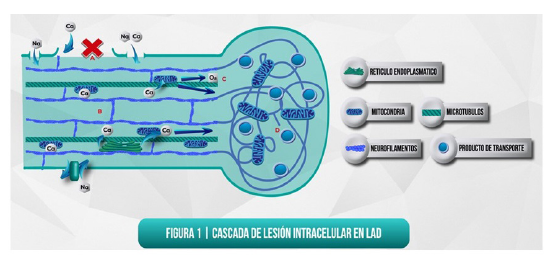
Figura 1 Estruturas celulares que participam de lesões axonais (feita pelos autores) [A] Em resposta ao trauma, o axolema sofre uma falha mecânica primária, expondoo citossol no espaço extracelular e ativando os canais mechanosensi-tivos de sódio que resultam em um fluxo de sódio para o axoplasma [B] A perturbação do equilíbrio iônico resulta em mudanças direcionais no fluxo de cálcio, o que leva à sua acumulação intracelular [C] O cálcio pode ser sequestrado pelas mitocôndrias, no entanto, isso gera espécies reativas de oxigênio que interrompem o metabolismo oxidativo e causam danos ao axônio. Da mesma forma, o cálcio elevado pode ativar calpainas dependentes de cálcio, que medeiam a degradação do citoesqueleto. [D] O dano do citoesqueleto produz alteração do transporte axonal, edema axonal e compactação de neurofilaments
Calpains tem diferentes isotipos, incluindo macro-calpain e micro-calpain que estão localizados no sistema nervoso central. Embora calpaínas têm diferentes substratos de degradação dentro dos neurônios, como elementoscitoesqueleto, neurofilamen-tos, proteína quinase C, ligação à proteína calmodulina e fatores de transcrição, um dos mais amplamente investigados é o spectrin 13.
Spectrin é o principal componente do citoesqueleto neuronal e sua clivagem pelo calpain conduz à destruição da integridade celular, aparência de permeabilidade da membrana, compromisso de transporte axonal e indução de mecanismos de morte celular 13.
O excesso de influxo de cálcio e a ativação concomitante de calpains conduzem a degradação proteolítica de proteínas e membranas intracelulares. Além disso, facilitar a liberação de neurotransmissores excitatórios para criar um "loop" de "feedback" positivo, que perpetua a despolarização em neurônios 13,18 (figura 1).
Exitoxicidade
Os neurotransmissores desencadeiam excitoxicidade; O glutamato é o principal contribuindo para a referida lesão devido ao seu poderoso efeito no aumento do cálcio intracelular através de receptores ionotrópicos (principalmente NMDA) 12. A sobrecargade cálcio induzido por receptores de glutamato ativa as enzimas dependentes de cálcio, aumenta as espécies reativas de oxigênio e nitrogênio e culmina com a ativação de cascatas de morte celular necrótica ou apoptótica 11.
A deterioração da recaptação de glutamato por astrocitos no nível extracelular aumenta a excitotoxicidade 19. Os Astrocytes são a principal defesa durante a liberação extrace-lular de glutamato, devido à sua alta capacidade de captura através dos transportadores de glutamato-1 (GLT-1) e do transportador de aspartato de glutamato (GLAST) 20. Através deste mecanismo, as concentrações o glutamato extracelular é tamponado, quando capturado e metabolizado paraglutamina, que é diluída em sincitia astrocítica, através das junções defenda 21.
Numa segunda fase, se persistirem altas concentrações de glutamato extracelular, astrocitos diminuem os transportadores de glutamato e sobrecarregam de sódio intracelular, favorecendo a saída de glutamato do astrocito eaumentando o dano excitotóxico 22. O hipocampo e o estriado são duas regiões do cérebro particularmente sensíveis à morte neuronal excitotóxica após isquemia cerebral. Um estudo realizado em pacientes que sofreram o trauma encefalônico-craniano grave descobre aumento do glutamato extracelularem mais de 75% dos pacientes. Os valores de glutamato são normalizados em 60% dos pacientes ao longo de cinco dias, mas há maior mortalidade em pacientes com elevações persistentes 23.
Resposta celular neuroinflamatória
Migra rapidamente para a área lesada e ativa processos citoplasmáticos para os axônios lesados, a fim de isolar as estruturas danificadas 21. Está associado a uma variedade de funções nocivas e regenerativas, incluindo fagocitose, secreção de neutro-fina e citoquinas 25. A secreção de citocinas possivelmente ocorre em níveis elevados de trifosfato de adenosina (ATP) liberados pelas células lesadas. As citocinas pró-inflamatórias que predominam durante a lesão é o fator de necrose tumoral alfa, interleucina-1, interleucina-6, interleucina-12 e interferão-gama 26.
Um "ciclo de citoquinas" foi proposto onde o trauma cerebral-craniano pode, em indivíduos suscetíveis, iniciar uma resposta inflamatória sustentada que resulte em neurodegeneração 26. Neste ciclo, a interleucina-1 é um agente chave de iniciação e coordenação que promove a síntese e processamento neuronal da proteína precursora beta-amilóide, favorecendo a deposição contínua de beta-amilóide e a ativação de astrócitos e síntese astrocítica 27.
A lesão resultante desse dano neuronal induzido por citocinas pode ativar a mi-croglia com uma superexpressão adicional da interleucina-1, produzindo assim a amplificação do feedback e auto-propagação deste ciclo de citoquinas. A propagação crônica deste ciclo representa um possível mecanismo para a progressão das alterações neurodegenerativas observadas na doença de Alzheimer 27.
Na próxima fase da lesão aguda, uma série complexa de respostas é iniciada inflamações com comprometimento inicial da barreira hematoencefálica e infiltração deleucócitos polimorfonucleares, células T e macrófagos do sangue 28.
Os astrocitos e os oligodendrócitos participam ativamente de muitas das funções do sistema nervoso central e podem ter um papel proeminente na perpetuação dos processos inflamatórios pós-trauma 29. Essas células geralmente despolarizam (alteram seu potencial elétrico) em resposta a lesões diretas aos neurônios. Seu efeito é propagado porque essas células são unidas por junções de fenda 29.
A despolarização de astrocitos e oligodendrócitos altera a homeostase de íons, danosa mitocôndria e permite a aparência de degeneração axonal ao longo do tecidocérebro que contribui para a perda pós-traumática de matéria branca 29. A presença de oli-godendrócitos está associada à degeneração da mielina 30. Em modelos animais com lesão axonal difusa, os astrocitos produzem infiltração do tálamo às quatro e oito horas após a lesão, com marcadores de dano máximo evidentes entre 48 horas e duas semanas após a lesão 18.
Na próxima fase da lesão aguda, uma série complexa de respostas é iniciada inflamações com comprometimento inicial da barreira hematoencefálica e infiltração de leucócitos polimorfonucleares, células T e macrófagos do sangue 28.
Os astrocitos e os oligodendrócitos participam ativamente de muitas das funções do sistema nervoso central e podem ter um papel proeminente na perpetuação dos processos inflamatórios pós-trauma 29. Essas células geralmente despolarizam em resposta a lesões diretas aos neurônios. Seu efeito é propagado porque essas células são unidas por junções de fenda 29.
A despolarização de astrocitos e oligodendrócitos altera a homeostase de íons, danosa mitocôndria e permite a aparência de degeneração axonal ao longo do teci-docérebro que contribui para a perda pós-traumática de matéria branca 29. O a presença de oligodendrócitos está associada à degeneração da mielina 30. Em modelos animais com lesão axonal difusa, os astrocitos produzem infiltração do tálamo às quatro e oito horas após a lesão, com marcadores de dano máximo evidentes entre 48 horas e duas semanas após a lesão 18.
Mudanças na permeabilidade vascular
As mudanças na permeabilidade vascular levam a alterações no fluxo sanguíneo cerebral, na difusão da água e na ruptura da barreira hematoencefálica, que se manifestam clinicamente com aparência de edema cerebral e hemorragias 6.
As mudanças no fluxo sanguíneo cerebral dependem do tamanho, localização e tipo de ferimento no tecido 6. A maioria dos traumas encefalo-cranianos tem reduções significativas no fluxo sanguíneo cerebral nas primeiras 12 horas pós-trauma. Foi relatado que os valores do fluxo sanguíneo cerebral podem atingir níveis isquêmicos que caem para 18-20 mL / 100 mL / min. após traumatismo cerebral-craniano grave (valores normais são 45-50 mL / 100 mL / min.) 6.
Após este período inicial, muitos pacientes experimentam hiperemia, enquanto que outros mostraram valores de fluxo sanguíneo cerebral baixos ou normais. Tem observou que a diminuição do fluxo sanguíneo cerebral pode levar a uma lesão cerebral isquêmica, que é a principal causa de morte após traumacranio cerebral intenso 6.
O edema cerebral é causado pelo acúmulo de líquido no cérebro. Depois de um trauma encefalo-craniano forma edema no local da lesão e pode incorporar o tecido circundante 6. Foram observados dois tipos de edema no trauma cerebral-craniano: edema citotóxico e vasogênico. O edema citotóxico é produzido pelo acúmulo de água nas células devido à alteração do sódio e do potássio devido à falha das bombas de membrana celular 6. A retenção de íons e água pode afetar negativamente a função celular e até levar à apoptose. A barreira hematoencefálica permanece intacta nas células citotóxicas.
O edema vasogênico ocorre devido ao acúmulo de água no espaço extracelular e é causado pela interrupção da barreira hematoencefálica 6. Está associada a elevação da pressão intracraniana, mudanças no fluxo sanguíneo e compressão das estruturas cerebrais 6.
A hemorragia ocorre nas horas seguintes após trauma cerebral cerebral e resulta na expansão do dano tecidual devido ao aumento da pressão intracraniana, isquemia e hipoxia, a formação de radicais livres e a indução de inflamação 31.
Pacientes com hemorragia óbvia associada à lesão axonal difusa têm pior prognóstico. Portanto, é importante identificar a presença e a posição pontual dos focos hemorrágicos para um diagnóstico mais preciso 32. Frequentemente, nenhum dano associado à lesão axonal difusa é identificado com tomografia computadorizada craniana 33. A ressonância magnética é muito mais sensível porque detecta lesões hemorrágicas e não hemorrágicas 33. Uma revisão descobre que a ressonância magnética é substancialmente mais sensível do que a tomografia para a detecção de lesões intraparenquimatosas, que são detectadas em 50% dos pacientes por tomografia computadorizada e em 75% por ressonância magnética.
A taxa de detecção da lesão axonal difusa não associada à hemorragia: é detectada em 0% dos pacientes por tomografia computadorizada e 11% por ressonância magnética. Da mesma forma, a taxa de lesão axonal difusa associada à hemorragia é detectada em 22% dos pacientes por tomografia computadorizada e 47% por ressonância magnética 33).
Conclusão
O dano cerebral em pacientes está relacionado à manifestação focal e difusa. As sequelas neurológicas estão relacionadas a mudanças primárias e secundárias sofridas como mecanismo de trauma, afetando funções neurológicas e neuropsicológicas. As lesões cerebrais estão cada vez mais associadas à excitabilidade, alterações de cálcio, resposta neuroinflamatória e mudanças de permeabilidade sofridas por neurônios e células gliais, levando a um maior compromisso ao longo do tempo. O futuro da atividade cerebral está diretamente relacionado ao controle de mecanismos fisiopa-tológicos para poder conhecer e processar o tratamento de pacientes após o trauma encefalocraneal.















