Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.36 no.4 Bogotá oct./dic. 2021 Epub 19-Abr-2022
https://doi.org/10.22516/25007440.696
Trabajos originales
Prevalencia y manejo de anemia en enfermedad inflamatoria intestinal en un centro de referencia en Colombia
1Hospital Pablo Tobón Uribe. Medellín, Colombia.
2Universidad Pontificia Bolivariana. Medellín, Colombia.
3Universidad de Antioquia. Medellín, Colombia.
Introducción:
la anemia es la complicación más frecuente en enfermedad inflamatoria intestinal (EII). El objetivo de este estudio fue determinar la prevalencia, asociaciones y tratamiento de la anemia en EII en nuestro medio.
Materiales y métodos:
se analizaron de forma retrospectiva datos de pacientes adultos con EII del Hospital Pablo Tobón Uribe en Medellín, Colombia, que consultaron desde 2001 hasta febrero de 2019. Se emplearon frecuencias absolutas y relativas. Para comparar dos proporciones se utilizó la prueba de chi cuadrado de independencia y se estimó el Odds ratio (OR).
Resultados:
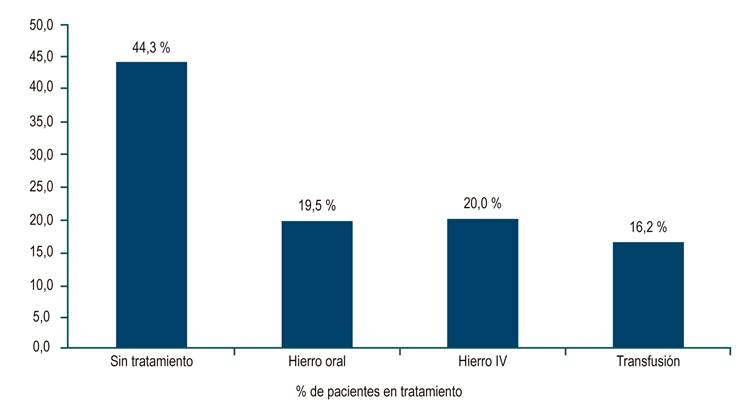
se documentaron 759 pacientes con EII, de los cuales 544 (71,6 %) presentaron colitis ulcerativa (CU); 200 (26,3 %), enfermedad de Crohn (EC), y 15, EII no clasificable (1,9 %). En total, 185 (24,4 %) pacientes con EII presentaron anemia, que es menos frecuente en CU que en EC (22,2 % frente a 32,5 %, respectivamente; OR: 0,684; IC: 0,456-0,96; p = 0,03). Los pacientes con CU extensa (54,1 %) tenían más anemia que aquellos con CU no extensa (46,3 %) (OR: 4,4; IC: 2,6-7,4; p = 0,001); lo mismo se observó al comparar la CU grave (66,1 %) con la no grave (32,3 %) (OR: 4,95; IC: 2,87-8,51; p = 0,000). En la EC, los pacientes con comportamiento no inflamatorio (B2, B3: 73,9 %) presentaron más anemia en comparación con aquellos con comportamiento inflamatorio (B1: 26,2 %) (OR: 0,35; IC: 0,18-0,67; p = 0,000). 44,3 % de los pacientes no recibió tratamiento, 19,5 % recibió hierro oral, 20,0 % recibió hierro intravenoso y 16,2 % fue transfundido.
Conclusiones:
la anemia es una complicación frecuente de la EII en nuestro medio (24,4 %). A pesar de las guías internacionales, el tratamiento es subóptimo en nuestro medio.
Palabras clave: Anemia; enfermedad inflamatoria intestinal; prevalencia; hierro parenteral
Introduction:
Anemia is the most frequent complication of inflammatory bowel disease (IBD). This study aims to determine the prevalence, connection, and treatment of anemia in IBD in a local context.
Materials and Methods:
This retrospective study was conducted at The Pablo Tobon Uribe Hospital, in Medellín (Colombia) with adult patients who (were admitted) came for consultation from 2001, until February 2019. Absolut and relative frequencies were calculated. The Chi square test of independence was applied for comparing two proportions and the odds ratio (OR) was estimated.
Results:
A total of 759 IBD patients were enrolled, 544 (71.6%) with ulcerative colitis (UC); 200 (26.3%) Crohn’s disease (CD), and 15 (1.9%) with non-classifiable IBD. In total, 185 (24,4 %) IBD patients had a diagnosis of anemia, that is less frequent in UC patients that in CD patients (22,2 % versus 32,5 %, respectively; OR: 0,684; CI: 0,456-0,96; p = 0,03). Extensive UC patients (54,1 %) had a more recurrent level of anemia than non-extensive UC (46,3 %) (OR: 4,4; CI: 2,6-7,4; p = 0,001); the same result was observed when severe UC (66,1 %) was compared with UC non-severe (32,3 %) (OR: 4,95; CI: 2,87-8,51; p = 0,000). In the analysis of CD, patients with a non-inflammatory response (B2, B3: 73,9 %) had a more recurrent level of anemia than patients with an inflammatory response (B1: 26,2 %) (OR: 0,35; CI: 0,18-0,67; p = 0,000). 44,3 % of the total number of patients received treatment, 19,5 % received oral iron, 20,0 % received intravenous iron, and 16,2 % received a blood transfusion.
Conclusions:
In our context, Anemia is a common complication in IBD cases (24,4 %). Despite the existence of international guidelines, the treatment in our context is not optimal.
Keywords: Anemia; Inflammatory Bowel Disease; Prevalence; Parenteral Iron
Introducción
La anemia es la complicación más frecuente de la enfermedad inflamatoria intestinal (EII)1, se asocia con una enfermedad más discapacitante2 con un impacto significativo en la calidad de vida3,4 e históricamente ha recibido poca atención por parte de los gastroenterólogos5. La anemia se define por la Organización Mundial de la Salud (OMS) como los niveles de hemoglobina (Hb) < 12 g/dL en mujeres no embarazadas y < 13 g/dL en hombres6. La anterior definición de anemia fue adoptada por la Organización Europea de Enfermedad de Crohn y Colitis ulcerativa (ECCO) en un consenso reciente, en el que se recomienda descartar esta complicación en todos los individuos con EII1.
La etiología de la anemia en EII es multifactorial y la causa más común es la anemia por deficiencia de hierro (ADH) y la anemia asociada a enfermedad crónica (AEC), y estas pueden coexistir (mixta); otras causas de anemia como las asociadas con la deficiencia de vitamina B12 o ácido fólico, o inducidas por medicamentos son menos frecuentes7,8. En una revisión sistemática de 17 artículos con EC, la prevalencia oscila entre 4 % y 67 %9. Gisbert y colaboradores reportaron 17 % de prevalencia promedio de anemia en EII y se encontraron cifras de 16 % en pacientes ambulatorios y 68 % en individuos hospitalizados10. La prevalencia de EII en Latinoamérica está aumentado11 y existen pocos datos de la relación entre la anemia y la EII. Dos estudios en Brasil encontraron una prevalencia de anemia de 21 % y 24,6 % en pacientes con EII12,13. El objetivo de este estudio es determinar la prevalencia, asociaciones y tratamiento de la anemia en una cohorte de pacientes con EII en nuestro centro.
Materiales y métodos
Se buscaron los diagnósticos de CU y EC en las historias clínicas del Hospital Pablo Tobón Uribe en Medellín, Colombia, hasta febrero de 2019 teniendo en cuenta los siguientes códigos: K500 EC de intestino delgado, K501 EC del intestino grueso, K508 otros tipos de enfermedad de Crohn, K509 EC no especificada, K519 CU sin otra especificación y K518 otras CU. Se analizaron de forma retrospectiva los datos de pacientes adultos con CU y EC que asistieron por urgencias, hospitalizados o por consulta externa para determinar la presencia de anemia.
Definiciones de anemia
Se diagnosticó anemia en aquellos pacientes con niveles de Hb < 12 g/dL en mujeres no embarazadas y < 13 g/dL en hombres, según la recomendación de la OMS6. Se consideró ADH a los niveles de ferritina < 30 mg/L y niveles de proteína C-reactiva (PCR) normales, o en caso de ferritina < 100 mg/L y PCR elevada, pero con un porcentaje de saturación de transferrina < 16 %. La AEC se definió con niveles de ferritina normal o elevados, porcentaje de saturación de transferrina normal y PCR elevada8. La anemia por deficiencias de vitamina B12 (< 211 ng/mL) y ácido fólico (< 7 ng/mL) se definieron cuando los niveles se encontraban por debajo del nivel normal. Otras mediciones como el volumen corpuscular medio (VCM), el ancho de distribución de glóbulos rojos (RDW) y el porcentaje de reticulocitos también se tuvieron en cuenta para clasificar la anemia14,15. Los pacientes en los que no se pudo definir la presencia de anemia por no tener datos suficientes se excluyeron del estudio.
Se consideró anemia leve a los niveles de Hb entre 11,0 y 11,9 g/dL en mujeres y entre 11,0 y 12,9 en hombres, moderada entre 8,0 y 10,9 g/dL y grave con niveles < 8 g/dL, según las recomendaciones de la OMS1,6. La actividad de la CU se definió por la clasificación de Truelove y Witts16 y para el análisis se consideró la actividad presente al momento de la mayor gravedad de anemia encontrada. La extensión de CU se definió según la Clasificación de Montreal17. La localización y el comportamiento de EC se determinaron según la Clasificación de Montreal17.
Recolección de datos
Se construyó una base de datos con formato Excel, se recolectaron los siguientes datos de cada paciente para el análisis:
Tipo de EII (CU, EC y EII no clasificable).
Sexo del paciente.
Extensión anatómica de la CU.
Actividad de la CU.
Localización de la EC.
Comportamiento de la EC.
Tratamiento médico acumulado (ácido 5 aminosalicílico [5-ASA], esteroides, inmunosupresores, terapia biológica).
Tratamiento quirúrgico.
Tasa de hospitalización.
Presencia de anemia.
Tipo de anemia.
Gravedad de la anemia.
Tratamiento de la anemia.
Para clasificar la anemia se tuvieron en cuenta las siguientes mediciones: Hb, hematocrito, VCM, ferritina sérica, porcentaje de saturación de transferrina y PCR. En los pacientes con elevación de VCM se verificaban los niveles de vitamina B12 y ácido fólico.
Análisis estadístico
Se emplearon frecuencias absolutas y relativas para las variables cualitativas, y para las variables cuantitativas se utilizaron media y desviación estándar (DE) o mediana y rango intercuartílico (RIC; P25-P75) previa verificación del supuesto de normalidad con las pruebas Kolmogorov-Smirnov. Para comparar dos proporciones se utilizó la prueba de chi cuadrado (χ2) de independencia y se estimó el Odds ratio (OR) con su respectivo intervalo de confianza (IC) del 95 %.
Consideraciones éticas
Esta es una investigación sin riesgo, ya que se revisaron las historias clínicas de los pacientes y se garantizó la confidencialidad y privacidad de la información recogida. Los investigadores del proyecto se adhirieron a los principios internacionales de la Declaración de Helsinki versión 2013 en Fortaleza, Brasil, y con los artículos 10 y 11 de la resolución 008430 de 1993 del Ministerio de Salud Nacional de Colombia.
Resultados
Este es un estudio retrospectivo, descriptivo y analítico, en el que se incluyeron sistemáticamente 759 pacientes que cumplían criterios diagnósticos de EII, de los cuales 544 (71,6 %) presentaron diagnóstico de CU, 200 (26,3 %) de EC y 15 (1,9 %) de EII no clasificable.
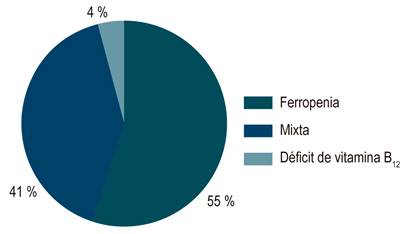
Se documentó anemia en 185 de los 759 pacientes (24,4 %) con EII. En CU, 121 de 544 (22,2 %) presentaron anemia, comparado con 65 de 200 pacientes (32,5 %) en EC (OR: 0,684; IC: 0,456-0,96 p = 0,03). En cuanto a anemia grave, se presentó en 87 de 185 pacientes (47,0 %) con EII, 61 de 121 (50,4 %) con CU y 26 de 65 (40,0 %) con EC. Del total de pacientes con anemia, 102 tenían ADH (55,1 %), 74 (41,1 %) tenían anemia mixta y 7 (3,7 %) presentaron déficit de vitamina B12 (Figura 1).
De los pacientes con CU y anemia, 18,2 % presentaron proctitis, 28,1 % colitis izquierda y 54,1 % colitis extensa. En la comparación de la anemia en colitis extensa frente a la no extensa (proctitis más colitis izquierda), se encontró una diferencia significativa (OR: 4,4; IC: 2,6-7,4 p = 0,001). En cuanto a la actividad de CU, el 5,0 % se encontraba asintomático (S0), 14,0 % con actividad leve (S1), 15,7 % con actividad moderada (S2) y 66,1 % con actividad grave (S3). Al comparar la presencia de anemia en actividad grave frente a la no grave, se encontró una diferencia significativa (OR: 4,95; IC: 2,87-8,51; p = 0,000).
Teniendo en cuenta la localización, la distribución de anemia en pacientes con EC fue la siguiente: ileal (40 %), ileocolónica (35,4 %), colónica (20 %) y con compromiso digestivo superior (4,6 %). No se encontró una diferencia significativa entre la localización colónica frente a la no colónica (OR: 1,2; IC: 0,66-2,19; p = 0,54). En cuanto al comportamiento de la EC y la presencia de anemia, en el 26,2% es inflamatorio (B1), el 27,7 % estenosante (B2), el 27,7 % penetrante (B3) y 18,5 % perianal. El comportamiento inflamatorio presentó menos frecuentemente anemia, comparado con el comportamiento no inflamatorio (B2 más B3) (OR: 0,35; IC: 0,18-0,67; p = 0,000).
Los pacientes con CU y anemia requirieron más terapia biológica que aquellos sin anemia (33,1 % frente a 14,4 %); esta diferencia fue significativa (OR: 2,29; IC: 1,46-3,58; p = 0,009). En EC, los pacientes con anemia también requirieron más terapia biológica (61,5 % frente a 39,3 %); sin embargo, esta diferencia no fue significativa (OR: 1,56; IC: 0,94-2,6; p = 0,08). No hubo diferencia significativa en cuanto a la necesidad de cirugía en pacientes con anemia frente a no anemia en CU (11,5 % frente a 11,1 %; OR: 1,04; IC: 0,55-1,95; p = 0,87), ni en EC (46,2 % frente a 34,8 %; OR: 1,32; IC: 0,76-2,28; p = 0,32). En cuanto a la hospitalización, los pacientes con CU y anemia requirieron más hospitalización en comparación con aquellos sin anemia (59,5 % frente a 47,0 %; OR: 1,95; IC: 1,37-2,77; p = 0,000). Lo anterior no se demostró en individuos con EC (72,3 % frente a 63,0 %, OR: 1,14; IC: 0,72-1,82; p = 0,63) (Tabla 1).
Tabla 1 Características clínicas de EII y anemia
| EC | CU | p | |||
|---|---|---|---|---|---|
| Pacientes (n) | 200 | 544 | 0,03 | ||
| Anemia | No anemia | Anemia | No anemia | ||
| 65 (32,5 %) | 135 (67,5 %) | 121 (22,2 %) | 423 (77,8 %) | ||
| Extensión de la CU | |||||
| E1: proctitis + E2: izquierda | 56 (45,9 %) | 0,001 | |||
| E3: colitis extensa | 65 (54,1 %) | ||||
| Localización de la EC | |||||
| L1: íleon terminal | 26 (40,0 %) | 0,54 | |||
| L3: íleon terminal + colon | 23 (35,4 %) | ||||
| L4: GI superior | 3 (4,6 %) | ||||
| L2: Colon | 13 (20,0 %) | ||||
| Gravedad de los síntomas de CU | |||||
| Actividad no grave (S1 + S2) | 40 (33,9 %) | 0,000 | |||
| Actividad grave (S3) | 81 (66,1 %) | ||||
| Comportamiento de la EC | |||||
| B1: inflamatoria | 17 (26,2 %) | 0,000 | |||
| B2 + B3 + P | 48 (73,9 %) | ||||
| Biológico/cirugía/hospitalización por CU | Anemia | No anemia | |||
| Biológico | 40 (33,1 %) | 61 (14,4 %) | 0,009 | ||
| Cirugía | 14 (11,5 %) | 47 (11,1 %) | 0,87 | ||
| Hospitalización | 72 (59,5 %) | 199 (47 %) | 0,000 | ||
| Biológico/cirugía/hospitalización por EC | Anemia | No anemia | |||
| Biológico | 40 (61,5 %) | 53 (39,3 %) | 0,08 | ||
| Cirugía | 30 (46,2 %) | 47 (34,8 %) | 0,32 | ||
| Hospitalización | 47 (72,3 %) | 85 (63 %) | 0,63 | ||
En cuanto al tratamiento de anemia y EII, 82 de 185 (44,3 %) pacientes con anemia no recibieron tratamiento, 19,5 % recibieron hierro oral, 20,0 % hierro intravenoso (IV) y 16,2 % tuvo transfusión (Figura 2). En el subgrupo de pacientes con anemia grave, 24 de 87 (27,6 %) no se trataron, 12,6 % recibió hierro oral, 29,9, % recibió hierro IV y 29,9 % tuvo transfusión. Ningún paciente recibió eritropoyetina.
Discusión
La prevalencia de anemia en 759 pacientes adultos con EII, tanto ambulatorios como hospitalizados, en nuestro centro es alta (24,4 %), y es más frecuente en EC (32,5 %) que en CU (22,2 %), datos similares a lo reportado en la literatura universal. Un metaanálisis europeo con 2192 pacientes encontró una prevalencia de anemia en el 24 % de casos con EII, 27 % de casos con EC y 21 % de casos con CU18. El grupo noruego IBSEN encontró también una mayor proporción de anemia al diagnóstico en EC (48,8, %), en comparación con CU (20,2 %)19. Un estudio sueco encontró 30 % de anemia en pacientes con EII al diagnóstico, 42 % en pacientes con EC y 24 % en pacientes con CU20. Una publicación más reciente de la Universidad de Pittsburgh encontró una prevalencia de anemia en pacientes con EII de 33,2 %, 34,3 % en pacientes con EC y 31,5 % en pacientes con CU2. El estudio de cohorte ECCO-EPICOM encontró una prevalencia mayor de anemia en pacientes con EC de 49 % y 39 % en pacientes con CU durante el primer año del diagnóstico21.
Llamó la atención la alta cantidad de pacientes con anemia grave en nuestros pacientes con EII (40,0 %), en comparación con otras series. En un estudio multicéntrico en 9 países europeos con 1404 pacientes con EII se observó la presencia del 56 % de individuos con al menos anemia moderada (Hb < 10 g/dL), pero solo el 15 % tuvo anemia grave22. La gravedad de la anemia fue leve en el 76,2 %, moderada en el 15 % y grave en el 8,8 %, en un registro de 193 casos de anemia asociada con EII, en 55 centros de Alemania23. Lo anterior puede explicarse por la gravedad de los pacientes con EII que se atienden en nuestro centro de alta complejidad; estas dos series son encuestas que se hicieron a los participantes y no se realizó análisis de la gravedad de EII en sus pacientes.
Por una parte, nuestro estudio demostró un predominio de ADH (55 %) y mixta (41 %) sobre otras etiologías de anemia. En un estudio escandinavo24, la etiología de anemia en EII fue ADH (20 %), AEC (12 %), mixta (68 %) y déficit de vitamina B12 y ácido fólico (< 5 %), similar a lo encontrado en nuestro estudio, pero con una mayor proporción de anemia mixta.
Por otra parte, en nuestro estudio los pacientes con CU y anemia presentaban actividad más grave (S3), mayor extensión anatómica y enfermedad más discapacitante, debido a una mayor tasa de hospitalización y mayor uso de terapia biológica. En individuos con EC, la presencia de anemia se asoció con el comportamiento no inflamatorio (estenosante o penetrante), por lo que estos pacientes son más complicados y de peor pronóstico en comparación con pacientes con comportamiento inflamatorio. En el estudio ECCO-EPICOM, ya señalado, se encontró que los pacientes con CU extensa y EC penetrante presentaron más riesgo de anemia, similar a lo demostrado en este estudio21. En el estudio sueco mencionado previamente, la presencia de anemia se asoció también con CU extensa20. Datos del estudio de la Universidad de Pittsburgh ya señalado muestran también una correlación significativa de anemia con índices más altos de actividad de la enfermedad y de hospitalización2.
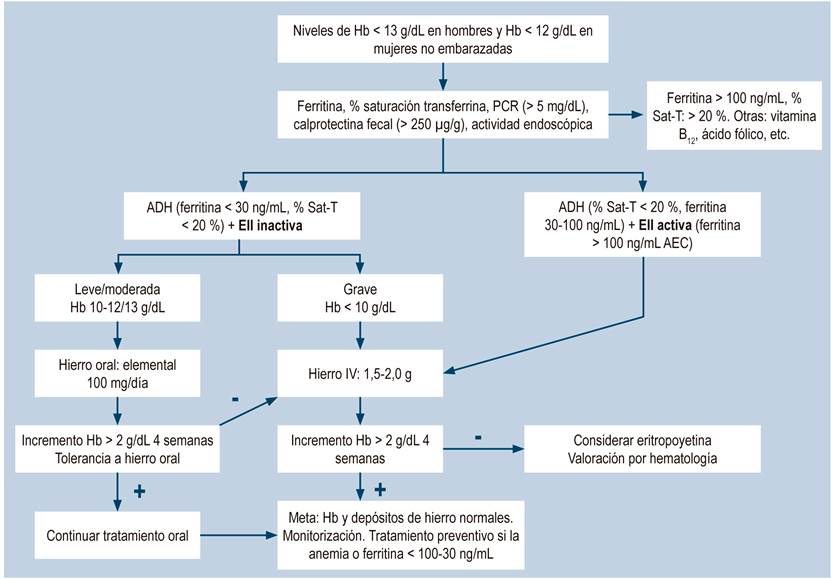
Las guías de ECCO1 recomiendan el uso de hierro oral en pacientes con EII con ADH leve definida por la OMS con niveles de Hb de 11-11-9 g/dL, cuya EII se encuentre clínicamente inactiva y con buena tolerancia al medicamento. El hierro IV debe ser considerado como primera línea de tratamiento en pacientes con intolerancia al hierro oral, EII activa, niveles de Hb < 10 g/dL y en pacientes que requieran eritropoyetina1. Un reciente artículo de revisión, teniendo en cuenta la pandemia por la enfermedad por coronavirus de 2019 (COVID-19), sugiere utilizar durante estos tiempos hierro oral en pacientes con EII y anemia leve y moderada, para evitar que los pacientes con EII asistan a centros hospitalarios para colocarse hierro parenteral, y reservar este último solo para sujetos con EII y anemia grave (Hb < 8 g/dL)25.
En cuanto al tratamiento de la ADH en este estudio, el 44,3 % de los pacientes no recibió tratamiento y un alto porcentaje del subgrupo de individuos con anemia grave tampoco (27,6 %). Consideramos que aún se maneja el concepto de anemia asintomática en el cuerpo médico, sin tener en cuenta la alteración en la calidad de vida a la que conlleva esta complicación. En una encuesta previa a gastroenterólogos de toda Colombia, ante la pregunta de cuál sería el mejor manejo de un paciente con EII y ADH < 10 g/dL, la respuesta fue que el 66 % la trataría con hierro oral, 15 % con hierro parenteral, 9 % transfunde hierro y 10 % no la trata26. En el estudio multicéntrico alemán mencionado anteriormente, solo el 43,5 % de pacientes con ADH y EII ha recibido tratamiento; de ellos, el 56 % con hierro oral, 15 % con hierro parenteral y 10 % en transfusión23. En Reino Unido se realizó una encuesta a pacientes ambulatorios con anemia y EII que recibieron hierro oral, solo el 42 % completó el tratamiento, y en 2 de 3 pacientes el tratamiento no fue efectivo para el control de la anemia27. En el estudio europeo mencionado previamente, 92 % de los pacientes con ADH recibió suplemento de hierro, 67 % hierro oral y solo 28 % hierro IV, a pesar de que el 56 % presentaba Hb < 10 g/dL21. Un estudio retrospectivo realizado en Estados Unidos encontró que, en pacientes anémicos con EII, solo el 37 % recibió hierro oral y 2,8 % hierro IV durante el seguimiento28. Una encuesta mundial a pacientes con anemia y EII encontró que el 33 % refirió que no recibió tratamiento para su anemia, y de los tratados, el 52 % recibió hierro oral, 27 % hierro IV y 19 % otro tipo de suplementos. De los pacientes con hierro oral, el 74 % no estaba satisfecho con el tratamiento; mientras que el 72 % de los pacientes con el hierro IV estaba satisfecho29.
Recientemente, la Fundación Estadounidense para la Enfermedad de Crohn y la Colitis Ulcerativa (CCFA) asignó un comité de expertos, quienes elaboraron recomendaciones y un algoritmo de tamizaje, evaluación, intervención y seguimiento de pacientes con anemia y EII30. Una publicación posterior evaluó la adherencia a estas recomendaciones y encontró que la terapia con hierro en pacientes anémicos se incrementó del 30 % al 80 % y la prevalencia de anemia disminuyó del 48 % al 25 %; sin embargo, el porcentaje de tamizaje de deficiencia de hierro no cambió: a solo el 20 % de los pacientes anémicos se les realizó una medición de ferritina31. Un artículo de revisión reciente recomienda tratar hacia un objetivo a pacientes con ADH asociado a EII (treat to target), similar a lo propuesto para el tratamiento de la EII, dividido en tres pasos: detección temprana, tratar hacia un objetivo (normalización de Hb y depósitos de hierro) y monitorización estricta (ferritina y porcentaje de saturación de transferrina cada 3-6 meses) ante el alto riesgo de recurrencia32.
Dentro de las limitaciones de este estudio se puede decir que, al ser un estudio retrospectivo y basado en datos recolectados de la historia clínica, puede contener sesgos de interpretación. Adicionalmente, este estudio fue realizado en un hospital de alta complejidad, centro de referencia de pacientes con EII de todo el país, y probablemente se incluyeron pacientes más graves y complicados en comparación con pacientes de otros centros del país.
Conclusiones
Existe una alta prevalencia de anemia asociada con EII en nuestro medio, la cual es más frecuente en EC que en CU, lo que es consistente con resultados de otros estudios a nivel mundial. Lo anterior se podría explicar por un diagnóstico insuficiente, un tratamiento inefectivo y una falta de monitorización en estos individuos con anemia. La presencia de anemia en pacientes con EII se asocia con una mayor gravedad de la enfermedad. Adicionalmente, la ruta de administración preferida de hierro en ADH, tanto en esta como en otras series citadas, es la vía oral, independiente de la gravedad de la anemia, y a pesar del alto porcentaje de intolerancia al hierro oral y de las recomendaciones de guías internacionales. Definitivamente, es necesario tomar más conciencia de esta complicación en los pacientes con EII y realizar más esfuerzos en educación médica, para implementar recomendaciones de guías y aplicarlas en el diagnóstico temprano, manejo adecuado y monitorización de estos individuos. Sin embargo, lo más importante va a ser siempre el tratamiento oportuno y adecuado de la EII para prevenir esta complicación. Una propuesta para el manejo de anemia en pacientes con EII se presenta en la Figura 3.
REFERENCIAS
1. Dignass AU, Gasche C, Bettenworth D, Birgegård G, Danese S, Gisbert JP, Gomollon F, Iqbal T, Katsanos K, Koutroubakis I, Magro F, Savoye G, Stein J, Vavricka S; European Crohn’s and Colitis Organisation [ECCO]. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases. J Crohns Colitis. 2015;9(3):211-22. https://doi.org/10.1093/ecco-jcc/jju009 [ Links ]
2. Koutroubakis IE, Ramos-Rivers C, Regueiro M, Koutroumpakis E, Click B, Schoen RE, Hashash JG, Schwartz M, Swoger J, Baidoo L, Barrie A, Dunn MA, Binion DG. Persistent or Recurrent Anemia Is Associated With Severe and Disabling Inflammatory Bowel Disease. Clin Gastroenterol Hepatol. 2015;13(10):1760-6. https://doi.org/10.1016/j.cgh.2015.03.029 [ Links ]
3. Wells CW, Lewis S, Barton JR, Corbett S. Effects of changes in hemoglobin level on quality of life and cognitive function in inflammatory bowel disease patients. Inflamm Bowel Dis. 2006;12(2):123-30. https://doi.org/10.1097/01.MIB.0000196646.64615.db [ Links ]
4. González Alayón C, Pedrajas Crespo C, Marín Pedrosa S, Benítez JM, Iglesias Flores E, Salgueiro Rodríguez I, Medina Medina R, García-Sánchez V. Prevalence of iron deficiency without anaemia in inflammatory bowel disease and impact on health-related quality of life. Gastroenterol Hepatol. 2018;41(1):22-29. https://doi.org/10.1016/j.gastrohep.2017.07.011 [ Links ]
5. Gasche C. Anemia in IBD: the overlooked villain. Inflamm Bowel Dis. 2000;6(2):142-150. https://doi.org/10.1097/00054725-200005000-00013 [ Links ]
6. WHO, Unicef, UNU. Iron Deficiency Anemia: Assessment, Prevention and Control. Report of a Joint WHO/UNICEF/UNU Consultation. Geneva, Switzerland: World Health Organization 2001. Disponible en: https://www.who.int/nutrition/publications/en/ida_assessment_prevention_control.pdf [ Links ]
7. Stein J, Hartmann F, Dignass AU. Diagnosis and management of iron deficiency anemia in patients with IBD. Nat Rev Gastroenterol Hepatol. 2010;7(11):599-610. https://doi.org/10.1038/nrgastro.2010.151 [ Links ]
8. Oustamanolakis P, Koutroubakis IE, Kouroumalis EA. Diagnosing anemia in inflammatory bowel disease: beyond the established markers. J Crohns Colitis. 2011;5(5):381-91. https://doi.org/10.1016/j.crohns.2011.03.010 [ Links ]
9. Kulnigg S, Gasche C. Systematic review: managing anaemia in Crohn’s disease. Aliment Pharmacol Ther. 2006;24(11-12):1507-23. https://doi.org/10.1111/j.1365-2036.2006.03146.x [ Links ]
10. Gisbert JP, Gomollón F. Common misconceptions in the diagnosis and management of anemia in inflammatory bowel disease. Am J Gastroenterol. 2008;103(5):1299-307. https://doi.org/10.1111/j.1572-0241.2008.01846.x [ Links ]
11. Kotze PG, Underwood FE, Damião AOMC, Ferraz JGP, Saad-Hossne R, Toro M, Iade B, Bosques-Padilla F, Teixeira FV, Juliao-Banos F, Simian D, Ghosh S, Panaccione R, Ng SC, Kaplan GG. Progression of Inflammatory Bowel Diseases Throughout Latin America and the Caribbean: A Systematic Review. Clin Gastroenterol Hepatol. 2020;18(2):304-312. https://doi.org/10.1016/j.cgh.2019.06.030 [ Links ]
12. Antunes CV, Hallack Neto AE, Nascimento CR, Chebli LA, Moutinho IL, Pinheiro Bdo V, Reboredo MM, Malaguti C, Castro AC, Chebli JM. Anemia in inflammatory bowel disease outpatients: prevalence, risk factors, and etiology. Biomed Res Int. 2015;2015:728925. https://doi.org/10.1155/2015/728925 [ Links ]
13. Parra RS, Feitosa MR, Ferreira SDC, Rocha JJRD, Troncon LEA, FÉres O. Anemia and iron deficiency in inflammatory bowel disease patients in a referral center in brazil: prevalence and risk factors. Arq Gastroenterol. 2020;57(3):272-277. https://doi.org/10.1590/S0004-2803.202000000-51 [ Links ]
14. Gasche C, Berstad A, Befrits R, Beglinger C, Dignass A, Erichsen K, Gomollon F, Hjortswang H, Koutroubakis I, Kulnigg S, Oldenburg B, Rampton D, Schroeder O, Stein J, Travis S, Van Assche G. Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm Bowel Dis. 2007;13(12):1545-53. https://doi.org/10.1002/ibd.20285 [ Links ]
15. Reinisch W, Staun M, Bhandari S, Muñoz M. State of the iron: how to diagnose and efficiently treat iron deficiency anemia in inflammatory bowel disease. J Crohns Colitis. 2013;7(6):429-40. https://doi.org/10.1016/j.crohns.2012.07.031 [ Links ]
16. Truelove Sc, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J. 1955;2(4947):1041-8. https://doi.org/10.1136/bmj.2.4947.1041 [ Links ]
17. Silverberg MS, Satsangi J, Ahmad T, Arnott ID, Bernstein CN, Brant SR, Caprilli R, Colombel JF, Gasche C, Geboes K, Jewell DP, Karban A, Loftus EV Jr, Peña AS, Riddell RH, Sachar DB, Schreiber S, Steinhart AH, Targan SR, Vermeire S, Warren BF. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol. 2005;19 Suppl A:5A-36A. https://doi.org/10.1155/2005/269076 [ Links ]
18. Filmann N, Rey J, Schneeweiss S, Ardizzone S, Bager P, Bergamaschi G, Koutroubakis I, Lindgren S, Morena Fde L, Moum B, Vavricka SR, Schröder O, Herrmann E, Blumenstein I. Prevalence of anemia in inflammatory bowel diseases in european countries: a systematic review and individual patient data meta-analysis. Inflamm Bowel Dis. 2014;20(5):936-45. https://doi.org/10.1097/01.MIB.0000442728.74340.fd [ Links ]
19. Høivik ML, Reinisch W, Cvancarova M, Moum B; IBSEN study group. Anaemia in inflammatory bowel disease: a population-based 10-year follow-up. Aliment Pharmacol Ther. 2014;39(1):69-76. https://doi.org/10.1111/apt.12541 [ Links ]
20. Sjöberg D, Holmström T, Larsson M, Nielsen AL, Holmquist L, Rönnblom A. Anemia in a population-based IBD cohort (ICURE): still high prevalence after 1 year, especially among pediatric patients. Inflamm Bowel Dis. 2014;20(12):2266-70. https://doi.org/10.1097/MIB.0000000000000191 [ Links ]
21. Burisch J, Vegh Z, Katsanos KH, Christodoulou DK, Lazar D, Goldis A, et al; EpiCom study group. Occurrence of Anaemia in the First Year of Inflammatory Bowel Disease in a European Population-based Inception Cohort-An ECCO-EpiCom Study. J Crohns Colitis. 2017;11(10):1213-1222. https://doi.org/10.1093/ecco-jcc/jjx077 [ Links ]
22. Stein J, Bager P, Befrits R, Gasche C, Gudehus M, Lerebours E, Magro F, Mearin F, Mitchell D, Oldenburg B, Danese S. Anaemia management in patients with inflammatory bowel disease: routine practice across nine European countries. Eur J Gastroenterol Hepatol. 2013;25(12):1456-63. https://doi.org/10.1097/MEG.0b013e328365ca7f [ Links ]
23. Blumenstein I, Dignass A, Vollmer S, Klemm W, Weber-Mangal S, Stein J. Current practice in the diagnosis and management of IBD-associated anaemia and iron deficiency in Germany: the German AnaemIBD Study. J Crohns Colitis. 2014;8(10):1308-14. https://doi.org/10.1016/j.crohns.2014.03.010 [ Links ]
24. Bager P, Befrits R, Wikman O, Lindgren S, Moum B, Hjortswang H, Dahlerup JF. The prevalence of anemia and iron deficiency in IBD outpatients in Scandinavia. Scand J Gastroenterol. 2011;46(3):304-9. https://doi.org/10.3109/00365521.2010.533382 [ Links ]
25. D’Amico F, Peyrin-Biroulet L, Danese S. Oral Iron for IBD Patients: Lessons Learned at Time of COVID-19 Pandemic. J Clin Med. 2020;9(5):1536. https://doi.org/10.3390/jcm9051536 [ Links ]
26. Juliao F, Agudelo Y, Yepes C. Variación en el cuidado de pacientes con Enfermedad Inflamatoria Intestinal (EII): resultado de una encuesta. Rev Col Gastroenterol. 2014;29(1):11-18. [ Links ]
27. Lugg S, Beal F, Nightingale P, Bhala N, Iqbal T. Iron treatment and inflammatory bowel disease: what happens in real practice? J Crohns Colitis. 2014;8(8):876-80. https://doi.org/10.1016/j.crohns.2014.01.011 [ Links ]
28. Patel D, Yang YX, Trivedi C, Kavani H, Xie D, Medvedeva E, Lewis J, Khan N. Incidence, Duration, and Management of Anemia: A Nationwide Comparison Between IBD and Non-IBD Populations. Inflamm Bowel Dis. 2020;26(6):934-940. https://doi.org/10.1093/ibd/izz206 [ Links ]
29. Danese S, Hoffman C, Vel S, Greco M, Szabo H, Wilson B, Avedano L. Anaemia from a patient perspective in inflammatory bowel disease: results from the European Federation of Crohn’s and Ulcerative Colitis Association’s online survey. Eur J Gastroenterol Hepatol. 2014;26(12):1385-91. https://doi.org/10.1097/MEG.0000000000000200 [ Links ]
30. Hou JK, Gasche C, Drazin NZ, Weaver SA, Ehrlich OG, Oberai R, Zapala S, Siegel CA, Melmed G. Assessment of Gaps in Care and the Development of a Care Pathway for Anemia in Patients with Inflammatory Bowel Diseases. Inflamm Bowel Dis. 2017;23(1):35-43. https://doi.org/10.1097/MIB.0000000000000953 [ Links ]
31. Qureshi T, Peter Nguyen T, Wang R, Willis D, Shah R, Hou JK. Improving Anemia in Inflammatory Bowel Disease: Impact of the Anemia Care Pathway. Dig Dis Sci. 2019;64(8):2124-2131. https://doi.org/10.1007/s10620-019-05559-w [ Links ]
32. Peyrin-Biroulet L, Lopez A, Cummings JRF, Dignass A, Detlie TE, Danese S. Review article: treating-to-target for inflammatory bowel disease-associated anaemia. Aliment Pharmacol Ther. 2018;48(6):610-617. https://doi.org/10.1111/apt.14922 [ Links ]
Citación: Juliao-Baños F, Arrubla M, Osorio L, Camargo J, Londoño J, Cáceres C, Carvajal J, Mosquera-Klinger G, Gómez A, Donado J. Prevalencia y manejo de anemia en enfermedad inflamatoria intestinal en un centro de referencia en Colombia. Rev Colomb Gastroenterol. 2021;36(4):446-454. https://doi.org/10.22516/25007440.696
Recibido: 22 de Noviembre de 2020; Aprobado: 12 de Febrero de 2021











 texto en
texto en