Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.1 Bogotá ene./mar. 2023 Epub 07-Jun-2023
https://doi.org/10.22516/25007440.979
Artículo de revisión
Hígado graso (parte 2): enfoque clínico y tratamiento
1Specialist Physician in Internal Medicine, Gastroenterology, and Hepatology, Universidad Nacional de Colombia, Hospital Clínic de Barcelona, Center for Hepatic and Digestive Diseases (CEHYD). Bogotá, Colombia
2Specialist Physician in Internal Medicine and Gastroenterology, Universidad del Rosario, Universidad Nacional de Colombia. Sanitas Organization, Center for Liver and Digestive Diseases (CEHYD). Bogotá, Colombia
3Specialist Physician in Internal Medicine, Gastroenterology, and Hepatology, Universidad de Cartagena, Universidad Nacional de Colombia, Hospital Clínic de Barcelona. Head of the Gastroenterology and Hepatology Service, Clínica del Norte. Barranquilla, Colombia
Los pacientes con hígado graso son casi siempre asintomáticos, las aminotransferasas usualmente están elevadas dos a cinco veces el valor normal y son una causa importante de consulta inicial. Todas las imágenes pueden evidenciar el hígado graso y la biopsia hepática sigue siendo la prueba de oro para su diagnóstico. En cualquier paciente las pruebas no invasivas son una excelente alternativa a la biopsia para determinar el grado de fibrosis hepática y establecer en qué etapa de la fibrogénesis se encuentra. La pérdida de peso y el ejercicio son los pilares fundamentales del tratamiento indicado para todos los pacientes con sobrepeso u obesidad; se recomienda una pérdida de peso entre 5% y 10% del peso corporal y una dieta con restricción calórica de 500-1000 kcal/día, baja en grasas saturadas y rica en productos de la dieta mediterránea como fruta, pescado, verduras, frutos secos, aceite de oliva, entre otros. Hay otros tratamientos como las medidas farmacológicas y los procedimientos endoscópicos y quirúrgicos.
Palabras clave: Hígado graso; diagnóstico no invasivo; enfoque clínico; tratamiento
Patients with fatty liver are almost always asymptomatic; aminotransferases are usually elevated two to five times the expected value and are an important cause of initial consultation. All images can show fatty liver, and liver biopsy remains the gold standard for diagnosis. In any patient, non-invasive tests are an excellent alternative to biopsy to determine the degree of liver fibrosis and establish the stage of fibrogenesis. Weight loss and exercise are the fundamental pillars of the indicated treatment for all patients with overweight or obesity; a weight loss between 5% and 10% and a diet with caloric restriction of 500-1000 kcal/day, low in saturated fat and rich in Mediterranean diet products such as fruit, fish, vegetables, nuts, olive oil, among others, are recommended. There are other treatments, such as pharmacological measures and endoscopic and surgical procedures.
Keywords: Fatty liver; non-invasive diagnosis; clinical approach; treatment
Clínica
Los pacientes con hígado graso (NAFLD), como en la mayoría de las enfermedades hepáticas, son casi siempre asintomáticos, ocasionalmente refieren astenia, adinamia o dolor en el hipocondrio derecho; en etapas avanzadas, los signos y síntomas son los de la hipertensión portal o cirrosis1. En el examen físico usualmente presentan sobrepeso u obesidad, aunque la enfermedad puede presentarse en pacientes delgados1,2. La hepatomegalia debida a la infiltración grasa del hígado se ha informado en el 5% de los pacientes con hígado graso y en el 18% de los pacientes con esteatohepatitis no alcohólica (NASH)3-5, y puede ser la causa del dolor abdominal en estos pacientes, aunque siempre se deben descartar otras causas1.
Laboratorio
Las aminotransferasas usualmente están elevadas dos a cinco veces el valor normal, y es una causa importante de consulta inicial; sin embargo, dicha elevación no predice el grado de inflamación o fibrosis hepática, y una alanina-aminotransferasa (ALT) normal no excluye diagnóstico de hígado graso o una lesión histológica importante6-8.
Otros hallazgos de laboratorio incluyen la elevación de la fosfatasa alcalina (FA) 2-3 veces el valor normal, una concentración sérica de ferritina o una saturación de transferrina elevada9. En los pacientes con hígado graso, una ferritina mayor de 1,5 el valor normal se asocia con fibrosis hepática avanzada10. La albúmina, bilirrubinas y tiempos de coagulación solamente se alteran en la cirrosis avanzada9.
Radiología
Todas las imágenes pueden evidenciar el hígado graso. La ecografía o ultrasonido abdominal o hepático es la prueba más utilizada, la esteatosis se manifiesta como un aumento difuso de ecogenicidad del parénquima hepático o un hígado brillante11. En un metaanálisis en el que se utilizó la biopsia hepática como estándar de oro se encontró una sensibilidad (S) y especificidad (E) del 85% y el 94%, respectivamente12; sin embargo, en pacientes con contenido de grasa < 30% y en obesos estas son menores, se han reportado valores de S entre 49% y 66%, y E entre 77% y 93,1%11,13.
La tomografía axial computarizada (TAC) tiene una S de 82% y una E de 100% para diagnosticar esteatosis hepática cuando el contenido de grasa es ≥ 30%14, pero con contenidos menores se reducen respectivamente a 50% y 83%11. Es un método rápido, no dependiente del operador, pero se debe tener en cuenta la radiación a la que se exponen los pacientes.
En cuanto a la resonancia magnética nuclear (RMN) en estudios con biopsia hepática como prueba de oro para la detección de esteatosis, se ha encontrado S entre 88% y 95%, y E entre 63% y 98%, respectivamente15,16; cuando la detección de esteatosis histológica se reduce a ≥ 5%, se describen valores de S entre 76,7% y 90,0% y de E entre 87,1% y 91%.
La fracción de grasa de densidad de protones (PDFF), estimada por espectroscopia de resonancia magnética (MRS), es un biomarcador no invasivo de esteatosis hepática preciso y reproducible17,18; sin embargo, no todos los escáneres tienen la capacidad de obtener secuencias espectroscópicas y no se usa de forma rutinaria por costos.
Biopsia hepática
Sigue siendo la prueba de oro para el diagnóstico de hígado graso y para diferenciar con certeza entre esteatosis simple, esteatohepatitis e incluso cirrosis, con implicaciones pronósticas; guía el manejo del paciente y, en muchas ocasiones, lo motiva a realizar cambios benéficos en su estilo de vida19-25. Se recomienda ante:
Pacientes con riesgo incrementado de fibrosis o cirrosis: obesidad, diabetes, dislipidemia o ferritina sérica > 1,5 veces el límite superior de lo normal, cuando las pruebas no invasivas no pueden excluir la fibrosis avanzada.
Sospecha de hígado graso no confirmado luego de un estudio prudencial con laboratorios e imágenes.
Sospecha de enfermedad hepática avanzada asociada al hígado graso, estigmas periféricos de cronicidad o cirrosis, esplenomegalia, citopenias.
Necesidad de estadificar la gravedad de la enfermedad o de excluir otras entidades.
Hallazgos
Para el diagnóstico histológico de hígado graso se requiere la presencia del 5% o más de los hepatocitos con esteatosis en una muestra de tejido hepático; según el porcentaje encontrado, se puede clasificar en leve (5%-33%), moderada (34%-66%) y grave (> 66%)21,22.
La esteatosis simple se diferencia de la NASH por los hallazgos histológicos: la esteatosis simple puede presentarse con inflamación lobulillar o portal, pero sin baloning de los hepatocitos, o con baloning, pero sin inflamación20,23. La NASH requiere la presencia de esteatosis hepática combinada con baloning de los hepatocitos e inflamación lobulillar hepática (típicamente en la zona acinar 3)20,23. La fibrosis no es una característica de diagnóstico necesaria, pero puede verse. Cuando la fibrosis progresa a cirrosis, la esteatosis y la inflamación pueden desaparecer, lo que da lugar al diagnóstico de cirrosis “criptogénica”23.
Con respecto a la predicción de la progresión de la fibrosis en hígado graso, se ha demostrado que sus mejores predictores son los parámetros histológicos, incluidos el baloning hepatocelular y la inflamación, asociados con la edad de los pacientes26. En otras series, la presencia de fibrosis en la biopsia inicial o la progresión de esta en otra biopsia parece ser el predictor histológico más destacado, de resultados adversos y mortalidad general en el hígado graso27,28. Por lo anterior, es fundamental determinar la presencia de fibrosis en los pacientes.
Determinación no invasiva de la fibrosis hepática
En cualquier paciente las pruebas no invasivas son una excelente alternativa a la biopsia hepática, para determinar el grado de fibrosis hepática y establecer en qué etapa de la fibrogénesis (F0-F4) se encuentra. Se considera fibrosis significativa una puntuación ≥ F2, y fibrosis avanzada ≥ F319,20,24,25,29. En el mercado existen dos categorías de pruebas no invasivas de fibrosis hepática, pruebas serológicas y pruebas basadas en imágenes. La tendencia actual es a usarlas de forma combinada de acuerdo con la disponibilidad local, dicha combinación de pruebas da como resultado menos pacientes con una puntuación de fibrosis indeterminada y una mayor especificidad25,29,30.
Pruebas serológicas
Se han validado varios productos de marcadores séricos:
El APRI
El FIB-4
Puntuación de fibrosis NAFLD
Puntuación BARD
Fibrotest/fibrosure
Hepascore
Fibrospect
La puntuación ELF (panel del Grupo Europeo de Estudio de Fibrosis Hepática).
Tienen una buena capacidad para diferenciar a los pacientes con fibrosis significativa (F2 a F4) de aquellos sin fibrosis significativa (F0 a F1), pero una desventaja es que no pueden diferenciar de manera confiable entre las diferentes etapas de la fibrosis, y los resultados indeterminados se presentan hasta en un 65%25,29,30. A continuación se mencionan las más útiles en nuestro medio.
El APRI o relación entre AST y plaquetas
Se ha estudiado en pacientes con el virus de la hepatitis C (VHC), virus de la inmunodeficiencia humana (VIH), coinfección VIH-VHC y en enfermedad hepática alcohólica29. Un metaanálisis de 40 estudios encontró que para predecir una fibrosis significativa (F2 a F4), un punto de corte APRI de 0,7 tenía una S del 77% y una E del 72%; para predecir la cirrosis (F4), un punto de corte APRI de 1,0 tenía una S del 76% y una E del 72%31. La capacidad del APRI para predecir resultados en pacientes con NAFLD se examinó en una serie retrospectiva con 320 pacientes32, el área bajo la curva ROC (AUROC) para predecir resultados adversos relacionados con el hígado fue de 0,80 y para predecir muerte o trasplante de hígado fue de 0,63.
El FIB-4
Combina el recuento de plaquetas, ALT, AST y edad, estudiado básicamente en hepatitis C. En hígado graso es útil para predecir la fibrosis avanzada33, el AUROC para predecir resultados adversos fue de 0,81 y para predecir muerte o trasplante de hígado fue de 0,6732. El FIB-4 se interpreta con dos umbrales de diagnóstico, uno inferior (< 1,30) para excluir fibrosis avanzada y uno superior (> 2,67) para confirmarla29.
Puntuación de fibrosis NAFLD
Se calcula con los datos de las pruebas de laboratorio de rutina, tiene en cuenta la edad del paciente, el IMC, los niveles de glucosa en sangre, los niveles de aminotransferasas, el recuento de plaquetas y la albúmina34. En un estudio de validación, un valor de corte alto en la puntuación de fibrosis NAFLD (> 0,676) se asoció con un valor predictivo positivo para fibrosis avanzada (F3 a F4) del 82% (S: 43%, E: 96%) y un valor de corte bajo (< -1,455) se asoció con un valor predictivo negativo del 88% (S: 77%, E: 71%)33.
Puntuación BARD
Tiene en cuenta el IMC, la relación AST/ALT y la presencia de diabetes mellitus35. En una serie de 126 pacientes con hígado graso, los valores predictivos positivo y negativo para fibrosis avanzada fueron del 69% y el 96%, respectivamente, con un AUROC de 0,8736. En otro estudio, las AUROC que predicen resultados adversos relacionados con el hígado y muerte o trasplante hepático fueron 0,73 y 0,66, respectivamente32.
Pruebas basadas en imágenes
Determinan la rigidez hepática al aplicar ondas mecánicas y medir la velocidad de propagación a través del tejido mediante imágenes, estas pruebas se conocen como elastografía, la mayoría se basan en la ecografía e incluyen la elastografía transitoria (ET) o Fibroscan®, elastografía en tiempo real o de onda bidimensional (2D-SWE) conocida en nuestro medio como Supersonic®, elastografía por impulso de fuerza de radiación acústica (ARFI) y elastografía por resonancia magnética (ERM). 2D-SWE y ERM combinan la elastografía con imágenes morfológicas hepáticas convencionales en la misma sesión37. Las pruebas basadas en ecografía son muy buenas para predecir hígado sano, fibrosis avanzada o cirrosis, pero en los estadios intermedios deben analizarse con cautela25,29,38.
Elastografía transitoria o Fibroscan®
Es el dispositivo más evaluado para medir la rigidez hepática. Se utilizan dos sondas, la clásica M y la XL, desarrollada para optimizar la medición y reducir la tasa de falla en pacientes obesos29,38,39. Los dos umbrales con Fibroscan® para descartar o sospechar fibrosis hepática avanzada (≥F3) son < 7,9 kPa y > 9,6 kPa, respectivamente, valor predictivo negativo del 96% y una S del 89%40. La zona gris entre los dos umbrales con diagnóstico indeterminado afecta al 10%-15% de los pacientes. Dos tercios de los pacientes con resultado > 9,6 kPa tienen fibrosis hepática avanzada, correspondiente a un valor predictivo positivo del 67%40. Aunque puede lograr una precisión diagnóstica (AUROC) superior a 0,92 para fibrosis avanzada, en pacientes con hígado graso es menos preciso para etapas intermedias41.
Imágenes de impulso de fuerza de radiación acústica
Utiliza un pulso acústico de alta intensidad y corta duración y se mide el desplazamiento del tejido en la misma dirección42. El rendimiento diagnóstico de ARFI y TE puede ser comparable para la detección de fibrosis hepática; en un estudio, el AUROC para ARFI frente a TE fue de 0,77 y 0,74 para diagnosticar el estadio de fibrosis ≥ F2, y de 0,84 y 0,80 para diagnosticar fibrosis ≥ F4. Sin embargo, en pacientes sin obesidad, ARFI funcionó ligeramente mejor para el diagnóstico de fibrosis en estadio ≥ F4 (área bajo la curva [AUC]: 0,92), una diferencia que no se observó con TE43.
Elastografía de ondas de corte bidimensional, 2D-SWE o Supersonic®
Ofrece imágenes simultáneas en escala de grises en tiempo real del tejido objeto del estudio. Supersonic® está integrado en los mismos escáneres que realizan una ecografía convencional, por lo que los dos procedimientos se pueden realizar en la misma sesión37,38,44. En un estudio prospectivo y controlado con biopsia de pacientes de hígado graso, el AUROC para el diagnóstico de fibrosis en estadio ≥ F2 fue de 0,84, en estadio ≥ F3, 0,88, y para cirrosis fue de 0,9345; otros estudios muestran resultados similares para el diagnóstico de fibrosis significativa, avanzada y cirrosis46,47.
Elastografía por resonancia magnética
A diferencia de la elastografía basada en ultrasonido, la ERM examina todo el hígado y no se limita a objetivo definido para el muestreo, se realiza en un escáner de RMN convencional que se ha equipado con hardware y software adicionales, la elastografía y la imagen morfológica se pueden realizar en la misma sesión. Un metaanálisis encontró S y E para la detección de la fibrosis ≥ F2 de 79% y 81%, para fibrosis ≥ F3, de 85% y 85%, y para cirrosis, de 91% y 81%, respectivamente48. La ERM también se ha comparado con la ET; en un estudio, la ERM mostró resultados similares a la ET basada en ultrasonido49, mientras que otros han encontrado una mayor tasa de éxito técnico y una mejor precisión diagnóstica con la ERM30,50.
Cada día se diagnostica más hígado graso en el mundo y en nuestro medio, asociado básicamente al síndrome metabólico y eso conlleva un aumento en las complicaciones asociadas a la fibrosis progresiva que culmina en la cirrosis; por tanto, los pacientes con hígado graso deben ser sometidos a estudios de clasificación de riesgo por parte de todos los médicos que los atiendan inicialmente51,52, fundamentalmente de atención primaria, medicina interna y gastroenterología, razón por la cual se propone el algoritmo de la Figura 1.
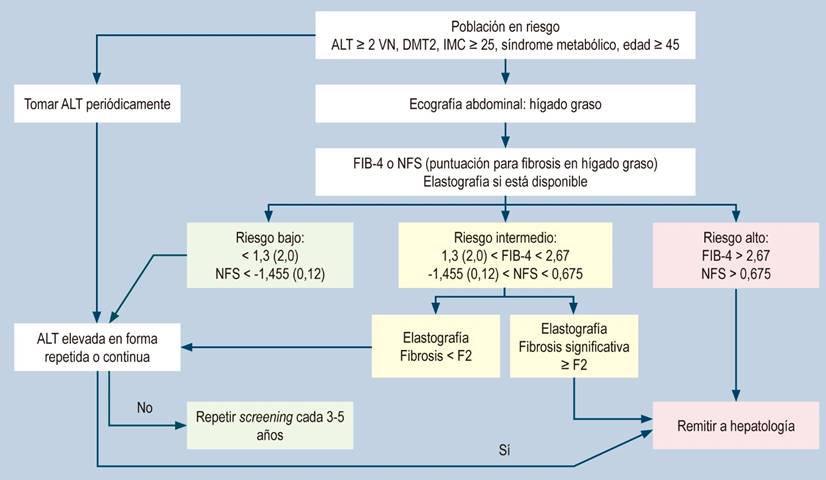
Figura 1 Algoritmo de riesgo hepático en hígado graso51. DMT2: diabetes mellitus tipo 2; VN: valor normal. Modificado de: Dietrich CG et al. World J Gastroenterol. 2021;27(35):5803-5821.
Tratamiento
Debido a los diseños de la mayoría de los ensayos clínicos actuales a corto plazo, los objetivos terapéuticos son la resolución histológica, la mejoría de la NASH sin progresión de la fibrosis, la mejoría de la fibrosis en al menos un estadio o la mejoría de los parámetros bioquímicos25,53,54. Idealmente se deberían buscar resultados clínicos como reducción de la enfermedad hepática terminal o el trasplante asociado con el hígado graso. En diabetes tipo 2 se deben considerar objetivos extrahepáticos cardiovasculares o microvasculares54.
El tratamiento se basa en 4 etapas progresivas:
Pérdida de peso con dieta y ejercicio
Medidas farmacológicas
Procedimientos endoscópicos
Procedimientos quirúrgicos.
Pérdida de peso con dieta y ejercicio
Es el tratamiento básico y más importante indicado para todos los pacientes con sobrepeso (IMC > 25 kg/m2) u obesidad (IMC > 30 kg/m2). Se recomienda una pérdida de peso entre el 5% y 7% del peso corporal para los pacientes con esteatosis simple, a una tasa de 0,5 a 1,0 kg por semana. Para los pacientes con NASH sospechada o comprobada por biopsia, la pérdida de peso debe ser de 7% a 10%. Si una vez alcanzado el objetivo de pérdida de peso el nivel sérico de ALT no se normaliza (ALT < 20 para mujeres y < 30 para hombres), se requiere una pérdida de peso adicional hasta su normalización19,20,24,25,55,56.
Dieta
La evidencia actual sugiere que la combinación de restricción calórica en al menos 500-1000 kcal día o una dieta adecuada baja en grasas saturadas es el mejor enfoque con buena adherencia del paciente30,57. La dieta mediterránea (DM), rica en fruta, pescado, verduras, frutos secos, aceite de oliva, entre otros, es la más recomendada20,25,30,58,59, y adicionalmente mejora el contenido de lípidos intrahepáticos y la sensibilidad a la insulina60. En la Figura 2 se representan los elementos constitutivos de la dieta mediterránea.
Ejercicio
Se recomiendan 150-200 min/semana de actividad física aeróbica de intensidad moderada en tres a cinco sesiones20,25,57. El ejercicio ayuda a mantener la pérdida de peso de la dieta y puede tener beneficios independientes sobre la grasa del hígado y su histología61; sus resultados parecen relacionarse más con la intensidad y la adherencia a un programa de entrenamiento que con el tipo de ejercicio y estos programas resultan en una mayor pérdida de peso en comparación con solo educación61,62. La actividad física se ha relacionado con beneficios en la supervivencia para los pacientes con hígado graso, y a mayor duración de la actividad física se presenta un menor riesgo de mortalidad relacionada con enfermedades cardiovasculares, especialmente con el ejercicio aeróbico63,64.
Medidas farmacológicas
La Asociación Estadounidense para el Estudio de las enfermedades del hígado (AASLD) recomienda tratamientos farmacológicos principalmente para mejorar la enfermedad hepática y deben limitarse a aquellos con NASH comprobada por biopsia y fibrosis19. Las guías de la Asociación Europea para el Estudio del Hígado (EASL), Asociación Europea para el Estudio de la Diabetes (EASD) y Asociación Europea para el Estudio de la Obesidad (EASO) recomiendan el tratamiento farmacológico para pacientes con hígado graso con NASH comprobado y fibrosis ≥ F2, o pacientes con alto riesgo de progresión como pacientes con diabetes tipo 2, síndrome metabólico, ALT elevada en forma persistente, o alta necroinflamación20.
Pacientes con NASH sin diabetes
Vitamina E: la AASLD no recomienda la vitamina E debido a que los estudios que muestran su utilidad no incluyeron pacientes con diabetes mellitus o cirrosis descompensada19. Aunque un metaanálisis no encontró mejoría histológica con la vitamina E65, está respaldada por algunos estudios en dosis de 800 UI/día, y el ensayo aleatorizado más grande incluido en el metaanálisis (pioglitazona frente a vitamina E frente a placebo para el tratamiento de pacientes no diabéticos con NASH) sugirió un beneficio con la vitamina E, los pacientes a los que se les administró tenían más probabilidades de mejorar su puntuación histológica global (43% frente a 19%)66. Un informe posterior encontró que la disminución en los valores de ALT era más común en los pacientes que recibieron la vitamina (48% frente a 16%)67. Se cree que la ventaja potencial está relacionada con sus propiedades antioxidantes; por tanto, la vitamina E puede ser una indicación razonable para pacientes con hígado graso y estadio de fibrosis ≥ 2 que no tienen diabetes mellitus, se debe evitar en hombres con historia familiar alta de cáncer de próstata y, en dosis ≥ 400 unidades internacionales por día, se ha asociado de manera inconsistente con un aumento en la mortalidad por todas las causas.
Pacientes con NASH y diabetes
La metformina es el fármaco de primera línea, no mejora ni la esteatosis ni la histología hepática en pacientes con y sin diabetes tipo 2, pero promueve una pérdida de peso moderada19,20,24,25,30,68-70.
Las tiazolidinedionas, y específicamente la pioglitazona, mejoran los parámetros bioquímicos e histológicos del hígado en pacientes con NASH30. Un metaanálisis encontró mejoría del baloning, inflamación lobulillar y esteatosis con tiazolidinedionas, además de una mejoría en la fibrosis con pioglitazona71. Para el beneficio clínico, probablemente se requiera un tratamiento a largo plazo, puesto que la mejoría observada con la pioglitazona puede regresar al suspender el fármaco72. Se ha demostrado reversión histológica de NASH sin empeoramiento de la fibrosis con pioglitazona en pacientes con y sin diabetes tipo 273. La pioglitazona actúa sobre el receptor de peroxisoma-proliferador-activado gamma (PPARγ) en los adipocitos, lo que lleva a remodelación del tejido adiposo y una mayor secreción de adiponectina con una reducción consecutiva de la lipólisis, la resistencia a la insulina y el almacenamiento hepático de lípidos70,74; sin embargo, sus efectos colaterales y riesgos (aumento de peso, insuficiencia cardíaca y fracturas) limitan su uso a casos seleccionados20.
Agonistas del receptor del péptido similar al glucagón 1. La secreción inducida por la comida de las hormonas intestinales, el péptido similar al glucagón 1 (GLP-1) y el péptido inhibidor gástrico (GIP), conocidas juntas como incretinas, potencian la secreción de insulina estimulada por la glucosa en las células β pancreáticas. El GLP-1 suprime y el GIP estimula la secreción de glucagón; adicionalmente, el GLP-1 retrasa el vaciamiento gástrico y la captación intestinal de glucosa, e interviene en la regulación central de la ingesta de alimentos y la saciedad75.
Los agonistas del receptor del péptido similar al glucagón 1 (AR GLP-1) son fundamentales en el tratamiento de la diabetes tipo 2 y la obesidad: inducen pérdida de peso, mejoran el control de la glicemia y producen cambios benéficos en el metabolismo cardíaco30,70.
Liraglutida: ha demostrado resolución de la NASH, disminución del contenido de grasa hepática y menores probabilidades de presentar una progresión de la fibrosis70,76,77. La dosis aprobada como antidiabético es de hasta 1,8 mg y para reducción de peso de 3 mg78.
Semaglutida: en pacientes con hígado graso y fibrosis en dosis de 0,4 mg una vez al día se asocia con resolución histológica de la NASH70,76,79,80. Es superior a la liraglutida en la disminución del peso corporal en personas con diabetes tipo 2, y también está aprobada para la pérdida de peso en pacientes sin diabetes; por el momento y en dosis altas es el más efectivo de los medicamentos disponibles para este fin, razón por la cual recientemente la Food and Drug Administration (FDA) aprobó una dosis subcutánea semanal de semaglutida de 2,4 mg para el manejo de la obesidad crónica en pacientes sin diabetes76,80.
Inhibidores del cotransportador de sodio-glucosa 2. Reducen eficazmente los niveles de glucosa en sangre e inducen una pérdida de peso moderada debido a la pérdida de glucosa renal y al déficit calórico resultante69,70,76,81. Se ha reportado recientemente que la inhibición de SGLT2 con empagliflozina resulta en una reducción absoluta en el contenido de grasa hepática en pacientes con diabetes tipo 2 después de 24 semanas de tratamiento81. Muy pocos estudios con inhibidores del cotransportador de sodio-glucosa 2 (I SGLT2) se correlacionan con criterios de valoración histológicos, además de que tienen pocos pacientes y escasa duración69,76; uno de ellos evidenció una mejoría del grado de esteatosis, balonización y grado de fibrosis con 25 mg diarios de empagliflozina en comparación con el placebo82.
Inhibidores de la dipeptidil peptidasa 4. Evitan la degradación endógena de la incretina y, por tanto, prolongan la acción endógena del GLP-1. En ensayos clínicos, los inhibidores de la dipeptidil peptidasa 4 (I DPP4) proporcionaron resultados negativos para el tratamiento de NAFLD69,70,76, excepto por una reducción de la grasa hepática con vildagliptina.
Un enfoque prometedor en hígado graso es el tratamiento combinado con diferentes clases de medicamentos que han demostrado su efectividad y fortalezas; por ejemplo, los AR GLP-1 e I SGLT2 reducen el riesgo cardiovascular y se recomiendan como terapias de primera línea para pacientes con diabetes tipo 2 y enfermedad cardiovascular (ECV) establecida o con alto riesgo. Posibles combinaciones son semaglutida/I SGLT2 o dosis bajas de pioglitazona en combinación con AR GLP-1 o I SGLT269,70,76.
Otros tratamientos en general
Estatinas: el beneficio se centra fundamentalmente en la disminución del riego cardiovascular. Los estudios piloto encontraron un beneficio de la atorvastatina en los niveles de aminotransferasa en pacientes con NAFLD30,69,76, y no se ha demostrado hepatotoxicidad con su uso83.
Ácidos grasos omega 3: en hígado graso se ha sugerido un beneficio con su uso, un metaanálisis evidenció una mejoría en la esteatosis hepática y en los niveles de AST84; cuando el análisis se restringió a los datos de los ensayos aleatorizados, solo la esteatosis hepática continuó mostrando una mejoría con el tratamiento con ácidos grasos omega 3.
En la Tabla 1 se resumen los aspectos básicos de los tratamientos de la diabetes.
Tabla 1 Tratamiento de la diabetes(70)
| Medicamentos | Grasa hepática | Actividad del NASH/NAS | Cambios en el peso | Efectos cardiovasculares | Efectos colaterales |
| Metformina | Sin cambios | Sin cambios | Sin cambios | Potencial beneficio en ECVA | Efectos gastrointestinales comunes (diarrea, náuseas) Acidosis láctica Déficit de vitamina B12 |
| Pioglitazona | Disminuye | Mejoría | Aumenta | Potencial beneficio en ECVA Riesgo incrementado de FC | Aumento de peso Retención de líquidos Aumenta el riesgo de fracturas Aumenta el cáncer de vejiga |
| I SGLT2 Empagliflozina Canagliflozina Dapagliflozina | Disminuye | Desconocido | Disminuye | Beneficio en ECVA de empagliflozina y canagliflozina Beneficio en FC de empagliflozina, canagliflozina y dapagliflozina | Riesgo de CAD ante cirugía Riesgo de fracturas óseas con canagliflozina Infecciones genitourinarias Depleción de volumen Aumenta la LDL |
| AR GLP-1 Lixisenatida Liraglutida Semaglutida Dulaglutida Albiglutida Exenatida | Disminuye | Mejoría | Disminuye | Beneficio en ECVA de liraglutida, semaglutida y dulaglutida | FDA indica riesgo de tumores de tiroides en roedores Efectos gastrointestinales comunes (diarrea, náuseas, vómito) Pancreatitis |
| I DPP4 Saxagliptina Alogliptina Sitagliptina Vildagliptina Linagliptina | Sin cambios | Desconocido | Sin cambios | Potencial riesgo en FC de saxagliptina | Pancreatitis Dolor articular |
AR GLP-1: agonistas del receptor del péptido similar al glucagón 1; CAD: cetoacidosis diabética; ECVA: enfermedad cardiovascular ateroesclerótica; FC: falla cardíaca; I DPP4: inhibidores de la dipeptidil peptidasa 4; I SGLT2: inhibidores del cotransportador de sodio-glucosa 2; LDL: lipoproteína de baja densidad; NAS: índice de actividad de NAFLD; NASH: esteatohepatitis no alcohólica. Modificado de: American Diabetes Association. Diabetes Care. 2021;44(Suppl 1):S111-S124.
Futuro del tratamiento para pacientes con hígado graso y diabetes tipo 2
Actualmente, el agonismo combinado de GLP-1, GIP y receptor de glucagón (agonistas dobles y triples) se está probando en ensayos clínicos de fase 2 y 3 para el tratamiento de la obesidad y la diabetes tipo 275.
La tirzepatida, un agonista dual del receptor GLP-1/GIP, mostró una reducción promedio del peso corporal de 9,5 kg (11,0%) con 15 mg por semana85,86.
La tesamorelina, un análogo de la hormona liberadora de la hormona del crecimiento, indicado para el tratamiento de la lipodistrofia en VIH, condujo a reducciones selectivas de la grasa visceral y hepática y pérdida de peso; esta evidencia generó un estudio en curso en hígado graso69,86.
El resmetirom, un agonista selectivo del receptor β de la hormona tiroidea (THR-β), se diseñó para mejorar la NASH al aumentar el metabolismo de las grasas hepáticas y reducir la lipotoxicidad69,86.
El lanifibranor es un agonista pan-PPAR que logró una mejora de la resolución combinada de NASH y fibrosis de una manera dependiente de la dosis en adultos con diabetes tipo 2 y NASH69,86.
Procedimientos endoscópicos
La FDA de Estados Unidos ha aprobado en la última década 6 tipos de terapias bariátricas y metabólicas endoscópicas (EBMT), y que han surgido como métodos alternos a la cirugía bariátrica, algunos reversibles, con menor costo y riesgo de complicaciones87,88. Básicamente, son la colocación de balones intragástricos o suturas endoscópicas intragástricas, los más conocidos son el sistema de balón intragástrico Orbera, el sistema de balón Obalon y el sistema de sutura endoscópica Over-Stitch (Apollo Endosurgery) para gastroplastia endoscópica en manga (ESG)87. Se reservan para los pacientes que no pierden peso con dieta, ejercicio y medicamentos y tienen alto riesgo de progresión de la fibrosis. Los procedimientos endoscópicos bariátricos proporcionan porcentajes más altos de pérdida de peso de una manera sostenida con regresión de la esteatosis hepática, la esteatohepatitis y la fibrosis en el 30% de los pacientes89,90.
Procedimientos quirúrgicos
La cirugía bariátrica está indicada para pacientes con NASH o fibrosis avanzada sin cirrosis descompensada que no cumplen con sus objetivos de pérdida de peso después de un adecuado seguimiento91. En una revisión sistemática se informó una mejoría de la esteatosis en 18 estudios, disminución de la inflamación en 11 estudios y mejoría en la puntuación de fibrosis en 6 estudios92; sin embargo, en 4 estudios hubo empeoramiento de la fibrosis; por tanto, todos los pacientes deben someterse a un seguimiento posoperatorio adecuado.
La cirugía bariátrica brinda otra opción para la pérdida de peso a largo plazo con una mejoría de la diabetes tipo 2 y los componentes histológicos de NAFLD93. Además, demostró mejoras en los resultados cardiovasculares en pacientes obesos con y sin diabetes tipo 294; sin embargo, la cirugía puede estar acompañada de complicaciones peri- o posoperatorias92,95.
Finalmente, en la Figura 3 se resumen los pilares actuales del tratamiento.
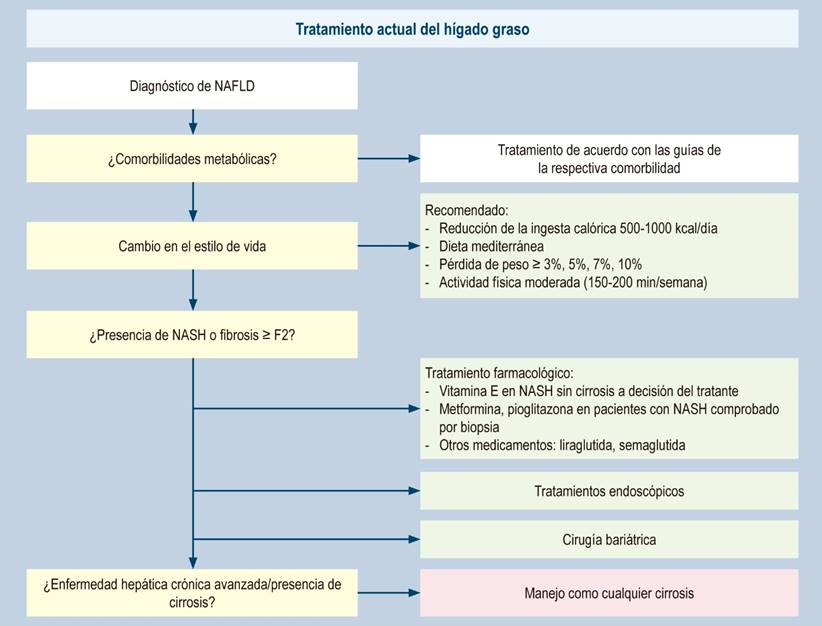
Figura 3 Tratamiento del hígado graso57. Modificado de: Paternostro R et al. J Intern Med. 2022;292(2):190-204.
REFERENCIAS
1. Patel V, Sanyal AJ, Sterling R. Clinical Presentation and Patient Evaluation in Nonalcoholic Fatty Liver Disease. Review Clin Liver Dis. 2016;20(2):277-92. https://doi.org/10.1016/j.cld.2015.10.006 [ Links ]
2. Arun J, Clements RH, Lazenby AJ, Leeth RR, Abrams GA. The prevalence of nonalcoholic steatohepatitis is greater in morbidly obese men compared to women. Obes Surg 2006;16(10):1351-8. https://doi.org/10.1381/096089206778663715 [ Links ]
3. Amarapurkar D, Kamani P, Patel N, Gupte P, Kumar P, Agal S, et al. Prevalence of non-alcoholic fatty liver disease: population based study. Ann Hepatol. 2007;6(3):161-3. https://doi.org/10.1016/S1665-2681(19)31922-2 [ Links ]
4. Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40(6):1387-95.https://doi.org/10.1002/hep.20466 [ Links ]
5. Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology. 1999;30(6):1356-62. https://doi.org/10.1002/hep.510300604 [ Links ]
6. Mofrad P, Contos MJ, Haque M, Sargeant C, Fisher RA, Luketic VA, et al. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values. Hepatology. 2003;37(6):1286-92.https://doi.org/10.1053/jhep.2003.50229 [ Links ]
7. Noguchi H, Tazawa Y, Nishinomiya F, Takada G. The relationship between serum transaminase activities and fatty liver in children with simple obesity. Acta Paediatr Jpn. 1995;37(5):621-5. https://doi.org/10.1111/j.1442-200X.1995.tb03389.x [ Links ]
8. Charatcharoenwitthaya P, Lindor KD, Angulo P. The spontaneous course of liver enzymes and its correlation in nonalcoholic fatty liver disease. Dig Dis Sci. 2012;57(7):1925-31. https://doi.org/10.1007/s10620-012-2098-3 [ Links ]
9. Neuschwander-Tetri BA, Clark JM, Bass NM, Van Natta ML, Unalp-Arida A, Tonascia J, et al. Clinical, laboratory and histological associations in adults with nonalcoholic fatty liver disease. Hepatology. 2010;52(3):913-24.https://doi.org/10.1002/hep.23784 [ Links ]
10. Kowdley KV, Belt P, Wilson LA, Yeh MM, Neuschwander-Tetri BA, Chalasani N, et al. Serum ferritin is an independent predictor of histologic severity and advanced fibrosis in patients with nonalcoholic fatty liver disease. Hepatology. 2012;55(1):77-85. https://doi.org/10.1002/hep.24706 [ Links ]
11. Lee SS, Park SH. Radiologic evaluation of nonalcoholic fatty liver disease. World J Gastroenterol. 2014;20(23):7392-402. https://doi.org/10.3748/wjg.v20.i23.7392 [ Links ]
12. Hernaez R, Lazo M, Bonekamp S, Kamel I, Brancati FL, Guallar E, et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a meta-analysis. Hepatology. 2011;54(3):1082-1090. https://doi.org/10.1002/hep.24452 [ Links ]
13. Mottin CC, Moretto M, Padoin AV, Swarowsky AM, Toneto MG, Glock L, et al. The role of ultrasound in the diagnosis of hepatic steatosis in morbidly obese patients. Obes Surg. 2004;14(5):635-7. https://doi.org/10.1381/096089204323093408 [ Links ]
14. Park SH, Kim PN, Kim KW, Lee SW, Yoon SE, Park SW, et al. Macrovesicular hepatic steatosis in living liver donors: use of CT for quantitative and qualitative assessment. Radiology. 2006;239(1):105-12. https://doi.org/10.1148/radiol.2391050361 [ Links ]
15. Cho CS, Curran S, Schwartz LH, Kooby DA, Klimstra DS, Shia J, et al. Preoperative radiographic assessment of hepatic steatosis with histologic correlation. J Am Coll Surg. 2008;206(3):480-8.https://doi.org/10.1016/j.jamcollsurg.2007.08.020 [ Links ]
16. Borra RJ, Salo S, Dean K, Lautamäki R, Nuutila P, Komu M, et al. Nonalcoholic fatty liver disease: rapid evaluation of liver fat content with in-phase and out-of-phase MR imaging. Radiology. 2009;250(1):130-6. https://doi.org/10.1148/radiol.2501071934 [ Links ]
17. Yokoo T, Shiehmorteza M, Hamilton G, Wolfson T, Schroeder ME, Middleton MS, et al. Estimation of hepatic proton-density fat fraction by using MR imaging at 3.0 T. Radiology. 2011;258(3):749-59. https://doi.org/10.1148/radiol.10100659 [ Links ]
18. Dulai PS, Sirlin CB, Loomba R. MRI and MRE for non-invasive quantitative assessment of hepatic steatosis and fibrosis in NAFLD and NASH: Clinical trials to clinical practice. J Hepatol. 2016;65(5):1006-1016.https://doi.org/10.1016/j.jhep.2016.06.005 [ Links ]
19. Chalasani N, Younossi Z, Lavine JE, Charlton M, Cusi K, Rinella M, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018;67(1):328-357. https://doi.org/10.1002/hep.29367 [ Links ]
20. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-402. https://doi.org/10.1016/j.jhep.2015.11.004 [ Links ]
21. Neuschwander-Tetri BA, Clark JM, Bass NM, et al. Clinical, laboratory and histological associations in adults with nonalcoholic fatty liver disease. Hepatology 2010; 52:913. [ Links ]
22. Kleiner DE, Brunt EM. Nonalcoholic fatty liver disease: pathologic patterns and biopsy evaluation in clinical research. Semin Liver Dis. 2012;32(1):3-13. https://doi.org/10.1055/s-0032-1306421 [ Links ]
23. Brunt EM, Tiniakos DG. Histopathology of nonalcoholic fatty liver disease. World J Gastroenterol. 2010;16(42):5286-96. https://doi.org/10.3748/wjg.v16.i42.5286 [ Links ]
24. Aller R, Fernández-Rodríguez C, Lo Iacono O, Bañares R, Abad J, Carrión JA, et al. Consensus document. Management of non-alcoholic fatty liver disease (NAFLD). Clinical practice guideline. Gastroenterol Hepatol. 2018;41(5):328-349. https://doi.org/10.1016/j.gastrohep.2017.12.003 [ Links ]
25. Arab JP, Dirchwolf M, Álvares-da-Silva MR, Barrera F, Benítez C, Castellanos-Fernandez M, et al. Latin American Association for the study of the liver (ALEH) practice guidance for the diagnosis and treatment of non-alcoholic fatty liver disease. Ann Hepatol. 2020;19(6):674-690. https://doi.org/10.1016/j.aohep.2020.09.006 [ Links ]
26. Argo CK, Northup PG, Al-Osaimi AM, Caldwell SH. Systematic review of risk factors for fibrosis progression in non-alcoholic steatohepatitis. J Hepatol. 2009;51(2):371-9.https://doi.org/10.1016/j.jhep.2009.03.019 [ Links ]
27. Vilar-Gomez E, Calzadilla-Bertot L, Wai-Sun Wong V, Castellanos M, Aller-de la Fuente R, Metwally M, et al. Fibrosis Severity as a Determinant of Cause-Specific Mortality in Patients With Advanced Nonalcoholic Fatty Liver Disease: A Multi-National Cohort Study. Gastroenterology. 2018;155(2):443-457.e17.https://doi.org/10.1053/j.gastro.2018.04.034 [ Links ]
28. Ekstedt M, Hagström H, Nasr P, Fredrikson M, Stål P, Kechagias S, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology. 2015;61(5):1547-54. https://doi.org/10.1002/hep.27368 [ Links ]
29. European Association for Study of Liver; Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63(1):237-64. https://doi.org/10.1016/j.jhep.2015.04.006 [ Links ]
30. Cusi K, Isaacs S, Barb D, Basu R, Caprio S, Garvey WT, et al. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocr Pract. 2022;28(5):528-562. https://doi.org/10.1016/j.eprac.2022.03.010 [ Links ]
31. Lin ZH, Xin YN, Dong QJ, Wang Q, Jiang XJ, Zhan SH, et al. Performance of the aspartate aminotransferase-to-platelet ratio index for the staging of hepatitis C-related fibrosis: an updated meta-analysis. Hepatology. 2011;53(3):726-36. https://doi.org/10.1002/hep.24105 [ Links ]
32. Angulo P, Bugianesi E, Bjornsson ES, Charatcharo-enwitthaya P, Mills PR, Barrera F, et al. Simple noninvasive systems predict long-term outcomes of patients with nonalcoholic fatty liver disease. Gastroenterology. 2013;145(4):782-9.e4. https://doi.org/10.1053/j.gastro.2013.06.057 [ Links ]
33. Shah AG, Lydecker A, Murray K, Tetri BN, Contos MJ, Sanyal AJ, et al. Comparison of noninvasive markers of fibrosis in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2009;7(10):1104-12. https://doi.org/10.1016/j.cgh.2009.05.033 [ Links ]
34. Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45(4):846-54. https://doi.org/10.1002/hep.21496 [ Links ]
35. Harrison SA, Oliver D, Arnold HL, Gogia S, Neuschwander-Tetri BA. Development and validation of a simple NAFLD clinical scoring system for identifying patients without advanced disease. Gut. 2008;57(10):1441-7. https://doi.org/10.1136/gut.2007.146019 [ Links ]
36. Cichoż-Lach H, Celiński K, Prozorow-Król B, Swatek J, Słomka M, Lach T. The BARD score and the NAFLD fibrosis score in the assessment of advanced liver fibrosis in nonalcoholic fatty liver disease. Med Sci Monit. 2012;18(12):CR735-40.https://doi.org/10.12659/MSM.883601 [ Links ]
37. Ozturk A, Grajo JR, Dhyani M, Anthony BW, Samir AE. Principles of ultrasound elastography. Abdom Radiol (NY). 2018;43(4):773-785. https://doi.org/10.1007/s00261-018-1475-6 [ Links ]
38. Boursier J, Guillaume M, Bouzbib C, Lannes A, Pais R, Smatti S, et al. Non-invasive diagnosis and follow-up of non-alcoholic fatty liver disease. Clin Res Hepatol Gastroenterol. 2022;46(1):101769.https://doi.org/10.1016/j.clinre.2021.101769 [ Links ]
39. Castera L. Non-invasive tests for liver fibrosis in NAFLD: Creating pathways between primary healthcare and liver clinics. Liver Int. 2020;40 Suppl 1:77-81. https://doi.org/10.1111/liv.14347 [ Links ]
40. Xiao H, Shi M, Xie Y, Chi X. Comparison of diagnostic accuracy of magnetic resonance elastography and Fibroscan for detecting liver fibrosis in chronic hepatitis B patients: A systematic review and meta-analysis. PLoS One. 2017;12(11):e0186660. https://doi.org/10.1371/journal.pone.0186660 [ Links ]
41. Castera L, Friedrich-Rust M, Loomba R. Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2019;156(5):1264-1281.e4. https://doi.org/10.1053/j.gastro.2018.12.036 [ Links ]
42. D’Onofrio M, Crosara S, De Robertis R, Canestrini S, Demozzi E, Gallotti A, et al. Acoustic radiation force impulse of the liver. World J Gastroenterol. 2013;19(30):4841-9. https://doi.org/10.3748/wjg.v19.i30.4841 [ Links ]
43. Cassinotto C, Lapuyade B, Aït-Ali A, Vergniol J, Gaye D, Foucher J, et al. Liver fibrosis: noninvasive assessment with acoustic radiation force impulse elastography--comparison with FibroScan M and XL probes and FibroTest in patients with chronic liver disease. Radiology. 2013;269(1):283-92. https://doi.org/10.1148/radiol.13122208 [ Links ]
44. Ferraioli G, Tinelli C, Dal Bello B, Zicchetti M, Filice G, Filice C, et al. Accuracy of real-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: a pilot study. Hepatology. 2012;56(6):2125-33.https://doi.org/10.1002/hep.25936 [ Links ]
45. Sharpton SR, Tamaki N, Bettencourt R, Madamba E, Jung J, Liu A, et al. Diagnostic accuracy of two-dimensional shear wave elastography and transient elastography in nonalcoholic fatty liver disease. Therap Adv Gastroenterol. 2021;14:17562848211050436. https://doi.org/10.1177/17562848211050436 [ Links ]
46. Cassinotto C, Boursier J, Paisant A, Guiu B, Irles-Depe M, Canivet C, et al. Transient Versus Two-Dimensional Shear-Wave Elastography in a Multistep Strategy to Detect Advanced Fibrosis in NAFLD. Hepatology. 2021;73(6):2196-2205. https://doi.org/10.1002/hep.31655 [ Links ]
47. Furlan A, Tublin ME, Yu L, Chopra KB, Lippello A, Behari J. Comparison of 2D Shear Wave Elastography, Transient Elastography, and MR Elastography for the Diagnosis of Fibrosis in Patients With Nonalcoholic Fatty Liver Disease. AJR Am J Roentgenol. 2020;214(1):W20-W26. https://doi.org/10.2214/AJR.19.21267 [ Links ]
48. Singh S, Venkatesh SK, Wang Z, Miller FH, Motosugi U, Low RN, et al. Diagnostic performance of magnetic resonance elastography in staging liver fibrosis: a systematic review and meta-analysis of individual participant data. Clin Gastroenterol Hepatol. 2015;13(3):440-451.e6.https://doi.org/10.1016/j.cgh.2014.09.046 [ Links ]
49. Yin M, Talwalkar JA, Glaser KJ, Manduca A, Grimm RC, Rossman PJ, et al. Assessment of hepatic fibrosis with magnetic resonance elastography. Clin Gastroenterol Hepatol . 2007;5(10):1207-1213.e2.https://doi.org/10.1016/j.cgh.2007.06.012 [ Links ]
50. Imajo K, Kessoku T, Honda Y, Tomeno W, Ogawa Y, Mawatari H, et al. Magnetic Resonance Imaging More Accurately Classifies Steatosis and Fibrosis in Patients With Nonalcoholic Fatty Liver Disease Than Transient Elastography. Gastroenterology. 2016;150(3):626-637.e7. https://doi.org/10.1053/j.gastro.2015.11.048 [ Links ]
51. Dietrich CG, Rau M, Geier A. Screening for nonalcoholic fatty liver disease-when, who and how? World J Gastroenterol. 2021;27(35):5803-5821. https://doi.org/10.3748/wjg.v27.i35.5803 [ Links ]
52. Saiman Y, Duarte-Rojo A, Rinella ME. Fatty Liver Disease: Diagnosis and Stratification. Annu Rev Med. 2022;73:529-544. https://doi.org/10.1146/annurev-med-042220-020407 [ Links ]
53. Sanyal AJ, Brunt EM, Kleiner DE, Kowdley KV, Chalasani N, Lavine JE, et al. Endpoints and clinical trial design for nonalcoholic steatohepatitis. Hepatology. 2011;54(1):344-53. https://doi.org/10.1002/hep.24376 [ Links ]
54. Friedman SL, Neuschwander-Tetri BA, Rinella M, Sanyal AJ. Mechanisms of NAFLD development and therapeutic strategies. Nat Med. 2018;24(7):908-922. https://doi.org/10.1038/s41591-018-0104-9 [ Links ]
55. Musso G, Cassader M, Rosina F, Gambino R. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia. 2012;55(4):885-904. https://doi.org/10.1007/s00125-011-2446-4 [ Links ]
56. Beltrán O, Galindo A, Mendoza Y, Hernández G, Varón A, Garzón M, et al. Guía de práctica clínica para la enfermedad hepática grasa no alcohólica. Rev Col Gastroenterol. 2015;30(1):89-96. [ Links ]
57. Paternostro R, Trauner M. Current treatment of non-alcoholic fatty liver disease. J Intern Med. 2022;292(2):190-204. https://doi.org/10.1111/joim.13531 [ Links ]
58. Haigh L, Kirk C, Gendy K, Gallacher J, Errington L, Mathers J, et al. The effectiveness and acceptability of Mediterranean diet and calorie restriction in non-alcoholic fatty liver disease (NAFLD): A systematic review and meta-analysis. Clin Nutr. 2022;41(9):1913-1931. https://doi.org/10.1016/j.clnu.2022.06.037 [ Links ]
59. Zelber-Sagi S. Dietary Treatment for NAFLD: New Clinical and Epidemiological Evidence and Updated Recommendations. Semin Liver Dis. 2021;41(3):248-262. https://doi.org/10.1055/s-0041-1729971 [ Links ]
60. Gepner Y, Shelef I, Komy O, Cohen N, Schwarzfuchs D, Bril N, et al. The benefcial efects of Mediterranean diet over low-fat diet may be mediated by decreasing hepatic fat content. J Hepatol. 2019;71(2):379-88. https://doi.org/10.1016/j.jhep.2019.04.013 [ Links ]
61. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 2015;149(2):367-78.e5. https://doi.org/10.1053/j.gastro.2015.04.005 [ Links ]
62. Promrat K, Kleiner DE, Niemeier HM, Jackvony E, Kearns M, Wands JR, et al. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology. 2010;51(1):121-9. https://doi.org/10.1002/hep.23276 [ Links ]
63. Croci I, Coombes JS, Bucher Sandbakk S, Keating SE, Nauman J, Macdonald GA, et al. Non-alcoholic fatty liver disease: Prevalence and all-cause mortality according to sedentary behaviour and cardiorespiratory fitness. The HUNT Study. Prog Cardiovasc Dis. 2019;62(2):127-134. https://doi.org/10.1016/j.pcad.2019.01.005 [ Links ]
64. Kim D, Murag S, Cholankeril G, Cheung A, Harrison SA, Younossi ZM, et al. Physical Activity, Measured Objectively, Is Associated With Lower Mortality in Patients With Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol . 2021;19(6):1240-1247.e5. https://doi.org/10.1016/j.cgh.2020.07.023 [ Links ]
65. Musso G, Gambino R, Cassader M, Pagano G. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease. Hepatology. 2010;52(1):79-104. https://doi.org/10.1002/hep.23623 [ Links ]
66. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010;362(18):1675-85. https://doi.org/10.1056/NEJMoa0907929 [ Links ]
67. Hoofnagle JH, Van Natta ML, Kleiner DE, Clark JM, Kowdley KV, Loomba R, et al. Vitamin E and changes in serum alanine aminotransferase levels in patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2013;38(2):134-43. https://doi.org/10.1111/apt.12352 [ Links ]
68. Rakoski MO, Singal AG, Rogers MA, Conjeevaram H. Meta-analysis: insulin sensitizers for the treatment of non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2010;32(10):1211-21. https://doi.org/10.1111/j.1365-2036.2010.04467.x [ Links ]
69. Kahl S, Pützer J, Roden M. Novel Antidiabetic Strategies and Diabetologists› Views in Nonalcoholic Steatohepatitis. Semin Liver Dis. 2022;42(1):48-60. https://doi.org/10.1055/s-0041-1732354 [ Links ]
70. American Diabetes Association. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes-2021. Diabetes Care. 2021;44(Suppl 1):S111-S124. https://doi.org/10.2337/dc21-S009 [ Links ]
71. Boettcher E, Csako G, Pucino F, Wesley R, Loomba R. Meta-analysis: pioglitazone improves liver histology and fibrosis in patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2012;35(1):66-75. https://doi.org/10.1111/j.1365-2036.2011.04912.x [ Links ]
72. Lutchman G, Modi A, Kleiner DE, Promrat K, Heller T, Ghany M, et al. The effects of discontinuing pioglitazone in patients with nonalcoholic steatohepatitis. Hepatology. 2007;46(2):424-9. https://doi.org/10.1002/hep.21661 [ Links ]
73. Cusi K, Orsak B, Bril F, Lomonaco R, Hecht J, Ortiz-Lopez C, et al. Long-Term Pioglitazone Treatment for Patients With Nonalcoholic Steatohepatitis and Prediabetes or Type 2 Diabetes Mellitus: A Randomized Trial. Ann Intern Med. 2016;165(5):305-15.https://doi.org/10.7326/M15-1774 [ Links ]
74. Cusi K. Treatment of patients with type 2 diabetes and non-alcoholic fatty liver disease: current approaches and future directions. Diabetologia. 2016;59(6):1112-20. https://doi.org/10.1007/s00125-016-3952-1 [ Links ]
75. Svegliati-Baroni G, Patrício B, Lioci G, Macedo MP, Gastaldelli A. Gut-pancreas-liver axis as a target for treatment of NAFLD/NASH. Int J Mol Sci 2020;21(16):5820. https://doi.org/10.3390/ijms21165820 [ Links ]
76. Davies MJ, Aroda VR, Collins BS, Gabbay RA, Green J, Maruthur NM, et al. Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2022;65(12):1925-1966. https://doi.org/10.1007/s00125-022-05787-2 [ Links ]
77. Armstrong MJ, Gaunt P, Aithal GP, Barton D, Hull D, Parker R, et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016;387(10019):679-690. https://doi.org/10.1016/S0140-6736(15)00803-X [ Links ]
78. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015;373(1):11-22. https://doi.org/10.1056/NEJMoa1411892 [ Links ]
79. Lingvay I, Desouza CV, Lalic KS, Rose L, Hansen T, Zacho J, et al. A 26-Week Randomized Controlled Trial of Semaglutide Once Daily Versus Liraglutide and Placebo in Patients With Type 2 Diabetes Suboptimally Controlled on Diet and Exercise With or Without Metformin. Diabetes Care. 2018;41(9):1926-1937. https://doi.org/10.2337/dc17-2381 [ Links ]
80. Nachawi N, Rao PP, Makin V. The role of GLP-1 receptor agonists in managing type 2 diabetes. Cleve Clin J Med. 2022;89(8):457-464. https://doi.org/10.3949/ccjm.89a.21110 [ Links ]
81. Androutsakos T, Nasiri-Ansari N, Bakasis AD, Kyrou I, Efstathopoulos E, Randeva HS, et al. SGLT-2 Inhibitors in NAFLD: Expanding Their Role beyond Diabetes and Cardioprotection. Int J Mol Sci. 2022;23(6):3107.https://doi.org/10.3390/ijms23063107 [ Links ]
82. Lai LL, Vethakkan SR, Nik Mustapha NR, Mahadeva S, Chan WK. Empagliflozin for the Treatment of Nonalcoholic Steatohepatitis in Patients with Type 2 Diabetes Mellitus. Dig Dis Sci. 2020;65(2):623-631.https://doi.org/10.1007/s10620-019-5477-1 [ Links ]
83. Abdallah M, Brown L, Provenza J, Tariq R, Gowda S, Singal AK. Safety and efficacy of dyslipidemia treatment in NAFLD patients: a meta-analysis of randomized controlled trials. Ann Hepatol. 2022 27(6):100738. https://doi.org/10.1016/j.aohep.2022.100738 [ Links ]
84. Parker HM, Johnson NA, Burdon CA, Cohn JS, O’Connor HT, George J. Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis. J Hepatol. 2012;56(4):944-51. https://doi.org/10.1016/j.jhep.2011.08.018 [ Links ]
85. Hartman ML, Sanyal AJ, Loomba R, Wilson JM, Nikooienejad A, Bray R, et al. Effects of Novel Dual GIP and GLP-1 Receptor Agonist Tirzepatide on Biomarkers of Nonalcoholic Steatohepatitis in Patients With Type 2 Diabetes. Diabetes Care. 2020;43(6):1352-1355.https://doi.org/10.2337/dc19-1892 [ Links ]
86. Chew NWS, Ng CH, Truong E, Noureddin M, Kowdley KV. Nonalcoholic Steatohepatitis Drug Development Pipeline: An Update. Semin Liver Dis. 2022;42(3):379-400. https://doi.org/10.1055/a-1877-9656 [ Links ]
87. Hashem A, Khalouf A, Acosta A. Management of Obesity and Nonalcoholic Fatty Liver Disease: A Literature Review. Semin Liver Dis. 2021;41(4):435-447. https://doi.org/10.1055/s-0041-1731704 [ Links ]
88. Ali MR, Moustarah F, Kim JJ; American Society for Metabolic and Bariatric Surgery Clinical Issues Committee. American Society for Metabolic and Bariatric Surgery position statement on intragastric balloon therapy endorsed by the Society of American Gastrointestinal and Endoscopic Surgeons. Surg Obes Relat Dis. 2016;12(3):462-467. https://doi.org/10.1016/j.soard.2015.12.026 [ Links ]
89. Jirapinyo P, McCarty TR, Dolan RD, Shah R, Thompson CC. Effect of Endoscopic Bariatric and Metabolic Therapies on Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol . 2022;20(3):511-524.e1. https://doi.org/10.1016/j.cgh.2021.03.017 [ Links ]
90. Ren M, Zhou X, Zhang Y, Mo F, Yang J, Yu M, et al. Effects of Bariatric Endoscopy on Non-Alcoholic Fatty Liver Disease: A Comprehensive Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2022;13:931519. https://doi.org/10.3389/fendo.2022.931519 [ Links ]
91. Lassailly G, Caiazzo R, Buob D, Pigeyre M, Verkindt H, Labreuche J, et al. Bariatric Surgery Reduces Features of Nonalcoholic Steatohepatitis in Morbidly Obese Patients. Gastroenterology. 2015;149(2):379-88. https://doi.org/10.1053/j.gastro.2015.04.014 [ Links ]
92. Lee Y, Doumouras AG, Yu J, Brar K, Banfield L, Gmora S, et al. Complete Resolution of Nonalcoholic Fatty Liver Disease After Bariatric Surgery: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol . 2019;17(6):1040-1060.e11. https://doi.org/10.1016/j.cgh.2018.10.017 [ Links ]
93. Vangoitsenhoven R, Wilson RL, Cherla DV, Tu C, Kashyap SR, Cummings DE, et al. Presence of Liver Steatosis Is Associated With Greater Diabetes Remission After Gastric Bypass Surgery. Diabetes Care. 2021;44(2):321-325. https://doi.org/10.2337/dc20-0150 [ Links ]
94. Moussa O, Ardissino M, Heaton T, Tang A, Khan O, Ziprin P, et al. Effect of bariatric surgery on long-term cardiovascular outcomes: a nationwide nested cohort study. Eur Heart J. 2020;41(28):2660-2667. https://doi.org/10.1093/eurheartj/ehaa069 [ Links ]
95. Mendoza YP, Becchetti C, Watt KD, Berzigotti A. Risks and Rewards of Bariatric Surgery in Advanced Chronic Liver Diseases. Semin Liver Dis. 2021;41(4):448-460. https://doi.org/10.1055/s-0041-1731705 [ Links ]
Citación:
2Prieto-Ortiz JE, Sánchez-Luque CB, Ortega-Quiroz R. Hígado graso (parte 2): enfoque clínico y tratamiento. Revista. colomb. Gastroenterol. 2023;38(1):46-58. https://doi.org/10.22516/25007440.979
Recibido: 02 de Agosto de 2022; Aprobado: 23 de Septiembre de 2022











 texto en
texto en 




