Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.1 Bogotá ene./mar. 2023 Epub 07-Jun-2023
https://doi.org/10.22516/25007440.884
Reporte de caso
Colitis ulcerativa inducida por secukinumab en el tratamiento de espondilitis anquilosante
1Specialist in General Surgery, Resident of Clinical-Surgical Gastroenterology, Universidad de Caldas. Manizales. Colombia
2Specialist in General Surgery, Clinical Surgical Gastroenterologist. Professor of Gastroenterology, Universidad de Caldas. Manizales. Colombia
Los inhibidores de interleucina 17 (IL-17) se encuentran aprobados para el tratamiento de psoriasis, artropatía psoriásica y espondilitis anquilosante. La IL-17 se encuentra involucrada en la patogenia de la enfermedad inflamatoria intestinal (EII); sin embargo, hasta la fecha se han reportado eventos paradójicos con el uso inhibidores selectivos de IL-17 como el secukinumab, cuyos mecanismos fisiopatológicos no han sido del todo aclarados. Aunque la incidencia de EII en este grupo de pacientes es baja, el riesgo podría disminuirse mediante una evaluación cuidadosa de factores de riesgo tales como historia familiar, síntomas gastrointestinales y la realización de calprotectina fecal previo al inicio del tratamiento.
Palabras clave: Secukinumab; colitis ulcerativa; espondilitis anquilosante
Interleukin 17 (IL-17) inhibitors are approved for treating psoriasis, psoriatic arthropathy, and ankylosing spondylitis. IL-17 is involved in the pathogenesis of inflammatory bowel disease (IBD); however, paradoxical events have been reported using selective IL-17 inhibitors such as secukinumab, whose pathophysiological mechanisms have not been fully clarified. Although the incidence of IBD in this group of patients is low, the risk could be reduced by carefully assessing risk factors such as family history, gastrointestinal symptoms, and fecal calprotectin before starting treatment.
Keywords: Secukinumab; ulcerative colitis; ankylosing spondylitis
Introducción
La interleucina 17 (IL-17) es una citocina proinflamatoria que se encuentra asociada con la patogenia de la enfermedad inflamatoria intestinal (EII)1; sin embargo, el uso de inhibidores selectivos de la misma, como el secukinumab (anticuerpo monoclonal aprobado para el tratamiento de psoriasis, artropatía psoriásica y espondilitis anquilosante [EA]) de manera paradójica se ha asociado con exacerbaciones o el desarrollo de EII, al parecer debido al efecto protector que tiene la IL-17 frente a la inflamación mediante la inhibición de la respuesta Th1, el mantenimiento de la barrera epitelial del enterocito y, por tanto, de la homeostasis intestinal2.
Presentación del caso
Se trata de una paciente femenina de 43 años con antecedente de EA desde los 20 años (tratamiento previo con etanercept, adalimumab, abatacept y desde 2017 secukinumab), fibromialgia, hipertensión arterial, hipotiroidismo y tuberculosis latente tratada en 2019, quien consultó por clínica de una semana de evolución caracterizada por dolor abdominal difuso asociado a deposiciones diarreicas sanguinolentas múltiples (más de 15 al día). Al ingreso estaba taquicárdica, deshidratada, afebril y con dolor de predominio en el hemiabdomen inferior sin signos de irritación peritoneal. Se realizaron laboratorios en los que el hemograma resultó sin alteración de las líneas celulares, y el estudio ecográfico y tomográfico informaron engrosamiento mural de las paredes del colon derecho con realce mucoso, adenopatías mesentéricas múltiples y escaso líquido libre en el fondo del saco (Figura 1). Se realizó una colonoscopia en la que se encontró edema, eritema, friabilidad de la mucosa, pérdida del patrón vascular y ulceraciones cubiertas por fibrina desde el recto hasta el ciego, hallazgos compatibles con colitis ulcerativa extensa (Figura 2).
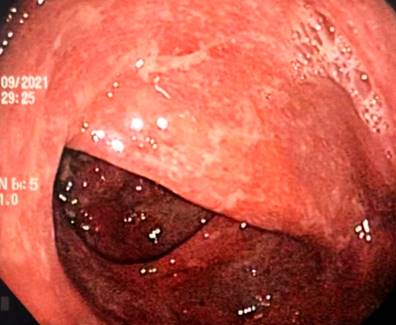
Figura 1 Hallazgos tomográficos. Engrosamiento de las paredes del colon ascendente con realce mucoso (flecha). Fuente: archivo de los autores.
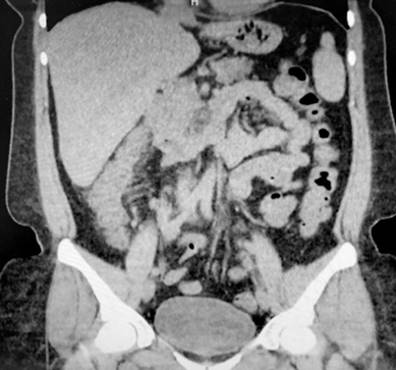
Figura 2 Hallazgos endoscópicos. Edema, eritema, pérdida del patrón vascular y ulceraciones cubiertas por fibrina. Fuente: archivo de los autores.
Dados los hallazgos endoscópicos y los síntomas descritos, se consideró una paciente con colitis ulcerativa grave, por lo que se inició el manejo con corticoide endovenoso, ácido 5-aminosalicílico (5-ASA) oral (gránulos) y tópico (enemas). El reporte patológico concluyó que se trataba de una enfermedad inflamatoria intestinal sugestiva de colitis ulcerativa con actividad grave, negativo para displasia o metaplasia. Se realizó el perfil infeccioso y se encontró como único hallazgo positivo inmunoglobulina G (IgG) para citomegalovirus (CMV), perfil hepático normal y calprotectina fecal > 1000 ng/mL. La paciente evolucionó favorablemente con la resolución de los síntomas de ingreso, se realizó el retiro progresivo del corticoide y, en conjunto con reumatología, se decidió realizar el cambio de terapia biológica e iniciar el manejo con tofacitinib.
Discusión
El secukinumab es un anticuerpo monoclonal humano que actúa de forma específica bloqueando la interleucina 17A (IL-17A)3, la actividad de esta molécula de regulación inflamatoria se ha vinculado con el desarrollo de enfermedades autoinmunes como EA, artritis psoriásica (AP) y psoriasis, existen además estudios con pruebas murinas que sugieren para la IL-17A un papel en la homeostasis gastrointestinal y en la reparación de los tejidos mediante el mantenimiento de la integridad de la barrera intestinal4, esto último a través de la estimulación de la producción de mucina, que favorece una fuerte unión entre las proteínas claudina y ocludina5. El secukinumab es una molécula empleada con frecuencia en el tratamiento de espondiloartropatías tipo EA y AP, estas son patologías poligénicas que pueden tener características sobrepuestas con la EII, aunque no se conoce muy bien el mecanismo inmune involucrado. Se conoce que al menos el 50% de los pacientes con EA o AP tienen cambios histológicos de inflamación en muestras tomadas del colon, cerca del 7% puede desarrollar enfermedad de Crohn o colitis ulcerativa6 y tienen tres veces más riesgo de desarrollar EII con respecto a la población general7,8.
La inhibición de la IL-17A como tratamiento de EA puede resultar en un potencial deterioro de la barrera epitelial intestinal propiciando el inicio o exacerbación de la EII en sus fenotipos colitis ulcerativa o enfermedad de Crohn3.
Se ha reportado que hasta el 7,8% de los pacientes que reciben secukinumab pueden presentar síntomas gastrointestinales, asociados a su administración9; sin embargo, la mayoría no desarrolla evidencia objetiva de EII ni requiere suspensión del tratamiento. La incidencia de casos nuevos de EII después de la administración de secukinumab se ha reportado entre el 0,2% y 0,7%7,10,11.
Aunque la incidencia de EII en pacientes tratados con secukinumab es baja, se recomienda investigar de manera cuidadosa la historia familiar de EII o síntomas gastrointestinales no estudiados en el paciente previo al inicio del tratamiento7. Se debe siempre informar al paciente la posibilidad de desarrollar eventos adversos gastrointestinales y, puesto que algunos pueden cursar con EII subclínica, se sugiere la realización de calprotectina fecal, de manera que aquellos con valores normales sean considerados candidatos a iniciar el tratamiento (aunque sigue siendo fundamental una vigilancia estrecha de la aparición de síntomas gastrointestinales) y aquellos con valores elevados deberán ser evaluados para descartar este diagnóstico. En caso de EII activa, el inicio del tratamiento está contraindicado, y en aquellos con diagnostico conocido de EII en fase quiescente se sugiere considerar otras opciones terapéuticas12. Hasta la fecha no se conocen casos reportados de EII exacerbada o inducida por secukinumab en Colombia.
Conclusiones
Aunque la incidencia de EII en pacientes tratados con inhibidores de IL-17 es baja, debe tenerse en cuenta que un porcentaje considerable de los pacientes que reciben este grupo de medicamentos puede desarrollar eventos adversos de tipo gastrointestinal que requieren vigilancia y seguimiento.
Una evaluación cuidadosa de la historia familiar, de síntomas previos y la realización de calprotectina fecal previo al inicio del tratamiento son las estrategias propuestas para disminuir el riesgo de desarrollar EII o de presentar exacerbaciones.
Agradecimientos
Al Dr Lázaro Arango Molano, coordinador del programa de Gastroenterología clínicoquirúrgica de la Universidad de Caldas y Unión de cirujanos - Oncólogos de Occidente, institución donde se atendió a la paciente.
REFERENCIAS
1. Kobayashi T, Okamoto S, Hisamatsu T, Kamada N, Chinen H, Saito R, et al. IL23 differentially regulates the Th1/Th17 balance in ulcerative colitis and Crohn’s disease. Gut. 2008;57(12):1682-9. https://doi.org/10.1136/gut.2007.135053 [ Links ]
2. Abraham C, Dulai PS, Vermeire S, Sandborn WJ. Lessons Learned From Trials Targeting Cytokine Pathways in Patients With Inflammatory Bowel Diseases. Gastroenterology. 2017;152(2):374-388.e4. https://doi.org/10.1053/j.gastro.2016.10.018 [ Links ]
3. Wang J, Bhatia A, Cleveland NK, Gupta N, Dalal S, Rubin DT, et al. Rapid Onset of Inflammatory Bowel Disease after Receiving Secukinumab Infusion. ACG Case Reports J. 2018;5(1):e56. https://doi.org/10.14309/crj.2018.56 [ Links ]
4. Whibley N, Gaffen SL. Gut-busters-IL-17 Ain’t Afraid Of No IL-23 HHS Public Access. Immunity. 2015;43(4):620-2. https://doi.org/10.1016/j.immuni.2015.10.001 [ Links ]
5. Eichele DD, Kharbanda KK. Dextran sodium sulfate colitis murine model: An indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis. World J Gastroenterol. 2017;23(33):6016-29. https://doi.org/10.3748/wjg.v23.i33.6016 [ Links ]
6. Van Praet L, Van Den Bosch FE, Jacques P, Carron P, Jans L, Colman R, et al. Microscopic gut inflammation in axial spondyloarthritis: A multiparametric predictive model. Ann Rheum Dis. 2013;72(3):414-7. https://doi.org/10.1136/annrheumdis-2012-202135 [ Links ]
7. Onac IA, Clarke BD, Tacu C, Lloyd M, Hajela V, Batty T, et al. Secukinumab as a potential trigger of inflammatory bowel disease in ankylosing spondylitis or psoriatic arthritis patients. Rheumatology (Oxford). 2021;60(11):5233-5238. https://doi.org/10.1093/rheumatology/keab193 [ Links ]
8. Emond B, Ellis LA, Chakravarty SD, Ladouceur M, Lefebvre P. Real-world incidence of inflammatory bowel disease among patients with other chronic inflammatory diseases treated with interleukin-17a or phosphodiesterase 4 inhibitors. Curr Med Res Opin. 2019;35(10):1751-9. https://doi.org/10.1080/03007995.2019.1620713 [ Links ]
9. Caron B, Jouzeau JY, Miossec P, Petitpain N, Gillet P, Netter P, et al. Gastroenterological safety of IL-17 inhibitors: a systematic literature review. Expert Opin Drug Saf. 2021;00(00):1-17. https://doi.org/10.1080/14740338.2021.1960981 [ Links ]
10. Orrell KA, Murphrey M, Kelm RC, Lee HH, Pease DR, Laumann AE, et al. Inflammatory bowel disease events after exposure to interleukin 17 inhibitors secukinumab and ixekizumab: Postmarketing analysis from the RADAR (“Research on Adverse Drug events And Reports”) program. J Am Acad Dermatol. 2018;79(4):777-8. https://doi.org/10.1016/j.jaad.2018.06.024 [ Links ]
11. Schreiber S, Colombel JF, Feagan BG, Reich K, Deodhar AA, McInnes IB, et al. Incidence rates of inflammatory bowel disease in patients with psoriasis, psoriatic arthritis and ankylosing spondylitis treated with secukinumab: A retrospective analysis of pooled data from 21 clinical trials. Ann Rheum Dis. 2019;78(4):473-9. https://doi.org/10.1136/annrheumdis-2018-214273 [ Links ]
12. Fauny M, Moulin D, D’Amico F, Netter P, Petitpain N, Arnone D, et al. Paradoxical gastrointestinal effects of interleukin-17 blockers. Ann Rheum Dis. 2020;79(9):1132-8. https://doi.org/10.1136/annrheumdis-2020-217927 [ Links ]
Citación:
2Bautista-Parada IR, Puentes-Manosalva FE. Colitis ulcerativa inducida por secukinumab en el tratamiento de espondilitis anquilosante. Revista. colomb. Gastroenterol. 2023;38(1):79-81. https://doi.org/10.22516/25007440.884
Recibido: 14 de Febrero de 2022; Aprobado: 09 de Marzo de 2022











 texto en
texto en 



