Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actualidades Biológicas
versión impresa ISSN 0304-3584
Actu Biol v.29 n.86 Medellín ene./jun. 2007
ARTÍCULOS IV CONGRESO COLOMBIANO DE BOTÁNICA
DIVERSIDAD Y COMPOSICIÓN FLORÍSTICA EN BOSQUES SUCESIONALES ANDINOS DE LA REGIÓN DEL RÍO PORCE, COLOMBIA
DIVERSITY AND FLORISTIC COMPOSITION OF SUCCESSIONAL ANDEAN FORESTS OF THE PORCE REGION, COLOMBIA
Adriana P. Yepes–Quintero1; Sandra L. Jaramillo–Restrepo2; Jorge I. del Valle–Arango3; Sergio A. Orrego–Suáza4
1 Departamento de Ciencias Forestales, Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. apyepes@unal.edu.co.
2 Departamento de Ciencias Forestales, Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. sljarami@unal.edu.co.
3 Departamento de Ciencias Forestales, Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. jidvalle@unal.edu.co.
4 Departamento de Ciencias Forestales, Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. saorrego@unal.edu.co.
Resumen
La sucesión secundaria en las regiones tropicales tiende a variar de una localidad a otra debido, entre muchos factores, al tipo e intensidad de la perturbación, la distancia al bosque original, la fauna existente, la topografía y el clima local, los cuales determinan la composición florística y la velocidad con la que la sucesión avanza. En esta investigación se estudió la dinámica del proceso sucesional en suelos dedicados previamente a la ganadería en el cañón del río Porce (Antioquia), Colombia. Se muestrearon en total 25 parcelas, incluyendo 9 (20 x 50 m) en bosques primarios y 16 (20 x 25 m) en bosques secundarios; para éstos últimos la edad fue estimada en estudios previos usando datación por radiocarbono (C14), fotografías aéreas y una imagen de satélite de alta resolución. Se calculó la diversidad y la composición florística en los bosques secundarios, y los resultados se compararon con los obtenidos en bosques primarios cercanos. Se registraron 220 y 197 especies en los bosques primarios y secundarios, respectivamente. Las dos coberturas presentaron composición florística diferente sugiriendo alta diversidad beta. Análisis multivariados mostraron un gradiente sucesional definido y una alta correlación entre la composición florística y las variables ambientales. No obstante, en el área de estudio se presenta un proceso sucesional degradado como consecuencia del uso previo de la tierra. El índice de valor de importancia indica que en los bosques primarios la especie más importante fue Anacardium excelsum (Anacardiaceae) y en los secundarios Vismia baccifera (Hyperiaceae). Además, este índice y la presencia y ausencia de las especies en cada fase de desarrollo, sugieren la existencia de un gradiente sucesional que se ajusta tanto a la teoría clásica clementsiana de relevo florístico, como a la de composición florística original. El ajuste de ciertas especies a dos de las teorías sucesionales existentes, sugieren que el proceso sucesional es diferente y de complejidad variable según las características ecofisiológicas de las especies involucradas y las del ecosistema que se está regenerando.
Palabras clave: bosques primarios, bosques secundarios, composición florística, diversidad, gradiente sucesional, uso previo de la tierra
Abstract
Some studies indicate that tropical secondary succession is to be affected by factors such as disturbances, distance from original forests, surface configuration, and local climate, determining not only the composition of species but also the time trend of the succession itself. This study seeks to understand the dynamics of successional processes in soils devoted to cattle ranching over various decades in the Porce region of Colombia. A set of 25 permanent plots was measured, including 9 plots (20 x 50 m) in primary forests and 16 (20 x 25m) in secondary forests. The age of secondary forests was estimated in previous studies, using radiocarbondating, aerial photographs and a high–resolution satellite image. Both diversity and composition of species in secondary forests were calculated, and the results were compared against those obtained from natural forests located in the same study area. In total, 220 and 197 species were identified in primary and secondary forests, respectively. The floristic composition for both vegetation types was significantly different, indicating a high Beta diversity. Multivariate analyses suggest the existence of a well–defined successional gradient, and a high correlation between composition of species and some environmental variables as well. However, the study area is characterized by a successional process highly degraded, which seems to be the obvious consequence of the previous land use. The importance value index indicates that Anacardium excelsum (Anacardiaceae) and Vismia baccifera (Hypericaceae) tend to be the dominant species in primary and secondary forests, respectively. The importance value index and the presence or absence of species show that the ecological behavior of various species of the successional gradient may be explained by both the relay and original floristic composition. This finding might be the result of ecophysiological strategies of the species and environmental attributes of the ecosystems, which are experiencing slow but natural recovery.
Key words: diversity, floristic composition, land use, primary forests, secondary forests, successional gradient
INTRODUCCIÓN
La sucesión secundaria en las regiones tropicales tiende a variar de una localidad a otra debido, entre muchos factores, al tipo e intensidad de la perturbación, la distancia al bosque original, la fauna existente, la topografía y el clima local, los cuales determinan la composición florística y la velocidad con la que la sucesión avanza (Aide et al., 1995; Brown y Lugo, 1990; Finegan, 1996, 1997; Guariguata y Ostertag, 2001; Kennard, 2001; Saldarriaga, 1991). Durante décadas los bosques del cañón del río Porce han sido talados y quemados para establecer pasturas ganaderas y, en menor proporción, agricultura. Este tipo de prácticas pudieron ser decisivas para el proceso sucesional, ya que la degradación producida en el suelo pudo afectar la riqueza y diversidad de especies, la composición florística y la productividad de la vegetación secundaria establecida (Aide et al., 1995; Ferreira y Prance, 1999; Finegan, 1996). Los resultados de investigaciones preliminares en el cañón del río Porce sugieren la existencia de una sucesión degradada. Existen claras evidencias de la compactación de los suelos hasta 30 cm de profundidad (Lara, 2003), de la gran dominancia de dos especies pioneras típicas de suelos empobrecidos del género Vismia, así como de una acumulación de 6 t ha–1 año–1 de biomasa aérea total en los bosques secundarios (Orrego y del Valle, 2003), lo cual difiere significativamente de 12 t ha–1 año–1 en los bosques primarios, cuando teóricamente debe ocurrir lo contrario (Brown y Lugo, 1990; Fontaine et al., 1980; Guariguata y Ostertag, 2001; Sutton y Harmon, 1996). En esta investigación se analizó la diversidad y la composición florística del proceso sucesional en suelos dedicados previamente a la ganadería en el cañón del río Porce y se compararon con los resultados obtenidos en bosques primarios cercanos.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en el área de influencia de la Central Hidroeléctrica Porce II, localizada al noreste del departamento de Antioquia a 120 km de la ciudad de Medellín, Colombia (6° 45' 37'' N y 75° 06' 28'' O). De acuerdo con la clasificación de Holdridge (1978), el área de estudio pertenece a la zona de vida bosque muy húmedo premontano (bmh–PM). La elevación fluctúa entre 925 y 1.222 m. Los suelos son Inceptisoles de baja fertilidad natural, buen drenaje y procesos de compactación como consecuencia directa de la actividad ganadera (Jaramillo, 1989). La precipitación promedia anual para el período 1981–2002, registrada en la estación climatológica existente cerca de la presa, es de 1.950 mm aproximadamente (Moreno, 2004). La temperatura promedia anual es de 22,7 ºC, con promedios mínimos de 17,9 °C y máximos de 29,3 °C en la estación los Mangos localizada a 975 m de altitud. Hay un período seco que comienza a finales del mes de noviembre y termina en marzo y un período lluvioso de 7 meses, desde abril hasta octubre. En los meses de julio y agosto se presenta una pequeña estación seca (EPM, 1987).
Colección de datos. Se seleccionaron 25 parcelas al azar, 9 en bosques primarios y 16 en bosques secundarios, de las establecidas por el Grupo de Investigación en Bosques y Cambio Climático de la Universidad Nacional de Colombia, Sede Medellín, durante los años 1999 y 2000 (Orrego y del Valle, 2003).
En los bosques primarios el tamaño de las parcelas fue de 1.000 m2 (50 x 20 m); y en ellas se midió el diámetro normal (D) a 1,3 m sobre el suelo o arriba de las bambas, si las hubiera, de todas las plantas leñosas (árboles, arbustos, palmas y bejucos), con D 3 10 cm; por lo regular el instrumento para esta medición fue el calibrador forestal (forcípula) con exactitud de 0,5 mm. Además, en el tercer vértice de cada parcela se levantó una subparcela de 0,01 ha (10 x 10 m), en la cual se midieron con calibrador digital, con exactitud de 0,01mm, todas las plantas leñosas con 1cm £ D < 10 cm. Finalmente, se tomaron las pendientes topográficas de las parcelas con un clinómetro Sunnto. En los bosques secundarios se aplicó un protocolo similar, excepto que las parcelas fueron de 500 m2 (25 x 20 m) y las subparcelas de 0,0025 ha (5 x 5 m). En todas las parcelas se midieron las plantas leñosas con D 3 5 cm, y aquellas con 1 cm £ D < 5 cm se midieron en las subparcelas.
Identificación botánica de las especies. Se identificaron botánicamente los individuos con D 3 1 cm. Las muestras botánicas se llevaron al Herbario de la Universidad de Antioquia (HUA), así como a los dos herbarios de la Universidad Nacional de Colombia, Sede Medellín: Laboratorio de Ecología y Conservación Ambiental (LECA) y el Herbario Gabriel Gutiérrez V (MEDEL).
Determinación de la edad de las parcelas de bosques secundarios. La edad de 12 parcelas se obtuvo con datación por C14 por ciento moderno, método radiométrico basado en la vida media del isótopo C14 y comúnmente empleado para determinar la edad de materiales orgánicos portadores de carbono, cuya antigüedad esté comprendida entre el presente y 40.000–50.000 años atrás (Sierra et al., 2007). En las 4 parcelas restantes, la edad se determinó mediante secuencias temporales de fotografías aéreas y una imagen Ikonos clasificada mediante correcciones y realces, que permitió identificar claramente los estadios sucesionales estudiados (Agudelo y Restrepo, 2004).
Análisis de datos. Se construyeron curvas especies–área para comparar la riqueza y la diversidad florística de las comunidades presentes en bosques secundarios con las de bosques primarios, empleando el software EstimateS, versión 5.01. Se calcularon índices de diversidad: exponencial de Shannon (eH'); de dominancia: recíproco de Simpson (1/D) y la equidad de Shannon (E) para cada cobertura. La comparación estadística de estos índices entre tipos de cobertura se realizó mediante una prueba de t, para lo cual se unificó el área de las dos coberturas a 8.000 m2.
La similitud florística entre coberturas se determinó por medio del índice de Jaccard y análisis multivariados: Detrended Correspondence Analysis (DCA) y Análisis de Correspondencia Canónico (CCA), empleando el software PC–ORD, versión 4.0. Para determinar la importancia de cada especie dentro de cada tipo de cobertura, se calculó el índice de valor de importancia (IVI) como la suma de la abundancia, dominancia y frecuencia relativa de cada especie (Lamprecht, 1990), utilizando la biomasa (BM) como criterio de dominancia (Matteucci y Colma, 1982). El índice de valor de importancia para las familias (IVF) se obtuvo a partir de la sumatoria del IVI de las especies pertenecientes a cada familia. Para analizar la composición florística de cada parcela se determinó la importancia relativa de las especies con el cálculo del valor de importancia (VI) (Matteucci y Colma, 1982).
RESULTADOS
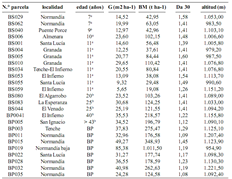
En la tabla 1 se presentan el código de identificación, la edad, el área basal, la biomasa, la densidad aparente del suelo a 30 cm de profundidad, así como la altitud de las parcelas seleccionadas; los datos estructurales como el área basal y la biomasa, corresponden a la remedición realizada por el 'Grupo de Investigación en Bosques y Cambio Climático' durante los meses de junio y julio de 2003. Las parcelas de bosques secundarios conformaron una cronosecuencia que va desde 7 a más de 43 años de edad.
Tabla 1. Localización, edad, área basal (G), biomasa (BM), densidad aparente del suelo a 30 cm de profundidad (Da 30) y altitud de las parcelas seleccionadas en el área de influencia de la Central Hidroeléctrica Porce II, cuenca media del río Porce (Antioquia), Colombia. [a edad estimada mediante carbono catorce (C14);b edad estimada por fotografías aéreas e imagen de satélite Ikonos; BS = bosque secundario; BP = bosque primario]
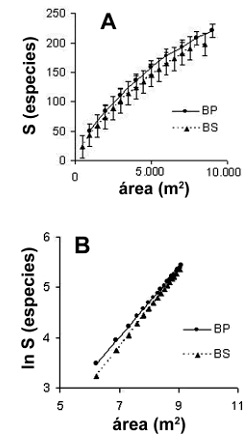
Riqueza de especies. Se muestrearon en total 2.891 individuos, de los cuales 96,2% se identificaron hasta especie, 2,5% hasta género, 0,7% hasta familia y 0,6% quedaron sin identificar. Se registraron 220 y 197 especies en los bosques primarios y secundarios, respectivamente. Al comparar las curvas especie–área de las dos coberturas, se observaron diferencias significativas entre las pendientes de las rectas obtenidas al linealizarlas (–0,71 vs.–1,44), y al comparar estadísticamente las desviaciones estándar de los valores de riqueza de especies (t = 2,9; P = 0,004) (figura 1 A, B).
Figura 1. A. Curvas especies–área. B. Linealización de la curvas para el total de las parcelas en bosques primarios (BP) y bosques secundarios (BS) del área de influencia de la Central Hidroeléctrica Porce II, cuenca media del río Porce (Antioquia), Colombia [(las curvas fueron generadas a partir de 100 aleatorizaciones realizadas por el software EstimateS 5.01; las ecuaciones linealizadas fueron: ln (S) = –0,71 + 0,67 ln (área) y ln (S) = –1,44 + ln (área) para los bosques primarios y secundarios, respectivamente)]
Diversidad alfa de especies. Los índices de diversidad calculados mediante el método Jack–knife para bosques primarios fueron: 137,4 el exponencial de Shannon (eH'), 80,0 el recíproco de Simpson (1/D) y 0,8 la equidad de Shannon (E). Para bosques secundarios los valores fueron de 44,7, 36,3 y 0,04, respectivamente. La prueba de rangos múltiples de Fisher, que compara las medias de cada índice, permite concluir que no existen diferencias significativas entre el exponencial y la equidad de Shannon de las dos coberturas (F = 3,07 y P = 0,0946; F = 1,65 y P = 0,21). El recíproco de Simpson para bosques primarios es casi dos veces el valor obtenido para bosques secundarios (80,0 vs. 36,3), conllevando a diferencias estadísticas significativas entre ambos valores (F = 10,81; P = 0,002).
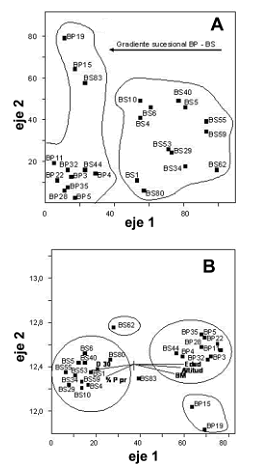
Diversidad beta. El coeficiente de Jaccard entre coberturas refleja una disimilitud de 0,28, evidenciando alta diversidad beta. El primer eje del DCA separó las parcelas en dos grupos, en el lado izquierdo bosques de 25 años de edad junto con bosques primarios y, en el lado derecho, bosques secundarios con edades entre 7–20 años; este análisis asume que parcelas más cercanas entre sí en el diagrama de ordenación tienen una mayor similaridad florística, por tanto, los resultados sugieren la existencia de un gradiente sucesional con recambio de especies influenciado posiblemente por la edad del abandono (figura 2A). La varianza explicada por los 3 primeros ejes del CCA es del 21%. La variable edad está correlacionada negativamente y positivamente con la densidad aparente del suelo a 30 cm de profundidad (Pearson = –0,78) y con la altitud (Pearson = 0,57), respectivamente (figura 2B). Finalmente, el CCA tiende a agrupar estadios tempranos caracterizados por pendientes menores y mayor densidad aparente, ocurriendo lo contrario con los estadios avanzados (figura 2B).
Figura 2. A. Diagrama de ordenación Detrented Correspondence Analysis (DCA) empleando los datos florísticos. B. Análisis de Correspondencia Canónica (CCA, en inglés) empleando variables estructurales como: densidad aparente a los 30 cm de profundidad (D 30), pendiente topográfica promedio (% Ppr), biomasa total por hectárea (BM), altitud (Alt) y edad. Para ambos análisis se emplearon las parcelas en bosques primarios (BP) y secundarios (BS) del área de influencia de la Central Hidroeléctrica Porce II, cuenca media del río Porce (Antioquia), Colombia.
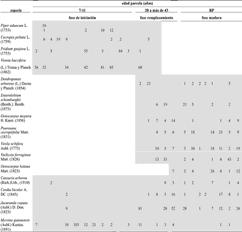
Importancia ecológica de las especies. La importancia ecológica de las especies (IVI) varía entre las dos coberturas. En bosques primarios la especie más importante es Anacardium excelsum (Kunth) Skeels. (Anacardiaceae) con IVI de 32,1% (como consecuencia de su alta biomasa), seguida de Jacaranda copaia (Aubl.) D. Don. (Bignoniaceae) con IVI de 12,2%. La palma Oenocarpus bataua Mart., aparece entre las diez especies más importantes. En bosques secundarios (7–40 años) la especie más importante es Vismia baccifera (L.) Triana y Planch. con IVI de 26,3%, seguida por Piper aduncum L. (Piperaceae), Myrsine guianensis (Aubl.) Kuntze. (Myrsinaceae) y J. copaia con un IVI de 13,3, 12,1 y 10,5%, respectivamente. Es interesante anotar que la especie J. copaia es una de las más importantes en ambos tipos de coberturas. Las familias más importantes en bosques primarios son Anacardiaceae (34,3%) y Mimosaceae (23,5%), mientras que en secundarios son Clusiaceae (43,9%) y Melastomataceae (25,4%). Familias como Cyatheaceae, Menispermaceae, Monimiaceae, Lythraceae, Passifloraceae, Rhamnaceae, Rhyzophoraceae, Rutaceae, Urticaceae y Verbenaceae son exclusivas de bosques secundarios. En estados avanzados de la sucesión y bosques primarios es notable la presencia de especies de la familia Arecaceae. El valor de importancia (VI) calculado para las especies de cada parcela, mostró diferencias entre las especies más importantes en cada una de ellas, siendo notorias las disimilitudes entre parcelas de igual edad y cobertura. La presencia y ausencia de las especies y el valor de importancia de las mismas en cada fase de desarrollo, evidenció un gradiente sucesional que se ajusta tanto a la teoría clásica clementsiana de relevo florístico, como a la de composición florística original (tabla 2); es decir, algunas especies son remplazadas por otras con el avance de la sucesión, mientras otras se encuentran es en todas las fases, conservando valores de importancia similares.
Tabla 2. Presencia de especies en el gradiente sucesional identificado en los bosques del área de influencia de la Central Hidroeléctrica Porce II, cuenca media del río Porce (Antioquia), Colombia, de acuerdo con los valores de importancia (VI) (BP = bosque primario)
DISCUSIÓN
Las curvas especies–área muestran que los valores de riqueza de la presente investigación superan valores reportados por otros estudios con área de muestreo mayor. Aunque las curvas de las dos coberturas fueron diferentes estadísticamente, los datos muestrales indican que a los 25 años se ha recuperado 40% del número de especies promedio presentes en los bosques primarios, mientras a los 40 años la cobertura sucesional ha alcanzado la riqueza promedia de los bosques primarios.
Los índices de diversidad específica sugieren que ambas coberturas presentan diversidad similar, aunque difieren en la dominancia de las especies presentes. La diversidad de cada una de las parcelas estudiadas está influenciada por el uso previo de la tierra, el tipo de perturbación y características específicas como la pendiente y la altitud. La densidad aparente da cuenta de la variabilidad en la intensidad del uso previo de la tierra y del tiempo de abandono. En este estudio, valores bajos de densidad aparente son propios de los bosques primarios y sitios con más de 40 años (tabla 1), donde comienza a evidenciarse la recuperación de esta variable y de la biomasa (Lara, 2003). Las observaciones de campo y los resultados del presente estudio sugieren también que aquellas parcelas dedicadas previamente a la agricultura presentan una mayor diversidad, en comparación con las dedicadas a pasturas ganaderas. Finalmente, los resultados indican que los índices de diversidad aumentan a medida que avanza el proceso sucesional, lo cual es consistente con lo reportado en otros estudios (Saldarriaga, 1991; Toro y Saldarriaga, 1990).
El índice de Jaccard entre parcelas muestra mayor disimilitud entre los bosques secundarios debido al proceso de remplazamiento florístico, en el que el grado y frecuencia de la intervención antrópica, condicionan el establecimiento y el posterior desarrollo de las diferentes especies vegetales. Las diferencias en similitud de especies en las parcelas de bosques secundarios reflejan alta diversidad beta ya que la composición florística de los estadios sucesionales depende de varios factores como la amplitud de destrucción de la vegetación, la flora de los alrededores, los agentes dispersores y los usos previos de la tierra (Fontaine et al., 1980). Los análisis canónicos sugirieron que los bosques localizados a mayor altitud coinciden con bosques de edad avanzada o bosques primarios que presentan alta pendiente, difícil acceso y, por ende, menor grado de perturbación. Los bosques ubicados en terrenos planos, a menor altitud y más jóvenes, coincidieron con los estadios sucesionales tempranos e intermedios en los que la cercanía a asentamientos humanos y el fácil acceso, han favorecido los procesos de intervención antrópica.
Las coberturas sólo comparten una especie dentro de las diez más importantes: J. copaia. En este estudio se identificaron pioneras típicas como Trema micranta (L.) Blume. (Ulmaceae), Ochroma pyramidale (Cav. ex Lam.) Urb. (Sterculiaceae), y Schefflera morototoni (Aubl.) Maguire y Frodin. (Araliaceae), características de sitios tropicales con baja intensidad de perturbación y suelos fértiles (Álvarez, 2004). Sin embargo, las más importantes son especies pioneras indicadoras de suelos empobrecidos como Piper aduncum L. (Piperaceae), Bellucia pentamera Naudin. (Vochysiaceae), Vochysia ferruginea Mart. y las del género Vismia (V. baccifera y V. ferruginea Kunth.).
La sucesión en el área de estudio confirma la simultaneidad entre la teoría clásica clementsiana de relevo florístico y la teoría de composición florística original, ajustándose al modelo propuesto por Oliver y Larson (1990). Los bosques entre 7 y 11 años se encuentran en un estado de iniciación en el que se hace evidente la presencia de especies como V. baccifera, V. ferruginea, Acalypha diversifolia Jacq., Cecropia peltata L., Piper aduncum, P. guajava L. y la mayoría de las especies de la familia Melastomataceae, a partir del primer año de la sucesión (Toro, 2004), y las cuales permanecen hasta 25 años aproximadamente. Entre las especies que se comportan de acuerdo con la teoría de composición florística original, pueden mencionarse M. guianensis, J. copaia, Palicourea guianensis Aubl., Cespedezia spathulata (Ruiz y Pavon) Planch., Miconia albicans (Sw) Triana., Piper arboreum Aubl. y Roupala montana Aubl. En el trópico, ejemplos de este tipo de sucesión son escasos o han sido poco reportados; no obstante, puede citarse el trabajo realizado en Bolivia por Kennard (2001) para un bosque seco tropical de la región de Chiquitanía.
Los bosques entre 20 y 25 años muestran remplazamiento que limita las especies invasoras porque los sitios son reocupados por otras especies de larga vida como V. ferruginea, Enterolobium schomburgkii (Benth.) Benth., S. morototoni y otras que dominan el bosque. En el bosque de 40 años se observa este remplazamiento, pero en esta etapa, o quizás antes, especies esciófitas como Virola sebifera Aubl., y Abarema jupunba (Willd.) Britton y Killip., se establecen en el sotobosque hasta alcanzar una posición dominante y conspicua en los bosques primarios, a una edad relativamente temprana. Finalmente, los bosques primarios estudiados corresponden al estado maduro del proceso sucesional, en el que la presencia de multicohortes debido a la dinámica natural de claros, permite la recuperación del ecosistema y la coexistencia de individuos de diferentes tamaños y especies como Brosimum guianense (Aubl.) Huber., Dendropanax arboreus (L.) Decne y Planch., Garcinia cf. madruno (Kunth) Hammel., Oenocarpus mapora H. Karst. Pourouma cecropiifolia Mart., Euterpe precatoria Mart. y Trattinnickia cf. aspera (Standl.) Swart.
CONCLUSIONES
En el área de estudio se presenta un proceso sucesional degradado como consecuencia del uso previo de la tierra que se refleja en la diversidad y composición florística de los estadios sucesionales; la continuidad de prácticas ganaderas y otro tipo de intervenciones antrópicas destruyeron posiblemente el banco de semillas y crearon condiciones desfavorables en el suelo limitando el reclutamiento y el establecimiento de muchas especies.
La creencia general de que el relevo florístico es el único camino en el avance de la sucesión es válida para ciertas especies pero no es una regla, ya que existen especies que pueden estar presentes en to
das las fases de la sucesión. Por ello, la composición florística de las parcelas estudiadas y el ajuste de ciertas especies a dos de las teorías sucesionales existentes, sugieren que el proceso sucesional es diferente y de complejidad variable según las características ecofisiológicas de las especies involucradas y las del ecosistema que se está regenerando; especies con requerimientos lumínicos y nutricionales amplios pueden comportarse de acuerdo a la teoría de composición florística original, y aquellas que requieren condiciones ambientales particulares, pueden remplazar o ser remplazadas por otras a medida que avanza la sucesión.
AGRADECIMIENTOS
Los autores desean expresar sus agradecimientos a la Dirección de Investigaciones de la Universidad Nacional de Colombia, Sede Medellín (DIME), por la financiación parcial de la investigación a través del proyecto de investigación 'Sucesión vegetal, diversidad biológica y acumulación de carbono en el cañón del río Porce, Antioquia'; a la Universidad Nacional de Colombia, Sede Medellín, y las Empresas Públicas de Medellín (EPM) por el apoyo logístico; a los profesores Álvaro Lema Tapias, María Claudia Díez y Oswaldo Velásquez por su colaboración y asistencia técnica; a Rodrigo Caballero, Duván Correa, Eduardo Gutiérrez y Javier Gutiérrez, por su valiosa colaboración en las actividades de campo; a Álvaro Idárraga, Javier Roldán, Ricardo Callejas, León Morales, Darío Sánchez y Jorge Pérez, por su incondicional ayuda en la identificación botánica de las especies; a Juan Carlos Manjarrés por su apoyo en la base de datos; a Esteban Álvarez por su asistencia en la realización de los análisis multivariados.
REFERENCIAS
1. Agudelo EA, Restrepo JC. 2004. Análisis multitemporal de las coberturas en áreas del proyecto hidroeléctrico Porce II. Trabajo de grado Ingeniería Forestal. Departamento de Ciencias Forestales, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. Medellín. [ Links ]
2. Aide TM, Zimmerman JK, Herrera L, Rosario M. 1995. Forest recovery in abandoned tropical pastures in Puerto Rico. Forest Ecology and Management, 77:77–86. [ Links ]
3. Álvarez E. 2004. Composición florística, diversidad, estructura y biomasa de un bosque inundable en la Amazonía Colombiana. Caldasia, (en revisión). [ Links ]
4. Brown S, Lugo AE. 1990. Tropical secondary forest. Journal of Tropical Ecology, 6(1):1–32. [ Links ]
5. EPM (Empresas Públicas de Medellín). 1987. Desarrollo hidroeléctrico Porce II. Revista Empresas Públicas de Medellín, 9(3):1–106. [ Links ]
6. Ferreira LV, Prance GT. 1999. Ecosystem recovery in terra firme forest after cutting and burning: a comparison on species richness, floristic composition and forest structure in the Jaú National Park, Amazonia. Botanical Journal of the Linnean Society, 130:97–110. [ Links ]
7. Finegan B. 1996. Pattern and process in neotropical secondary rain forest: the first 100 years of succession. Trend in Ecology and Evolution, 11:119–124. [ Links ]
8. Finegan B. 1997. Bases ecológicas para el manejo de bosques secundarios de las zonas húmedas del trópico americano, recuperación de la biodiversidad y producción sostenible de madera. Pp. 106–127. En: Secretaría de Tempore Venezuela, Consejo Centroamericano de Bosques y Áreas Protegidas, Deutzche Gesellshaft für Technische Zusammenarbeit (GTZ) GMBH, Ministerio de Cooperación Técnica del Reino de los Países Bajos y IKC Natuur Beheer National Reference Center for Nature Management (eds.). Taller internacional sobre el estado actual y potencial de manejo y desarrollo del bosque secundario tropical en América Latina. Pucallpa, Perú. [ Links ]
9. Fontaine RG, Gómez–Pompa A, Ludlow B. 1980. Sucesiones secundarias. Pp. 245–263. En: UNESCO, UNEP, FAO (eds.). Ecosistemas de los bosques tropicales: Informe sobre el estado de conocimientos. Serie de Investigaciones sobre los Recursos Naturales XVI. Madrid. [ Links ]
10. Guariguata MR, Ostertag GR. 2001. Neotropical secondary forest successions: changes in structural and functional characteristics. Forest Ecology and Management, 148:185–206. [ Links ]
11. Holdridge L. 1978. Ecología basada en zonas de vida. San José, Costa Rica. [ Links ]
12. Jaramillo D. 1989. Estudio general de suelos, erosión y uso potencial agropecuario para los proyectos hidroeléctricos Porce II y Porce III. Empresas Públicas de Medellín. Unidad de Planeación, estudios de impacto ambiental. Medellín, Colombia. [ Links ]
13. Kennard KK. 2001. Secondary forest succession in a tropical dry forest: patterns of development across a 50–year chronosequence in lowland Bolivia. Journal of Tropical Ecology, 18(1):53–66. [ Links ]
14. Lamprecht H. 1990. Silvicultura en los trópicos: Los ecosistemas forestales en los bosques tropicales y sus especies arbóreas–posibilidades y métodos para un aprovechamiento sostenido. (GTZ) GMBH. Eschborn, Alemania. [ Links ]
15. Lara W. 2003. Estudio edafológico del carbono en distintas coberturas vegetales de la región de Porce, Colombia. Trabajo de grado Ingeniería Forestal. Departamento de Ciencias Forestales, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. Medellín. [ Links ]
16. Matteucci SD, Colma A. 1982. Metodología para el estudio de la vegetación. Secretaría General de la Organización de los Estados Americanos. Washington, Estados Unidos. [ Links ]
17. Moreno F. 2004. Soil carbon dynamics in primary and secondary tropical forest in Colombia. Trabajo de grado Doctor of Phylosophy in Biology. Florida International University. Miami, Florida. [ Links ]
18. Oliver C, Larson BC. 1990. Forest stand dynamics. McGraw Hill. USA. [ Links ]
19. Orrego SA, del Valle JI. 2003. Existencias y tasas de incremento neto de la biomasa y del carbono en bosques primarios intervenidos y secundarios. Pp. 215–242. En: Orrego SA, del Valle JI, Moreno FH (eds.). Medición de captura de carbono en ecosistemas forestales tropicales de Colombia: contribuciones para la mitigación del cambio climático. Medellín, Colombia. [ Links ]
20. Orrego SA., del Valle JI., Moreno FH. 2003. Medición de captura de carbono en ecosistemas forestales tropicales de Colombia: contribuciones para la mitigación del cambio climático. Panamericana Formas e Impresos S.A. Medellín, Colombia. [ Links ]
21. Saldarriaga JG. 1991. Estudios en la Amazonía colombiana V: Recuperación de la Selva de 'Tierra Firme' en el alto río Negro Amazonía colombiana–venezolana. TROPENBOS Colombia. Bogotá, Colombia. [ Links ]
22. Sierra CA, del Valle JI, Orrego SA, Moreno FH, Harmon MA, Zapata M, Colorado GJ, Herrera MA, Lara W, Retrepo DE, Berrouet LM, Loaiza LM, Benjumea JF. 2007. Total carbon stocks in a tropical forest landscape of the Porce region, Colombia. Forest Ecology and Management, 243:299–309. [ Links ]
23. Sutton DB, Harmon NP. 1996. Fundamentos de ecología. Limusa. México D. F, México. [ Links ]
24. Toro AP, Saldarriaga JG. 1990. Algunas características de la sucesión secundaria en campos abandonados en Araracuara, Amazonas, Colombia. Colombia Amazónica, 4(2):31–43. [ Links ]
25. Toro JC. 2004. Sucesión temprana tropical en pasturas abandonadas y rastrojos bajos: biodiversidad y productividad. Trabajo de grado Ingeniería Forestal. Departamento de Ciencias Forestales, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. Medellín. [ Links ]
Recibido: agosto 2007; aceptado: noviembre 2007.