Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.37 no.4 Bogotá oct./dic. 2022 Epub 06-Jul-2023
https://doi.org/10.22516/25007440.899
Trabajos originales
Estrés, depresión, ansiedad y el hábito alimentario en personas con síndrome de intestino irritable
1Nutritionist Dietitian, Universidad Nacional de Colombia. Clinical Nutritionist, Universidad Militar Central. Bogotá, Colombia.
2Nutritionist Dietitian, candidate for a Master’s in Physiology with an emphasis in research, Universidad Nacional de Colombia. Bogotá, Colombia.
3Nutritionist Dietitian, Master in Biology, PhD Biological Sciences, Universidad Nacional de Colombia. Bogotá, Colombia.
El síndrome de intestino irritable (SII) es un trastorno caracterizado por cambios en el hábito intestinal y afecta al 30% de la población mundial. Aunque se ha encontrado una conexión entre el eje cerebro-microbiota intestinal, el desarrollo del SII y su asociación con la prevalencia de trastornos mentales, las posibles implicaciones que tienen en el hábito alimentario de las personas no son claras. Este artículo tuvo como objetivo explorar la relación entre el estrés, depresión, ansiedad, trastornos mentales y hábitos alimentarios en pacientes con SII. Se realizó una exploración bibliográfica en los motores de búsqueda PubMed, ScienceDirect y BVS. Se encontró que las personas con SII pueden presentar anormalidades en la microestructura cerebral y alteraciones en la red cerebro-intestino asociadas a una mayor duración de los síntomas gastrointestinales y el aumento de la comorbilidad afectiva. También se sugiere una relación en distintas vías entre el estrés, depresión y ansiedad, síntomas de SIII y cambios en los hábitos de alimentación. Todo lo anterior puede motivar prácticas de alimentación restrictivas, cambios en el apetito, subadecuación de nutrientes incluso en algunos casos por el mismo manejo nutricional y, en general, deterioro de la calidad de vida de las personas con SII. Se sugiere un manejo integral que no solo implique un manejo farmacológico para los síntomas de SII y los estados de ansiedad y depresión, sino que también incluya un manejo psicológico, manejo nutricional personalizado y recomendaciones de mejora de los estilos de vida como la práctica de actividad física y manejo del estrés.
Palabras clave: Síndrome de intestino irritable; eje cerebro-intestino; microbiota; estrés; depresión; ansiedad; hábito alimentario
Irritable bowel syndrome (IBS) is a disorder characterized by changes in bowel habits and affects 30% of the world’s population. Although a connection has been found between the brain-gut microbiota axis, the development of IBS, and its association with the prevalence of mental disorders, the possible implications for people’s eating habits are unclear. This article aimed to explore the relationship between stress, depression, anxiety, mental disorders, and eating habits in patients with IBS. A literature search was conducted in the PubMed, ScienceDirect, and VHL search engines. We found that people with IBS may have abnormalities in the brain microstructure and alterations in the brain-gut network associated with a longer duration of gastrointestinal symptoms and increased affective comorbidity. A relationship between stress, depression and anxiety, IBS symptoms, and changes in eating habits in different pathways is also suggested. All these may lead to restrictive eating practices, changes in appetite, nutrient inadequacy, even due to the same nutritional management in some cases, and, generally, deterioration in the quality of life of people with IBS. We recommend comprehensive management that involves not only pharmacological treatment for IBS symptoms and states of anxiety and depression but also psychological therapy, personalized nutrition, and improving lifestyles, such as physical activity and stress management.
Keywords: Irritable bowel syndrome; brain-gut axis; microbiota; stress; depression; anxiety; eating habits
Introducción
El síndrome de intestino irritable (SII) se define como un trastorno funcional gastrointestinal que afecta aproximadamente al 30% de la población mundial, y es más común en mujeres y en países en vías de desarrollo. Se caracteriza por síntomas de dolor abdominal crónico y cambio en el hábito intestinal1,2. Según los criterios establecidos por la Fundación Roma (Roma IV), se clasifica en subtipos: SII con diarrea (SII-D), SII con estreñimiento (SII-C), SII con síntomas mixtos (diarrea y estreñimiento) (SII-M) y SII en pacientes que cumplen los criterios de diagnóstico, pero no encajan en ninguna de las categorías anteriores (SII-U)2.
Es una condición funcional que se caracteriza por presentar disfunción del eje cerebro-intestino. La alteración en el funcionamiento y el equilibrio del eje cerebro-intestino (ECI) y la microbiota pueden desencadenar una serie de reacciones adversas que causan los síntomas gastrointestinales comunes del SII3. Un motivo que puede llevar a este tipo de alteración es el estrés crónico al que se ve sometido el paciente en su entorno. Es común identificar que los pacientes que tienen signos de depresión y ansiedad cursan con síntomas como el dolor abdominal, náuseas y disminución del apetito, lo cual altera sus patrones alimentarios4. Los datos epidemiológicos han mostrado que un 40% a 90% de los pacientes que padecen SII también tienen los criterios para el diagnóstico de un trastorno mental, especialmente depresión y ansiedad1.
Aun cuando se ha reconocido la importancia del factor psicológico en el SII, la información disponible acerca de cómo estos estados mentales alterados afectan la relación con la comida del paciente con SII y que permitan entender y desarrollar estrategias para un óptimo tratamiento es escasa.
Por lo anterior, el presente artículo tuvo como objetivo explorar la relación entre el estrés, los trastornos mentales y el hábito alimentario en personas que padecen SII. Se espera que este artículo pueda ser de utilidad para comprender las relaciones existentes y contribuir con propuestas para definir estrategias para el manejo clínico con enfoque integral del síndrome, especialmente en el ámbito nutricional.
Metodología
Teniendo en cuenta que la investigación sobre la relación de los trastornos mentales, el estrés y la alimentación en el SII es reciente y poco precisa, se decidió realizar una revisión exploratoria (scoping review), la cual permite determinar la literatura existente sobre el tema de interés, particularmente cuando este no se ha revisado de forma extensa o es de naturaleza compleja o heterogénea5.
Se empleó la metodología de 5 pasos sugerido por Arksey y O’Malley6 y la extensión de PRISMA para scoping review de 20 ítems esenciales y 2 opcionales para incluir en este tipo de trabajos que fue publicada en el 20187.
La búsqueda de información se realizó por medio de las bases de datos de PubMed, ScienceDirect, Portal Regional de la Biblioteca Virtual en Salud (BVS) y Google Scholar. Se emplearon los términos DeCS “síndrome de intestino irritable”, “depresión”, “ansiedad”, “estrés psicológico” y “hábitos alimentarios”. En cuanto a los términos MeSH, solo se empleó el término “irritable bowel syndrome” debido a la especificidad de la búsqueda.
Para esta revisión, se construyeron las siguientes ecuaciones de búsqueda: ((brain-gut axis) AND (microbiota) AND (irritable bowel syndrome [MeSH])), ((irritable bowel syndrome [MeSH]) AND (microbiota) AND (serotonin)), ((stress) AND (gastrointestinal symptoms)), ((anxiety) AND (gastrointestinal symptoms)), ((depression) AND (gastrointestinal symptoms)) e ((irritable bowel syndrome [MeSH]) AND (feeding behavior)).
Como criterios de inclusión se consideraron los tipos de estudios (ensayos clínicos, revisiones sistemáticas, revisiones de literatura y metaanálisis), estudios realizados en humanos y el idioma (español o inglés). La ventana temporal no se tuvo en cuenta como criterio de inclusión dado que, al ser un tema de investigación reciente y heterogéneo, las publicaciones relacionadas son pocas. Como criterios de selección de los artículos se tuvo en cuenta el título del estudio, las palabras clave y el resumen. No se incluyeron publicaciones o estudios en la población pediátrica, que trataran sobre trastornos alimentarios u otras enfermedades inflamatorias del sistema digestivo como colitis ulcerosa, enfermedad de Crohn o enfermedad celíaca (Figura 1).
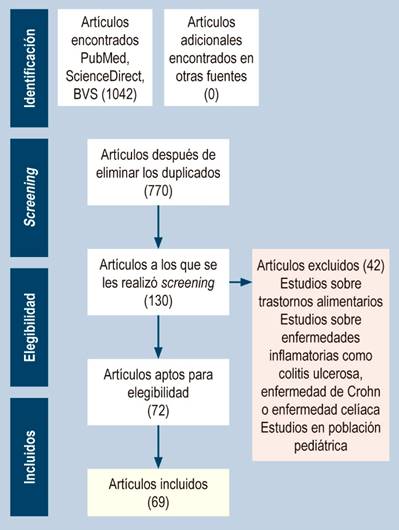
Figura 1 Diagrama de flujo del proceso de identificación y selección de estudios según el método PRISMA para artículos de revisión exploratoria. Fuente: elaboración propia.
Después de realizar la selección de los artículos, se realizó una matriz de extracción de la información en Excel y se usó el gestor bibliográfico de Mendeley. Para la extracción de información se emplearon los campos de título, año, país, autor(es), objetivo, materiales y métodos, y resultados clave.
Finalmente, con el fin de resumir los hallazgos de los estudios, se clasificaron en las siguientes líneas de investigación: “trastornos mentales, estrés y síntomas gastrointestinales en pacientes con SII”, que incluye la relación entre los trastornos mentales (ansiedad, depresión, estrés); los posibles síntomas gastrointestinales implicados en el SII: “hábitos alimentarios en personas que padecen SII”, donde se describe cómo los síntomas generados por el SII pueden modificar los hábitos alimentarios de las personas que lo padecen, y “eje cerebro-intestino-microbiota y SII”, que incluye las relaciones entre el sistema nervioso central, la microbiota intestinal, el SII, los neurotransmisores y metabolitos implicados. Lo anterior describe los posibles mecanismos que explican las asociaciones entre el SII, trastornos mentales y hábitos alimentarios.
Resultados
De los 130 artículos seleccionados para el screening, se incluyeron 70 artículos publicados entre los 2007 y 2021, de los cuales la mayoría corresponde al 2021. Se observó que gran parte de los artículos publicados fueron de países europeos y del este de Asia4,8-14, lo que resulta contradictorio teniendo en cuenta que son países que tienen las prevalencias más bajas de SII2. Por una parte, la mayoría de textos empleados correspondía a revisiones de literatura en los cuales se buscaba establecer la relación entre el eje cerebro-intestino-microbiota y el desarrollo de SII. Por otra parte, los estudios clínicos (ensayos clínicos aleatorizados y estudios prospectivos) tenían como objetivo demostrar la variación en la población microbiana de las personas con SII, así como sus niveles de concentración de ácidos grasos de cadena corta (AGCC) y serotonina. Adicionalmente, se indagó en las guías de práctica clínica (GPC) sobre el manejo del SII y se encontraron 4 guías.
Trastornos mentales, estrés y síntomas gastrointestinales en pacientes con SII
El estrés fue definido por primera vez por Hans Selye en 193615 como la respuesta fisiológica ante las amenazas, ya sean de carácter psicológico o real. Cuando aparece un factor estresante agudo se activa una respuesta de “lucha o huida” que prepara al cuerpo para defenderse y asegurar su supervivencia. Sin embargo, cuando el factor estresante es crónico, se vuelve dañino, debido a que no permite el alcance de la homeostasis basal.
Se ha observado que los pacientes con SII suelen tener una respuesta aumentada al estrés, lo que ha implicado un posible mecanismo que contribuye a la patología del síndrome14,16. La razón es que el estrés podría inducir cambios en la motilidad, permeabilidad y secreción intestinal, así como sensibilidad visceral que causa la reactivación de inflamaciones entéricas previas, y estímulos inflamatorios posteriores16,17; además, puede alterar la composición y la función de la microbiota18.
De igual manera, se ha encontrado que los traumas que ocurren durante la vida de la persona generan estrés crónico que puede conllevar al desarrollo de SII15. Especialmente, los traumas vividos durante la edad temprana (abuso sexual, físico o psicológico, enfermedad grave o muerte de algún padre, entre otros) se han asociado con mayores riesgos de sufrir malestar gastrointestinal y mayores probabilidades de sufrir enfermedades inflamatorias del sistema digestivo como el SII. Estos eventos pueden producir cambios epigenéticos a largo plazo en el eje hipotálamo-hipófisis-adrenal (HHA), resultando en la alteración de la retroalimentación negativa de los glucocorticoides y el aumento de susceptibilidad de sufrir trastornos relacionados con el estrés en la adultez19.
Asimismo, se ha observado que además de una cantidad frecuente de personas con SII y estrés, las personas que padecen SII muestran una alta prevalencia en el padecimiento de trastornos mentales como la ansiedad y la depresión, y como resultado de una exposición continúa a estímulos estresantes. Entre un 20% y un 90% de los pacientes con SII padece algún síntoma psiquiátrico grave que puede llegar a ser diagnosticado como un trastorno17,20. En un estudio prospectivo realizado por Koloski y colaboradores21, con 12 años de seguimiento a una población de más de 1000 individuos, se encontró que aquellos que presentaban niveles altos de ansiedad y depresión tenían mayores probabilidades de desarrollar SII.
La ansiedad relacionada con los síntomas gastrointestinales se conoce como ansiedad gastrointestinal específica (AGE) e influye en la gravedad de los síntomas y la calidad de vida de las personas con enfermedades gastrointestinales22. Van Oudenhove y colaboradores23 encontraron una asociación entre la morbilidad psicosocial (ansiedad, depresión y somatización) y el aumento de los síntomas gastrointestinales. Específicamente, detallaron que el aumento de los niveles de ansiedad y de depresión se relacionaban con la aparición de síntomas como la distensión, dolor abdominal y las náuseas en el período posprandial24. Estudios han mostrado que, a mayores niveles de ansiedad y depresión, mayor reducción del umbral del dolor, causado por un reajuste en el sistema nervioso autónomo (SNA) y las rutas neuroendocrinas que aumentan la percepción del dolor25.
Hábitos alimentarios en personas que padecen síndrome de intestino irritable
Estrés y trastornos mentales en síndrome de intestino irritable y su relación con el consumo de alimentos
El estrés y los trastornos mentales incrementan o disminuyen el consumo de alimentos, puesto que la exposición al estrés produce en el cuerpo sustancias tanto orexigénicas como anorexigénicas26. El estrés crónico genera el incremento de la activación de las vías orexigénicas, lo que causa un aumento en la ingesta de alimentos ricos en calorías y carbohidratos que sean “apetecibles” para la persona, y también interrumpe la señalización de saciedad sensorial específica, lo que conlleva al consumo de una comida determinada una y otra vez. En contraste, cuando hay ausencia de alimentos ricos en calorías o que sean apetecibles, el estrés activa las vías anorexigénicas, por lo que disminuye la ingesta de alimentos; la activación de esta vía puede ser aguda o sostenida durante un período de 24 horas27.
De hecho, se ha demostrado que, en condiciones de estrés agudo, la noradrenalina suprime el apetito y, junto a la acción de otras catecolaminas, aumentan la presión arterial y la frecuencia cardíaca, y disminuyen el flujo sanguíneo del sistema digestivo, renal y de la piel28. La alteración de la regulación del eje HHA como resultado del estrés crónico modifica la producción de la proteína de fusión celular 1 (CFR1) que actúa como una sustancia anorexigénica que influye en la ingesta de alimentos y el equilibrio energético. Se cree que la CFR1 disminuye la síntesis de neuropéptido Y (NPY) y su liberación, y aumenta la producción de leptina, conocida por ser la hormona de la saciedad19,28.
Síntomas gastrointestinales y percepciones negativas con la alimentación
Los síntomas gastrointestinales tienen una alta relevancia en la percepción del placer al comer, la selección de los alimentos y la participación en actividades de la vida cotidiana. Normalmente, los pacientes que presentan alguna enfermedad o síndrome relacionado con el sistema gastrointestinal suelen desarrollar percepciones negativas con la alimentación y un comportamiento evasivo a las situaciones sociales debido a la incomodidad que producen los síntomas gastrointestinales de la misma patología29.
Se ha observado que el miedo y la ansiedad alrededor de los síntomas gastrointestinales al comer aumenta las prácticas de alimentación restrictivas o desordenadas, lo que disminuye el apetito producto de los síntomas gastrointestinales derivados del mismo acto de comer30. La restricción de comida actúa como un factor para el riesgo de desórdenes/trastornos alimentarios que se asocia con una reducción en la calidad de vida, mecanismos de afrontamiento desadaptativos, depresión y estrés percibido.
Cuomo y colaboradores31 encontraron que más del 60% de los pacientes con SII informaban la aparición o el empeoramiento de los síntomas gastrointestinales 15 minutos después de las comidas, además de una alta intolerancia alimentaria que se relacionó con una calidad de vida reducida. Según los autores, esta intolerancia suele llevar a los pacientes a identificar y eliminar los alimentos que no toleran, y se encontró que al menos el 62% de las personas que padecen SII limitaban o excluían alimentos de la dieta32. En un estudio realizado con 1717 estudiantes coreanos se encontró que aquellos individuos que sufrían de SII solían saltar sus comidas diarias de forma frecuente, a diferencia de los sujetos sanos. Estos resultados fueron similares a los encontrados en otros estudios realizados con personas de la edad media y a los reportados en un estudio realizado con estudiantes de enfermería y medicina en Japón33.
Petrillo y colaboradores34 encontraron que el 57% de los individuos que tenían una disminución en el consumo de alimentos reunía los criterios para desórdenes psiquiátricos y se relacionaban también con distensión abdominal, dolor, hábito intestinal irregular, fatiga y dolor de cabeza. Varios estudios que han evaluado los patrones diarios de alimentación encuentran una disminución significativa en la ingesta de calorías, proteínas y carbohidratos, incluida la fibra, al igual que valores bajos comparados con la recomendación diaria de micronutrientes como calcio, tiamina y folatos en las personas con SII, en contraste con los controles sanos30,34,35. Los individuos con enfermedades gastrointestinales suelen tener horarios irregulares o saltos en las comidas, además de una mayor restricción en la ingesta.
En un estudio realizado por Melchior y colaboradores35 en 2021, el 26% de los pacientes con SII reportaron que frecuentemente no comían cuando tenían hambre debido al mismo trastorno, el 54% reportó que frecuentemente evadían los alimentos y el 31% reportó que tenían aversión a los alimentos. En un estudio de casos y controles realizado por Hayes y colaboradores36 también se encontró que los pacientes con SII tenían un factor de riesgo de 3,96 en el desarrollo de hábitos alimentarios irregulares en comparación con los controles sanos.
Recomendaciones dietéticas en síndrome de intestino irritable
La alimentación es clave considerando que el 60% de los pacientes con intestino irritable afirman que ciertos alimentos empeoran sus síntomas. En general, las indicaciones dietéticas para tratar la sintomatología del SII incluyen la reducción de la ingesta de lactosa, grasas, alimentos productores de gases (como leguminosas, legumbres, brócoli, entre otros), dieta baja en oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP), que es la más común y un adecuado aporte de fibra, especialmente soluble37. Según la GPC de Colombia de 201638 con una recomendación fuerte pero baja en evidencia, los profesionales afirman que se recomienda la implementación y adherencia de una dieta baja FODMAP para el tratamiento de los pacientes con SII que cursen con distensión, dolor abdominal y diarrea, debido a que estos carbohidratos aumentan la presión osmótica intraluminal y proveen un sustrato para la fermentación bacteriana, lo que resulta en producción de gases, distensión y dolor abdominal39.
Sin embargo, en algunos artículos se ha observado que, a pesar de la reducción de alguno de estos compuestos en la dieta, algunas personas con SII todavía presentan un grado de aversión y restricción de la comida y reportan una alta gravedad en los síntomas gastrointestinales35. Esto puede relacionarse con el estrés generado al momento de comer debido a los síntomas gastrointestinales percibidos u otras situaciones de estrés externas y los mismos trastornos mentales que causan una desregularización en los hábitos alimentarios y el apetito.
Las dietas basadas en la eliminación de los alimentos percibidos como “intolerantes” por los pacientes que padecen SII pueden incrementar el riesgo de desarrollar desorden restrictivo o de evasión de la ingesta de alimentos (ARFID), definido por la DSM-5 como un desorden que ocurre cuando una alteración en la ingesta de alimentos lleva a la inhabilidad de alcanzar las necesidades apropiadas de nutrientes o energía, lo que lleva a una pérdida de peso o una deficiencia nutricional, y en casos más graves, a la dependencia de alimentación enteral o suplementos nutricionales. Usualmente, este desorden no es motivado por el miedo a ganar peso o insatisfacción con la imagen corporal, sino por el poco interés en comer o hiporexia, la aversión a las características sensoriales de algunos alimentos o la preocupación o miedo a las consecuencias de la ingesta de ciertos alimentos29,40.
Gran parte de los pacientes que llegan a desarrollar ARFID son pacientes a los cuales se les prescribió una dieta baja en FODMAP, debido a un comportamiento alimentario desadaptativo que los lleva a evitar la fase de reintroducción de alimentos, lo que reduce su dieta a solo 10 “alimentos seguros” (29,41. Cabe destacar que más del 70% de estos pacientes ya cumplían criterios de ARFID, bajo peso o algún trastorno mental al prescribir la dieta29. Según los datos obtenidos por Mari y colaboradores42, una mayor adherencia a una dieta baja en FODMAP se asocia con los síntomas relacionados a los comportamientos de desórdenes alimentarios, y se encontró que todos los pacientes que dieron positivo a un desorden alimentario tenían un porcentaje de adherencia del 57,4% comparado con el 35,8% en aquellos que dieron negativo a los desórdenes de alimentación.
En general, Kayar y colaboradores43 encontraron que, de 200 pacientes, 118 (59%) eran mujeres y 92 (41%) eran varones. La puntuación en las pruebas de actitudes alimentarias (eating attitudes test [EAT]) fue significativamente superior en el grupo de SII (cociente de probabilidades: 5,3; intervalo de confianza [IC] del 95%: 4,3-9,3; p < 0,001). La cantidad de sujetos con puntuación de EAT > 30 fue significativamente superior en el grupo de SII (p < 0,001). Además, se encontraron mayores puntajes en pacientes mujeres con SII y en edades más jóvenes considerando un rango de edad general entre los 18 y 65 años (p = 0,013 y p = 0,043, respectivamente). A la vez, no hallaron una asociación significativa entre el subtipo de SII y la puntuación de EAT (p > 0,05). Sin embargo, la intensidad y la duración del SII presentaron una correlación positiva con las puntuaciones de EAT, lo que justifica algunos comentarios de otros autores en los que se vincula la presencia de SII con alimentación desordenada e incluso con trastornos alimenticios como anorexia nerviosa, bulimia y trastornos no especificados44.
La restricción de alimentos también se ha relacionado con la posibilidad de generar una subadecuación en las necesidades de nutrientes; por ejemplo, el bajo consumo de lácteos conduce a menores aportes de calcio, vitamina B12, riboflavina y vitamina D, o la baja ingesta de grasas en la dieta puede implicar una ingesta inadecuada de vitaminas liposolubles. De hecho, se ha encontrado que los pacientes que padecen SII tienen bajas concentraciones o deficiencia de vitaminas A y riboflavina, y minerales como calcio y potasio37.
Síndrome de intestino irritable y obesidad abdominal
Recientes investigaciones como la de Akhondi y colaboradores45 han determinado que el SII es más frecuente entre los individuos con obesidad abdominal en comparación con los sujetos en normopeso (23,8% frente al 19%), condición que se podría relacionar con los hábitos alimentarios. Pero la asociación entre SII, obesidad y sobrepeso dejó de ser significativa después del ajuste por posibles factores de confusión (odds ratio [OR]: 1,09; IC 95%: 0,82-1,44). En las categorías de índice de masa corporal (IMC) no encontraron ninguna asociación significativa entre sobrepeso (OR: 0,89; IC 95%: 0,62-1,27), obesidad (OR: 1,05; IC 95%: 0,58-1,87) y la gravedad del dolor abdominal. El sobrepeso abdominal (OR: 0,96; IC 95%: 0,65-1,40) y la obesidad (OR: 1,61; IC 95%: 0,67-1,63) no se asociaron con la intensidad del dolor abdominal. Por lo anterior se proponen mayores investigaciones a futuro.
Eje cerebro-intestino-microbiota y SII, posible mecanismo para explicar la relación de los síntomas en el SII con los trastornos mentales y los hábitos alimentarios
En el núcleo del eje cerebro-intestino (ECI) se encuentra la conexión entre el sistema nervioso entérico (SNE) y el sistema nervioso central (SNC), que crea una comunicación directa de “abajo hacia arriba” y de “arriba hacia abajo”. De forma descendente, el ECI permite la regulación central de la función intestinal y facilita las respuestas intestinales a las emociones y la cognición; y de forma ascendente, las respuestas a los estímulos derivados del intestino influyen en los centros cognitivos y emocionales del cerebro46. Esta modulación ocurre a través de entradas simpáticas y parasimpáticas de las neuronas del SNA y podrían ser parte de los mecanismos que explican las relaciones entre síntomas gastrointestinales de SII, trastornos mentales y cambios en los hábitos de alimentación.
Microbiota intestinal
La microbiota intestinal es el último componente de esta red en ser reconocido. Se ha observado que los organismos comensales del intestino tienen la capacidad de influir directamente en el SNE y modular indirectamente la función del ECI20 por medio de numerosas vías, incluido el sistema inmune, el reclutamiento de señales neuroendocrinas, rutas directas del SNE y el nervio vago, y la producción de metabolitos bacterianos como los ácidos grasos de cadena corta (AGCC), los ácidos biliares, la serotonina, los aminoácidos de cadena ramificada y peptidoglicanos9,47,48.
Mayer y colaboradores18 han propuesto que la señalización entre el cerebro, el intestino y la microbiota pueden contribuir a la dispepsia y que la microbiota puede mediar en la modulación de los reflejos entéricos que causan los síntomas relacionados con el SII. Un cambio local en los microbios de la microbiota intestinal lleva a la inflamación que puede permitir la translocación bacteriana junto con el aumento de citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α) y mediadores como la serotonina, que inducen una mayor sensibilidad al dolor y cambios en la motilidad, posiblemente por medio de los efectos en las células intersticiales de Cajal17,49,50. Esta situación puede verse reforzada por trastornos mentales como la depresión y la ansiedad que alteran el flujo del SNA con el aumento de los niveles de catecolaminas, que a su vez incrementan la producción de la hormona liberadora de hormona adrenocorticotropa (CRF) y la secreción de cortisol (Figura 2)17.
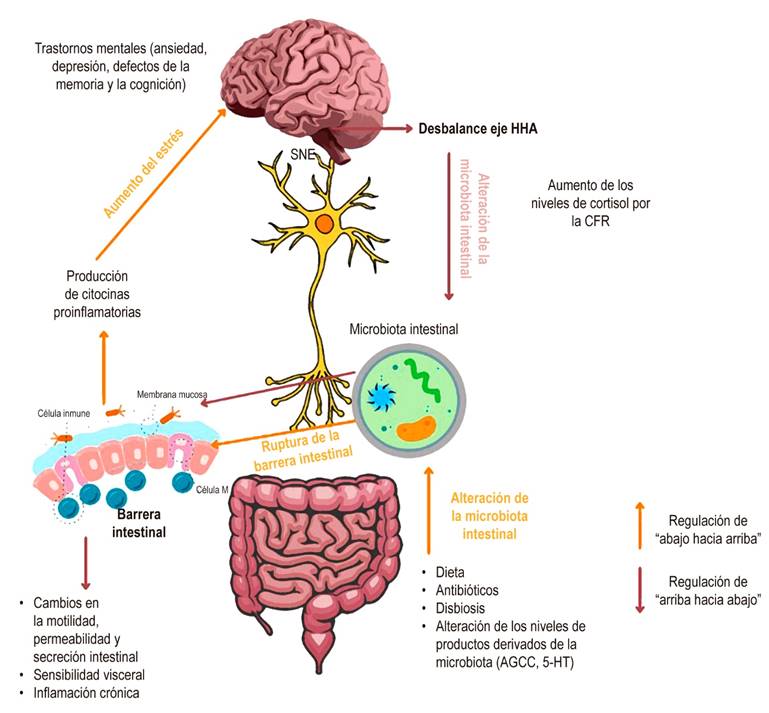
Figura 2 Alteración del eje cerebro-intestino-microbiota en el SII. El eje cerebro-intestino-microbiota se conecta por medio del sistema nervioso entérico creando una comunicación bidireccional. De forma ascendente, la alteración de la microbiota por factores como la dieta, los antibióticos o la disbiosis causa un cambio en los niveles de concentración de los metabolitos derivados (AGCC*, 5-HT**), que lleva a un rompimiento de la barrera intestinal, esto genera inflamación crónica y producción de citocinas proinflamatorias que pueden aumentar el estrés y causar un desbalance a nivel cerebral y el posible desarrollo de trastornos mentales como la depresión y la ansiedad. De forma descendente, un desbalance en el eje HHA, genera un aumento en los niveles de cortisol inducido por la CFR, lo que causa el incremento de catecolaminas que impactan en las bacterias intestinales, inflamación intestinal y cambios en la motilidad intestinal. *Ácidos grasos de cadena corta. **Serotonina. CFR: factor de liberación de corticotropina; HHA: eje hipotalámico-hipofisiario-adrenal. Fuente: elaboración propia.
Por otro lado, se ha encontrado que la composición de la microbiota intestinal en pacientes con SII suele diferir de la de las personas sanas. En varios estudios se ha observado que aquellas personas que padecen el síndrome tienen mayor riqueza bacteriana de Ruminococcus sp, Clostridium spp y proteobacterias, las cuales están ligadas a los síntomas del SII, incluidos la hipersensibilidad visceral y cambios en los valores de AGCC que se asocian con niveles alterados de citocinas fecales. También se presentan deficiencias de Bifidobacterium sp, Roseburia, Faecalibacterium y Lactobacillus, que ayudan a promover la salud intestinal3,11,49,51. Las bifidobacterium proporcionan una barrera mucosa que ayuda a mantener la homeostasis del intestino y los Lactobacillus son esenciales para aumentar la producción de mucina en el revestimiento intestinal, que evita la adherencia de microbios patógenos. Mientras, Faecalibacterium prausnitzii es un importante productor de butirato que promueve la reducción de la inflamación intestinal y también libera otros metabolitos importantes para mejorar la función de barrera de la mucosa4.
La microbiota intestinal juega un papel importante en el neurodesarrollo durante el período pre- y posnatal y el comportamiento afectivo en la edad adulta. La disbiosis de la madre gestante puede alterar las señales del desarrollo normal o inducir estímulos inapropiados del desarrollo52. La inflamación causada debido a la interrupción de la microbiota intestinal resulta en un estado proinflamatorio que puede afectar el desarrollo neural y afectar el sistema inmunitario del feto. Entre las causas de la disbiosis materna está el uso de antibióticos, el alto consumo de grasas y el estrés físico o psicológico que pueden suprimir la producción de metabolitos inmunorreguladores como los AGCC o promover la producción de metabolitos proinflamatorios53. La microbiota intestinal de la madre también puede afectar los niveles circulantes de serotonina (5-HT), que a su vez altera el neurodesarrollo fetal debido a que este metabolito regula la división, diferenciación y sinaptogénesis de las células neurofetales54.
La interrupción del microbioma en los primeros años de vida influye en los resultados negativos de la salud mental a largo plazo a través de su interacción con el eje cerebro-intestino55. En los neonatos nacidos mediante parto natural, el tracto gastrointestinal es colonizado principalmente por bifidobacterias, así como lactobacilos, Bacteroidetes, proteobacterias y Actinobacterias, mientras que en aquellos que nacen por cesárea tienen mayor cantidad de Escherichia coli, Clostridia y menor cantidad de Bacteroidetes y bifidobacterias. De manera similar, los bebés alimentados con leche materna muestran mayor abundancia de bifidobacteria, mientras que en los niños alimentados con leche de fórmula las bifidobacterias, bacteroides, clostridios y estafilococos se encontraron en cantidades equitativas56.
La especie Clostridium spp. que, como se mencionó, suele encontrarse en mayores cantidades en niños nacidos por cesárea y alimentados con leche de fórmula, así como en pacientes diagnosticados con trastorno depresivo mayor y SII, es la encargada de producir ácido acético, que también parece estar aumentado en el SII51. El ácido acético juega un papel relevante al suprimir el apetito activando la acetil-coenzima A carboxilasa y su efecto sobre la expresión de neuropéptidos reguladores en el hipotálamo57. Esto podría indicar que cuando se alteran las concentraciones de los AGCC por un cambio en la composición de la microbiota intestinal, también resultan alterados los niveles de estas hormonas. Se ha encontrado que las personas con SII tienen niveles anormales de péptido YY (PYY) y respuestas anormales de la colecistocinina (CCK) a la ingesta de alimentos, lo que aumenta la mecanosensibilidad rectal. De igual forma, se ha identificado que los desórdenes del ánimo, como la depresión, están asociados a polimorfismos genéticos que pueden alterar los niveles de la CCK y de la PYY24,56.
Ácidos grasos de cadena corta
Los AGCC derivados de la microbiota mantienen la homeostasis intestinal y tienen un papel dual en la inmunidad: antiinflamatorio, al fortalecer la integridad de la barrera epitelial a través de la regulación positiva de los receptores acoplados a proteína G en el intestino, y la inducción y mantenimiento de las células T reguladoras que fortalecen la integridad de la barrera epitelial. En contraste, en casos de disbiosis, los AGCC inducen la inflamación de la mucosa por medio de la transcripción del triptófano hidroxilasa 1 (TPH1) y la producción de 5-HT por medio de la vía serotoninérgica, lo cual justifica la inflamación de bajo grado en la patogénesis del SII58.
El 95% de estos AGCC los compone el acetato, el propionato y el butirato que se producen a partir de carbohidratos en el colon. El acetato y el propionato se asocian a la regulación de los ácidos grasos y la energía en el hígado51; el butirato participa en la modulación de la proliferación epitelial del intestino, la apoptosis y la diferenciación celular en el intestino, y en la inhibición de la factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-κB) manteniendo la integridad de la barrera intestinal49.
En un estudio realizado por Tana y colaboradores59 se encontraron niveles significativamente más altos de ácido acético y ácido propiónico en pacientes con SII que en los controles. Sin embargo, otros estudios muestran que los AGCC fecales de los pacientes con SII se caracterizaban por niveles más bajos de AGCC totales, ácido acético y ácido propiónico, y por niveles más altos de ácido butírico8,60. A pesar de que aún no existe un consenso en las diferencias observadas en los niveles de los AGCC, sí se ha demostrado que las alteraciones de la composición y concentración de los AGCC son evidentes en pacientes con SII, especialmente en pacientes con SII-D, en quienes las diferencias en la producción de AGCC por la microbiota del colon se asocian con una tasa de tránsito intestinal acelerada y disfunción neuromuscular8,10.
Serotonina
Cerca del 90% de la 5-HT del cuerpo humano se encuentra en el tracto gastrointestinal, principalmente en las células enterocromafines (EC) y las interneuronas mientéricas13. Para la peristalsis y secreción intestinal son fundamentales la inflamación y el desarrollo de neuronas. Está relacionada con el dolor, la sensibilidad y los reflejos a través de la activación de las EC y células enteroendocrinas16,51. Se ha demostrado que las anormalidades en el metabolismo de este neurotransmisor pueden estar asociadas con enfermedades funcionales del intestino y desórdenes de ansiedad. En diversos estudios clínicos se ha observado que los pacientes con SII-C tienen bajos niveles séricos de 5-HT posprandiales, lo que se asocia a tránsito intestinal lento, mientras que las concentraciones altas son más comunes en pacientes con SII-D, lo que se relaciona con una mayor prevalencia de depresión y ansiedad en pacientes con SII-C, probablemente debido al desbalance de la serotonina intestinal y la reducción de la respuesta a la serotonina en las regiones centrales y periféricas16,61.
En estudios recientes se ha encontrado que la variación polimórfica 5-HTTLPR del gen que codifica la proteína transportadora de serotonina (SERT) aumenta la expresión del transportador y mejora su actividad, lo que conlleva a una mayor absorción de serotonina y, a su vez, disminuye sus efectos en la secreción y motilidad, por lo que es posible que este polimorfismo se encuentre en los pacientes con SII-C62-65.
Los cambios en las concentraciones de serotonina no solo se reflejan a nivel del metabolismo intestinal, sino que también puede generar alteraciones en la señalización intestinal y los procesos nociceptivos viscerales causando mayor sensibilidad al dolor abdominal66,67.
Sistema de señalización del factor de liberación de corticotropina
El sistema de señalización del CFR es una vía clave en el mecanismo bioquímico por el cual el cerebro traduce un estímulo en una respuesta física integrada. Este sistema afecta directamente al tracto gastrointestinal produciendo efectos proinflamatorios, especialmente mediados por la CFR1, la cual se expresa en las neuronas entéricas y en la capa de la mucosa intestinal, lo que retarda el vaciamiento gástrico y acelera el tránsito colónico15,68,69. El CFR también juega un papel primario en la estimulación del eje HHA como respuesta al estrés físico o psicosocial: incrementa los niveles de catecolaminas, que impactan en las bacterias del intestino, y los niveles de cortisol, que estimulan la producción de ácido biliar en el hígado y afectan la microbiota15,69. Hay evidencia que indica que los pacientes con SII tienen una desregularización en el eje HHA en condiciones basales con una mejora en la respuesta sistémica, lo que produce un aumento en los niveles basales de cortisol y un aumento en los síntomas de ansiedad16.
Discusión
Aunque en los últimos años se ha ampliado la información sobre la relación entre el factor psicológico y el factor metabólico que confluyen en el SII, aún hay una condición poco estudiada en estos pacientes en relación con el modo en que estos factores influyen en los síntomas del SII y el cambio en el hábito alimentario.
Entre los mecanismos que parecen estar asociados al desarrollo del SII se encuentran las anormalidades en la estructura cerebral y en el funcionamiento del eje cerebro-intestino que causa una mayor respuesta emocional, mayor sensibilidad visceral, alteración del comportamiento afectivo, cambios en la función gastrointestinal y en la composición de la microbiota intestinal. Los cambios estructurales y conectivos dentro de las regiones sensoriales del cerebro pueden conducir a una mayor sensación del dolor abdominal y explicar el aumento de la comorbilidad afectiva observada en los pacientes con SII, especialmente porque la deficiente modulación de la vía intestino-cerebro de “arriba hacia abajo” junto a una hiperactividad de la amígdala y la ínsula anterior se han observado en los trastornos de ansiedad20,68.
De acuerdo con la evidencia, la relación entre síntomas gastrointestinales, los trastornos mentales y la alimentación parece ser en diferentes vías, muchas de ellas asociadas al eje microbiota-intestino-cerebro11. Los síntomas gastrointestinales en SII pueden relacionarse con percepciones negativas de la alimentación, así como con cambios en el apetito, y los trastornos mentales pueden generar cambios en el hábito alimentario, función gastrointestinal y estado nutricional de la persona, entre otras relaciones70. Igualmente, los cambios en la dieta para el manejo de SII logran inducir efectos sobre el consumo de alimento, estado mental y subadecuación de algunos nutrientes (Figura 3).
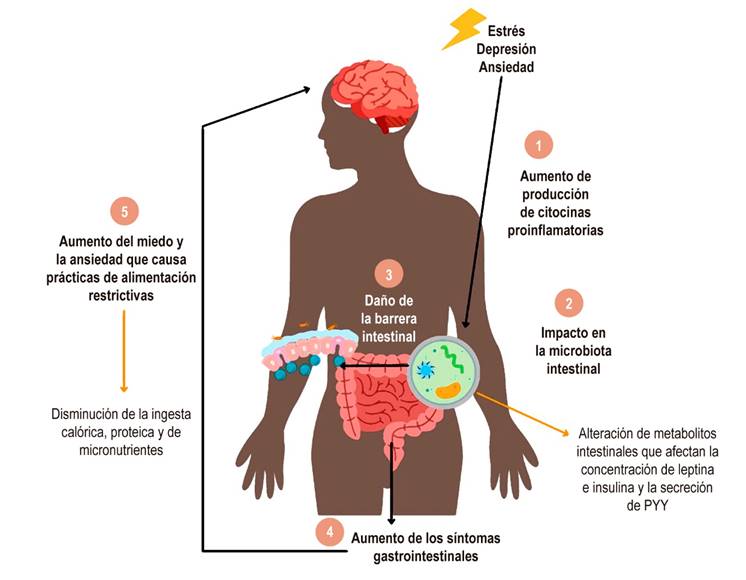
Figura 3 Modelo del rol de los trastornos mentales en la afectación del hábito alimentario de las personas con SII. 1. El estrés psicológico, la ansiedad o la depresión aumentan la liberación de citocinas proinflamatorias. 2. Estas citocinas impactan en la conformación de la microbiota intestinal, lo que puede alterar los niveles de metabolitos y, a su vez, los niveles de las hormonas que regulan el apetito. 3. La pérdida del equilibrio bacteriano de la microbiota y el aumento de citocinas proinflamatorias causan daño en la barrera intestinal. 4. Hay un aumento de los síntomas gastrointestinales como el dolor visceral, motilidad intestinal, distensión abdominal y generación de gases. 5. El aumento de los síntomas gastrointestinales incrementa el miedo y la ansiedad al ingerir un alimento, lo que causa prácticas de alimentación restrictivas en el paciente con SII. Fuente: elaboración propia.
Todo lo anterior respalda las recomendaciones en las que se sugiere que en personas con SII es importante instaurar una terapia integral, que incluya la terapia psicológica y, de ser necesario, la psiquiátrica, siempre acompañada de la guía nutricional que proporcione alternativas en la alimentación basadas en recomendaciones que modifiquen algunas prácticas alimentarias o la intervención de la dieta baja en FODMAP, incluidas una fase de personalización y recomendaciones que permitan una adecuada nutrición, y la prevención de enfermedades futuras.
De igual forma, resulta relevante incluir recomendaciones que promuevan cambios en el estilo de vida, como realizar actividad física o pausas activas durante las jornadas del trabajo que contribuyen a manejar el estrés de la vida diaria y mejorar la función gastrointestinal71. La terapia psicológica en el tratamiento del SII no solo ayuda a la mejora de los estados de ánimo, sino que también tiene efectos sobre la percepción del dolor, la hipersensibilidad visceral y la motilidad gastrointestinal, así como posibles efectos favorables sobre el apetito y el consumo de alimentos. Entre las terapias psicológicas se destacan la terapia de relajación, la terapia multicomponente y la terapia cognitiva conductual, que se han destacado por ser más efectivas en los pacientes con SII2.
En cuanto a las recomendaciones de alimentación, es muy importante que antes de prescribir cualquier tipo de dieta restrictiva, se evalúe el subtipo de SII, la presencia de algún trastorno mental, si el paciente ya viene o no con un bajo peso y el riesgo que tiene de padecer un trastorno alimentario42. La Asociación Británica de Dietistas en sus guías del 201672 consideran la incorporación de una dieta baja en FODMAP enfatizando en la eliminación de alimentos altos en dichos carbohidratos solo por 4 semanas. Adicionalmente, recomiendan el uso de probióticos por 4 semanas. Con menor evidencia, aconsejan controlar el consumo de alcohol, picante y preparaciones altas en grasas. En cuanto a la fibra, la Asociación Canadiense de Gastroenterología Clínica73 recomienda la fibra soluble, con una evidencia moderada.
La disbiosis intestinal y la inflamación de bajo grado reflejan la complejidad de la relación entre la microbiota intestinal, el desarrollo de SII y los trastornos mentales. Se sugiere la importancia de la regulación de la microbiota desde el período prenatal para asegurar que la madre mantenga hábitos sanos de alimentación y que su embarazo se dé en un entorno tranquilo, con el apoyo de la familia y el personal de salud, y para prevenir la aparición de infecciones durante la gestación. Igualmente, se resalta la importancia de la alimentación con leche materna en los lactantes, ya que no solo ayuda a desarrollar y proteger el sistema inmune del bebé, sino que potencia el desarrollo de una microbiota sana y podría ser o actuar como factor protector de enfermedades como la diabetes, la obesidad, el SII y la aparición de trastornos mentales en la vida adulta55.
Actualmente, el mundo atraviesa una emergencia de salud pública debido a la aparición del coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2), responsable de la enfermedad del coronavirus de 2019 (COVID-19). El rápido aumento de brotes en todo el mundo generó que el 11 de marzo de 2020 se declarara pandemia mundial y la mayoría de los gobiernos instauraron cuarentenas y bloqueos con el fin de reducir la cantidad de infecciones nuevas. Aunque aún no hay datos concluyentes sobre la prevalencia de SII a nivel global y regional durante la pandemia, sí está claro que la COVID-19 como enfermedad infecciosa ha incrementado la cantidad de casos de personas con SII y SII-posinfeccioso (SII-PI). De igual forma, ha tenido un impacto significativo en la salud mental a nivel mundial, no solo por la angustia psicológica que se experimenta en la fase aguda de la enfermedad, sino por el entorno de aislamiento y las secuelas inciertas de la resolución del aislamiento que generan ansiedad y pánico74. Esto probablemente ha traído consecuencias para el hábito alimentario de los ciudadanos, quienes han recurrido al aumento de alimentos ricos en carbohidratos y grasas como una forma de generar la sensación de reconforte 75. En un estudio realizado por Remes-Troche y colaboradores76 con 678 pacientes en los que se evaluó la incidencia de síntomas de estreñimiento durante el confinamiento implementado para contener la propagación de COVID-19 en México, se encontró que este cambio en los hábitos alimentarios aumentó las cifras de estreñimiento de “nueva aparición”, una disminución significativa de la cantidad de deposiciones y heces más duras durante el confinamiento.
Todo lo anterior resalta la importancia que tiene el manejo integral del SII que no solo abarque el tratamiento dietético y farmacológico de los síntomas, sino que también incluya el apoyo psicoterapéutico para garantizar una mejor calidad de vida a las personas que padecen SII. El manejo de la alimentación usando la dieta baja en FODMAP, como sugieren las GPC, o la identificación de grupos de alimentos intolerados son una buena opción para tratar este síndrome; sin embargo, no suele ser efectiva en todos los pacientes; por esta razón, deben considerarse alternativas complementarias como promover la actividad física o el yoga, que además de ayudar con la mejora de los síntomas gastrointestinales, puede ser una herramienta para el manejo de los trastornos mentales. Dentro de la alimentación, podría ser útil incrementar el consumo de fibra soluble y el consumo de agua debido a que ayudan a mejorar al tránsito intestinal, particularmente en pacientes con SII-C.
También podría evaluarse la posibilidad del uso de probióticos que protejan y fortalezcan la microbiota intestinal. Entre estos se ha observado que el Bifidobacterium infantis y el Lactobacillus salivarus reducen significativamente el dolor abdominal, la distensión y la dificultad de movimiento intestinal; adicionalmente, se ha encontrado que la cepa Lactobacillus rhamnosus podría tener efecto sobre la mejoría de los síntomas gastrointestinales presentes en el SII y en la reducción de los síntomas asociados a la depresión y la ansiedad77. Además de probióticos se mencionan intervenciones específicas dirigidas a modular la microbiota intestinal en el SII, incluidos prebióticos, simbióticos, dietas específicas, trasplante fecal y otros posibles enfoques futuros útiles para el diagnóstico, la prevención y el tratamiento del SII78.
Sería pertinente que se realice una evaluación más profunda sobre el funcionamiento del SNC y SNE en pacientes que padecen SII y algún trastorno mental. Estos aspectos pueden llevar al desarrollo de medicamentos y terapias no farmacológicas más específicas a la etiología del SII de forma individualizada en cada paciente con el fin de garantizar una mejor calidad de vida.
Conclusión
Se encontró una relación en distintas vías entre estrés, depresión y ansiedad, síntomas de SII y cambios en los hábitos de alimentación. Algunas de estas relaciones se explican en gran medida por la regulación que se ejerce en el eje cerebro-intestino, y probablemente no es el único mecanismo. Lo anterior sugiere que los síntomas gastrointestinales de SII y las alteraciones en el estado de ánimo y de alimentación se pueden asociar de igual manera a las variaciones en la función regulatoria que ejerce el eje cerebro-intestino-microbiota. Se recomienda un manejo integral que no solo implique manejo farmacológico para los síntomas de SII o de los estados de ansiedad y depresión, sino que además abarque el manejo psicológico79 junto con un plan de manejo nutricional personalizado, así como recomendaciones de estilos de vida saludable que impliquen actividad física y manejo del estrés79,80
REFERENCIAS
1. Adriani A, Ribaldone DG, Astegiano M, Durazzo M, Saracco GM, Pellicano R. Irritable bowel syndrome: The clinical approach. Panminerva Med. 2018;60(4):213-22. https://doi.org/10.23736/S0031-0808.18.03541-3 [ Links ]
2. Ford AC, Sperber AD, Corsetti M, Camilleri M. Irritable bowel syndrome. Lancet. 2020;396(10263):1675-88. https://doi.org/10.1016/S0140-6736(20)31548-8 [ Links ]
3. Koloski N, Holtmann G, Talley NJ. Is there a causal link between psychological disorders and functional gastrointestinal disorders? Expert Rev Gastroenterol Hepatol. 2020;14(11):1047-59. https://doi.org/10.1080/17474124.2020.1801414 [ Links ]
4. Aziz MNM, Kumar J, Nawawi KNM, Ali RAR, Mokhtar NM. Irritable bowel syndrome, depression, and neurodegeneration: A bidirectional communication from gut to brain. Nutrients. 2021;13(9):1-16. https://doi.org/10.3390/nu13093061 [ Links ]
5. Pham MT, Rajić A, Greig JD, Sargeant JM, Papadopoulos A, Mcewen SA. A scoping review of scoping reviews: Advancing the approach and enhancing the consistency. Res Synth Methods. 2014;5(4):371-85. https://doi.org/10.1002/jrsm.1123 [ Links ]
6. Sucharew H, Macaluso M. Methods for research evidence synthesis: The scoping review approach. J Hosp Med. 2019;14(7):416-8. https://doi.org/10.12788/jhm.3248 [ Links ]
7. Tricco AC, Lillie E, Zarin W, O’Brien KK, Colquhoun H, Levac D, et al. PRISMA extension for scoping reviews (PRISMA-ScR): Checklist and explanation. Ann Intern Med. 2018;169(7):467-73. https://doi.org/10.7326/M18-0850 [ Links ]
8. Luo M, Zhuang X, Tian Z, Xiong L. Alterations in short-chain fatty acids and serotonin in irritable bowel syndrome: a systematic review and meta-analysis. BMC Gastroenterol. 2021;21(1):14. https://doi.org/10.1186/s12876-020-01577- [ Links ]
9. Long-Smith C, O’Riordan KJ, Clarke G, Stanton C, Dinan TG, Cryan JF. Microbiota-gut-brain axis: New therapeutic opportunities. Annu Rev Pharmacol Toxicol. 2020;60:477-502. https://doi.org/10.1146/annurev-pharmtox-010919-023628 [ Links ]
10. Hyland NP, Quigley EMM, Brint E. Microbiota-host interactions in irritable bowel syndrome: Epithelial barrier, immune regulation and brain-gut interactions. World J Gastroenterol. 2014;20(27):8859-66. https://doi.org/10.3748/wjg.v20.i27.8859 [ Links ]
11. Margolis KG, Cryan JF, Mayer EA. The Microbiota-Gut-Brain Axis: From Motility to Mood. Gastroenterology. 2021;160(5):1486-501. https://doi.org/10.1053/j.gastro.2020.10.066 [ Links ]
12. Kennedy PJ, Clarke G, Quigley EMM, Groeger JA, Dinan TG, Cryan JF. Gut memories: Towards a cognitive neurobiology of irritable bowel syndrome. Neurosci Biobehav Rev. 2012;36(1):310-40. https://doi.org/10.1016/j.neubiorev.2011.07.001 [ Links ]
13. Pae CU, Masand PS, Ajwani N, Lee C, Patkar AA. Irritable bowel syndrome in psychiatric perspectives: A comprehensive review. Int J Clin Pract. 2007;61(10):1708-18. https://doi.org/10.1111/j.1742-1241.2007.01409.x [ Links ]
14. Buckley MM, O’Mahony SM, O’Malley D. Convergence of neuro-endocrine-immune pathways in the pathophysiology of irritable bowel syndrome. World J Gastroenterol. 2014;20(27):8846-58. https://doi.org/10.3748/wjg.v20.i27.8846 [ Links ]
15. Qin HY, Cheng CW, Tang XD, Bian ZX. Impact of psychological stress on irritable bowel syndrome. World J Gastroenterol. 2014;20(39):14126-31. https://doi.org/10.3748/wjg.v20.i39.14126 [ Links ]
16. Bolino CM, Bercik P. Pathogenic Factors Involved in the Development of Irritable Bowel Syndrome: Focus on a Microbial Role. Infect Dis Clin North Am. 2010;24(4):961-75. https://doi.org/10.1016/j.idc.2010.07.005 [ Links ]
17. Pellissier S, Bonaz B. The Place of Stress and Emotions in the Irritable Bowel Syndrome. Vitam Horm. 2017;103:327-354. https://doi.org/10.1016/bs.vh.2016.09.005 [ Links ]
18. Osadchiy V, Martin CR, Mayer EA. The Gut-Brain Axis and the Microbiome: Mechanisms and Clinical Implications. Clin Gastroenterol Hepatol. 2019;17(2):322-332. https://doi.org/10.1016/j.cgh.2018.10.002 [ Links ]
19. Labanski A, Langhorst J, Engler H, Elsenbruch S. Stress and the brain-gut axis in functional and chronic-inflammatory gastrointestinal diseases: A transdisciplinary challenge. Psychoneuroendocrinology. 2020;111:104501. https://doi.org/10.1016/j.psyneuen.2019.104501 [ Links ]
20. Tait C, Sayuk GS. The Brain-Gut-Microbiotal Axis: A framework for understanding functional GI illness and their therapeutic interventions. Eur J Intern Med. 2021;84:1-9. https://doi.org/10.1016/j.ejim.2020.12.023 [ Links ]
21. Koloski NA, Jones M, Talley NJ. Evidence that independent gut-to-brain and brain-to-gut pathways operate in the irritable bowel syndrome and functional dyspepsia: a 1-year population-based prospective study. Aliment Pharmacol Ther. 2016;44(6):592-600. https://doi.org/10.1111/apt.13738 [ Links ]
22. Surdea-Blaga T, Bằban A, Dumitrascu DL. Psychosocial determinants of irritable bowel syndrome. World J Gastroenterol. 2012;18(7):616-26. https://doi.org/10.3748/wjg.v18.i7.616 [ Links ]
23. Van Oudenhove L, Levy RL, Crowell MD, Drossman DA, Halpert AD, Keefer L, et al. Biopsychosocial aspects of functional gastrointestinal disorders: How central and environmental processes contribute to the development and expression of functional gastrointestinal disorders. Gastroenterology. 2016;150(6):1355-1367.e2. https://doi.org/10.1053/j.gastro.2016.02.027 [ Links ]
24. Van Oudenhove L, Törnblom H, Störsrud S, Tack J, Simrén M. Depression and Somatization Are Associated with Increased Postprandial Symptoms in Patients with Irritable Bowel Syndrome. Gastroenterology. 2016;150(4):866-74. https://doi.org/10.1053/j.gastro.2015 [ Links ]
25. Mudyanadzo TA, Hauzaree C, Yerokhina O, Architha NN, Ashqar HM. Irritable Bowel Syndrome and Depression: A Shared Pathogenesis. Cureus. 2018;10(8):e3178. https://doi.org/10.7759/cureus.3178 [ Links ]
26. Dinan TG, Cryan JF. Regulation of the stress response by the gut microbiota: Implications for psychoneuroendocrinology. Psychoneuroendocrinology. 2012;37(9):1369-78. https://doi.org/10.1016/j.psyneuen.2012.03.007 [ Links ]
27. Bazhan N, Zelena D. Food-intake regulation during stress by the hypothalamo-pituitary-adrenal axis. Brain Res Bull. 2013;95:46-53. https://doi.org/10.1016/j.brainresbull.2013.04.002 [ Links ]
28. Ans AH, Anjum I, Satija V, Inayat A, Asghar Z, Akram I, et al. Neurohormonal Regulation of Appetite and its Relationship with Stress: A Mini Literature Review. Cureus. 2018;10(7):e3032. https://doi.org/10.7759/cureus.3032 [ Links ]
29. Simons M, Taft TH, Doerfler B, Ruddy JS, Bollipo S, Nightingale S, et al. Narrative review: Risk of eating disorders and nutritional deficiencies with dietary therapies for irritable bowel syndrome. Neurogastroenterol Motil. 2022;34(1): e14188. https://doi.org/10.1111/nmo.14188 [ Links ]
30. Satherley R, Howard R, Higgs S. Disordered eating practices in gastrointestinal disorders. Appetite. 2014;84:240-50. https://doi.org/10.1016/j.appet.2014.10.006 [ Links ]
31. Cuomo R, Andreozzi P, Zito FP, Passananti V, De Carlo G, Sarnelli G. Irritable bowel syndrome and food interaction. World J Gastroenterol. 2014;20(27):8837-45. https://doi.org/10.3748/wjg.v20.i27.8837 [ Links ]
32. Litleskare S, Wensaas KA, Eide GE, Hanevik K, Kahrs GE, Langeland N, et al. Perceived food intolerance and irritable bowel syndrome in a population 3 years after a giardiasis-outbreak: A historical cohort study. BMC Gastroenterol. 2015;15(1):164. https://doi.org/10.1186/s12876-015-0393-0 [ Links ]
33. Vakhshoori M, Saneei P, Esmaillzadeh A, Daghaghzadeh H, Hassanzadeh Keshteli A, Adibi P. The association between meal and snack frequency and irritable bowel syndrome. Public Health Nutr. 2021;24(13):4144-55. https://doi.org/10.1017/S1368980020002967 [ Links ]
34. De Petrillo A, Hughes LD, McGuinness S, Roberts D, Godfrey E. A systematic review of psychological, clinical and psychosocial correlates of perceived food intolerance. J Psychosom Res. 2021;141:110344. https://doi.org/10.1016/j.jpsychores.2020.110344 [ Links ]
35. Melchior C, Algera J, Colomier E, Törnblom H, Simrén M, Störsrud S. Food Avoidance and Restriction in Irritable Bowel Syndrome: Relevance for Symptoms, Quality of Life and Nutrient Intake. Clin Gastroenterol Hepatol. 2022;20(6):1290-1298.e4. https://doi.org/10.1016/j.cgh.2021.07.004 [ Links ]
36. Hayes P, Corish C, O’Mahony E, Quigley EMM. A dietary survey of patients with irritable bowel syndrome. J Hum Nutr Diet. 2014;27 Suppl 2:36-47. https://doi.org/10.1111/jhn.12114 [ Links ]
37. Böhn L, Störsrud S, Simrén M. Nutrient intake in patients with irritable bowel syndrome compared with the general population. Neurogastroenterol Motil. 2013;25(1):23-30.e1. https://doi.org/10.1111/nmo.12001 [ Links ]
38. Alvarado J, Otero W, Jaramillo M, Roa P, Puentes G, Jimenez A, Grillo F, Pardo R, Sabbagh LC. Guía de práctica clínica para el diagnóstico y tratamiento del síndrome de intestino irritable en la población adulta. Revista. colomb. Gastroenterol. 2015;30(Suppl1):43-56. [ Links ]
39. Ferreira AI, Garrido M, Castro-Poças F. Irritable Bowel Syndrome: News from an Old Disorder. GE Port J Gastroenterol. 2020;27(4):255-68. https://doi.org/10.1159/000503757 [ Links ]
40. Guía de consulta de los criterios diagnósticos del DSM-5. Arlington, VA: Asociación Americana de Psiquiatría, 2013. [ Links ]
41. McGowan A, Harer KN. Irritable Bowel Syndrome and Eating Disorders: A Burgeoning Concern in Gastrointestinal Clinics. Gastroenterol Clin North Am. 2021;50(3):595-610. https://doi.org/10.1016/j.gtc.2021.03.007 [ Links ]
42. Mari A, Hosadurg D, Martin L, Zarate-Lopez N, Passananti V, Emmanuel A. Adherence with a low-FODMAP diet in irritable bowel syndrome: Are eating disorders the missing link? Eur J Gastroenterol Hepatol. 2019;31(2):178-82. https://doi.org/10.1097/MEG.0000000000001317 [ Links ]
43. Kayar Y, Agin M, Dertli R, Kurtulmus A, Boyraz RK, Onur NS, et al. Eating disorders in patients with irritable bowel syndrome. Gastroenterol Hepatol. 2020;43(10):607-13. https://doi.org/10.1016/j.gastrohep.2020.03.001 [ Links ]
44. Hanel V, Schalla MA, Stengel A. Irritable bowel syndrome and functional dyspepsia in patients with eating disorders - a systematic review. Eur Eat Disord Rev. 2021;29(5):692-719. https://doi.org/10.1002/erv.2847 [ Links ]
45. Akhondi N, Memar Montazerin S, Soltani S, Saneei P, Hassanzadeh Keshteli A, Esmaillzadeh A, et al. General and abdominal obesity in relation to the prevalence of irritable bowel syndrome. Neurogastroenterol Motil. 2019;31(4):e13549. https://doi.org/10.1111/nmo.13549 [ Links ]
46. Wang Y, Kasper LH. The role of microbiome in central nervous system disorders. Brain Behav Immun. 2014;38:1-12. https://doi.org/10.1016/j.bbi.2013.12.015 [ Links ]
47. Cryan JF, O’riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen TFS, Boehme M, et al. The microbiota-gut-brain axis. Physiol Rev. 2019;99(4):1877-2013. https://doi.org/10.1152/physrev.00018.2018 [ Links ]
48. Malagelada JR. The Brain-Gut Team. Dig Dis. 2020;38(4):293-8. https://doi.org/10.1159/000505810 [ Links ]
49. Slyepchenko A, Maes M, Jacka FN, Köhler CA, Barichello T, McIntyre RS, et al. Gut Microbiota, Bacterial Translocation, and Interactions with Diet: Pathophysiological Links between Major Depressive Disorder and Non-Communicable Medical Comorbidities. Psychother Psychosom. 2016;86(1):31-46. https://doi.org/10.1159/000448957 [ Links ]
50. Pimentel M, Lembo A. Microbiome and Its Role in Irritable Bowel Syndrome. Dig Dis Sci. 2020;65(3):829-39. https://doi.org/10.1007/s10620-020-06109-5 [ Links ]
51. Xiao L, Liu Q, Luo M, Xiong L. Gut Microbiota-Derived Metabolites in Irritable Bowel Syndrome. Front Cell Infect Microbiol. 2021;11:729346. https://doi.org/10.3389/fcimb.2021.729346 [ Links ]
52. Sullivan EL, Riper KM, Lockard R, Valleau JC. Maternal High-Fat Diet Programming of the Neuroendocrine System and Behavior. Physiol Behav. 2012;43(2):145-53. https://doi.org/10.1016/0031-9384(88)90230-2 [ Links ]
53. Rogers GB, Keating DJ, Young RL, Wong ML, Licinio J, Wesselingh S. From gut dysbiosis to altered brain function and mental illness: Mechanisms and pathways. Mol Psychiatry. 2016;21(6):738-48. https://doi.org/10.1038/mp.2016.50 [ Links ]
54. Gaspar P, Cases O, Maroteaux L. The developmental role of serotonin: News from mouse molecular genetics. Nat Rev Neurosci. 2003;4(12):1002-12. https://doi.org/10.1038/nrn1256 [ Links ]
55. Ghaisas S, Maher J, Kanthasamy A. Gut microbiome in health and disease: Linking the microbiome-gut-brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases. Pharmacol Ther. 2016;158:52-62. https://doi.org/10.1016/j.pharmthera.2015.11.012 [ Links ]
56. El-Salhy M, Gundersen D, Gilja OH, Hatlebakk JG, Hausken T. Is irritable bowel syndrome an organic disorder? World J Gastroenterol. 2014;20(2):384-400. https://doi.org/10.3748/wjg.v20.i2.384 [ Links ]
57. Zydecka KS-, Ka K. Gut Biofactory-Neurocompetent Metabolites within the Gastrointestinal Tract. A Scoping Review. Nutrients. 2020;12(11):3369. https://doi.org/10.3390/nu12113369 [ Links ]
58. Mishima Y, Ishihara S. Enteric microbiota-mediated serotonergic signaling in pathogenesis of irritable bowel syndrome. Int J Mol Sci. 2021;22(19):10235. https://doi.org/10.3390/ijms221910235 [ Links ]
59. Tana C, Umesaki Y, Imaoka A, Handa T, Kanazawa M, Fukudo S. Altered profiles of intestinal microbiota and organic acids may be the origin of symptoms in irritable bowel syndrome. Neurogastroenterol Motil. 2010;22(5) 512-9, e114-5. https://doi.org/10.1111/j.1365-2982.2009.01427.x [ Links ]
60. Farup PG, Rudi K, Hestad K. Faecal short-chain fatty acids - a diagnostic biomarker for irritable bowel syndrome? BMC Gastroenterol. 2016;16(1): 51. https://doi.org/10.1186/s12876-016-0446-z [ Links ]
61. Spiller R. Serotonergic agents and the irritable bowel syndrome: what goes wrong? Curr Opin Pharmacol. 2008;8(6):709-14. https://doi.org/10.1016/j.coph.2008.07.003 [ Links ]
62. Park JM, Choi MG, Park JA, Oh JH, Cho YK, Lee IS, et al. Serotonin transporter gene polymorphism and irritable bowel syndrome. Neurogastroenterol Motil. 2006;18(11):995-1000. https://doi.org/10.1111/j.1365-2982.2006.00829.x [ Links ]
63. Wang YM, Chang Y, Chang YY, Cheng J, Li J, Wang T, et al. Serotonin transporter gene promoter region polymorphisms and serotonin transporter expression in the colonic mucosa of irritable bowel syndrome patients. Neurogastroenterol Motil. 2012;24(6): :560-5, e254-5. https://doi.org/10.1111/j.1365-2982.2012.01902.x [ Links ]
64. Zhang ZF, Duan ZJ, Wang LX, Yang D, Zhao G, Zhang L. The serotonin transporter gene polymorphism (5-HTTLPR) and irritable bowel syndrome: A meta-analysis of 25 studies. BMC Gastroenterol. 2014;14: 23. https://doi.org/10.1186/1471-230X-14-23 [ Links ]
65. Grzesiak M, Beszłej JA, Waszczuk E, Szechiński M, Szewczuk-Bogusławska M, Frydecka D, et al. Serotonin-related gene variants in patients with irritable bowel syndrome and depressive or anxiety disorders. Gastroenterol Res Pract. 2017;2017:4290430. https://doi.org/10.1155/2017/4290430 [ Links ]
66. Keszthelyi D, Troost FJ, Jonkers DM, van Eijk HM, Dekker J, Buurman WA, et al. Visceral hypersensitivity in irritable bowel syndrome: Evidence for involvement of serotonin metabolism - a preliminary study. Neurogastroenterol Motil. 2015;27(8):1127-37. https://doi.org/10.1111/nmo.12600 [ Links ]
67. Mujakovic S, ter Linde JJM, de Wit NJ, van Marrewijk CJ, Fransen GAJ, Onland-Moret NC, et al. Serotonin receptor 3A polymorphism c.-42C > T is associated with severe dyspepsia. BMC Med Genet. 2011;12:140. https://doi.org/10.1186/1471-2350-12-140 [ Links ]
68. Weltens N, Iven J, Van Oudenhove L, Kano M. The gut-brain axis in health neuroscience: implications for functional gastrointestinal disorders and appetite regulation. Ann N Y Acad Sci. 2018;1428(1):129-50. https://doi.org/10.1111/nyas.13969 [ Links ]
69. de Weerth C. Do bacteria shape our development? Crosstalk between intestinal microbiota and HPA axis. Neurosci Biobehav Rev. 2017;83:458-71. https://doi.org/10.1016/j.neubiorev.2017.09.016 [ Links ]
70. Bremner JD, Moazzami K, Wittbrodt MT, Nye JA, Lima BB, Gillespie CF, et al. Diet, stress and mental health. Nutrients. 2020; 12(8):2428. https://doi.org/10.3390/nu12082428 [ Links ]
71. Irritable bowel syndrome in adults: diagnosis and management. Clinical guideline. Gastroenterology. NICE; 2008. [ Links ]
72. McKenzie YA, Bowyer RK, Leach H, Gulia P, Horobin J, O’Sullivan NA, et al. British Dietetic Association systematic review and evidence-based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):549-75. https://doi.org/10.1111/jhn.12385 [ Links ]
73. Moayyedi P, Andrews CN, MacQueen G, Korownyk C, Marsiglio M, Graff L, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol. 2019;2(1):6-29. https://doi.org/10.1093/jcag/gwy071 [ Links ]
74. Settanni CR, Ianiro G, Ponziani FR, Bibbò S, Cammarota G, Gasbarrini A, et al. COVID-19 as a trigger of irritable bowel syndrome: A review of potential mechanisms. World J Gastroenterol. 2021;27(43):7433-45. https://doi.org/10.3748/wjg.v27.i43.7433 [ Links ]
75. Gill S, Adenan AM, Ali A. Living through the COVID-19 Pandemic : Impact and Lessons on Dietary Behavior and Physical Well-Being. Int J Environ Res Public Health. 2022;19(2):642. https://doi.org/10.3390/ijerph19020642 [ Links ]
76. Remes-Troche JM, Coss-Adame E, Amieva-Balmori M, Velarde-Ruiz Velasco JA, Gómez-Castaños PC, Flores-Rendón R, et al. Incidence of “new-onset” constipation and associated factors during lockdown due to the COVID-19 pandemic. BMJ Open Gastroenterol. 2021;8(1):e000729. https://doi.org/10.1136/bmjgast-2021-000729 [ Links ]
77. Hod K, Ringel Y. Probiotics in functional bowel disorders. Best Pract Res Clin Gastroenterol. 2016;30(1):89-97. https://doi.org/10.1016/j.bpg.2016.01.003 [ Links ]
78. Rodiño-Janeiro BK, Vicario M, Alonso-Cotoner C, Pascua-García R, Santos J. A Review of Microbiota and Irritable Bowel Syndrome: Future in Therapies. Adv Ther. 2018;35(3):289-310. https://doi.org/10.1007/s12325-018-0673-5 [ Links ]
79. Ford AC, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. Effect of antidepressants and psychological therapies, including hypnotherapy, in irritable bowel syndrome: systematic review and meta-analysis. Am J Gastroenterol. 2014;109(9): 1350-65; quiz 1366. https://doi.org/10.1038/ajg.2014.148 [ Links ]
80. Lacy BE, Pimentel M, Brenner DM, Chey WD, Keefer LA, Long MD, et al. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2021;116(1):17-44. https://doi.org/10.14309/ajg.0000000000001036 [ Links ]
Citación: Vergara-Alvira MS, Ahumada-Ossa LM, Poveda-Espinosa E. Estrés, depresión, ansiedad y el hábito alimentario en personas con síndrome de intestino irritable. Revista. colomb. Gastroenterol. 2022;37(4):369-382. https://doi.org/10.22516/25007440.899
Recibido: 07 de Abril de 2022; Aprobado: 22 de Agosto de 2022











 texto en
texto en 



