Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.2 Santa Marta jul./dic. 2021 Epub 03-Dic-2021
https://doi.org/10.25268/bimc.invemar.2021.50.2.1066
Artículos de Investigación
Conservación de la tortuga carey (Eretmochelys imbricata) en Rincón del Mar, Colombia
1Universidad de los Andes, Bogotá, Colombia. nicolas.r.gar@gmail.com
2Corporación Autónoma Regional de Sucre- CARSUCRE . Sincelejo, Colombia. rafalvarez1227@gmail.com
3Corporación para el Desarrollo de la Costa Caribe - CORPOCARIBE, Sincelejo, Colombia. ramirezgallego.cristian@gmail.com
4Corporación Autónoma Regional de Sucre - CARSUCRE. Sincelejo, Colombia. truiz@carsucre.gov.co
5Fundación Tortugas del Mar - FTM y Wider Caribbean Sea Turtle Conservation Network - WIDECAST. Envigado, Antioquia, Colombia. karla.barrientos@udea.edu.co
The conservation and nesting ecology of the hawksbill turtle (Eretmochelys imbricata) are described, as a result of a systematic monitoring between 2018 and 2019 in the municipality of Rincón del Mar, San Onofre, Sucre. Six hawksbill turtle nests were recorded in situ, one nest was poached by humans. The nesting female spawned a total of 761 eggs in five clutches (mean 152.2 ± 15.5 eggs per clutch). Mean hatching success was 78.2 ± 12.4 % and the mean emergence success was 74.7 ± 14.1 % (n = 5). The mean incubation period was 54 ± 7.8 days (n = 4). 591 hatchlings were released into the sea, of which 22 (3.72 %) were rescued and released with the community. In addition, physical measurements of the nests (width, depth, distance to the beach) and morphometric measurements of the hatchlings (SCW, SLC and weight) were carried out. Finally, 14 natural and anthropogenic threats were identified for the species in Rincón del Mar and different degrees of threat, according to the beach sector, being high, medium and low for Chichimán, Ana Gómez and Balsillas with Punta Gorda respectively. Our results contribute to the knowledge of the current status of the hawksbill turtle, as well as the importance of the community participation, systematic and standardized monitoring, and the urgency of generating plans and management units for their conservation in Rincón del Mar.
KEYWORDS: hawksbill turtle; conservation; nesting ecology; hatching success; Colombian Caribbean.
Se describen los procesos de conservación y ecología de anidación de la tortuga carey (Eretmochelys imbricata), producto del monitoreo sistemático entre 2018 y 2019 en el corregimiento de Rincón del Mar, San Onofre, Sucre. Se registraron seis nidadas de tortuga carey, todos fueron dejadas in situ y un nido fue saqueado por humanos. Las hembras desovaron un total de 761 huevos en cinco nidadas (promedio ± DE: 152,2 ± 15,5 huevos por nidada). El éxito de eclosión fue en promedio 78,2 ± 12,4 % y el éxito de emergencia fue en promedio 74,7 ± 14,1 % (n = 5). El periodo de incubación fue en promedio de 54 ± 7,8 días (n = 4). Fueron liberadas 591 crías al mar, de las cuales 22 (3,72 %), fueron rescatadas y liberadas con la comunidad. Además, se realizaron mediciones físicas de los nidos (ancho, profundidad, distancia a la playa), medidas morfométricas de los neonatos (ARC, LRC y peso) y se identificaron amenazas en el sector. Nuestros resultados contribuyen al conocimiento del estado actual de la tortuga carey, así como lo indispensable de la participación comunitaria para su conservación en Rincón del Mar.
PALABRAS CLAVE: tortuga carey; conservación; ecología de anidación; éxito de eclosión; Caribe colombiano.
INTRODUCCIÓN
La tortuga carey (Eretmochelys imbricata) se encuentra categorizada En Peligro Crítico de extinción por La Unión Internacional para la Conservación de la Naturaleza (UICN) y en el libro Rojo de reptiles de Colombia (Meylan y Donelly 1999; Mortimer y Donelly, 2008; Barrientos-Muñoz et al., 2015). Adicionalmente, se encuentra en el Apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres, CITES (Rhodin et al., 2018), en los Apéndices I y II de la Convención sobre la Conservación de las Especies Migratorias de Animales Silvestres, CMS, y en el Anexo II del Protocolo Relativo a las Áreas y Flora Fauna Silvestres Especialmente Protegidas, SPAW (Barrientos-Muñoz et al., 2020).
Sin embargo, a pesar de estar protegida por leyes y tratados nacionales e internacionales, es la tortuga marina con mayor presión antrópica (Meylan y Donelly 1999; Mortimer y Donelly, 2008; Barrientos-Muñoz et al., 2015). Además del consumo de su carne y huevos, el tráfico ilegal de su caparazón para la elaboración de artesanías, utensilios de cocina y espuelas para peleas de gallos, es la principal razón de su estado crítico a nivel mundial y local (Meylan, 1999; Reuter y Allan, 2006; Barrientos-Muñoz et al., 2015, 2020; Ramírez-Gallego y Barrientos-Muñoz, 2020, 2021 ).
En Colombia, la tortuga carey es la especie con mayor distribución en playas de anidación en el mar Caribe, teniendo presencia en todos los departamentos de la cuenca, pero con la menor abundancia de nidos por temporada y sin estudios poblacionales exclusivos para la especie (Ceballos-Fonseca, 2004; Barrientos-Muñoz et al., 2015). Los aportes al conocimiento de la tortuga carey están relacionados con avistamientos en sitios de anidación y/o en el agua de manera esporádica, mientras se monitorean otras especies, no necesariamente tortugas marinas (McCormick, 1997, 1998; Rincón et al., 2001; Arcos et al., 2002; Ceballos-Fonseca, 2004; Rincón-Díaz y Rodríguez-Zárate, 2004; Barrientos-Muñoz et al., 2015).
Ahora bien, aunque no existen estudios poblacionales de la especie en Rincón del Mar, en el Caribe colombiano la temporada de anidación de la tortuga carey se extiende desde abril hasta noviembre (Kaufmann, 1967) con dos picos de anidación en mayo y septiembre (Barrientos-Muñoz et al., 2015). En la actualidad el departamento con mayor anidación de la tortuga carey en Colombia es el Archipiélago de San Andrés, Providencia y Santa Catalina (Eckert y Eckert, 2019; Ramírez-Gallego y Barrientos-Muñoz, 2020b; Barrientos-Muñoz et al., 2020).
Por su lado, en la subregión de Morrosquillo, departamento de Sucre, históricamente se han registrado de manera esporádica nidos de la tortuga carey en El Francés, isla Palma, Punta Seca, Balsillas y Altos de Julio (Rueda, 1987; Ceballos-Fonseca, 2004; Caraballo et al., 2008; Duque et al., 2011; Barrientos-Muñoz et al., 2015). Además de las zonas de anidación, la presencia de extensas praderas de pastos marinos y arrecifes coralinos ha permitido identificar múltiples etapas de vida de las tortugas marinas en zonas de alimentación, descanso y/o reproducción (Rincón-Díaz y Rodríguez-Zárate, 2004; Moncada et al., 2019). La diversidad de hábitats marinos y playas son cruciales para la conservación de tortugas marinas en esta amplia región (Rincón-Díaz y Rodríguez-Zárate, 2004; Moncada et al., 2019). Sin embargo, la pesca dirigida para el uso de su caparazón, consumo y venta de carne y/o huevos, pérdida de hábitat, erosión costera y la contaminación por plásticos son algunas de las principales amenazas que enfrentan las tortugas carey (Caraballo et al., 2008; Barrientos-Muñoz et al., 2015 , 2020).
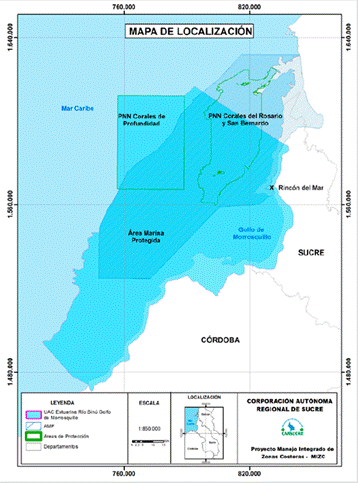
La Unidad Ambiental Costera Estuarina del Río Sinú́ y Golfo de Morrosquillo, como unidad de planificación costera, incluye áreas protegidas a nivel nacional y regional que integran Subsistema de Áreas Marinas Protegidas (SAMP): PNN Corales del Rosario y San Bernardo, PNN Corales de Profundidad, DRMI Bahía Cispata, La Balsa, Tinajones y sectores vecinos al delta río Sinú, PNR Boca de Guacamayas, DRMI Ciénaga de la Caimanera y, en proceso de declaratoria, el DRMI Sabanetica, Chichimán, Rincón del Mar y Berrugas (Carsucre) (Figura 1). Dando cumplimiento a las metas Aichi de aumentar 10% las áreas protegidas para el año en curso y permitiendo fortalecer el Sistema Nacional de Áreas Protegidas (SINAP) y la Política Nacional Ambiental para el Desarrollo Sostenible de los Espacios Oceánicos y Zonas Costeras e Insulares de Colombia (PNAOCI), lo cual se convierte en un mecanismo para la protección de la biodiversidad marina y costera, incluidas las tortugas marinas (INVEMAR-CVS, 2012; SIRAP, 2013; Cardique et al., 2016).
Desde hace cinco años la Corporación Autónoma Regional de Sucre, Carsucre, ha realizado esfuerzos en control y vigilancia para reducir el uso de redes tortugueras en su jurisdicción. En isla Boquerón han sido identificados puntos de caladeros para la captura dirigida de tortugas marinas (Chelonia mydas y Eretmochelys imbricata) para su consumo y comercialización (Carsucre , 2017). Por lo cual, continuar con esfuerzos de control, vigilancia y aportes para el conocimiento de las tortugas marinas en Sucre es urgente.
Después de una década, en 2018, se registran de nuevo nidos de tortuga carey para Rincón del Mar. Por esta razón, se implementa en el marco del proyecto “Manejo integrado de la UAC estuarina río Sinú-Golfo de Morrosquillo” de Carsucre y la Fundación Tortugas del Mar el proceso de fortalecimiento comunitario, educación ambiental y monitoreo sistemático de la anidación de la tortuga carey en Rincón del Mar. Durante las temporadas de anidación de 2018 y 2019 se realizó el monitoreo sistemático para aportar al conocimiento de la ecología de anidación de la tortuga carey en Rincón del Mar.
ÁREA DE ESTUDIO
Rincón del Mar (9º 46,5’, 23” N, 75º 38,31’, 30” O) se encuentra localizado en el municipio de San Onofre, Sucre (Figura 2). Presenta un clima seco, con temperaturas entre 24º C y 38° C, con precipitaciones que oscilan entre 800 y 1000 mm anuales y un régimen de lluvias bimodal. Con dos períodos secos de diciembre a abril y junio a julio, los meses restantes son lluviosos (Cusado-Zapa y González -Pérez, 2010).
Su litoral costero se caracteriza por tener playas intermedias, con alta energía de oleaje y poca pendiente. La arena tiene tonalidades cremosas-pardas y están compuestas por materiales carbonatados de tamaño grueso, 27,7 % (DE = 0,5 mm), y mediano, 56 % (DE = 0,25 mm) (Caraballo et al., 2008).
En esta área se presentan asentamientos humanos destinados principalmente a la actividad turística y en algunos lugares persisten ecosistemas de manglar dominados por mangle rojo (Rhizophora mangle) y mangle blanco (Laguncularia racemosa), además de otras especies como uvita de playa (Coccoloba uvifera), clemón (Thespesia populnea), lirio de playa (Hymenocallis caribaea) y almendro (Terminalia catappa), con una distribución más limitada (Ulloa et al., 2016). En el área marina circundante se encuentran ecosistemas conformados por praderas de fanerógamas y arrecifes de coral, que han sido identificados como zonas de alimentación y reproducción de las tortugas marinas que transitan por el área (Rincón-Díaz y Rodríguez-Zárate, 2004).
MATERIALES Y MÉTODOS
Monitoreo
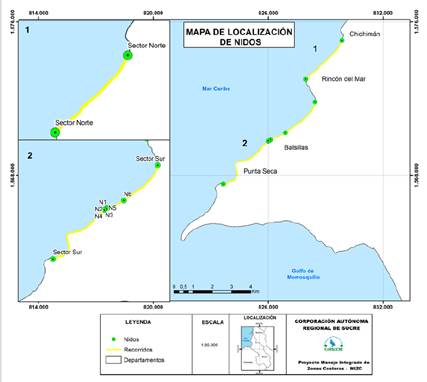
Se realizaron patrullajes diurnos y nocturnos entre julio-septiembre de 2018 y 2019 (meses en los cuales hay una mayor probabilidad de anidación de acuerdo con los expertos locales). Los patrullajes se dividieron en dos sectores, el sector norte comprendido entre las playas de Punta Rincón y Chichimán (9° 46’ 26,43” N, 75° 38’ 43,54” O - 9° 47’ 32,43” N, 75° 37’ 41,76” O) con una extensión de 2,8 km. El segundo sector corresponde a la parte sur entre Balsillas y la boca de Ana Gómez (9° 45’ 47,53” N, 75° 38’ 27,36” O - 9° 43’ 27,66” N, 75° 41’ 3,95” O) con una extensión de 6,9 km. El sector norte se monitoreó durante un corto tiempo debido a la escasa actividad de las tortugas y problemas de orden público (Figura 2). Los patrullajes nocturnos se realizaron entre 20:00 y 23:00 h en búsqueda de rastros y/o hembras anidantes. Los patrullajes diurnos se realizaron entre 5:00 y 8:00 h para el registro de huellas de tortugas en caso de no haber avistado en la noche anterior y verificar los eventos de anidación exitosos.
Registro y protección de nidos
Todos los nidos registrados fueron dejados in situ y vigilados diariamente en horas de la noche y en las mañanas. Al momento de identificar un nido, éste se señalizaba, se registraba su ubicación geográfica con un GPS (Gpsmap 64S), la hora y fecha de puesta, y la distancia al punto más alto de marea. Posteriormente, los nidos se protegieron con encierros de malla plástica con dimensiones de 2 x 2 m y 60 cm de alto. A las nidadas que en el transcurso del periodo de incubación presentaron evidente exposición al oleaje, se les construyeron barreras con sacos rellenos de arena de la misma playa, la cual era nuevamente depositada al culminar el proceso.
Luego de 40 días de incubación, se revisaron varias veces al día, para inspeccionar evidencia de emergencia de las crías. Cuando se observaron huellas de crías salidas de un nido, se esperaron varias horas y hasta un máximo de 24 horas para realizar la excavación.
Productividad de las nidadas
Posterior a que las crías emergieran de los nidos hacia el mar, se esperaron 24 h para realizar la excavación y determinar el éxito de eclosión y de emergencia. Durante las excavaciones se contaron los cascarones vacíos (˃ 50 % completa) (C), huevos sin desarrollo aparente (HSDA), embriones a término no eclosionados (ETNE), huevos depredados (D), crías vivas encontradas atrapadas y/o por debajo del cuello del nido (V), crías muertas que lograron salir del cascarón (M) y huevos no eclosionados (HNE) (Miller, 1999), los cuales se clasificaron dentro de cuatro categorías de estadios embrionarios (Chacón et al., 2007).
Se estimó el éxito de la eclosión utilizando la fórmula: Éxito de Eclosión (%) = C / (C + HSDA + HNE + ETNE + D) * 100. A su vez, se calculó el éxito de emergencia usando la fórmula, Éxito Emergencia (%) = C - (V + M) / (C + HSDA + HNE + ETNE + D) * 100 (Miller, 1999).
Las crías vivas atrapadas dentro del nido fueron rescatadas y liberadas en horas frescas de la madrugada o al anochecer en compañía de la comunidad de Rincón del Mar. Luego de la exhumación se midió la profundidad, ancho y distancia a la línea de marea de cada nido. Además de anotaciones en campo sobre la flora y fauna asociada a la nidada.
Biometría de crías
Se tomaron diez crías por nidada, a las cuales se les registró el peso con una balanza digital (Digital Pocket MH-500; precisión: 0,1 g), y con un calibrador pie de rey plástico de 15 cm (CLP06U; precisión: 0,05 mm), fueron tomados los datos biométricos: largo recto del caparazón (LRC), ancho recto del caparazón (ARC) (Chacón et al., 2007) y posteriormente fueron liberadas.
Educación ambiental
Se conformaron dos grupos de trabajo con expertos locales para el monitoreo participativo en los sectores sur y norte. Además, se realizaron talleres de sensibilización, fortalecimiento, liberación de tortugas y limpiezas de playa incluyendo a la comunidad de Rincón del Mar.
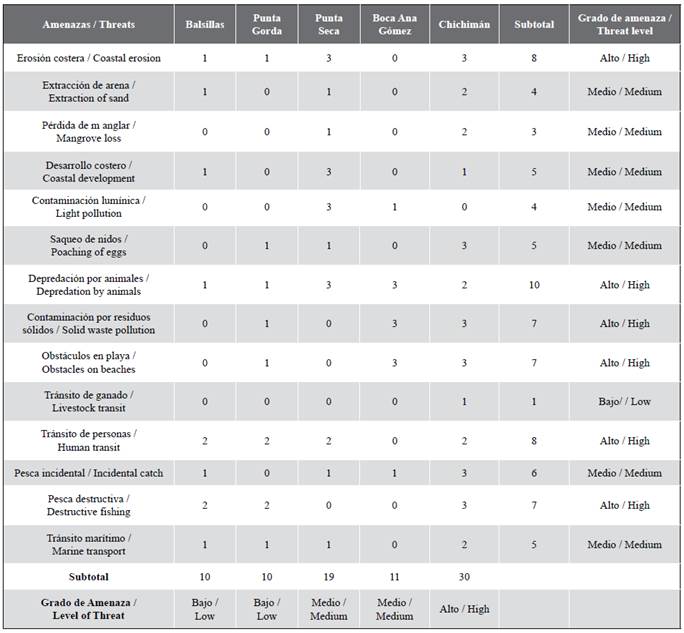
Amenazas
Las amenazas naturales y antrópicas se identificaron mediante los recorridos en campo e información suministrada por Carsucre en sus labores de control y vigilancia de la zona. Los datos obtenidos como tensores fueron registrados en una tabla y evaluados en una escala de cero a tres grados (Ninguno: 0, Bajo: 1, Medio: 2, Alto: 3), de acuerdo con la metodología realizada por Rincón- Díaz y Rodríguez-Zárate (2004).
RESULTADOS
Monitoreo
Durante los dos años de monitoreo se emplearon 246 días (julio-octubre) con un esfuerzo de 6 h/día para un total de 1 476 h para los patrullajes diurnos y nocturnos durante las temporadas de anidación 2018 y 2019.
Registro y protección de nidos
Se registraron en total seis nidos de tortuga carey, de los cuales cinco fueron registrados en 2018 y uno en 2019, entre los meses de julio-septiembre. Un nido (20 %) fue saqueado en 2018 para su consumo. Mientras que en la temporada 2019 no se presentó saqueo de nidadas. Las playas frecuentadas por las hembras anidantes fueron las del sector sur (entre Balsillas y la Boca de Ana Gómez), con 100 % de las nidadas desovadas (Figura 2).
Productividad de las nidadas
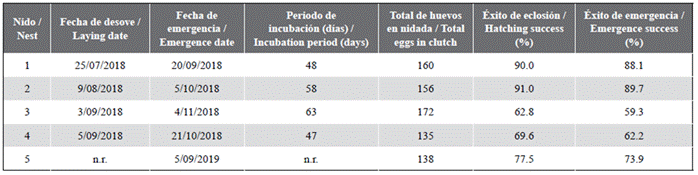
Un total de 761 huevos fueron desovados con un promedio de 152,2 ± 15,5 huevos por nidada (n = 5; Tabla 1). Se registraron 591 crías liberadas al mar, de las cuales 569 crías emergieron por sí solas y 22 crías (3,72 %) fueron rescatadas de entre raíces, huevos y cascarones.
El promedio del éxito de eclosión fue 78,2 ± 12,4 % (rango 62,8 - 91,0; n = 5) (Tabla 1) y el promedio del éxito de emergencia fue 74,7 ± 14,1 % (rango 59,3 - 89,7; n = 5) (Tabla 1). El período de incubación para la emergencia promedio fue de 54 ± 7,8 días (rango 47 - 63; n = 4) (Tabla 1).
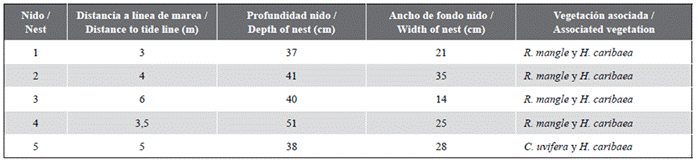
Tabla 1 Productividad de las nidadas de E. imbricata en Rincón del Mar, Sucre. n.r. = no registrado.
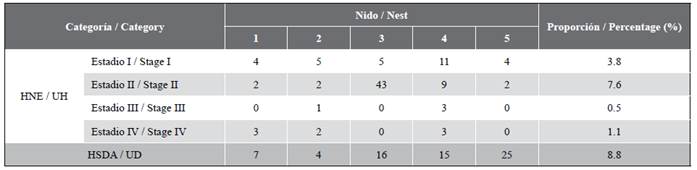
La principal mortalidad durante el periodo de incubación ocurrió en la fase de desarrollo embrionario (13 %), mientras que los huevos sin desarrollo aparente (HSDA) representaron 8,8 % (n = 5 nidos; Tabla 2).
Tabla 2 Categorías HNE (subdividido en Estadios I, II, III y IV) y HSDA para las exhumaciones de nidadas de E. imbricata en Rincón del Mar, Sucre.
El tamaño de los nidos fue de 41,4 ± 5,6 cm de profundidad y 24,6 ± 7,8 cm de ancho, con una distancia a la línea de marea de 9,7 ± 12,5 m (n = 5; Tabla 3). Las nidadas 1, 2, 3 y 4 fueron desovadas entre R. mangle y H. caribaea rodeadas por un mosaico de hábitats estructurados por un complejo lagunar ubicado de forma paralela a la línea de costa, de manera que los huevos de la parte inferior de las nidadas alcanzaron a tener contacto con el nivel freático. Por su parte el nido 5, se encontró debajo de C. uvifera y H. caribaea (Tabla 3). En general, se encontraron bajo sombra proporcionada por el dosel de los árboles y cubiertos de hojarasca.
La fauna silvestre observada con influencia en el área de anidación fueron principalmente aves de las especies Megaceryle torquata, Pelecanus occidentalis, Quiscalus mexicanus, Egretta tricolor, E. thula, Milvago chimachima, Sterna hirundo, Thalasseus maximus, T. sandvicensi y Fregata magnificens. Sobre mastofauna se presenció a la especie Procyon cancrivorus, además de rastros de animales domésticos como perros y cerdos.
Biometría de crías
Se tomaron diez crías de una nidada con valores promedio de LRC de 4,0 (± 0,4) cm, de ARC de 2,9 (± 0,2) cm y peso total de 15,4 (± 0,5) g (Tabla 4).
Educación ambiental
Se conformó el grupo “Guardianes de las Tortugas de Rincón del Mar” con su logo e implementos para los patrullajes diurnos y nocturnos, con el fin de fortalecer su sentido de pertenencia y establecer el monitoreo participativo comunitario. Doce personas mayores de edad hicieron parte del grupo.
Un total de ocho talleres y capacitaciones sobre la biología de las tortugas marinas, técnicas de monitoreo y manejo fueron llevados a cabo con público en general de Rincón del Mar. Un total de 24 personas participaron de los eventos de fortalecimiento. Un taller interinstitucional e intersectorial con pares internacionales fue llevado a cabo en el corregimiento de Rincón del Mar, con la participación de 5 entidades y 28 personas.
Dos liberaciones de crías fueron realizadas con la institución educativa de Rincón del Mar y el grupo Titanes Ecológicos. Un total de 30 personas entre niños y adultos de la comunidad hicieron parte de las liberaciones. Cuatro actividades de sensibilización fueron llevadas a cabo alrededor de Rincón del Mar con volantes y afiches en puntos estratégicos: tiendas y hoteles, para desestimar el consumo de carne y huevos de la tortuga carey, además del uso de su caparazón para la realización de artesanías, utensilios de cocina y espuelas de gallo. Finalmente, dos limpiezas de playa en el sector de Punta Gorda fueron llevadas a cabo con 12 personas de Rincón del Mar y un video informativo del proyecto fue uno de los productos de divulgación del proceso.
Amenazas
En 2019 se identificó el sacrificio de una hembra anidante en el sector norte (entre las playas de Punta Rincón y Chichimán) y en 2018 el robo de una nidada en el sector sur (entre Balsillas y la Boca de Ana Gómez). Además, se identificaron 14 amenazas naturales y antropogénicas en el corregimiento de Rincón del Mar. Por su “Alto” grado de amenaza, se destacaron: la erosión costera, depredación por animales domésticos (perros y cerdos) y silvestres (zorra manglera), contaminación por residuos sólidos, obstáculos en playa, tránsito de personas y pesca destructiva (Tabla 5). Al discriminar por playas se encontró, que las playas de Chichimán presentaron un grado “Alto” de amenaza, la boca de Ana Gómez grado “Medio” y un grado “Bajo” tanto en Balsillas como en Punta Gorda (Tabla 5).
DISCUSIÓN
El monitoreo sistemático diurno y nocturno de las zonas de anidación de la tortuga carey es indispensable para conocer el estado actual de la especie en el país. Por lo cual, al igual que Barrientos et al. (2015), se recomienda dar continuidad al monitoreo estandarizado de la especie en Rincón del Mar, para determinar la tendencia de la población reproductiva en el área. La frecuencia, tipo y esfuerzo en el monitoreo determinan la efectividad para identificar la situación actual de la especie y los esfuerzos donde los monitoreos deben de ser enfocados. Por lo tanto, en lugares de difícil acceso o con anidación esporádica como Rincón del Mar, los investigadores locales con base comunitaria son indispensables para llevar a cabo este monitoreo, que llevó al registro de seis nidadas durante los meses de mayor anidación.
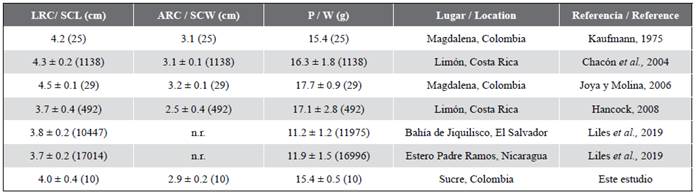
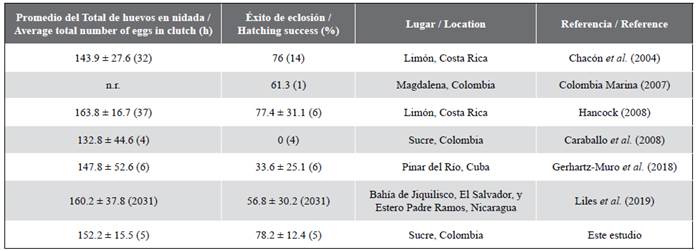
El tamaño de la nidada es similar a lo reportado por otros estudios con la tortuga carey en el Caribe y Pacífico (Tabla 6). El éxito de eclosión (78,2 %) en Rincón del Mar es superior a lo registrado por Chacón et al. (2004), Colombia Marina (2007), Hancock (2008), Gerhartz-Muro et al. (2019) y Liles et al. (2019), incluyendo una previa aproximación a la especie en el área por Caraballo et al. (2008) (Tabla 6), lo que sugiere que las playas de Rincón del Mar presentan características óptimas para que las nidadas tengan un desarrollo embrionario completo y una alta tasa de supervivencia de las nidadas. Algunos factores determinantes para la supervivencia de las nidadas son la humedad, la temperatura, el tipo de arena, la pendiente y extensión de la playa (Bolongaro et al., 2010; Piedra-Castro y Morales-Cerdas, 2015). Es probable que la presencia de la vegetación nativa de las playas de Rincón del Mar (Tabla 3) esté brindando las características ideales de una zona de anidación, que para esta especie son indispensables al desovar su nidada y mantener las condiciones microclimáticas estables.
Tabla 6 Resumen del total de huevos en nidadas (huevos), éxito de eclosión (%) (promedio ± DE y n) de E. imbricata de Rincón del Mar, Sucre y otros estudios realizados en el Caribe y Pacífico. n.r. = no registrado.
Por otra parte, las medidas biométricas de LRC de 4,0 ± 0,4 cm, de ARC de 2,9 ± 0,2 cm y peso total de 15,4 ± 0,5 g en Rincón del Mar son similares a lo registrado en otros estudios realizados en el Caribe y Pacífico (Kaufmann, 1975; Chacón et al., 2004; Joya y Molina, 2006; Hancock, 2008; Liles et al., 2019) (Tabla 4).
La educación ambiental, la participación de la comunidad de Rincón del Mar y el trabajo interinstitucional realizado fueron indispensables para la protección de los nidos in situ hasta el momento de la eclosión. El fortalecimiento comunitario sobre la importancia de la tortuga carey incentivó a la comunidad en apoyar acciones de conservación para la especie. La inclusión y la participación comunitaria son un paso importante hacia la conservación de las tortugas marinas, siendo fundamentales para el monitoreo, teniendo en cuenta la baja frecuencia de nidos en el sector y su significancia por la conectividad que representa con otras zonas marino costeras aledañas. Así como en otras partes del mundo, en donde los proyectos participativos en un largo periodo de tiempo han llevado a estabilizar o incluso incrementar las poblaciones de tortugas marinas (Godley et al., 2020), se espera que la continuidad de estos procesos logre afianzar el sentido de pertenencia por parte de la comunidad y un trabajo mancomunado con grupos y/o entidades protectoras del medio ambiente.
Finalmente, en cuanto a las amenazas para las zonas de anidación en Rincón del Mar, las más severas incluyen la erosión costera, la depredación de los nidos y la contaminación por desechos sólidos, las cuales también fueron identificadas previamente por Caraballo et al. (2008) y por Rincón-Díaz y Rodríguez-Zárate (2004) en el archipiélago de San Bernardo. En el corregimiento de Rincón del Mar la erosión costera presenta una vulnerabilidad de media a alta (Corporación Ecoversa , 2018), principalmente en el sector norte hacia Chichimán, a pesar de tener las playas más extensas y con cobertura vegetal consolidada (Caraballo et al., 2008). El mayor grado de amenaza encontrado en Chichimán es ocasionado probablemente por una acelerada pérdida de barreras naturales de la línea costera, como manglares, pastos marinos y formaciones coralinas, sumada a la limitada intervención de las autoridades por el contexto social que aún persiste en la región . De igual manera, en el sector de Punta Gorda, debido a la erosión se necesitaron sacos de arena para evitar que dos de los nidos fueran lavados por el mar.
Respecto a la depredación de los nidos, la presencia de animales domésticos como los perros y cerdos en las playas de anidación es alarmante, ya que pone en riesgo las colonias anidantes de tortugas marinas (Kontos 1985, 1987, 1988; Richardson, 1990; Suganuma, 2005; Andrews et al., 2006; Meylan et al., 2006; Whytlaw, 2013; Engeman et. al. 2016, 2019). Por otro lado, el consumo y comercialización de nidadas de tortugas marinas también sigue siendo una práctica común, como en otros lugares del país, incluso en áreas bajo alguna figura de protección (Rincón-Díaz y Rodríguez-Zárate, 2004; Barrientos et al., 2013 , 2014, 2015, 2020; Moreno-Munar et al., 2014 ). Un ejemplo de ésto es lo ocurrido durante este estudio, en donde, a pesar de haberse instalado encierros demarcados sobre los nidos, uno de éstos fue saqueado. Lo que demuestra el alto grado de exposición a la depredación por especies foráneas o humanos y la necesidad de continuar con labores de monitoreo, protección y sensibilización en el área.
La captura de adultos para consumo y comercialización del caparazón para el tráfico de carey es también una amenaza para la especie en Rincón del Mar (Caraballo et al., 2008), como en el resto de la costa Caribe de Colombia, siendo el segundo país con mayor captura de tortuga carey en el mundo, con un estimado de más de 600 tortugas por año (Campbell, 2014; Humber et al., 2014; Barrientos et al., 2015, 2020; Ramírez-Gallego y Barrientos-Muñoz, 2020a, 2021). En el caso de Sucre, la isla de Boquerón se ha identificado como el centro de mayor captura de tortugas verde y carey de manera directa empleando redes tortugueras (Rincón-Díaz y Rodríguez-Zárate, 2004) y en Sabanetica por captura incidental en redes agalleras. Para combatir esto, Carsucre (2017) en su jurisdicción ha decomisado 6600 m de redes tortugueras en 2015-2017 y ha propuesto la declaratoria del DRMI Sabanetica, Chichimán, Rincón del Mar y Berrugas, cómo una figura de protección del área para la conservación la tortuga carey.
La contaminación por residuos sólidos, a su vez, es de gran preocupación, ya que las playas tenían una alta acumulación de plásticos. Lo que puede afectar las propiedades de los nidos, como la temperatura y la permeabilidad, e impactar de manera directa a las hembras anidantes y las crías por ahogamiento u obstaculización (Nelms et al., 2015).
Otros factores identificados en campo que afectan de manera indirecta y que requieren atención incluyen el uso de artes de pesca destructivas como chinchorro playero y pesca con dinamita sobre áreas coralinas, la pérdida de hábitat por erosión costera, la tala ilegal del manglar y el desarrollo costero. Estos factores actúan de manera sinérgica como agentes transformadores de los ecosistemas, afectando los procesos de ovoposición por la disminución del espacio disponible e influir en cambios en las características del entorno (composición de la arena, sombreo por la vegetación) que podrían incidir en la disminución del éxito de eclosión y de emergencia de las nidadas.
CONCLUSIONES
Las playas continentales del Caribe colombiano identificadas para la anidación de la tortuga carey son pocas y con anidación esporádica. En Rincón del Mar y áreas circundantes la abundancia de nidos es reducida, sin embargo E. imbricata continúa dando uso a estas playas para el desove de sus nidadas a pesar de las amenazas locales. Por lo cual, siendo la tercera zona con mayor abundancia para la anidación de la tortuga carey en playas continentales, es indispensable fortalecer procesos de protección precisando mecanismos con esfuerzos de conservación dirigidos desde la participación comunitaria y el trabajo interinstitucional e intersectorial.
Por otra parte, las condiciones geomorfológicas de la playa y la composición vegetal pueden estar influyendo para que se mantenga la filopatria de la especie a la zona, permitiéndoles a las hembras realizar una óptima selección del sitio de postura dejar lo nidos in situ. Tal como se como se comprobó en este estudio, con un alto éxito reproductivo de las nidadas. No obstante, se ha observado que algunas playas están siendo modificadas, no sólo por variables ambientales, sino por la influencia antrópica.
Estas playas son un lugar clave para proteger una de las etapas más críticas en el ciclo de vida de E. imbricata, beneficiando así la conservación de la especie en esta amplia región en donde existe e incluso sobrelapa un mosaico de áreas marinas y costeras protegidas, como lo son el Área Marina Protegida Archipiélago del Rosario y San Bernardo, el Parque Nacional Natural Los Corales del Rosario y de San Bernardo y, en proceso de declaratoria, el DRMI Sabanetica, Chichimán, Rincón del Mar y Berrugas. Por lo tanto, es urgente establecer un plan de manejo interinstitucional e intersectorial para su protección.
En el plan de manejo de la especie deben incluirse recursos económicos permanentes para un monitoreo a largo plazo, saturación de marcaje y transmisores satelitales que nos permitan conocer sus rutas migratorias, uso y conectividad del área, además de un programa de educación ambiental que sea transversal a toda la comunidad y la generación de un programa de alternativas económicas locales sostenibles que ayude a eliminar el uso de subproductos de la tortuga carey.
AGRADECIMIENTOS
El proyecto no hubiese sido posible sin el trabajo de los Guardianes de las Tortugas de Rincón del Mar: Nehemías Tapia Robles, Johonis Tapia Robles, Arnold Díaz Blanco, José Pedro Guerrero Contreras, Gregorio Contreras Meza, Juan Silgado Flórez, Jorge Tapia, Denerys Blanco Arrieta, Luis Eduardo Zúñiga Contreras, Jhon Enrique Ramos Ocón, Jeisson Ramos Ocón y Johanis Patricia Tapia Robles, su colaboración, compromiso, toma de datos y protección de las nidadas fue crucial para el proyecto. A la Corporación Autónoma Regional de Sucre, en cabeza de su director Johnny Avendaño Estrada y a Jesús Romaní Lobo por su apoyo en los monitoreos diurnos y nocturnos durante 2018. Un especial agradecimiento a todos los niños de Rincón del Mar, por su compromiso con la conservación de las tortugas marinas, principalmente a la Institución Educativa Rincón Del Mar, con el grupo ambiental Guardianes Apasionados por las Tortugas Marinas liderado por la Profesora Delcy Lares Ramos, y a los Titanes Ecológicos. Al condominio Balsillas y su administrador Martín Álvarez, la Asociación Colombian Reef (Alberto González y Julie Lobbestael), Dos Aguas Lodge (Dania Bianuni y Daniele Bertolotti), Canto de Caracola (Angela Olarte) y Casita B lanca (familia Tapia Robles) por el apoyo en hospedaje y logístico durante el proyecto. Los autores agradecen especialmente a la familia Tapia Robles que por muchos años ha protegido a la tortuga carey en Rincón del Mar. Financiado en el marco del proyecto “Manejo integrado de la UAC estuarina río Sinú-Golfo de Morrosquillo” de Carsucre y la Fundación Tortugas del Mar.
REFERENCIAS
Andrews, H.V., S. Krishnan and P. Biswas. 2006. Distribution and status of marine turtles in the Andaman and Nicobar Islands: 33-57 in Shanker, K. and B. Choudhury (E ds. ) Marine turtles of the Indian subcontinent. Universities , Hyderabad, India. [ Links ]
Arcos, M., A. Barrero, G. Guarín y P. Quintero. 2002. Establecimiento y comparaciones de características estructurales de puntos focales de anidación de tortugas marinas ya establecidos en el sector de Arrecifes Parque Nacional Natural Tayrona, Caribe colombiano. Seminario de investigación, Univ. Jorge Tadeo Lozano, Santa Marta. 54 p. [ Links ]
Barrientos-Muñoz, K.G., C. Ramírez-Gallego and L. Rivas. 2013. First report of nesting of the Black Sea turtle (Chelonia mydas) on the north Pacific coast of Colombia. Mar. Turtle Newslet., 138: 19-21. http://www.seaturtle.org/mtn/archives/mtn138/mtn138-7.shtml [ Links ]
Barrientos-Muñoz, K.G ., C. Ramírez-Gallego and V. Páez . 2014. Nesting ecology of olive Ridley (Lepidochelys olivacea) (Cheloniidae) at El Valle Beach, northern Pacific, Colombia. Acta Biol. Col., 19(3): 437-445: https://dx.doi.org/10.15446/abc.v19n3.42457 [ Links ]
Barrientos-Muñoz, K., C. Ramírez-Gallego y V.P. Páez. 2015. Eretmochelys imbricata (Linnaeus, 1766): 127-131. En: Morales-Betancourt, M.A., C.A. Lasso, V.P. Páez y B.C. Bock (Eds.). Libro rojo de reptiles de Colombia. Inst. Invest. Rec. Biol. Alexander von Humboldt (IAvH), Univ. Antioquia, Bogotá, D.C. 258 p. [ Links ]
Barrientos-Muñoz, R. A. Álvarez-Rodríguez, W. Álzate-Montoya, J. Arends, J. Bernal-Gutiérrez, S. Bessudo , J. P. Caldas, E. Córdoba-Borja, M.C Diazgranados, J. Herrera, K. Iguarán Quijada, A. Jáuregui-Romero, F. Ladino, H. Marimón, V. Márquez, A. Carlos Mata, J. David Miranda, J. Moreno-Sotomayor, V. P. Páez, L. Payan, M.F Pereira-Gutiérrez, D. Ramírez-Acosta, E. Ramírez-Gáfaro, N. Restrepo-Garzón, E.L Robledo-Leal, J. Tapia-Robles, N.J Tapia-Robles, S. Valencia-González, M. Valencia, M. X. Zorrilla - Arroyave y C. Ramírez-Gallego. 2020. Eretmochelys imbricata (Linnaeus 1766). En revisión. Catálogo de anfibios y reptiles de Colombia. Asociación Colombiana de Herpetología. [ Links ]
Bolongaro, A., Z. Márquez, V. Torres y A. García. 2010. Vulnerabilidad de sitios de anidación de tortugas marinas por efectos de erosión costera en el estado de Campeche: 73-96. En: Botello, A.V., S. Villanueva-Fragoso, J. Gutiérrez y J.L. Rojas Galaviz (Eds.) Vulnerabilidad de las zonas costeras mexicanas ante el cambio climático. Semarnat-INE, UNAM-ICMyL. Univ. Autón. Campeche, Campeche. 514 p. [ Links ]
Campbell, C.L. 2014. Estado de c onservación de la tortuga c arey en las regiones del Gran Caribe, Atlántico Occidental y Pacífico Oriental. Secretaría Pro Tempore CIT, Virginia . 76 p [ Links ]
Caraballo-Pérez, M., M. Fernández-Pérez y A. Zamora-Guzmán . 2008. Caracterización de zonas potenciales de anidación de Eretmochelys imbricata y búsqueda de su anidamiento en el sector punta Seca - Rincón del Mar, departamento de Sucre. Sincelejo: Conservación Internacional - Colombia, Fundación Omacha, CARSUCRE, Universidad de Sucre. 24 p. [ Links ]
Cardique , Carsucre , Codechocó , Coralina , orpamag , Corpoguajira , Corponariño , Corpourabá , CRA, CRC, CVC, CVS, Invemar , MADS y PNN. 2016. Plan de Acción del Subsistema de Áreas Marinas Protegidas - SAMP 2016-2023: Lineamientos para su consolidación en el marco de los Subsistemas Regionales de Áreas Protegidas del Pacífico y del Caribe. Zamora-Bornachera, A.P. (Ed.) Proyecto COL75241, PIMS # 3997, Invemar, MADS, GEF y PNUD. Serie Publ. Gen. Invemar 85, . 60 p. [ Links ]
Carsucre . 2017. Informe de actividades de control y vigilancia flora y fauna enero-junio. Bol. Amb. 1. Sincelejo, Sucre. [ Links ]
Ceballos-Fonseca, C. 2004. Distribución de playas de anidación y áreas de alimentación de tortugas marinas y sus amenazas en el Caribe colombiano. Bol. Invest. Mar. Cost., 33: 79-99 doi: 10.25268/bimc.invemar.2004.33.0.249 [ Links ]
Chacón, D., A. Morales y E.V. Passapera. 2004. Informe de la anidación de la tortuga de carey Eretmochelys imbricata en el Parque Nacional Cahuita, Limón, Costa Rica. Proyecto para la Conservación de las Tortugas Marinas en el Caribe Sur. Asoc. ANAI, Talamanca, Costa Rica. [ Links ]
Chacón, D ., J. Sánchez, J.J. Calvo y J. Ash. 2007. Manual para el manejo y la conservación de las tortugas marinas en Costa Rica; con énfasis en la operación de proyectos en la playa y viveros. Asociación ANAI, SINAC , MINAE). Gobierno de Costa Rica, San José. 103 p. [ Links ]
Colombia Marina. 2007. Project: Strengthening the conservation process of nesting sea turtles in Tayrona National Park - Colombian Caribbean. Season 2007. Final r eport . Santa Marta . 16 p. [ Links ]
Cusado-Zapa, C.A. y A.M. González -Pérez. 2010. Análisis fitosociológico del ecosistema de manglar del parque natural boca Guacamayas, departamento de Sucre. Sincelejo-Sucre. Trabajo de grado Biología, Univ. Sucre. Sincelejo, Colombia. [ Links ]
Duque, D., B. Medrano y R. Franke. 2011. Avances de un proceso participativo para generar línea base para monitoreo de tortugas marinas en el área protegida y su zona de influencia. Capítulo 26: 351-363 . En: Zarza-González , E. (Ed.). Entorno Ambiental del Parque Natural Corales del Rosario. Parques Nacionales Naturales de Colombia. Quito Publicidad, Cartagena de Indias. 416 p. [ Links ]
Eckert, K.L. and A.E. Eckert. 2019. An atlas of sea turtle nesting habitat for the wider Caribbean region. Revised Edition. WIDECAST Tech. . Rep., 19. Godfrey, USA. 232 p. [ Links ]
Ecoversa . 2018. Estudio técnico para la declaratoria de punta San Bernardo y Chichimán - Rincón del Mar en el municipio de San Onofre (Sucre) como Área Protegida Regional y formulación del plan de manejo, en el marco del Proyecto GCP/COL/041/GFF. Medellín . 120 p. [ Links ]
Engeman, R.M., D. Addison and J.C. Griffin. 2016. Defending against disparate sea turtle nest predators: benefits to nesting success from eradicating invasive feral swine and caging nests from raccoons. Oryx, 50(2): 289-295. [ Links ]
Engeman, R.M ., R.W. Byrd., J. Dozier., M.A. McAlister., J.O. Edens., E.M. Kierepka., T.J. Smyser. and N. Myers. 2019. Feral swine harming insular sea turtle reproduction: The origin, impacts, behavior and elimination of an invasive species. Acta Oecol. , 99: 103442 https://doi.org/10.1016/j.actao.2019.103442 [ Links ]
Gerhartz-Muro, J.L., J. Azanza., F. Moncada, A. Gerhartz-Abraham, L. Espinosa, Y. Forneiro, and D. Chacón. 2019. Su n and i ncubation temperatures in a sea turtle nesting beach at the cayos de San Felipe National Park, Pinar del Río, Cuba, during the 2012-2013 season. Rev. Invest. Mar. , 38(2): 100-116. [ Links ]
Godley, B. J., A.C. Broderick, L.P. Colman, A. Formia, M.H. Godfrey, M. Hamann and A.F. Rees. 2020. Reflections on sea turtle conservation. Oryx, 54(3): 287-289. https://doi.org/10.1017/S0030605320000162 [ Links ]
Hancock, J. 2008. Monitoreo de la anidación de la t ortuga carey (Eretmochelys imbricata) y de la tortuga verde (Chelonia mydas) en el Parque Nacional Cahuita, Caribe sur, Costa Rica. Inf. Activ. . WIDECAST, Costa Rica. 33 p. [ Links ]
Humber, F., B.J. Godley and A.C. Broderick. 2014. So excellent a fishe: a global overview of legal marine turtle fisheries. Div. Distrib. , 20(5): 579-590. doi: 10.1111/ddi.12183. [ Links ]
INVEMAR-CVS . 2012. Lineamientos de manejo integrado de la Unidad Ambiental Costera Estuarina río Sinú -golfo de Morrosquillo. Hernández-Ortiz, M., A. P. Zamora-Bornachera y A. López-Rodríguez (Eds.). Ser. Doc. G en. Invemar 53. 79 p. [ Links ]
Joya, A. M. y M.P. Molina. 2006. Levante de neonatos de t ortuga carey, Eretmochelys imbricata (L inneaus, 1766) mediante la implementación de dos tipos de dietas en el acuario Mundo Marino, Santa Marta. Trabajo grado Biol. Mar., . Universidad Jorge Tadeo Lozano. Santa Marta . 133 p. [ Links ]
Kaufmann, R. 1967. Wachtstumsraten in Gefangenschaft gehaltener Meersschildkröten. Mitteilun. Inst. Colombo-Alemán Invest. Cient. Punta de Betín, 1: 65−72. [ Links ]
Kaufmann, R. 1975. Observaciones sobre el crecimiento de tortugas marinas en cautividad. Caldasia, 139-150. doi: 10.15446/caldasia. [ Links ]
Kontos, A.R. 1985. Sea turtle research report, 1985, Mona Island, Puerto Rico. An. Rep. ort U.S. Fish Wildl. Serv. . 35 p. [ Links ]
Kontos, A.R. 1987. 1986 annual summary: estimation of sea turtle abundance and nesting success of Mona Island, Puerto Rico. An. Rep. ort U.S. Fish Wildl. Serv. 22 p. [ Links ]
Kontos, A.R. 1988. 1987 annual summary: estimation of sea turtle abundance, Mona Island, Puerto Rico. An. Rep. ort U.S. Fish Wildl. Serv. . 24 p. [ Links ]
Liles, M.J., T.R. Peterson, J.A. Seminoff, A.R. Gaos, E. Altamirano, A.V. Henríquez, V. Gadea, S. Chavarria, J. Urteaga, B.P. Wallace and M.J. Peterson. 2019. Potential limitations of behavioral plasticity and the role of egg relocation in climate change mitigation for a thermally sensitive endangered species. Ecol. Evol. , 9(4): 1603-1622. doi: 10.1002/ece3.4774 [ Links ]
McCormick, C.C. 1997. Porque ellas también tienen derecho a seguir dejando huella. Diagnóstico actual de las tortugas marinas del archipiélago de San Andrés, Providencia y Santa Catalina, Fase II.CORALINA, San Andrés. 67 p. [ Links ]
McCormick, C.C. 1998. Diagnóstico actual de las tortugas marinas del archipiélago de San Andrés, Providencia y Santa Catalina. Coralina , San Andrés. 41 p. [ Links ]
Meylan, A.B. 1999. Status of the hawksbill turtle (Eretmochelys imbricata) in the Caribbean r egion. Chel. Cons. Biol., 3(2): 177-184. [ Links ]
Meylan, A.B. and M. Donelly. 1999. Status justification for listing the hawksbill turtle (Eretmochelys imbricata) as Critically Endangered on the 1996 IUCN Red List of Threatened Animals. Chel. Cons. Biol., 3(2): 200-224. [ Links ]
Meylan, A.B ., I. Castillo, N . Decastro, C. Ordóñez, S. Troëng, A. Ruiz and P.A. Meylan. 2006. Bastimentos Island National Marine Park and Playa Chiriqui: protected areas vital to the recovery of the hawksbill turtle (Eretmochelys imbricata) in Caribbean Panama: 145- 146. In: Frick, M., A. Panagopoulou, A.F. Rees and K. Williams (compilers). Abstracts Twenty-sixth 26th An. Symp. Sea Turtle Biol. Cons . Internat. Sea Turtle Society. Athens . [ Links ]
Miller, J. 1999. Determining c lutch size and hatching success: 124-129. I n: Eckert K., K.A. Bjorndal, F.A. Abreu-Grobois and M. Donnelly (Eds.) Research and management techniques for the conservation of sea turtles. IUCN/SSC Mar. Turt. Spec. Group Publ. 4. Washington, D.C. 248 p. [ Links ]
Moncada, F., C. Ramírez-Gallego, J. Camero, M. González, G. Nodarse and K.G. Barrientos-Muñoz. 2019. A juvenile loggerhead turtle (Caretta caretta) tagged in Cuba is recaptured in Colombian waters. Mar. Turtle Newslet., 156: 30-32. http://www.seaturtle.org/mtn/archives/mtn156/mtn156-9.shtml [ Links ]
Moreno-Munar, Á. A., S.C. Ospina-Sánchez, A.G. Jáuregui-Romero y R. Álvarez-León. 2014. Monitoramiento de poblaciones de tortugas marinas en los sectores de Arrecifes y Cañaveral, Parque Nacional Natural Tayrona, Colombia. Arq. Cien. Mar. Fortaleza, 47: 19-30. Available online at: http://www.repositorio.ufc.br/bitstream/riufc/28712/1/2014_art_aammunar.pdf [ Links ]
Mortimer, J.A. and M. Donnelly . 2008. Eretmochelys imbricata. IUCN Red List Threatened Species 2008. Version 2014.3.1 1 www.iucnredlist.org . 06/12/2020. [ Links ]
Nelms, S. E., E.M. Duncan, A.C. Broderick, T.S. Galloway , M.H. Godfrey, M. Hamann, P.K. Lindque and B.J. Godley. 2015. Plastic and marine turtles: a review and call for research. ICES J. Mar. Sci. , 73(2): 165-181. [ Links ]
Piedra-Castro, L. y V. Morales-Cerdas. 2015. Preferencias en la anidación de tortugas carey (Eretmochelys imbricata) y baulas (Dermochelys coriacea) en el Refugio Nacional de Vida Silvestre Gandoca Manzanillo, Limón, Costa Rica. Tecnol. Marcha, 28(3): 86-98. [ Links ]
Ramírez-Gallego, C. and K.G. Barrientos-Muñoz. 2020a. Illegal hawksbill trafficking: five years of records of the handicrafts and meat trades of the hawksbill turtle (Eretmochelys imbricata) in Cartagena de Indias, Colombia. J. Aquacult. Mar. Biol. , 9(3): 101-105. doi: 10.3389/fmars.2019.00817 [ Links ]
Ramirez-Gallego, C. and K.G. Barrientos-Muñoz. 2021. Stopping illegal hawksbill trafficking in Cartagena de Indias, Colombia. Pp. 141-148. In: Sea turtle Research and Conservation: Lessons From Working In The Field. Editors, Nahill B. Elsevier Academic Press, USA. 224p. Ramirez-Gallego, C. and K.G. Barrientos-Muñoz. 2020b. Sea Turtles at Serrana Island and Serranilla Island, Seaflower Biosphere Reserve, Colombian Caribbean. Front. Mar. Sci., 6: 817. doi: 10.3389/fmars.2019.00817 [ Links ]
Reuter, A. and C. Allan. 2006. Tourists, t urtles and trinkets: a look at the trade in marine turtle products in the Dominican Republic and Colombia. Field Report, TRAFFIC, 12 p. [ Links ]
Rhodin, A. G., C.B. Stanford, P.P. Van Dijk, C. Eisemberg, L. Luiselli, R.A. Mittermeier, R. Hudson, B.D. Horne, E. Goode, G. Kuchling, A. Walde, E.H.W. Baard , K. H. Berry, A Bertolero, T.E.G. Blanck, R. Bour, K.A. Buhlmann, L.J. Cayot, S. Collett, A. Currylow, I. Das, T. Diagne, J.R. Ennen, G. Forero-Medina, M.G. Frankel, U. Fritz, G. García, J.W. Gibbons, P.M. Gibbons, S. Gong, J. Guntoro, M.D. Hofmeyr, J.B. Iverson, A.R. , Kiester, M. Lau, D.P. Lawson, J.E. Lovich, E.O., Moll, V.P. Páez, R. Palomo-Ramos, K. Platt, S.G. Platt, P.C.H. Pritchard, H.R. Quinn, S.C. Rahman, S. T. Randrianjafizanaka, J. Schaffer, W. Selman, H.B. Shaffer, D.S.K. Sharma, H. Shi, S. Singh, R. Spencer, K. Stannard, S. Sutcliffe, S. Thomson, and R. C. Vogt. 2018. Global conservation status of turtles and tortoises (order Testudines). Chel. Cons. Biol. , 17(2): 135-161. doi: 10.2744/CCB-1348.1 [ Links ]
Richardson, J.I., 1990. Estimation of S ea Turtle Abundance and Nesting Success on Mona Island, Puerto Rico. Final Rep. USFWS, Unit Coop. Agr. 14-16- 009-1551, U.S. Fish and Wildlife Service. South Florida Ecosystem Office, Vero Beach, USA . [ Links ]
Rincón-Díaz, M.P. and C.J. Rodríguez-Zárate. 2004. Characterization of nesting beaches and feeding areas of marine turtles at the San Bernardo Archipelago, Colombian Caribbean. Bol. Invest. Mar. Cost. , 33(1): 137-158. doi: 10.25268/bimc.invemar.2004.33.0.252 [ Links ]
Rincón, M.P., D. F. Rivera, C.J. Rodríguez y J.P. Tello. 2001. Establecimiento y caracterización estructural de puntos focales de anidación en el sector de Arrecifes, Parque Nacional Natural Tayrona, Caribe colombiano. Sem. I nvest. , Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 67 p . [ Links ]
Rueda, J. V. 1987. Informe sobre la situación actual de las poblaciones de tortugas marinas en el Caribe Colombiano. Rep. Nal. Inderena II Simp. Tort. Mar. Atlántico Occidental STAO, Puerto Rico, 32 p. [ Links ]
SIRAP Caribe e Invemar . 2013. Articulación del Subsistema de Áreas Marinas Protegidas (SAMP) al plan de acción del SIRAP Caribe. Ser. Publ. Gen. Invemar, . 38 p. [ Links ]
Suganuma, H., 2005. Leatherback turtle management of feral pig predation in Indonesia: 37-38. In: Kinan, I. (Ed.), Proc. 2nd West. Pac. Sea Turtle Coop. Res. Manag. Workshop Vol. 1 . West. Pac. Reg. Fish. Manag. Counc. , Honolulu. [ Links ]
Ulloa, J.C., Quiroga, D.A. y T.R. Ruiz. 2016. Caracterización de los p rincipales humedales costeros en la jurisdicción de Carsucre. Inf. Téc. , Carsucre. Sincelejo. 79 p. [ Links ]
Whytlaw, P.A., W. Edwards and B.C. Congdon. 2013. Marine turtle nest depredation by feral pigs (Sus scrofa) on the w estern Cape York Peninsula, Australia: implications for management. Wildl. Res., 40: 377-384. [ Links ]
Recibido: 26 de Julio de 2020; Aprobado: 25 de Mayo de 2021











 texto en
texto en