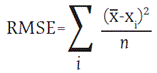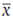Introducción
Los cultivos en los Andes peruanos se desarrollaron desde el surgimiento de la civilización andina, lo cuales se adaptaron a condiciones orográficas (de 0 a 4200 m s. n. m.), microclimáticas y entornos muy variados e, incluso, extremos. En las últimas décadas el área de estos cultivos se ha incrementado notablemente tanto en el Perú y Andes sudamericanos, como en otras regiones del mundo, gracias a que sus productos tienen un elevado valor nutricional con efectos beneficiosos para la salud (healthier foods). Varios de los cultivos andinos, como determinadas variedades de quinua (Chenopodium quinoa), papas nativas (Solanum tuberosum) o maíz (Zea mays) han logrado adaptarse y desarrollarse en alturas incluso mayores de 2500 msnm, donde predominan condiciones medioambientales extremas, como, por ejemplo, la intensa radiación solar, particularmente en el rango UV.
Por otro lado, es conocida la función clave de la clorofila en la fotosíntesis de las plantas (Covshoff, 2018; Croce et al., 2018; Jacquemond y Ustin, 2019) y la dependencia del contenido de esta con el tipo de cultivo y las condiciones ambientales del crecimiento de la planta. Es también conocida la importancia de cuantificar el contenido de otros pigmentos de las hojas, como carotenoides y antocianinas, que desempeñan funciones complementarias y un rol protector en la fotosíntesis, a manera de atenuantes y antioxidantes frente a la radiación solar (Zulfiqar et al., 2021; Maslova et al., 2021; Stetsenko et al., 2020; Hu et al., 2020).
En las últimas décadas los métodos ópticos se han convertido en herramientas efectivas para la estimación del contenido de clorofila y otros pigmentos de las hojas vegetales, con la disponibilidad de instrumentos que permiten estimar dichos pigmentos. Así, el conocimiento de la reflectancia espectral de las hojas tiene un interés especial, ya que a través de ella se puede estimar el contenido de pigmentos, tanto in situ como a distancia, midiendo la radiación reflejada por las hojas. Para ello se han definido índices de valores de reflectancias a determinadas longitudes de onda, teniendo en cuenta que hay fuerte absorción de luz en la región “azul” (baja reflectancia), débil en la “verde” (fuerte reflectancia), absorción intensa en la “roja” (débil reflectancia) y una intensa reflectancia en el infrarrojo cercano (NIR) (Jacquemond y Ustin, 2019).
Entre el fondo rojo y la cima del NIR está el denominado borde rojo, punto sensible al contenido de clorofila y definido como un punto de inflexión de la curva rojo-NIR (Gitelson et al., 1996). Las ventajas de las medidas de reflectancia frente a las de absorbancia han sido descritas por Richardson et al. (2002) y se han asociado distintas expresiones de índices de contenido de clorofila (Jacquemoud y Ustin, 2019), como, por ejemplo, los índices de la razón y diferencia normalizada (Lichtenthaler et al., 1996), que consideran inversas de la reflectancia en el borde rojo y NIR (Gitelson et al., 2009; Gitelson y Solovchenko, 2017). Muchos índices se han utilizado en diferentes investigaciones, como el contenido de clorofila en verduras (Xue y Yang, 2009) y el estudio de tolerancia del maíz a las heladas (Obeidat et al., 2018). Por su parte, Li et al. (2019) evaluaron distintos índices para el análisis de la dependencia angular de la reflectancia en las hojas, basados en propuestas anteriores.
En cuanto a las evaluaciones del contenido de antocianinas, hay aportes importantes que han llevado a proponer índices validados para obtener información del contenido de estos pigmentos (Gitelson y Solovchenko, 2017). También se han evaluado índices del contenido de carotenoides basados en las bandas de reflectancia de las hojas (Gitelson et al., 2006; Kong et al., 2016; Zhou et al., 2017; Wong et al., 2020; He et al., 2022).
Los contenidos de clorofila (Chl) y carotenoides (Car) en las plantas son bajos al inicio del crecimiento y se incrementan en las etapas estacionales. La razón carotenoides/clorofila (Car/Chl) es un buen indicativo del desarrollo de la planta y, por tanto, un índice recomendable para monitorear el impacto medio ambiental en el desarrollo de un cultivo, lo que se asocia al desarrollo “normal” a una razón Car/Chl constante en el tiempo (estacionario) (Merzlyak et al., 1999; Kong et al., 2016; Zhou et al., 2017; Wong et al., 2020; He et al., 2022), antes del inicio de la senescencia de la planta.
De tal manera, el objetivo del presente trabajo fue evaluar distintos índices de reflectancia espectral de pigmentos básicos, como clorofila, antocianinas y carotenoides, en hojas de algunas variedades de cultivos andinos (quinua, papa, maíz). Para determinar estos índices se tomaron en cuenta parámetros de bandas críticas de reflectancia espectral de las hojas, como el borde rojo, el máximo de reflectancia en la región “verde” o el NIR, región donde no se produce absorción de la luz por pigmentos (Jackemoud y Ustin, 2019). Los índices evaluados permitieron monitorear el estado de desarrollo y adaptabilidad al medio ambiente de los cultivos andinos, que fueron considerados bajo las mismas condiciones del suelo, clima y suministro de agua, con lo cual se obtuvieron diferencias y similitudes en las variaciones de los índices calculados.
Materiales y métodos
Los estudios se realizaron en el Instituto Nacional de Innovación Agraria (INIA) ubicado en el distrito de Andrés Avelino Cáceres, provincia de Huamanga, departamento de Ayacucho, Perú. Este Lugar está situado a 2700 m s. n. m. con coordenadas geográficas 13°9’17’’ S, 74°13’33’’ O. Para ello se consideraron 6 cultivos: i/ 2 de maíz de las variedades INIA 620 Wari de grano blanco (MB) e INIA 615 Negro Canaán de grano morado (MM); ii/ 2 de papas de las variedades Yungay de tubérculos blancos (PB) e INIA 316 Roja Ayacuchana de color rojo (PR); y iii/ 2 de quinua de las variedades Blanca de Junín de grano blanco (QB) e INIA 415 Pasankalla de grano rojo (QR). Los cultivos fueron sembrados en enero de 2020 y se desarrollaron bajo condiciones de régimen de lluvias y complementadas con riego por gravedad en condiciones normales de crecimiento. Los datos se tomaron entre el 17 de febrero y el 9 de marzo de 2020, periodo en el que aún no había ocurrido la floración de las papas ni la formación de inflorescencias como espigas en el maíz y panojas en la quinua. El periodo completo de 3 semanas, que incluyó 4 medidas, fue dividido en tres partes: primera semana o “periodo inicial”, segunda semana o “periodo crítico”, donde hubo disminución de lluvias, y finalmente la tercera semana o “periodo final”.
Las mediciones de las reflectancias espectrales se realizaron con un espectrorradiómetro ASD Field Spec 4 en un rango de 350 a 2500 nm e intervalos de medida de 1 nm. Se registraron medidas directas (entre las 10 a. m. y 12:00 m.) sobre 3 hojas de cada cultivo elegidas aleatoriamente para cada variedad estudiada. Antes del cálculo de los índices, se aplicó el filtro de Savitzky-Golay (Savitzky y Golay, 1964; Press et al., 2007), que consiste en un algoritmo polinomial flexible muy utilizado para eliminar el ruido y suavizar los datos. Los índices fueron determinados para cada conjunto de datos, luego promediados y seguidamente se determinó la desviación cuadrática media (RMSE) según la fórmula:
Resultados y discusiones
En la Figura 1 se muestran las curvas de reflectancia (R= R(λ)) de los 6 cultivos andinos en las que se indican las diferentes regiones del espectro donde se ubican los parámetros ópticos (bandas y longitudes de onda) utilizados para determinar los diferentes índices de reflectancia en las regiones visible e infrarrojo-cercano (NIR). El mínimo de la reflectancia en la región “rojo” se sitúa en torno a 670 nm, a partir del cual hay una subida abrupta hasta llegar a la “meseta” del NIR. El borde rojo (RRE) corresponde al punto de inflexión de la curva(R= R(λ)). La meseta del NIR se da aproximadamente desde 780 nm hasta 900 nm. En los cálculos de los índices de reflectancia se consideró la reflectancia del NIR a 800 nm (R800).
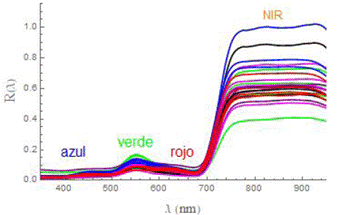
Figura 1 Curvas de reflectancias R=R(λ), entre 350 y 950 nm, de hojas de cultivos andinos estudiados.
En la Figura 2, se muestran los valores medios de las reflectancias espectrales de la región visible medidas en los 4 períodos. En ella se puede apreciar que el maíz blanco (MB) y la quinua blanca (QB) tienen reflectancias R(λ) más altas que las correspondientes al maíz morado (MM) y a la quinua roja (QR); mientras que las R(λ) de la papa blanca (PB) y roja (PR) no tienen diferencias significativas. De acuerdo con Gitelson et al. (2001), las hojas de cultivos con menor reflectancia (o mayor absorción) en la región “verde” contendrían más antocianinas. En este contexto, en la Figura 2 (d), se representan las R(λ) de todos los cultivos con el pico en la región “verde”, donde el pico de menor valor corresponde a la QR, indicando que contendría una mayor proporción de antocianinas y las de menor contenido de este pigmento se darían para el maíz blanco y la quinua blanca (MB, QB), lo cual se manifiesta en el cultivo mediante un color verde oscuro de las hojas de las variedades de maíz morado y quinua roja. La papa blanca (PB) y roja (PR) tendrían prácticamente las mismas proporciones en el contenido antocianina-clorofila, por ello se observan en el cultivo hojas de color verde muy similares. La meseta de la región NIR de la Figura 1 muestra disparidades en las alturas de la reflectancia, lo que se debe a la poca absorción de la luz, es decir, alta reflectancia, y a las heterogeneidades particulares de la estructura de cada hoja (Jacquemoud y Ustin, 2019).
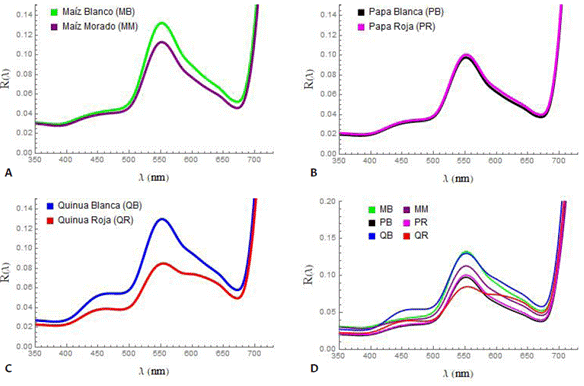
Figura 2 Valores medios de las reflectancias R(λ) de las hojas de cultivos andinos estudiados, mostrando solo la parte visible; (a) maíz blanco (MB) y maíz morado (MM); (b) papa blanca (PB) y papa roja (PR); (c) quinua blanca (QB) y quinua roja (QR); (d) de todos los cultivos para apreciar las diferencias entre ellos en el entorno del máximo del “verde”.
En la Figura 3 se muestran, en función de las fechas en las que se realizaron las mediciones, los 4 índices de clorofila calculados: la razón simple (SR), el índice de clorofila de diferencia normalizada (NDCI), el índice de clorofila del borde rojo (ChlRE) y el índice de clorofila del máximo del verde (Chlgreen); además se establecen 3 periodos de medida (inicial, crítico y final). La evolución de SR es similar a la de NDCI para cada cultivo debido a que el segundo es una normalización del primero. Lo característico de los 4 índices es la similitud con la que desciende cada tipo de cultivo, lo cual se observa más pronunciadamente en la papa blanca, seguida de la papa roja y del maíz blanco. En el maíz morado y la quinua blanca se observan similitudes en su descenso con a un valor constante, mientras que en la quinua roja se observa un ligero incremento de los 4 índices para el tercer periodo.
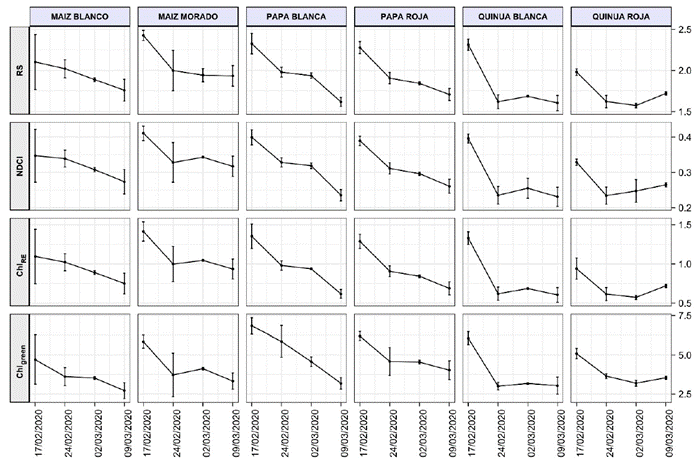
Figura 3 Índice de la razón simple (SR), índice de clorofila de diferencia normalizada (NDCI), índice de clorofila del borde rojo (ChlRE) e índice de clorofila del máximo verde (ChlGreen), con sus correspondientes barras de errores.
Hay numerosos estudios que relacionan el contenido de clorofila y el de nitrógeno de las hojas utilizando métodos ópticos, donde el incremento de uso de nitrógeno por la planta tiene que ver con el aumento de clorofila de las hojas (Baret et al., 2007; Miao et al. 2009; Padilla et al, 2019; Fu et al., 2021; Mendoza-Tafolla et al., 2022; Lu et al., 2023).
Los resultados de la disminución del contenido de clorofila observados en la Figura 3 para los 4 índices espectrales del contenido de clorofila evidenciarían que habría una disminución de la nitrogenación de los cultivos, lo cual es explicable si se considera que no se ha utilizado ningún tipo de fertilizante en los cultivos. También hay que tener en cuenta que en el periodo intermedio de las mediciones hubo escasez de lluvias, lo cual es otro factor que influenciaría en la disminución del índice de clorofila. Sin embargo, en la cuarta medición se observa un ligero incremento del índice de clorofila de la quinua roja, lo que representa un comportamiento positivo diferente de este cultivo respecto a los otros, e indica que es una especie mejor adaptada para captar más nitrógeno que los demás cultivos. Se sabe que la quinua roja se desarrolla en condiciones climáticas adversas, y a futuro será interesante investigar los mecanismos fisiológicos de este cultivo para su resiliencia, como también las similitudes y diferencias con la quinua blanca y el maíz morado.
Los índices de antocianinas ARI y , se muestran en la Figura 4. En los 6 cultivos se observa un descenso de los índices de antocianinas. La evolución de ambos índices es similar tanto para el MB y la PR, como también se da con el MM, la PR y la QB. Para la QR se aprecia una tendencia al ascenso de los 2 índices de antocianinas. Estos comportamientos se asemejan a los índices de clorofila de la Figura 3. Teniendo en cuenta que los cultivos se han desarrollado en la temporada natural de lluvias, en la que las horas de nubes compiten con las de Sol, no se estimula el incremento del contenido de antocianinas debido a su rol fotoprotector de la fotosíntesis cuando la radiación solar es más prolongada e intensa (Pietrini et al., 1998; Gitelson et al., 2006; Stetsenko et al., 2020; Zheng et al., 2021).
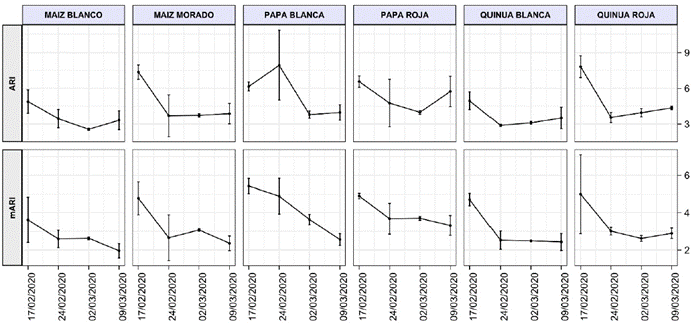
Figura 4 Índice de contenido de antocianinas (ARI) e índice modificado del contenido de antocianinas (mARI) en cultivos andinos.
Los índices de carotenoides mostrados en la Figura 5 también se comportan de manera similar a los índices de antocianinas debido al rol protector y colaborativo de los carotenoides en la fotosíntesis, que estimulan su activación especialmente en etapas de intensa radiación solar para disipar el deterioro del proceso fotosintético (Gitelson et al., 2006, Maslova et al., 2021; Sun et al., 2022). Los 4 índices fueron validados por sus autores para diferentes especies utilizadas en las investigaciones; en ningún caso se utilizaron cultivos andinos ni alturas como las que se estudiaron en este trabajo, sin embargo, es importante observar las similitudes del comportamiento de estos índices, como, por ejemplo, el descenso evidente en la PB, el MB y el MM, y la tendencia a mantenerse constante después del descenso en la PR, la QB y la QR. Tratándose de cuantificar carotenoides en las hojas de cultivos andinos, posiblemente podrían utilizarse cualquiera de los índices de la Tabla 1.
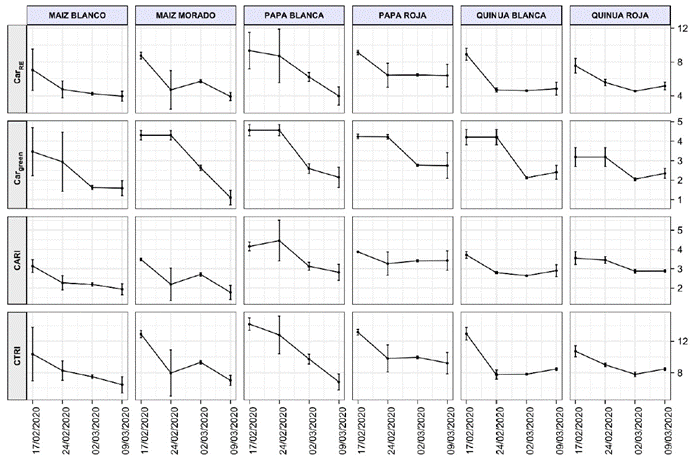
Figura 5 Índice de carotenoides del borde rojo (CarRE), índice de carotenoides del máximo verde (Cargreen), índice de carotenoides (CARI) e índice de caroten oides de la razón triangular (CTRI) para cultivos andinos.
En las gráficas de las relaciones de Carotenoides/Clorofila (Car/Chl) mostradas en la Figura 6 se observan comportamientos diferentes que necesitan ser analizados para cada especie e índice. A la disminución de la relación Car/Chl se le atribuye ser indicativa de la senescencia de la planta, para lo cual se han propuesto varios índices en los últimos años (Zhou et al., 2019; Wong et al., 2020; He et al., 2022). Sin embargo, para el índice CClHe de los 6 cultivos se observa cierta estacionalidad indicativa de la no senescencia; de manera análoga también se da con el índice CCRI, aunque se evidencian sus ascensos en la PB, la PR y la QB. Hay que tener en cuenta que las mediciones espectrales se realizaron en una etapa de crecimiento de los cultivos, anterior a su madurez, y no debería esperarse disminución de estos índices como se da en el caso del índice CCI del MM y la PB, lo cual nos indica que este índice no sería adecuado para ser utilizado en estos cultivos.
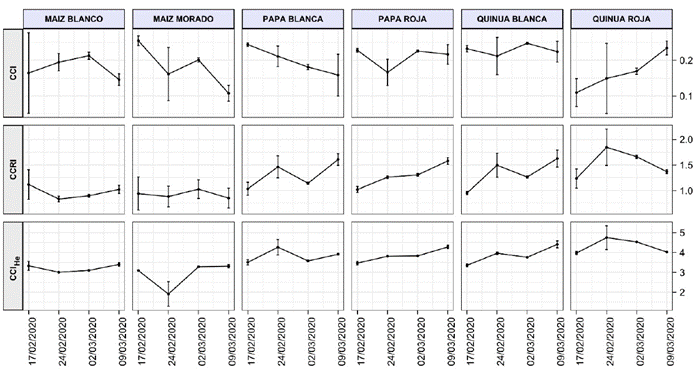
Figura 6 Tres índices de la razón de carotenoides - clorofila (Car/Chl), para los cultivos andinos, de acuerdo con la Tabla 1.
Igualmente, es importante destacar la evolución de todos los índices considerados para la quinua roja (QR), pues alcanza situaciones estacionarias en el periodo crítico, mientras que en el periodo final se observa una tendencia ascendente o de recuperación de niveles de clorofila, carotenoides y antocianinas. Estos resultados indicarían una mejor adaptabilidad al suelo y al entorno medioambiental natural de la QR, con su comportamiento diferenciado en el índice de clorofila, lo que le atribuye una mejor adaptación a alturas de 2700 m s. n. m. e, incluso, mayores que esta, dado que a 3000 m s. n. m la quinua roja encuentra también su hábitat natural (Apaza et al., 2013).
Conclusiones
Se estudió la evolución de 6 índices de reflectancias espectrales R(λ) de pigmentos en hojas de 6 variedades de cultivos andinos, agrupados en 2 variedades de quinua, 2 de papa y 2 de maíz. Los resultados permitieron evaluar índices de reflectancia de clorofila, antocianinas, carotenoides y de la razón carotenoide-clorofila a lo largo de 3 periodos (entre el 17 de febrero y el 9 de marzo de 2020), cada uno de una semana de duración: “inicial”, “critico” (disminución de lluvias) y “final”.
Los valores medios de R(λ) registrados, particularmente en la región verde y a lo largo de tres periodos de medida, indicarían una mayor presencia de antocianinas en la quinua roja QR que en el resto de cultivos, de tal manera que es posible establecer la siguiente relación cualitativa de concentración de antocianinas: QR > PR ≈ PB > MM > QB ≈ MB.
Para cada cultivo, el comportamiento de los 4 índices de clorofila es similar, lo cual indica que cualquiera de ellos podría ser utilizado para la cuantificación del contenido de clorofila. Esto es una ventaja cuando se busca el monitoreo remoto del estado de los cultivos, tal como el satelital o actualmente mediante drones. El descenso de los índices de clorofila se puede atribuir a las limitaciones en la captación del nitrógeno, ya que no se utilizaron fertilizantes en los cultivos. El ascenso en la tercera etapa que se da en la quinua roja muestra un comportamiento particular de este cultivo e invita a una exploración futura para un mejor entendimiento de sus mecanismos fisiológicos.
Una situación análoga se observa en los índices de antocianinas y carotenoides, ya que el comportamiento de los índices es similar en cada tipo de cultivo, aunque diferenciados entre ellos, lo cual significa que cualquiera de los índices podría ser adaptable para cuantificar los contenidos de antocianinas y clorofila.
En cuanto a los índices de la razón Car/Chl, los cualitativa de concentración de antocianinas: más adaptables serían el CCl seguido del CCRI, QR > PR ≈ PB > MM > QB ≈ MB.
Para cada cultivo, el comportamiento de los 4 índices de clorofila es similar, lo cual indica que cualquiera de ellos podría ser utilizado para la cuantificación del contenido de clorofila. Esto es una ventaja cuando se busca el monitoreo remoto debido a los comportamientoHes similares en los 6 cultivos. Teniendo en cuenta que las mediciones se realizaron antes de la etapa madura de los cultivos, no debería presentarse disminución del índice Car/Chl que se observó en el índice CCI, por lo cual no se recomienda su uso.
En general, los índices espectrales para determinar pigmentos foliares se siguen investigando y el reto es proponer índices validados para los cultivos andinos.