Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biotecnología en el Sector Agropecuario y Agroindustrial
versão impressa ISSN 1692-3561
Rev.Bio.Agro vol.13 no.2 Popayán jul./dez. 2015
https://doi.org/10.18684/BSAA(13)40-48
DOI: http://dx.doi.org/10.18684/BSAA(13)40-48
EVALUACIÓN DE LA PRODUCCIÓN DE ETANOL A PARTIR DE MELAZA CON CEPAS NATIVAS Saccharomyces cerevisiae
EVALUATION OF ETHANOL PRODUCTION FROM MOLASSES WITH NATIVE STRAINS Saccharomyces cerevisiae
AVALIAÇÃO DA PRODUÇÃO DE ETANOL A PARTIR DE MELAÇO COM OS NATIVOS CEPAS Saccharomyces cerevisiae
FRANCISCO EMILIO ARGOTE V1, RAÚL ALBERTO CUERVO M2, ESTEBAN OSORIO C3, JOHANNES DELGADO-OSPINA4, HECTOR SAMUEL VILLADA5
1 Universidad de San Buenaventura sede Cali; Grupo de investigación de Biotecnología. Magíster en Marketing Agroindustrial. Cali, Colombia.
2Universidad de San Buenaventura sede Cali, Grupo de investigación de Biotecnología. Magíster en Ciencias Biológicas. Cali, Colombia.
3Universidad del Valle, Grupo de investigación Biomoléculas. Ph.D en Biotecnología. Cali, Colombia.
4Universidad de San Buenaventura sede Cali, Grupo de investigación de Biotecnología. Magíster en Ciencias Agrarias. Cali, Colombia.
5Universidad del Cauca, Grupo de investigación CYTBIA. Ph.D en Ingeniería. Popayán, Colombia
Correspondencia: feargote@usbcali.edu.co
Recibido para evaluación: 25 de Abril de 2013. Aprobado para publicación: 27 de Febrero de 2015.
RESUMEN
Este trabajo tuvo como objetivo principal evaluar la producción de etanol de nueve levaduras aisladas y caracterizadas en el Valle con un testigo de un ingenio brasilero. La evaluación de las variables como temperatura, oxígeno, dióxido de carbono y etanol durante el proceso de fermentación se realizó con la ayuda del equipo Ecochamber y la técnica HPLC para contrastar los valores encontrados. El diseño experimental correspondió al modelo unifactorial, y el tiempo de observación fue transversal en 48 horas, la unidad muestral fue de 600 mL de solución de melaza con una concentración de 16°Brix cuyo pH se ajustó a 4,5 con adición de acido cítrico. Los resultados se analizaron con el programa estadístico STATGRAPHICS 5.1, mediante ANOVA con un nivel de significancia de 0,05 y las diferencias con prueba de Tuckey. Como resultados relevantes se encontró que las variables temperatura y oxígeno no presentaron diferencias estadísticas con valores entre 24 a 32°C y 6,7 a 20% de manera respectiva, mientras que las cepas IC1, IP3, IP4, IP5 mostraron los mayores valores en producción de dióxido de carbono. En lo concerniente a la variable etanol, las cepas con mayor producción fueron T, IC1, IP3, IP4, IP6, IP5.
PALABRAS CLAVE:
Levaduras nativas, Fermentación, Testigo, Eficiencia.
ABSTRACT
This paper's main objective was to evaluate the production of ethanol from nine yeasts isolated and characterized in the Valley with a witness to a Brazilian ingenuity. The evaluation of variables such as temperature, oxygen, carbon dioxide and ethanol during the fermenting process was performed with the aid of HPLC Ecochamber equipment and technique to test the values found. The experimental design was the factor model, and the observation time was transverse in 48 hours, the sample unit was 600 mL of molasses solution with a concentration of 16°Brix whose pH was adjusted to 4,5 by addition of citric acid. The results were analyzed with the statistical program STATGRAPHICS 5.1 by ANOVA with a significance level of 0,05 and the differences with Tukey test. As a notable result was that the temperature and oxygen variables not statistically different values between 24 to 32°C and 6,7 to 20% of respective manner, while IC1, IP3, IP4, IP5 strains showed higher values in carbon dioxide production. With regard to ethanol varies, with higher production strains were T, IC1, IP3, IP4, IP6, IP5.
KEYWORDS: Native yeasts, Fermentation, Witness, Efficiency.
RESUMO
O principal objetivo deste trabalho foi avaliar a produção de etanol a partir de nove leveduras isoladas e caracterizadas no Vale com uma testemunha de um engenho brasileiro. A avaliação das variáveis como a temperatura, oxigénio, dióxido de carbono e de etanol durante o processo de fermentação foi realizada com o auxílio de equipamento de HPLC Ecochamber e técnica para testar os valores encontrados. O desenho experimental foi o modelo de factores, e o tempo de observação foi transversal em 48 horas, a unidade da amostra foi de 600 ml de solução de melaço com uma concentração de 16°Brix, cujo pH foi ajustado para 4,5 por adição de ácido cítrico. Os resultados foram analisados com o programa estatístico STATGRAPHICS 5,1 por ANOVA com nível de significância de 0,05 e as diferenças com teste de Tukey. Como um resultado notável foi que as variáveis de temperatura e de oxigénio não é estatisticamente diferentes valores entre 24 a 32°C e 6,7 a 20% da respectiva forma, enquanto IC1, IP3, IP4, IP5 estirpes apresentaram valores mais elevados em produção de dióxido de carbono. No que diz respeito ao etanol varia, com cepas de produção mais elevados foram T, IC1, IP3, IP4, IP6, IP5.
PALAVRAS-CHAVE: Leveduras nativas, Fermentação, Testemunha, Eficiência.
INTRODUCCIÓN
Las levaduras son hongos unicelulares que pueden ser clasificados en dos grupo filéticos: levaduras ascomicetos asanamórficas y teleomórficas y levaduras basidiomicetos asanamórficas [1].
Debido a su gran diversidad fisiológica pueden crecer en un amplio rango de hábitats. Al ser organismos heterotróficos requieren para su crecimiento nutrientes minerales y una cantidad significativa de carbono orgánico. La variedad de hábitats en los cuales se pueden encontrar levaduras incluyen: suelos, insectos, plantas, frutas, exudados de árboles, algas, ambientes marinos y la atmosfera. De igual manera, su presencia también es común en alimentos manufacturados, bebidas fermentadas, en intestinos de animales entre otros [2].
Las frutas son micro hábitats importantes para una variedad de especies de levaduras en la naturaleza debido a su alta concentración de azúcares simples, bajo pH y la constante visita por insectos vectores [3]. En estos sustratos la sucesión de levaduras está involucrada en varios procesos bioquímicos y ecológicos, incluyendo el deterioro de las frutas. Esto ocurre debido a la habilidad de las levaduras para utilizar rápidamente azúcares simples presentes en los sustratos. La presencia de especies proteolíticas y pectinolíticas sobre estos sustratos puede cumplir un papel muy importante en el establecimiento y mantenimiento de la comunidad levaduriforme [4].
Durante la colonización de las frutas algunos de estos factores pueden conferirle ventajas adaptativas a algunas especies. La presencia de cepas productoras de b-glucosidasa puede contribuir a mejorar las características aromáticas de las frutas, además de ser de importancia biotecnológica para su aplicación en la industria alimenticia [5].
En Colombia existe una investigación relacionada con el aislamiento e identificación de levaduras nativas a partir del plátano con capacidades fermentativas en el departamento de Córdoba, sin embargo, no se conocen más reportes sobre levaduras nativas aisladas para la producción de alcohol [6].
De acuerdo con Salazar et al, (2011) el empleo de este tipo de microorganismo es imprescindible para la producción a escala industrial de biocombustibles, azúcar, metabolitos secundarios, vacunas, entre otros, sin embargo se usan cepas seleccionadas e importadas de otros países [7].
De acuerdo con Salazar et al, (2011) el empleo de este tipo de microorganismo es imprescindible para la producción a escala industrial de biocombustibles, azúcar, metabolitos secundarios, vacunas, entre otros, sin embargo se usan cepas seleccionadas e importadas de otros países [7].
Según Machado (2010), el biocombustible más importante es el alcohol carburante (etanol), el cual puede ser utilizado como oxigenante de la gasolina, elevando su contenido en O, lo que permite una mayor combustión de la misma disminuyendo las emisiones contaminantes de hidrocarburos no oxidados completamente. El Etanol se obtiene a partir de la caña de azúcar en países tropicales como Brasil e India. En algunos países europeos como Francia se utilizan melazas de remolacha azucarera. La materia prima principal para la obtención de Etanol en los EEUU es el almidón [8].
Para Claassen et al. (2011) la biomasa lignocelulósica, que incluye residuos agrícolas, forestales y sólidos urbanos, así como residuos agroindustriales, de la industria de alimentos y de otras industrias, comprende aproximadamente el 50% de la biomasa en el mundo [9]. Esta biomasa de acuerdo a Chum y Overend (2010) es un recurso que puede ser procesado de diferentes formas para la obtención de una gran variedad de productos además del Etanol como gas de síntesis, metanol,hidrógeno y electricidad [10].
El microorganismo más utilizado para la obtención de Etanol es la levadura Saccharomyces cerevisiae, que convierte las hexosas en Etanol en condiciones anaeróbicas, generando 2 moles del compuesto portador de energía en los seres vivos, el adenosín trifosfato (ATP), por cada mol de hexosa consumida además de 2 moles de Etanol. Este microorganismo tiene también la capacidad de convertir las hexosas en CO aeróbicamente, por lo que en dependencia de las concentraciones de O en el medio de cultivo y de la fuente de carbono, se puede favorecer uno de los dos procesos. Las levaduras tienen la ventaja adicional de tolerar concentraciones relativamente altas de Etanol (hasta 150 g·L-1) [9].
Para Moreira y Goldemberg (2010), la principal materia prima para la producción de Etanol es la caña de azúcar, ya sea en forma de jugo de caña o como melazas (subproducto de la industria azucarera). Se pueden obtener cerca de 70 L de Etanol/ton de caña y 9 L de Etanol /ton de melaza grado C, además de cerca de 100 kg de azúcar [11].
El propósito de esta investigación fue evaluar la producción de etanol utilizando un subproducto de la industria azucarera como lo es la melaza y nueve cepas nativas de levaduras del banco levaduriforme de la Universidad de San Buenaventura.
MÉTODO
Activación y selección de levaduras del banco levaduriforme
Preparación de los bioplásticos
Las cepas aisladas y debidamente identificadas fueron almacenadas en un banco de levaduras con un crioprotector (Glicerol). En total se almacenaron 40 cepas de levaduras pertenecientes a diversos géneros y especies. De estas se seleccionaron las 9 cepas de Saccharomyces cerevisiae. Las cepas fueron escogidas especie habitualmente utilizado en la industria por su capacidad fermentativa en la producción de alcohol cuadro 1:
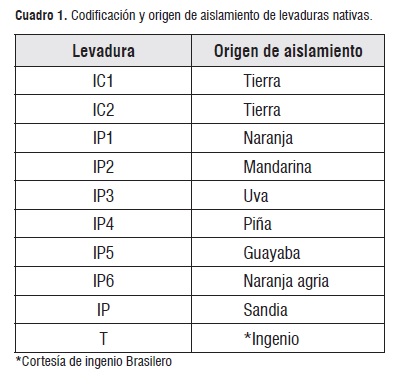
Para la activación se tomó el inóculo de las cepas almacenadas en el banco y fueron crecidas a 30°C en YPD con agitación constante durante 48 horas.
De otra manera, se planteó un diseño experimental unifactorial completamente al azar con tres repeticiones, la unidad muestral correspondió a 600 mL de solución de melaza a 16°Brix, se midieron variables intervinientes en el proceso de fermentación como temperatura, oxígeno dióxido de carbono y crecimiento celular. La variable de respuesta o de interés en la investigación es la producción de etanol en un proceso in batch durante 48 horas, empleando 9 cepas nativas y un testigo proveniente de un ingenio brasilero (cuadro 1:). Los resultados se analizaron con el programa estadístico STATGRAPHICS 5.1®, mediante ANOVA con un nivel de significancia de 0,05 y las diferencias estadísticas con prueba de Tuckey.
Preparación de la melaza
Inicialmente la melaza proveniente del ingenio Providencia del departamento del Valle del Cauca, se disolvió en un beaker con 600 mL de agua destilada hasta alcanzar una concentración de 16°Brix, posteriormente se centrifugó y filtró para eliminar impurezas, después se esterilizó en autoclave a 20 PSI durante 15 minutos y se corrigió la concentración mediante lectura con refractómetro. Se tomó una muestra y se realizó la lectura de los azúcares iniciales de la solución mediante la técnica de cromatografía líquida de alta resolución HPLC, con la ayuda de un equipo Hitachi Elite Lachrom con detector IR (L-2490) ®. La determinación se realizó tanto para azúcares como para etanol de la siguiente manera:
La muestra se centrifugó en tubos eppendorf por 10 minutos a 10000 rpm, el sobrenadante se pasó a través de filtros de membrana 0,22 µm y se inyectaron 20 µl en una columna Agilent Hi-Plex H Ligand Exchange (30 cm x 6,5 mm), tamaño de partícula de 8 µm, acondicionada en el equipo Hitachi Elite Lachrom ®, la temperatura de la columna fue de 65°C alcanzada en un horno (L-2300). El tiempo de corrida del análisis fue de 30 minutos durante los cuales la muestra se efluyó a 0,4 mL min-1 con H2SO4 5 mM de manera isocrática.
Ajuste de pH y adición de nutrientes
La melaza presentó un pH inicial de 6,5 para esta investigación se ajustó a 4,5 con la adición de acido cítrico marca Carlo Erba al 99,5% una vez se agregaron los ingredientes de acuerdo a la siguiente formulación: Urea 4,8 g; fosfato bibásico (Carlo Erba ® 98%) 2,4 g; antiespumante (Genquímicos ® 20%) 6 mL [9,10,11]
Una vez se adicionaron los ingredientes se preparó un inoculo al 30% del volumen de la solución y 1% de levadura, se llevó hasta una temperatura de 30®C, se mcontó la población inicial en cámara de Neubauer, de la misma manera se determinó la población final.
Determinación de condiciones en la cámara Ecochamber
El equipo permitió medir la actividad de las levaduras durante el proceso de fermentación, constaba de una cámara con capacidad de 1,5 L, 4 sensores para medir la temperatura, el dióxido de carbono, el oxígeno y la producción de etanol. Con la ayuda de una plancha y un electroimán se realizó la agitación la cual fue de 120 rpm. La muestra se depositó en su interior y se realizó el cierre hermético de la misma, dando inicio al proceso.
RESULTADOS
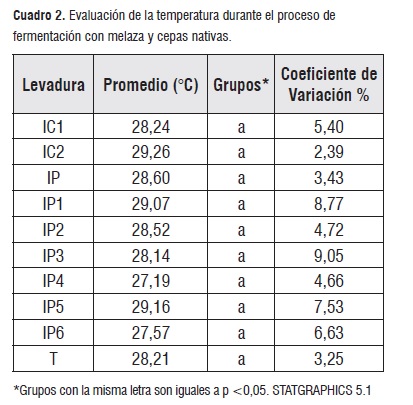
El cuadro 2 indica el comportamiento de la temperatura en el proceso de fermentación de la melaza con las levaduras de estudio, en él se puede apreciar que durante las 48 horas no existieron diferencias significativas entre los grupos de levaduras, por otra parte las levaduras IC1, IC2, IP4 presentaron los mayores valores a las 30 horas, mientras que IP1,IP3, IP en las 36 horas de iniciado el proceso, IP5 y IP6 entre las 42 y 48 horas, y finalmente IP2 y el testigo entre las 12 y 24 horas de manera respectiva. La temperatura se mantuvo entre 24 y 32°C.
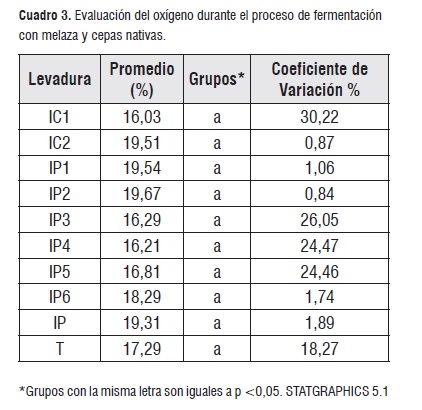
Para la variable oxígeno (O2), no se encontraron diferencias significativas, el rango se mantuvo entre los 6,7% y 20%. El menor porcentaje se observó para IC1, IP3, IP4 en 36 horas, IP2 e IP5 en las 42 horas, IC2 e IP1 en 48 horas, T a las 24 horas, IP6 a las 18 horas y IP a la hora de haber iniciado el proceso (cuadro 3):
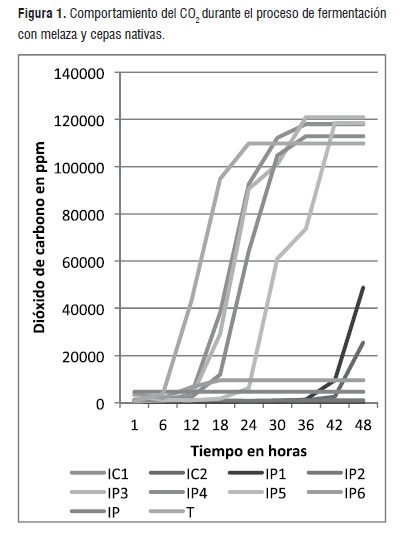
Por otra parte se pudo observar que en la cámara para la variable dióxido de carbono (CO2), en los mismos tiempos indicados anteriormente en el oxígeno, laslevaduras indicaron los valores más representativos, los cuales se hallaron en un intervalo entre 1,07 g/L y 118,6 g/L. Este comportamiento se puede apreciar en la figura 1.
En lo referente al etanol los mayores valores de producción se presentaron a las 36 horas para las levaduras IC1, IP3, IP4, mientras IC2, IP1, IP5 lo indicaron a las 48 horas, IP2,IP6 y T lo hicieron en 18 y 30 horas de manera respectiva, por el contrario IP indicó un valor constante (figura 2). Es importante anotar que la cuantificación del etanol durante las 48 horas se hizo mediante el sensor de la cámara del ecochamber, posteriormente se analizaron las muestras mediante la técnica HPLC al finalizar el proceso para verificar datos con mayor precisión.
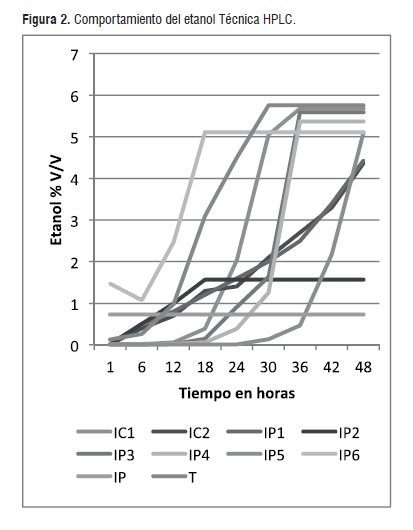
El cuadro 4 muestra la producción de etanol en g/L, de acuerdo a los valores máximos medidos por el sensor en el medio ambiente de la cámara del ecochamber durante el proceso de fermentación. Posteriormente se verificó estos valores con la técnica HPLC, en el medio de fermentación cuyos resultados se reportan el figura 2.
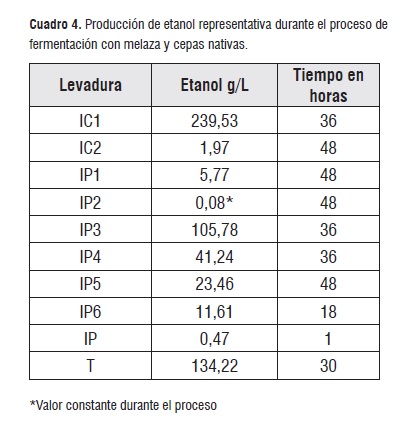
En el cuadro 5 se presentan los resultados para la producción de etanol obtenida mediante la técnica HPLC al finalizar el proceso, en él se puede observar que las cepas T, IC1, IP3, IP4, IP6, IP5 presentan los valores más representativos en la producción de etanol en su orden. IC2 e IP1 indicaron valores iguales, mientras que IP2 e IP obtuvieron los valores más bajos al terminar el proceso. La eficiencia de la reacción en la fermentación para los diferentes tipos de cepas estuvo entre el 14,6 y 96,76%. El primer valor corresponde a la cepa IP, la cual presentó los más bajos porcentajes de consumo en glucosa y fructosa (cuadro 5)
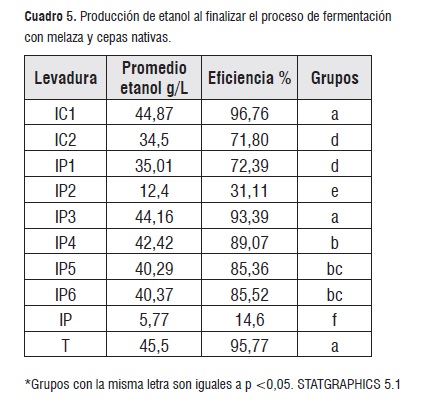
Para determinar el porcentaje de conversión de los azúcares, el cuadro 6 indica las cantidades de fructosa, gluocasa y maltosa que no reaccionaron en el proceso de fermentación a 48 horas. Los valores representativos en glucosa y fructosa corresponden para las cepas IP e IP2 quienes a su vez presentan los valores mas bajos en la producción de etanol y dióxido de carbono(5,04 g/L y 0,99 g/L de manera respectiva).
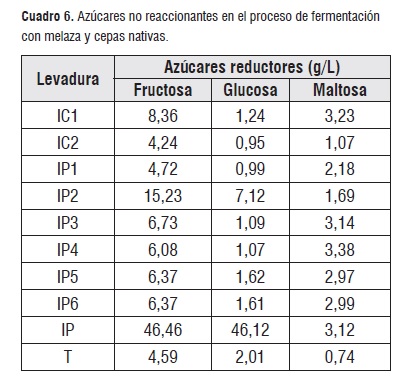
En lo referente a la maltosa IP4, IC1,IP3 e IP presentan similares valores representativos dentro de los grupos de cepas. Los azúcares reductores iniciales en la solución de melaza a 16 °Brix fueron: glucosa: 47,94 g/L; fructosa 50,73 g/L y maltosa 1,58 g/L.
En el cuadro 7 se indica el porcentaje de las cantidades de los azúcares que reaccionaron en la fermentación, los consumos menores de glucosa fueron para las cepas IP2 e IP, mientras las demas cepas presentaron porcentajes similares entre 96 y 98%. Para la fructosa las cepas IP2 e IP indicaron los valores mas bajos, siendo representativos en un intervalo entre 83,52 y 91,64% para las restantes.
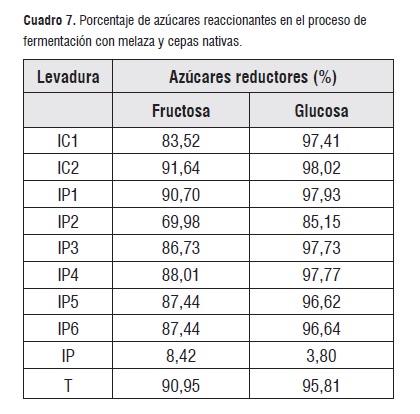
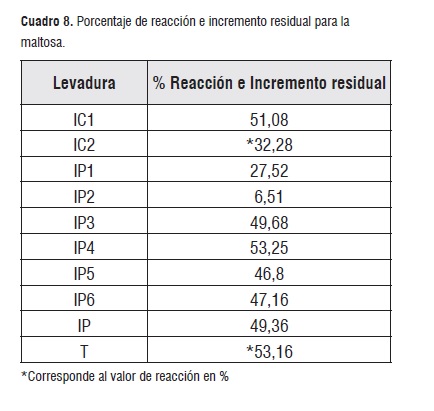
En lo referente a la maltosa se encontró que para las cepas IC2 y T, los porcentajes de azúcares reaccionates fueron 32,28 y 53,16%, no obstante las demas cepas necesitaron incrementos adicionales a las cantidades con que partió el experimento y se pueden observar en el cuadro 8 en el porcentaje de incremento residual, esto se puede explicar como el consumo adicional que tuvieron las cepas a partir de la hidrólisis de otros azúcares como la sacarosa.
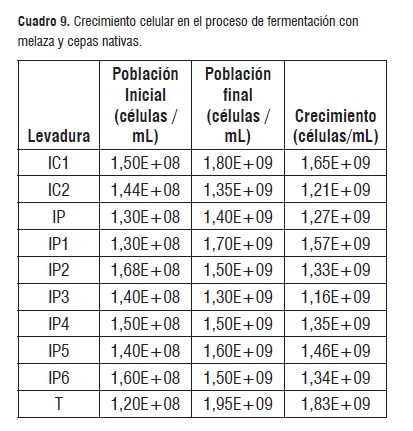
Por otra parte, el cuadro 9 muestra el crecimiento celular obtenido al finalizar el proceso con cada una de las cepas de levaduras, los valores mayores se reportaron para T, IC1, IP1,IP5, IP4, IP6, IP2, por el contrario IP, IC2, IP3 fueron las que presentaron los valores mas bajos. Es importante anotar que las cepas IP e IP1 inician el proceso con la misma población pero el crecimiento reporta valores diferentes y la producción de etanol fue mayor para IP1. Por otro lado IP3 obtuvo el valor mas bajo en crecimiento celular, pero ocupó el tercer lugar en la producción de etanol al finalizar la fermentación.
Las frutas son fuentes importantes de levaduras debido a su gran cantidad de azúcares simples y a la constante visita de vectores. De acuerdo a Skiner et al. (2011) y a Phaff (2011), la microbiota natural de las frutas está compuesta comúnmente de levaduras y hongos levaduriforfmes de los géneros Aureobasidium, Rhodotorula, Sporobo-lomyces, Cryptococcus, Candida, Pichia, Aureobasidium, Rhodotorula, Sporobo-lomyces, Cryptococcus, Candida, Pichia, Hanseniaspora y raramente Saccha-romyces y Schizosaccharomyces[12,13].
Por otra parte la concentración de azúcar y el tipo de microorganismo empleado son factores que influyen en la producción de etanol, ya que en el proceso de fermentación se fermentan los azúcares disponibles en materias primas renovables [14,15].
Peña y Arango (2008) en un sustrato industrial de melaza de caña de azúcar con cepas recombinantes de Saccharomyces cerevisiae obtuvieron la mayor producción de etanol a concentración de 250 g de sacarosa/L. En estas condiciones la cepa GG570- CIBII produjo en promedio 2,34 g/L de etanol más con respecto a la cepa control y en adición, a las 10 horas, produjo 8,02 g/L por arriba de la cepa control. Por otro lado, la cepa GG570-CIBI produjo 3,46 g/L menos que la cepa control, demostrando que la primera cepa es tolerante a la elevada concentración de sacarosa con mayor producción de etanol respecto al testigo a partir de melaza de caña de azúcar. Las eficiencias alcanzadas por las cepas fueron de 98,81 y 97,94% [16].
Experimentalmente se ha demostrado que las concentraciones de oxígeno disuelto y la de azúcares superiores a 0,16 g/L ó 9 g/L, la levadura Saccharomyces cerevisiae mediante el metabolismo oxidoreductivo incrementa la producción de etanol, conocido el fenómeno como efecto Crabtree [17,18].
Las enzimas que participan en la fermentación etanólica son principalmente la piruvato descarboxilasa y la alcohol deshidrogenasa presentes especialmente en Saccharomyces cerevisiae y Zymomonas mobilis, estas últimas presentan mayores rendimientos de etanol comparadas con las primeras con valores de 0,49 y 0,46 g/g respectivamente a 200 rpm, pH 5,0 y temperatura de 30°C a una concentración de 100 g/L de glucosa [19].
Para las condiciones de la presente investigación, la temperatura se mantuvo en valores cercanos a los 30°C, sin embargo incrementó cuando disminuyó el oxígeno y se disparó la producción de dióxido de carbono, lo cual obedece a que el metabolismo celular de la levadura inicia la fermentación cuando existe una atmósfera oxidoreductora, así mismo en esta etapa se encontró la mayor producción de etanol para cada una de las cepas. De igual forma se pudo observar que la producción de etanol está íntimamente ligada al consumo de azúcares reductores en especial glucosa, más no al crecimiento celular, lo cual se pudo inferir con el comportamiento de la cepa IP3, que reportó el valor más bajo en crecimiento celular pero una producción representativa en la elaboración de etanol al finalizar el proceso.
La técnica HPLC fué más precisa en la cuantificación del etanol al compararse con el sensor de la cámara Ecochamber.
CONCLUSIONES
El porcentaje de conversión o eficiencia fue mayor para las cepas nativas IC1, IP3, IP4, IP6, IP5.
La producción promedio de etanol obtenido al finalizar el proceso para las cepas anteriormente en mención estuvo entre 44,87 y 40,29 g/L.
Las variables de control, temperatura y oxígeno no presentaron diferencias significativas en el proceso por parte de las diferentes levaduras nativas.
Los valores para la variable dióxido de carbono se encontraron en un intervalo entre 1,07 y 118,6 g/L.
La producción de etanol se encuentra asociada fundamentalmente con el consumo de azúcares reductores en especial glucosa por el microorganismo empleado como la levadura. Por lo que la eficiencia de la reacción química se encuentra en función de las condiciones adecuadas a las que se someta el microorganismo.
AGRADECIMIENTOS
Este trabajo se realizó gracias a la financiación por parte de la Universidad de San Buenaventura-Cali.
REFERENCIAS
[1] BOEKHOUT, T., KURTZMAN, C.P. and FELL, J.W. The Yeasts: a Taxonomic Study. Elsevier, 2(5),2011, p. 270-279 [ Links ]
[2] DUARTE, F.L., BALEIRAS-COUTO, M.M. and ZANOL, G. Restriction profiles of 26S rDNA as a molecular approach for wine yeasts identification. Ciência e Técnica Vitivinícola, 25, 2010, p.75-85. [ Links ]
[3] SWANGKEAW, J., VICHITPHAN, S., BUTZKE, C. and VICHITPHAN, K. Characterization of bglucosidases from Hanseniaspora sp. and Pichia anomala with potentially aroma-enhancing capabilities in juice and wine. activity in yeasts of oenological origin. World Journal of Microbiology and Biotechnology, 27, 2011, p. 423–430. [ Links ]
[4] TRINDADE, R.C., RESENDE, M.A., SILVA, C.M. and ROSA, C.A. Yeasts associated with fresh and frozen pulps of Brazilian tropical fruits. System Applied Microbiology, 25, 2012, p. 294–300. [ Links ]
[5] ROMO-SÁNCHEZ, S., ALVES-BAFFI, M., ARÉVALO-VILLENA, M., ÚBEDA-IRANZO, J. and BRIONES-PÉREZ, A. Yeast biodiversity from oleic ecosystems: Study of their biotechnological properties. Food microbiology, 27, 2010, p. 487- 492. [ Links ]
[6] ZUMAQUE, L., MANTILLA, C. y PANTOJA, M. Levaduras autóctonas con capacidad fermentativa en la producción de etanol a partir de la pulpa de excedente de plátano Musa en el Departamento de Córdoba. Revista Colombiana de Biotecnología, 11, 2009, p. 40-47. [ Links ]
[7] SALAZAR, B., CAMIRUAGA, A.I., GARCÍA, O., GARCÍA, D.B. y FAVILA, H.J. Consumo y conocimiento actual de una bebida fermentada tradicional en Ixtapan del Oro, Mexico. Alteridades, 22, 2012, p. 313-349. [ Links ]
[8] MACHADO, M.C. Situación de los biocombustibles de 2da y 3era generación en América latina y el Caribe. Brasilia (Brasil): Organización Latinoamericana de Energía- IICA, 2010, 104 p. [ Links ]
[9] CLAASSEN, P., VAN, J., LÓPEZ, A., SIJTSMA, L., STAMS, A., DE VRIES, S. and WEUSTHUIS, R. Utilisation of biomass for the supply of energy carriers. Applied Microbiology and Biotechnology,52, 2011, p. 741-755. [ Links ]
[10] CHUM, H.L. and OVEREND, R.P. Biomass and renewable fuels. Fuel Process Technology, 71, 2010, p. 187-195. [ Links ]
[11] MOREIRA, J. and GOLDEMBERG, J. The alcohol program: United States experience with gasoline additives. Energy Policy, 29, 2010, p. 1-5. [ Links ]
[12] SKINNER, F.A., PASSMORE, S.M. and DAVENPORT, R.R. Biology and Activities of Yeasts. 2 ed. London (England): Academic Press, 2010, p. 37-54. [ Links ]
[13] PHAFF, H.J. Specific habitats of yeasts and their isolation. USFCC Newsletter, 18(4), 2011, p. 11-12. [ Links ]
[14] COLOMBIA. FEDERACIÓN NACIONAL DE BIOCOMBUSTIBLES. ABC de los alcoholes carburantes [online]. Disponible: http://www.minminas. gov.co/sectores.nsf. [citado 23 de Mayo del 2013] [ Links ]
[15] SOLICLIMA ENERGIA SOLAR. El etanol como biocombustible [online]. Disponible: http://news. soliclima.com/modules.php?[citado 12 de Junio del 2013] [ Links ]
[16] PEÑA, C. y ARANGO, R. Evaluación de la producción de etanol utilizando cepas recombinantes de Saccharomyces cervisiae a partir de melaza de caña de azúcar. Dyna, 159, 2008, p. 153-161. [ Links ]
[17] GONZALEZ, R., BARCENILLA, J. y TABERA, L.Cepas vínicas de Saccharomyces cervisiae con bajo rendimiento en etanol. Revistas de Enología, 86, 2010, p. 36-45. [ Links ]
[18] HIDALGO, J. Tratado de Enología. 2 ed. México (México): Ediciones Mundi- Prensa, p. 27-45. [ Links ]
[19] GENG, A. and ZHANG, W. Improved ethanol production by a xylose fermented yeast strain constructed through a modified genome shuffling method. Biotechnology for biofuels, 5, 2012, p. 56-68. [ Links ]













