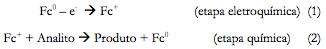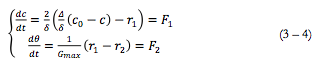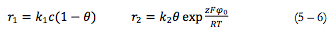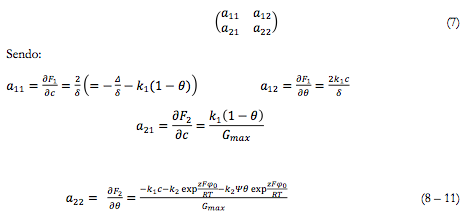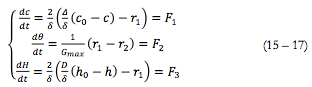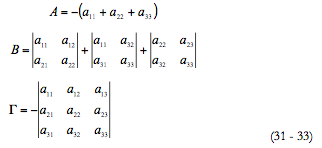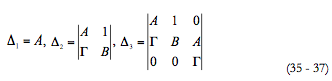Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Químico - Farmacéuticas
versão impressa ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.43 no.1 Bogotá jan./jun. 2014
https://doi.org/10.15446/rcciquifa.v43n1.45463
http://dx.doi.org/10.15446/rcciquifa.v43n1.45463
Artículo de investigación científica
Modelagem matemática do desempenho de elétrodos, modificados por camada de ferroceno, nos processos da eletrooxidação de compostos orgânicos em meios neutro e ácido
Modelación matemática del comportamiento de electrodos, modificado por los procesos de la capa de ferroceno en la electro-oxidación de los compuestos orgánicos en medios neutros y ácidos
Volodymyr V. Tkach1, Reza Ojani2, Vasyl´V. Nechyporuk1, Petró I. Yagodynets1, Aline M. da Rocha3
1Universidade Nacional de Chernivtsi, Ucrânia
2Universidade de Mazandarã, Babolsar, Irã
2Universidade Federal de Minas Gerais, Brasil
Recibido para evaluación:Febrero 10 de 2013
Aceptado para publicación:Mayo 15 de 2014
RESUMO
O comportamento de elétrodos modificados por camada de ferroceno nos processos da eletrooxidação de certos compostos orgânicos em meios neutro e ácido foi descrito matematicamente, sendo os modelos correspondentes analisados por meio da teoria de estabilidade linear e da análise de bifurcações. Através da comparação dos modelos foi avaliada a influência do pH ao comportamento dos elétrodos, modificados por ferroceno.
Palavras-chave: ferroceno, potencial de hidrogênio, sensores eletroquímicos, oscilações eletroquímicas, estado estacionário estável
SUMMARY
The behavior of the electrodes modified by ferrocene layer in the electrooxidation of certain organic compounds in neutral and acid media was mathematically described and the mathematical models were analyzed by linear stability theory and bifurcation analysis. Comparing the models, the influence of pH on the electrodes´ behavior was evaluated.
Key words: ferrocene, hydrogen potential, electrochemical sensors, electrochemical oscillations, stable steady-state
INTRODUÇÃO
Ferroceno e derivados são compostos orgânicos aromáticos, cujo comportamento eletroquímico atrai interesse [1-11], devido à sua composição:
Sendo os compostos eletroquimicamente ativos, já são amplamente usados em sensores e biossensores [1-7, 11-19], como monômeros em polímeros condutores [8-10, 20-23] e nos revestimentos modificadores de elétrodos [24-27].
O desempenho de sensores e biossensores, baseados em ferroceno e derivados consiste em duas etapas:
A etapa (1) cinética e dinamicamente não depende do pH [2], mas na etapa (2) podem ser envolvidos os compostos, cuja oxidação depende do pH, por isso o comportamento de elétrodos modificados por ferroceno pode depender do pH em casos diferentes. O mesmo pode observar-se para os polímeros condutores [28-40], cujo comportamento no caso se assemelha ao dos revestimentos de ferrocenos, o que pode dar para pensar que as instabilidades eletroquímicas, possíveis para o caso de polímeros condutores vão realizar-se também no caso de ferroceno. Para ver se eles se realizam, determinar o porquê da sua aparição e fundamentalizar o conhecimento do desempenho da camada de ferroceno no processo e da sua ação catalítica, é preciso construir um modelo matemático, capaz de descrever adequadamente os processos no sistema. Vários modelos têm sido construídos para o caso de sensores, baseados em polímeros condutores [41-49]. Neste trabalho, vem sendo apresentado o modelo matemático do desempenho da camada de ferroceno na eletrooxidação de certos compostos orgânicos.
Geralmente, os modelos para os casos de ferroceno e dos polímeros condutores não diferem muito, sendo o fato provado pelo terceiro teorema de semelhança: os sistemas semelhantes descrevem-se por equações semelhantes, apresentando, porém, algumas diferenças.
O SISTEMA E O MODELO (CASO DO MEIO NEUTRO)
Para descrever o sistema de eletrooxidação de um composto orgânico em meio neutro no mo do potenciostático, mediada pela camada de ferroceno, introduzem-se as duas variáveis:
c - a concentração do composto orgânico na camada pré-superficial;
θ - a concentração de espécies neutras de ferroceno.
Como nos casos anteriores, para simplificar a modelagem, supõe-se que o líquido esteja agitando-se intensamente e que o eletrólito de suporte esteja em excesso para menosprezar as influências hidrodinâmicas e despesas do dopante. Ademais, supõe-se que a camada pré-superficial tenha o perfil concentracional linear e espessura constante, igual a &.
Como no caso da camada do polímero condutor, o sistema para o meio neutro e modo potenciostático, descreve-se pelo sistema de equações a seguir:
As equações (3) e (4) representam balanço da concentração pré-superficial da substância oxidada (analito no caso de sensores e biossensores) e da forma neutra de ferroceno. Δ representa o coeficiente de difusão da substância orgânica. c0 a sua concentração no interior da solução, r1 e r2 são as velocidades de reações (2) e (1) correspondentemente. Gmax é a concentração máxima de ferroceno na camada.
As velocidades de reações (2) e (1) podem calcular-se como:
Sendo k1 e k2 as constantes de respectivas reações, z a quantidade de elétrons transferidos, F= NA*e, φ0 o salto do potencial, relativo ao potencial de carga zero.
RESULTADOS E DISCUSSÃO (SEÇÃO I)
A fim de investigar o comportamento do sistema com a eletrooxidação de um composto orgânico sobre o elétrodo, modificado por ferroceno, analisamos o sistema de equações diferenciais (3 - 4) por meio da teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são calculados para um estado estacionário pode descrever-se como:
Sendo ψ o parâmetro que descreve a influência da oxidação eletroquímica sobre a dupla camada elétrica.
Para simplificar o jacobiano, introduzem-se as novas variáveis, de modo que o determinante da matriz se escreve conforme:
Sendo o parâmatro κ o representante da difusão, ξ1 e ξ2 os representantes da etapa química e o X, o representante da oxidação de ferroceno.
A estabilidade de estado estacionário. A condição principal de estabilidade de estado estacionário é Det J>0 (a condição Tr J<0 satisfaz-se na maioria dos casos). Resolvendo a inequação na base do determinante de jacobiano, obter-se-á o valor crítico do parâmetro de difusão, relativo à margem entre os estados estacionários estáveis e instáveis:
Como as variáveis ξ1 e ξ2 sempre têm valores positivos e a variável X, na maioria dos casos, também, o requisito (13) satisfar-se-á na região topológica ampla. Ela é referente ao trecho linear da curva parâmetro eletroquímico - concentração, no caso de utilisação analítica do processo de oxidação. O sistema permanece num dos estados estacionários estáveis, sendo o processo controlado pela difusão (pois o impacto das reações química e eletroquímica à estabilidade e instabilidade de estado estacionário é igual e o valor do módulo da fração na parte direita da inequação permanece alto), o que vai ao encontro do descrito no artigo [2].
Complicar-se-á a análise no caso da negatividade da variável X, o que pode acontecer se o analito ou mediador é redutor forte e polar
a) A primeira etapa é devagar.
O caso muito frequente na eletrooxidação ou detecção de álcoois. O valor de ξ1 permanece alto, haja vista a regeneração de centros ativos na reação (1). Então, em concentrações baixas, em condição de ξ2<X a expressão à direita terá valor negativo e a estabilidade de estado estacionário definir-se-á pela difusão, conforme o descrito acima.
Outra interpretação aceitável é que nas concentrações baixas a reação da primeira etapa é relativamente mais rápida que a difusão e esta dará mais impacto à estabilidade do processo que aquela, pois deve ser rápida bastante para compensar a desaparição do analito por meio da reação.
Em concentrações altas, sob a condição de ξ2 > X, a fração terá valor negativo e a expressão, positivo. Os altos valores de ξ1 e ξ2 farão com que a o principal impacto à estabilidade do estado estacionário tenha a reação da primeira etapa, pois, sendo relativamente devagar, deve ser rápida bastante para compensar a aparição de novas porções do analito na camada pré-superficial. Posto assim, em concentrações altas, a estabilidade de estado estacionário definir-se-á pela primeira etapa. Isto vai ao encontro do observado experimentalmente nos trabalhos [28 - 30] para os revestimentos de polímeros condutores.
b) A primeira etapa é rápida
Sendo a primeira etapa rápida, os valores de ξ1 e ξ2 são altos, o caso parece ser semelhante ao descrito para a lentidão da primeira etapa e concentrações altas, mas, como agora esta é rápida, as novas porções de analito que vêm à camada pré-superficial desaparecem rapidamente. Assim sendo, o impacto principal à estabilidade de estado estacionário dar-se-á pela difusão.
A instabilidade monotônica para este sistema é possível no caso da nulidade da variável X, o que é definido pela igualdade da influência da reação da eletroxidação à dupla camada elétrica à da atração entre a camada de ferroceno e a superfície de elétrodo. Acrescenta-se também a condição da não nulidade do parâmetro ξ2.
A instabilidade de Takens e Bogdanov, que determina o deslocamento para o comportamento caótico não é possível para o sistema. Sendo a sua condição
é muito fácil observar que, satisfazendo-se a condição de Det J = 0 (a nulidade da variável X), não se satisfará a condição de Tr J =0 (o valor do traço permanecerá negativo).
A instabilidade oscilatória, cuja condição principal é Tr J = 0, ocorre só ao haver na diagonal principal do jacobiano os elementos que descrevem a positiva conexão de retorno.
O único elemento, capaz de ser positivo, é o -X, que pode sê-lo no caso da negatividade do parâmetro ψ. Assim sendo, na ausência de etapas autocatalíticas, o comportamento oscilatório será causado apenas pelas influências da oxidação eletroquímica sobre a dupla camada elétrica. Esta causa, geral para os sensores, baseados em polímeros condutores [41-49], é válida também para a camada de ferroceno.
Etapas autocatalíticas. Impossíveis para o ferroceno puro, mas possíveis para a participação de ferrocenos substituídos. Caso a reação na primeira etapa seja autocatalítica, alterar-se-á o modelo, conforme descrito nos trabalhos anteriores [41 - 44]. A etapa autocatalítica será mais uma causa do comportamento oscilatório.
Sendo usado o polímero ferrocênico, podem facilmente usar-se os modelos, desenvolvidos para o caso de polímeros condutores [41-49].
CONCLUSÕES (SEÇÃO I)
1. No processo da oxidação eletrocatalítica de substâncias orgânicas sobre elétrodos, modificados pela camada de ferroceno, foi confirmada a presença de estruturas dissipativas temporais, cuja existência, como no caso de polímeros condutores, é mantida pela difusão da substância orgânica e pela eletrooxidação.
2. A estabilidade de estado estacionário, no caso da rapidez da etapa química e no caso da sua lentidão (sendo as concentrações baixas), é controlada pela difusão. Contudo, no caso da lentidão da primeira etapa e alta concentração do analito, a estabilidade de estado estacionário controlar-se-á pela reação da primeira etapa.
3. A instabilidade monotônica é possível no caso da igualdade da influência da reação da eletroxidação à dupla camada elétrica à da atração entre a camada de ferroceno e a superfície de elétrodo.
4. A instabilidade oscilatória pode ser causada pela mesma causa que no caso de uso dos polímeros condutores, que são as influências de reações eletroquímicas sobre a dupla camada, e pelas etapas autocatalíticas, se as houver.
5. A instabilidade de Takens e Bogdanov não é possível para este sistema, haja vista a incoincidência de condições das instabilidades oscilatória e monotônica.
A DESCRIÇãO MATEMÁTICA DO PROCESSO DA OXIDAÇÃO ELETROCATALÍTICA EM MEIO ÁCIDO
O modelo descrito na seção anterior só é válido para o caso do meio neutro e, em alguns casos, alcalino (não sendo tomada em conta a entrada de hidroxila na matriz polimérica).
Apesar de a reação da oxidação de ferroceno não ser influenciada pelo potencial de hidrogênio, este pode afetar a cinética da primeira etapa. Assim sendo, em meio ácido o comportamento do sistema se acomplica. Assim, para descrever o comportamento do sistema, introduzem-se as 3 variáveis:
c - a concentração do composto orgânico na camada pré-superficial;
θ - a concentração de espécies neutras de ferroceno;
h - a concentração de prótons na camada pré-superficial.
supondo o suposto acima.
O comportamento do sistema, neste caso, descreve-se pelas 3 equações de balanço:
Sendo D o coeficiente da difusão dos prótons, h0 a sua concentração no interior da solução.
Como a eletrooxidação da camada ferrocênica não é pH-dependente (o que não é o caso de polímeros condutores de compostos heterocíclicos e, especialmente, seus derivados), a participação de prótons é possível apenas na primeira etapa, a velocidade de cuja reação agora poderá calcular-se como:
RESULTADOS E DISCUSSÃO (SEÇÃO II)
A fim de investigar o comportamento do sistema, analisamo-lo por meio da teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são calculados para o estado estacionário pode ser descrita como:
Com a simplificação, vinda por meio da introdução de novos parâmetros, a matriz descrever-se-á como:
Para determinar as condições do estado estacionário estável, vamos usar o critério de Routh e Hurwitz. A equação caraterística do sistema de equações (5 - 7) pode ser descrita como
θ3+ Îθ2+Îθ+ Γ=0 (30)
Sendo que
O critério de Routh e Hurwitz requer que para um estado estacionário estável os menores dos membros da diagonal principal da matriz de Hurwitz
sejam positivos. Os menores dos membros da diagonal principal da matriz:
Visto que Δ3= ΓΔ2, podemos formar a condição do estado estacionário estável como Γ>0. Resolvendo a inequação relativamente ao parâmetro de difusão de analito κ, obtemos o valor marginal, que define a "fronteira" entre os estados estacionários estáveis e instáveis:
Assim sendo, em meio ácido a estabilidade de estado estacionário também será regida pela difusão, sendo a difusão não só da substância orgânica (analito), mas também dos prótons (aumento do valor de numerador e do valor de denominador da fração), o que vai ao encontro dos dados, expressos no artigo.
Esta margem é correspondente à instabilidade monotônica, que, como no caso anterior, acontece no caso da nulidade da variável X, ou seja, no caso da igualdade da influência da reação da eletroxidação à dupla camada elétrica à da atração entre a camada de ferroceno e a superfície de elétrodo.
A instabilidade oscilatória, como no caso anterior, também pode ser causada única e exclusivamente pelo efeito da oxidação eletroquímica sobre a dupla camada elétrica, expresso pela negatividade da variável X.
Etapas autocatalíticas. O modelo sofre alterações, conforme descrito nos trabalhos anteriores [41-44], seja a formação autocatalítica dos prótons ou de um dos produtos de oxidação. A etapa autocatalítica será mais uma causa do comportamento oscilatório.
Reação lateral. São frequentes os casos da oxidação eletroquímica no meio ácido de substâncias, capazes de reagir com os prótons. Por exemplo, no caso de glutationa [2], a eletrocatálise, realizada em diferentes meios correu melhor no caso do pH neutro, devido ao equilíbrio de ocorrência de reações laterais. No caso da sua aparição, o modelo sofre alterações, acrescentando-se-lhe às equações primeira e terceira o elemento -r3, descrevendo a reação entre o analito e os prótons.
As reações laterais levemente alteram as condições de estabilidade de estado estacionário, bem como as de instabilidade monotônica, não alterando, todavia, as da instabilidade oscilatória. Apesar de ser mais complicado, o comportamento do elétrodo, modificado por ferroceno para o meio ácido aparece semelhante ao comportamento no meio neutro.
Esta modelagem pode servir para prever o comportamento não só do sensor concreto, descrito em [2], mas também para os sensores análogos, inclusive os ainda não desenvolvidos.
CONCLUSÕES (SEÇÃO II)
- 1. No processo da oxidação eletrocatalítica de substâncias orgânicas sobre elétrodos, modificados pela camada de ferroceno no meio ácido, como no meio neutro, foi confirmada a presença de estruturas dissipativas temporais, cuja existência, como no caso de polímeros condutores, é mantida pela difusão da substância orgânica e pela eletrooxidação. O comportamento no meio neutro é mais simples que no ácido, mas lhe permanece semelhante.
- 2. A estabilidade de estado estacionário neste sistema é regida pela difusão do analito e dos prótons.
- 3. A instabilidade monotônica é possível no caso da igualdade da influência da reação da eletroxidação à dupla camada elétrica à da atração entre a camada de ferroceno e a superfície de elétrodo.
- 4. A instabilidade oscilatória pode ser causada pela mesma causa que no caso de uso dos polímeros condutores, sendo ela as influências de reações eletroquímicas sobre a dupla camada, e pelas etapas autocatalíticas, se as houver.
- 5. A melhor eficiência da camada ferrocênica como eletrocatalisador da oxidação de glutationa no pH neutro explica-se pelo fato do equilíbrio de reações laterais entre o meio reacional e a molécula de glutationa.
REFERÊNCIAS
1. R. Hosseinzadeh, R. Ojani, L. Shabani, Synthesis and electrochemical study of some novel alkynylferrocene derivatives, Curr. Chem. Lett., 3, 37-42 (2014). [ Links ]
2. J.B. Raoof, R. Ojani, H. Karimi-Maleh, Multi-wall carbon nanotubes as a sensor and ferrocenedicarboxylic acid as a mediator for voltammetric determination of glutathione in hemolysed erythrocyte, Anal. Methods, 3, 2637-2643 (2011). [ Links ]
3. A. Togni, T. Hayashi, "Ferrocenes: Homogeneous catalysis, organic synthesis, materials science", VCH, Weinheim, 1995. [ Links ]
4. B. Brielbeck, M. Frede, E. Stechhan, Continuous electroenzymatic synthesis employing the electrochemical enzyme membrane reactor, Biocatalysis, 10, 49-64 (1994). [ Links ]
5. J.E. Kingston, L. Ashford, P.D. Beer, M.G.B. Drew, Anion recognition and sensing by neutral and charged transition metal co-ordinated ferrocene phosphine amide receptors, J. Chem. Soc. Dalton. Trans., 2, 251-258 (1999). [ Links ]
6. P.D. Beer, J. Cadman, J.M. Llois et. al., Anion interaction with ferrocene-functionalised cyclic and open-chain polyaza and aza-oxa cycloalkanes, J. Chem. Soc. Dalton. Trans., 3, 1805-1812 (2000). [ Links ]
7. C. Valerio, E. Alonso, J. Ruiz et. al., Ein polykationisches metallodendrimer mit 24 [Fe(5-C5Me5)(6-N-alkylanilin)]+- endgruppen zur erkennung von chlorid und bromid, Angew. Chem., 111, 1855-1859 (1999). [ Links ]
8. J.C. Moutet, E. Saint-Aman, M. Ungureanu, T. Visan, Electropolymerization of ferrocene bis-amide derivatives: A possible route to an electrochemical sensory device, J. Electroanal. Chem., 410, 79-85 (1996). [ Links ]
9. A. Naji, M. Cretin, M. Persin, J. Sarrazin, Preparation of membranes by electropolymerization of pyrrole functionalized by a ferrocene group, J. Appl. Polym. Sci., 91, 3947-3958 (2004). [ Links ]
10. C. Horwitz, N. Suhu, G.C. Dailey, Synthesis, Characterization, and electropolymerization of ferrocene substituted anilines, J. Electroanal. Interf. Chem., 1991 [ Links ]
11. G. Li, Y. Wang, H. Xu, A hydrogen peroxide sensor prepared by electropolymerization of pyrrole based on screen-printed carbon paste electrodes, Sensors, 7, 239-250 (2007). [ Links ]
12. C. Valerio, J.-L. Fillaut, J. Ruiz et. al., The dendritic effect in molecular recognition: Ferrocene dendrimers and their use as supramolecular redox sensors for the recognition of small inorganic anions, J. Am. Chem. Soc., 119, 2588-2589 (1997). [ Links ]
13. J. Fan, Q. Zhang, K. Wang et. al., Ferrocene functionalized grapheme: Preparation, characterization and efficient electron transfer toward sensors of H2O2, J. Mater. Chem., 22, 6165-6170 (2012). [ Links ]
14. L. Devlin, M. Jamal, K. M. Razeeb, Novel pH sensor based on anthraquinone-ferrocene modified free standing gold nanowire array electrode, Anal. Methods, 5, 880-884 (2013). [ Links ]
15. N. Shim, D. Bernards, D. Macaya et. al., All-plastic electrochemical transistor for glucose sensing using a ferrocene mediator, Sensors, 9, 9896-9902 (2009). [ Links ]
16. R. Mohammad, M. Ahmad, L. Yook-Heng, Sensors, 13, 10014-10026 (2013). [ Links ]
17. L. Lvova, P. Galloni, B. Floris et. al., A ferrocene-porphyrin ligand for multi-transduction chemical sensor development, Sensors, 13, 5841-5856 (2013). [ Links ]
18. A. Thakur, S. Sardar, S. Ghosh, Click-generated triazole based ferrocene-carbohydrate bioconjugates: A highly selective multisignaling probe for Cu(II) ions, J. Chem. Sci., 124, 1255-1260 (2012). [ Links ]
19. G. Mirri, "Ferrocene-based electrochemical chiral sensors", Ph. D. Thesis, University of Birmingham, 2011. [ Links ]
20. H. Plenio, J. Hermann, J. Leukel, Synthesis of soluble 1,3-bridged ferrocene-acetylene polymers and the divergent-convergent synthesis of defined oligomers, J. Eur. Inorg. Chem., 1998(12), 2063-2069 (1998). [ Links ]
21. S. Barlow, D.O. Hare, Metal-metal interactions in linked metallocenes, Chem. Rev., 97, 637-370 (1997). [ Links ]
22. D. Albagi, G. Bazan, M.S.Wrighton et. al., Well-defined redox-active polymers and block copolymers prepared by living ring-opening metathesis polymerization, J. Am. Chem. Soc., 114, 4150-4158 (1992). [ Links ]
23. N. Nguyen, A.F. Diaz, Electrochemical and electrochromic properties of poly(dialkylsilyleneferrocenylene) films, Chem. Mater., 5, 952-954 (1994). [ Links ]
24. M.E. Ghica, C.M.A. Brett, Development of a carbon film electrode ferrocene-mediated glucose biosensor, Anal. Lett., 38, 907-920 (2005). [ Links ]
25. S. Takahashi, J. Anzai, Recent progress in ferrocene-modified thin films and nanoparticles for biosensors, Materials, 6, 5742-5762 (2013). [ Links ]
26. F. Arslan, A. Yasar, E. Kiliç, Preparation of Pt/Polypyrrole-ferrocene hidrogen peroxide sensitive electrode for the use as a biosensor, Russ. J. Electrochem., 42, 137-140 (2006). [ Links ]
27. M. Kamyabi, F. Aghajanloo, Electrocatalytic response of dopamine at a carbon paste electrode modified with ferrocene, Croat. Chim. Acta, 82, 599-606 (2009). [ Links ]
28. V.M. de Andrade, "Confecção de biossensores através da imobilização de biocomponentes por eletropolimerização de pirrol", Tese de Mestrado em Engenharia, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2006. [ Links ]
29. A. Ramanavicius, A. Ramanaviciene, A. Malinauskas, Electrochim. Acta, 51, 6025-6037 (2006). [ Links ]
30. T. McQuade, A. Pullen, T.M. Swager, Conjugated polymer based Chemical Sensors, Chem. Rev., 100, 2537-2574 (2000). [ Links ]
31. S. Takeda, H. Yagi, S. Mizuguchi, H. Funahashi, H. Shiigi, T. Nagaoka, A highly sensitive amperometric adenosine triphosphate sensor based on molecularly imprinted overoxidized polypyrrole, J. Flow Injection Anal., 25, 77-79 (2008). [ Links ]
32. O. Korostynska, K. Arshak, E. Gill, A. Arshak., Sensors, 7, 3027-3042 (2008). [ Links ]
33. R. Singh, Prospects of organic conducting polymer modified electrodes: Enzymosensors, Int. J. Electrochem., Article ID 502707, doi: 10.1155/2012/502707 (2012). [ Links ]
34. D. Zane, G.B. Appetecchi, C. Bianchini, S. Passerini, A. Curulli, An impedimetric glucose biosensor based on overoxidized polypyrrole thin film, Electroanal., 23(5), 1134-1141 (2011). [ Links ]
35. J.P. Tosar Rovira, "Estudio de la inmovilización de oligonucleótidos a electrodos modificados de oro:polipirrol, y detección electroquímica de secuencias complementarias", Tesis de Licenciatura en Bioquímica, Universidad de la República, Montevideo, 2008. [ Links ]
36. Y. Oztekin, A. Ramanaviciene, Z. Yazicigil, A.O. Solak, A. Ramanavicius, Direct electron transfer from glucose oxidase immobilized on polyphenanthroline modified-glassy carbon electrode, Biosens. Bioelectron., 26, 2541-2546 (2011). [ Links ]
37. N. Gupta, S. Sharma, I.A. Mir, D. Kumar, Advances in sensor based on conducting polymer, J. Sci. Ind. Res., 65, 549-556 (2006). [ Links ]
38. R. Ojani, J. B. Raoof, S.R. Hosseini, Electrocatalytic oxidation of methanol on carbon paste electrode modified by nickel ions dispersed into poly (1,5-diaminonaphthalene) film, Electrochim. Acta, 53, 2402-2407 (2008). [ Links ]
39. M. StoÄes, K. Kalcher, I. Å vancara, K. VytÅas, A new biosensor for glucose based on carbon paste and enzyme immobilized onto polyaniline fillm, Int. J. Electrochem. Sci., 6, 1917-1926 (2006). [ Links ] 40. R. Ojani, J.B. Raoof, A. Ahmady, S.R. Hosseini, Electrochemical detection of hydrazine using a copper oxide nanoparticle modified glassy carbon electrode, Casp. J. Chem., 1, 74-85 (2013). [ Links ]
41. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets´, A investigação matemática do desempenho de biossensores eletroquímicos enzimáticos baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 41, 203-216 (2012). [ Links ]
42. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets´, El estudio de estabilidad en el proceso del desempeño de los sensores y biosensores, basados en los polímeros conductores en medio fuertemente ácido, Rev. Colomb. Cienc. Quím. Farm., 42, 30-41 (2013). [ Links ]
43. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets´, A descrição matemática do processo da detecção de duas substâncias com um grupo funcional comum pelos sensores e biossensores eletroquímicos baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 42, 215-225 (2013). [ Links ]
44. V. Tkach, V. Nechyporuk, P. Yagodynets´, Mathematical model of the work of the mediated conducting polymer sensors with the use of the polymers of heterocyclic compounds, Rev. Soc. Quím. Perú., 77, 259-266 (2011). [ Links ]
45. V. Tkach, V. Nechyporuk, P. Yagodynets´, I. Rusnak, The CP-based electrochemical biosensors with autocatalytic stage in their function and the mathematical description of their work, Orbital Elec. J. Chem., 4, 136-145 (2012). [ Links ]
46. V. Tkach, V. Nechyporuk, P. Yagodynets´, Livro de resumos do XVIII Encontro Luso-Galego de Química, Universidade de Trás-os-Montes e Alto Douro, Vila Real, Portugal, 28 a 30 de novembro de 2012, p. 29. [ Links ]
47. O.T. Slipenyuk, V.V. Nechyporuk, P.I. Yagodynets´, V.V. Tkach, Proceedings of the 1st Symposium in Medicinal Chemistry of the University of Minho, May 17, 2013, Braga, Portugal, p. 95. [ Links ]
48. V. Tkach, V. Nechyporuk, P. Yagodynets´, Abstract book of the 7th Nanoscience and Nanotechnology conference, June 26th-July 1st, 2011, Sabancι University, Istanbul, p. 173. [ Links ]
49. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets, Al. M. da Rocha, 2nd International Conference "Advances in Heterocyclic Chemistry", September 25-27, 2011, Tbilisi, Georgia, p. 126-127. [ Links ]




![Assessment of the anticonvulsant activity of pyrazolo[1,5-a][1,3,5]triazines obtained by synthesis](/img/pt/prev.gif)