Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombian Journal of Anestesiology
versão impressa ISSN 0120-3347versão On-line ISSN 2256-2087
Rev. colomb. anestesiol. vol.52 no.2 Bogotá abr./jun. 2024 Epub 07-Mar-2024
https://doi.org/10.5554/22562087.e1098
Artículo especial
Lesión renal aguda posoperatoria en cirugía mayor no cardiaca. Revisión narrativa
a Anestesiología y Reanimación, Universidad Surcolombiana. Neiva, Colombia.
La lesión renal aguda posoperatoria es una entidad subdiagnosticada. Su incidencia es variable y depende de factores demográficos, clínicos y los inherentes al estrés quirúrgico; por ende, la fisiopatología es multifactorial. Es de vital importancia reconocer precozmente dichos factores de riesgo durante la valoración preanestésica y hacer uso de herramientas para calcular el riesgo de desarrollarla para, de esta forma, adoptar medidas perioperatorias para mitigar su aparición e impacto. Entre las complicaciones derivadas de esta entidad se encuentran la estancia en unidades de cuidado intensivo prolongadas, mayor susceptibilidad de infecciones, complicaciones derivadas de la hospitalización, progresión a enfermedad renal aguda y crónica e incluso necesidad de terapias de reemplazo renal (TRR) transitorias o permanentes, además de enfermedades que aumentan el riesgo cardiovascular como hipertensión arterial sistémica y/o enfermedad coronaria, lo que genera aumento en morbimortalidad, con aumento en costos asociado a la atención en salud, menor calidad de vida y mayor carga de la enfermedad a corto y largo plazo. Se realizó una búsqueda sistemática de la literatura en bases de datos PubMed, Google Schoolar, Lilacs, bajo los términos MeSh y DeCs, usando los operadores booleanos, se revisó el resumen de los artículos encontrados y se seleccionaron 57 artículos para su lectura completa. Esta revisión narrativa sintetiza la información relevante sobre esta patología que permita prevenirla y reconocerla para el manejo adecuado de los pacientes que van a cirugía mayor no cardiaca.
Palabras clave: Lesión renal aguda posoperatoria; Cirugía mayor no cardiaca; Anestesia; Anestesiología
Postoperative acute kidney injury is an underdiagnosed condition. Its incidence is variable and depends on demographic, clinical, and surgical stress-associated factors; hence the pathophysiology is multifactorial. It is extremely important to acknowledge those risk factors early and use tools to estimate the risk of developing the condition, in order to adopt perioperative measures to mitigate its occurrence and impact. Some of the complications resulting from this condition include prolonged ICU stay, higher susceptibility for infections, hospitalization-related complications, progression to acute and chronic kidney failure, and even the need for transient or permanent renal replacement therapies (RRT) in addition to diseases that increase the cardiovascular risk, such as systemic high blood pressure and/or coronary heart disease that result in increased comorbidities and mortality, with subsequent increases in healthcare costs, lower quality of life and increased burden of the disease in the short and long term. A systematic search of the literature was conducted in PubMed, Google Schoolar, and Lilacs, under the terms MeSh and DeCs using Boolean operators; a review was conducted of the summary of the articles identified and 57 of them were selected for their comprehensive reading. This narrative review summarizes the relevant information on this pathology for prevention and identification purposes, for the adequate management of patients undergoing major non-cardiac surgery.
Key words: Postoperative acute kidney injury; Major non-cardiac surgery; Anesthesia; Anesthesiology
INTRODUCCIÓN
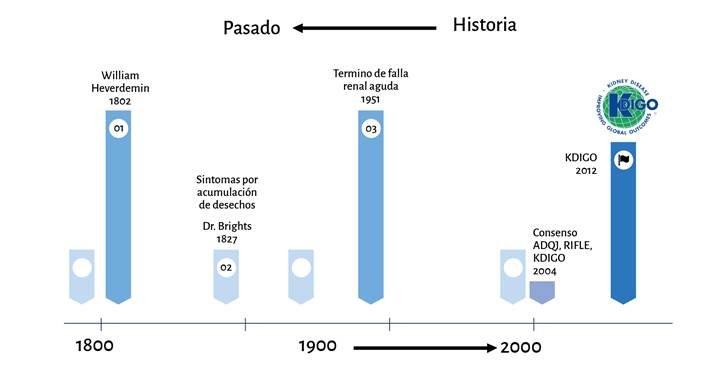
La lesión renal aguda (LRA) se define como una disminución abrupta de la capacidad del riñon para depurar los desechos tóxicos, como los nitrogenados, acompañada o no de una alteración en la homeostasis hidroelectrolítica 1,2; por tanto, la lesión renal aguda posoperatoria (LRAP) se define con los mismos criterios de una LRA, pero identificados luego de la exposición quirúrgica y hasta el séptimo día posoperatorio 3. Fue descrita por primera vez en 1802 por William Heberden, con el término ischuria y en 2004 la Acute Disease Quality Initiative (ADQI) adaptó el término moderno actual de lesión renal aguda (Figura 1) 4,5; para su categorización y estadificación se han desarrollado un número amplio de clasificaciones, las más conocidas y utilizadas son aquellas propuestas por la Acute Dialysis Quality Initiative, RIFLE (riesgo + lesión + falla + pérdida + etapa terminal, por sus iniciales en inglés) y Kidney Disease: Improving Global Outcomes (KDICO) 6,7.
Se han diseñado diversas escalas predictivas para estimar la incidencia de LRAP, incluyendo principalmente variables como cirugía cardiaca previa, cirugía de urgencia y niveles altos de creatinina intra o preoperatoria 8. De igual forma, en pacientes con función renal previa preservada sometidos a cirugía mayor se relacionó la edad, enfermedad arterial periférica, sangrado, infusión de coloidesy tipo de procedimiento quirúrgico como los factores de riesgo más relacionados 9. Se han recomendado diversas estrategias intraoperatorias, entre ellas el monitoreo hemodinámicoy el manejo de líquidos intravasculares guiado por objetivos 10,11. El presente artículo sintetiza información relevante del estado del arte al momento.
Respecto a la definición de cirugía mayor (excluyendo cirugía cardiovascular) se ha realizado consenso de expertos, y se ha llegado a la conclusión que se definirá de acuerdo con la duración y/o exposición al estrés quirúrgico ≥4 h y/o procedimientos en los que se estimen pérdidas sanguíneas ≥15 cm3/kg y/o procedimientos quirúrgicos que incluyan cavidad toracoabdominal; sin embargo, aún no hay una definición claramente reconocida 12.
EPIDEMIOLOGÍA
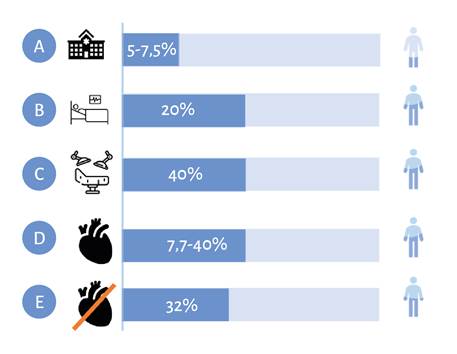
Se ha identificado que la incidencia de LRAP varía según los criterios diagnósticos, la exposición al estrés quirúrgico y las patologías concomitantes 13. Adicionalmente, se ha asociado mayor incidencia en grupos poblacionales como adultos mayores y obesos sometidos a cirugía mayor abdominal 14; sin embargo, los datos epidemiológicos no han sido consistentes y tienen una alta variabilidad en su incidencia. Por ejemplo, en cirugía mayor abdominal se ha reportado una incidencia de LRAP del 13 % 15 y en pacientes sometidos a cirugía cardiovascular la incidencia es mayor, oscila entre el 5 %y el 42%16. De hecho, el daño renal secundario a cirugía cardiovascular mayor es la causa más frecuente de patología renal en las unidades de cuidado intensivo (UCI) luego de la etiología séptica, con evidencia de aumento de la mortalidad directamente proporcional a la gravedad de la LRA (Figura 2) 16-20. Sin embargo, también se ha encontrado incidencia de esta entidad en cirugía mayor no cardiaca y está fuertemente asociada con resultados adversos a corto y largo plazo, incluido un mayor riesgo de enfermedad renal crónica, eventos cardiovasculares y muerte 3,21. En Colombia se han realizado algunos estudios de identificación de incidencia y de factores de riesgo asociados a LRA posoperatoria en Bogotá, pero en el contexto de cirugía cardiovascular. No hay datos a la fecha de incidencia de esta patología a escala regional.
La mortalidad en pacientes con LRAP es uno de los desenlaces más estudiados. Tanto el fenotipo de LRAP temprana como el tardío (LRA a las ≤48 h y después de 48 h, respectivamente) se relacionan con mayor mortalidad (10 veces más riesgo) 23 a un año en comparación con pacientes sin alteración de la función renal (19% vs. 8 %, respectivamente) 13,23-25. En pacientes con LRAP grave que progresan a requerimiento de terapia de reemplazo renal permanente o transitoria la mortalidad alcanza hasta un 46% 26,27.
Respecto a los costos asociados al cuidado de la salud de la LRAP, en 2015 se publicó un estudio retrospectivo que incluyó 50.314 pacientes sometidos a cirugía mayor, el cual concluyó que el costo promedio aumenta casi al doble de los pacientes sin LRA y aún más cuando presentan necesidad de ventilación mecánica prolongada, complicaciones cardiovasculares y sepsis 28.
Fisiopatología y etiología
La fisiopatología de la LRAP es multifactorial y está explicada desde varias aristas, entre ellas la hipoperfusión secundaria al uso de anestésicos con un efecto vasodilatador que lleva a un compromiso del gasto cardiaco (CC) y de la perfusión renal; el aumento de la presión venosa que también altera la presión de filtrado glomerular, básicamente determinado por aumento de la presión intraabdominal, falla ventricular derecha con edema secundario a una sobrecarga hídrica; la hipoperfusión de órganos remotos, con liberación de marcadores de daño que viajan a órganos distantes dada por mecanismos de isquemia/reperfusión o el trauma quirúrgico; la activación de la respuesta inmune y lesión endotelial directa secundaria al proceso inflamatorio, exposición a nefrotóxicos y finalmente la actividad procoagulante que favorece la aparición de microtrombos vasculares con la posterior obstrucción del flujo sanguíneo en el penacho glomerular 3.
El riesgo de desarrollo de LRAP dependerá entonces de la exposición a medicamentos nefrotóxicos, el estrés quirúrgico, comorbilidades de base y la hipoperfusión durante el transoperatorio; portanto, es importante identificar desde el preoperatorio factores de riesgo que aumentan la incidencia, entre ellos la edad >59 años, índice de masa corporal (IMC) >32 kg/m2, cirugía de alto riesgo, cirugía de emergencia, cirugía vascular, enfermedad hepática y enfermedad pulmonar obstructiva crónica (EPOC), como los más representativos 29. Respecto al tipo de cirugía, la cardiovascular tiene la mayor incidencia de LRAP, seguida de la gastrointestinal (56,4 % y 26 %, respectivamente), en parte debido a la población más añosa y mayores pérdidas sanguíneas que impactan en la perfusión renal respecto al resto de cirugías con menor incidencia con grupos poblacionales menos mórbidos y longevos 25,30.
DIAGNÓSTICO
Actualmente se cuenta con varias clasificaciones para el diagnóstico; sin embargo, desde 2012 se usan los criterios KDICO (Tabla 1). Adicionalmente, esta misma clasificación permite estadificar la gravedad, teniendo en cuenta dos variables: nivel de creatinina sérica (sCr) y diuresis 31.
Tabla 1 Criterios KDIGO. Creatinina Sérica.
| Etapa | Creatinina sérica (sCr) en mg/dl | Producción de orina | Biomarcador | |
|---|---|---|---|---|
| 1s | Sin cambios o aumento de sCr <0,3 | Sin criterios de gasto urinario | - | |
| 1a | Aumento de sCr 1,5-1,9 que se sabe | Diuresis <0,5 mL/kg/h | - | |
| 1b | o se presume que ocurrió dentro de los 7 días anteriores o aumen- to de sCr ≥0,3 dentro de las 48 horas | Durante 6-12 h | + | |
| 2a | Aumento de sCr 2-2,9 | Diuresis <0,5 durante ≥12 h | mL/kg/h | - |
| 2b | + | |||
| 3a | Aumento de sCr 3 o sCr ≥4 o inicio de terapia de reemplazo renal (TRR) o descenso de la tasa de filtración glomerular (TFG) <35 mL/min | Diuresis<0,3 mL/kg/h durante ≥24 h o anuria por ≥12 h | - | |
| 3b | + | |||
Fuente: Adaptado de Kellum et al. 32.
Adicionalmente, en 2009 se validó una herramienta para el cálculo del riesgo de presentar LRAP 33, reemplazada por otra herramienta predictiva de LRAP, la Simple Postoperative AKI Risk (SPARK) (Tabla 2), mediante la cual se identifican grupos con mayor riesgo de desarrollarla e incluye recomendaciones de acuerdo con el resultado; desafortunadamente, estas escalas no son muy usadas en el perioperatorio 34.
Tabla 2 Riesgo de LRA posoperatoria simple (SPARK).
| Factores de riesgo preoperatorio | Puntaje | Clase A |
|---|---|---|
|
|
|
Puntaje <20 |
| LRA <2 % | ||
| LRA crítica <2 % | ||
|
|
|
Clase B |
| Puntaje 20-39 | ||
| LRA ≥2 % | ||
| LRA crítica <2 % | ||
|
|
|
Clase C |
| Puntaje 40-59 | ||
| LRA ≥10 % | ||
| LRA crítica ≥2 % | ||
|
|
|
Clase D |
| Puntaje ≥60 | ||
|
|
|
LRA ≥20 % |
| LRA crítica ≥10 % | ||
|
|
|
Fuente: Adaptado Park et al. 34.
Como regla general, a los pacientes de alto riesgo de LRAP se les debe medir la creatinina al menos una vez al día y con mayor frecuencia después de una exposición de riesgo 31. Se debe considerar que cualquier LRAP, sea leve o grave, independientemente de su resolución, aumenta la morbilidad y la mortalidad posoperatoria 13,35,36. En la actualidad, se han estudiado diferentes biomarcadores para la evaluación del riesgo preoperatorio para LRAP; sin embargo, a la fecha no se ha validado ninguno de ellos como herramienta de valoración prequirúrgica 37.
Respecto a la cuantificación del gasto urinario, un estudio retrospectivo realizado en pacientes llevados a resección pulmonar bajo anestesia general identificó que un volumen urinario <0,8 mL/kg/h es un factor de riesgo independiente para desarrollar LRAP 38.
MANEJO
Evitar la hipoperfusión renal se ha convertido en un verdadero reto, dado que incluso aumentar el suministro renal de oxígeno no asegura que haya homogeneidad en la perfusión de la corteza y la médula renal y con ello una verdadera prevención de la LRAP 24. La tensión arterial y gasto cardiaco bajos, la presión venosa central alta y los niveles bajos de hemoglobina han demostrado ser buenos predictores del desarrollo de LRAP. En consecuencia, entre las acciones perioperatorias para la prevención de LRAP están mantener la estabilidad hemodinámica intraoperatoria, evitar potenciales nefrotóxicos, evitar la hipotensión y el manejo de líquidos guiado por objetivos, para mantener la euvolemia 13.
La terapia dirigida por objetivos incluye la monitorización invasiva de la estabilidad hemodinámica del paciente para indicar la cantidad de líquidos intravenosos y agentes vasoactivos que deben ser administrados. Es fundamental definir objetivos claros en los nuevos protocolos de manejo 39. Los inotrópicos y vasopresores tienen el potencial de aumentar la presión arterial sistémica y con ello la perfusión renal, lo que los convierte en pilar para combatir la hemodilución, la respuesta inflamatoria sistémica y la hipoperfusión que se evidencian durante los procedimientos quirúrgicos mayores. La fenilefrina, efedrina, norepinefrina, epinefrina, dopamina y vasopresina son los vasopresores más comúnmente utilizados y reconocidos en estas categorías 40. Sin embargo, a la fecha, no hay datos consistentes de cuál vasopresor es más eficaz en la prevención de la LRAP 13.
Ahora bien, por las cifras elevadas de daño renal, la terapia restrictiva de líquidos ha sido cuestionada especialmente en pacientes con alto riesgo de complicaciones durante cirugías abdominales mayores en comparación con regímenes más liberales de líquidos 41; sin embargo, sigue siendo un tema controversial.
Entre los fluidos disponibles se encuentra la solución salina normal que tiene una concentración alta de sodio y cloro en comparación con las soluciones balanceadas que contienen electrolitos adicionales como potasio, magnesio y calcio, y adiciona otros componentes que equilibran el estado ácido-base, como acetato o lactato. En cuanto a la incidencia de TRR posoperatoria, aún no se han podido encontrar diferencias entre el uso de estos tipos de fluidos 42. No obstante, el uso de soluciones con alto contenido de cloruro (solución salina normal), tanto en el perioperatorio como en las unidades de cuidado intensivo, se asocia con mayores tasas de LRAP 43.
En cuanto a la transfusión de hemoderivados y su relación con LRAP, la evidencia es limitada. Diferentes estudios han descrito cómo la transfusión de concentrados de hematíes intraoperatorios aumenta de forma independiente la incidencia de daño renal y la morbimortalidad en el posoperatorio inmediato comparado con aquellos que no lo necesitaron 44-46. No obstante, fisiopatológicamente, es sabido que el transporte de oxígeno en sangre es esencial para reducir la isquemia renal, incluso cuando el flujo de sangre es escaso. La justificación para transfundir tempranamente radica en el incremento de la disponibilidad tisular de oxígeno 45. La restricción de esta terapia se basa en el alto riesgo de efectos adversos a los que se ha asociado, tales como lesión pulmonar, hemólisis, sobrecarga de volumen, reacción inmune e infecciones 46.
Técnica anestésica y LRAP
Teniendo en cuenta que existen múltiples modalidades para administrar anestesia y que su elección dependerá de la evaluación individualizada de cada paciente, de acuerdo con la valoración prequirúrgica y el tipo de cirugía propuesta, se han realizado ensayos clínicos que evalúan el impacto de algunos agentes anestésicos en cuanto a la función renal; al respecto, se han encontrado datos contradictorios.
En un estudio realizado en 2017 en el que se incluyeron 328.540 pacientes, comparando las complicaciones posoperatorias entre anestesia general y anestesia regional, no se encontró ninguna diferencia en cuanto a las complicaciones renales 47. Se sabe que hay una relación importante entre la elección de anestésico y la función renal, reconociendo que algunos de estos, como el propofol, la dexmedetomidina y la ketamina inducen efectos antiinflamatorios, antinecróticos y antiapoptóticos, y tanto el sevoflurano como el isoflurano proporcionan efectos renoprotectores de preacondicionamiento, procesos que son cruciales en la lesión renal por isquemia/reperfusión, y cobran especial relevancia sobre todo en cirugías de trasplante renal para la conservación del órgano 48,49.
Los anestésicos inhalados como el sevoflurano, el desflurano y el enflurano han mostrado resultados controversiales en cuanto a su papel en la protección de la función renal, se ha descrito que su uso en pacientes con lesión renal previa no la empeoró 48,50,51. Sin embargo, estudios recientes compararon anestesia general con anestesia total intravenosa (TIVA) usando propofol vs. halogenado (sevoflurano) en pacientes llevados a cirugía abdominal mayor, en los que se encontró mayor incidencia de LRAP en quienes recibieron anestesia con sevoflurano (142 [11,2 %] frente a 272 [8,9 %], p=0,02 según los criterios de AKIN, 94 [7,4 %] frente a 157 [5,1 %], p=0,004 según los criterios RIFLE) 52,53; esto, al parecer, relacionado con la desfluoración y la producción de compuesto A derivado de la interacción con los absorbedores de dióxido de carbono, el cual forma un haloalcano nefrotóxico que es volátil y que puede absorberse en el intercambio alveolar de los gases 48,49. Una explicación adicional sería la mayor estabilidad hemodinámica generalmente reconocida en la TIVA.
Respecto a los anestésicos intravenosos, se han estudiado la dexmedetomidina, la ketamina y el propofol, y se ha encontrado que contribuyen en la regulación de las vías inflamatorias inhibiendo el estrés oxidativo, lo que confiere un factor protector para la preservación del daño en varios órganos, incluido el riñón 48,54; hay datos que soportan los efectos protectores de emulsiones de lípidos contra la lesión por isquemia/reperfusión, por lo que estos en las presentaciones del propofol parecen ser el mecanismo subyacente que le confiere sus efectos renoprotectores 48,55,56, lo que sugiere que la TIVA con propofol puede ser una opción adecuada con resultados clínicos positivos respecto a la incidencia LRAP 48,52.
En cuanto a técnicas regionales, estudios han sugerido el potencial beneficio de uso de técnicas analgésicas con el uso de catéter epidural (uso de anestésicos locales como lidocaína o bupivacaína) en combinación con anestesia general respecto a la reducción de LRAP, sobre todo en pacientes llevados a cirugía cardiovascular 48,57; sin embargo, los datos respecto a otro tipo de intervenciones no son concluyentes al respecto 48.
CONCLUSIÓN
Luego de examinar artículos originales y de revisión, con población heterogénea y diferentes escenarios intrahospitalarios, los autores de esta revisión narrativa concluyen que la prevención de LRAP dependerá de una evaluación del riesgo individualizado, teniendo en cuenta escalas de riesgo preoperatorio (SPARK), control de factores de riesgo (comorbilidades, hipovolemia, anemia, uso de nefrotóxicos, LRA previa, trastornos hidroelectrolíticos, etc.); elección de una técnica anestésica adecuada, reconociendo los beneficios renoprotectores de los anestésicos intravenosos, teniendo en cuenta su papel en procesos de isquemia y reperfusión involucrados en la fisiopatología de LRA, y el adecuado control de constantes vitales durante el perioperatorio, sin olvidar que es una entidad de incidencia variable que lleva a complicaciones tempranas y tardías, de no prevenirse, diagnosticarse y tratarse oportunamente.
Se sugiere a los lectores consultar la bibliografía para profundizar en los conceptos que se han descrito en esta revisión narrativa, con el fin de tomar decisiones individualizadas en el manejo intraoperatorio en pacientes en quien se identifique potencial riesgo de presentar LRA POP. Adicionalmente, se incentiva a realizar estudios de investigación, a escala nacional, en torno a esta patología para obtener estadísticas que permitan tomar acciones de prevención en pro de la población en riesgo.
REFERENCIAS
1. Ronco C. Acute kidney injury: from clinical to molecular diagnosis. Crit Care. 2016;20(1):201. doi: https://doi.org/10.1186/s13054-016-1373-7. [ Links ]
2. Monedero P, Sáiz N, Panadero A. [Perioperative renal protection: physiopathological basis of acute renal insufficiency and prophylactic methods]. Rev Esp Anestesiol Reanim. 1998;45(2):50-63. [ Links ]
3. Prowle JR, Forni LG, Bell M, Chew MS, Edwards M, Grams ME, et al. Postoperative acute kidney injury in adult non-cardiac surgery: joint consensus report of the Acute Disease Quality Initiative and PeriOperative Quality Initiative. Nat Rev Nephrol. 2021;17(9):605-18. doi: https://doi.org/10.1038/s41581-021-00418-2. [ Links ]
4. Himmelfarb J, Ikizler TA. Acute kidney injury: changing lexicography, definitions, and epidemiology. Kidney Int. 2007;71(10):971-6. doi: https://doi.org/10.1038/sj.ki.5002224. [ Links ]
5. Chawla LS, Bellomo R, Bihorac A, Goldstein SL, Siew ED, Bagshaw SM, et al. Acute kidney disease and renal recovery: consensus report of the Acute Disease Quality Initiative (ADQI) 16 Workgroup. Nat Rev Nephrol . 2017;13(4):241-57. doi: https://doi.org/10.1038/nrneph.2017.2. [ Links ]
6. Levey AS, de Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int . 2011;80(1):17-28. doi: https://doi.org/10.1038/ki.2010.483. [ Links ]
7. Venkataraman R, Kellum JA. Defining acute renal failure: the RIFLE criteria. J Intensive Care Med. 2007;22(4):187-93. doi: https://doi.org/10.1177/0885066607299510. [ Links ]
8. Di Bella I, Da Col U, Ciampichini R, Affronti A, Santucci A, Fabbri M, et al. [Validation of a new scoring system to predict the risk of postoperative acute renal failure in cardiac surgery]. G Ital Cardiol (Rome). 2007;8(5):306-10. PMID: 17650689. [ Links ]
9. Sabaté S, Gomar C, Canet J, Sierra P, Castillo J, ARISCAT. [Risk factors for postoperative acute kidney injury in a cohort of 2378 patients from 59 hospitals]. Rev Esp Anestesiol Reanim . 2011;58(9):548-55. doi: https://doi.org/10.1016/s0034-9356(11)70139-6. [ Links ]
10. Romagnoli S, Ricci Z. Postoperative acute kidney injury. Minerva Anestesiol. 2015;81(6):684-96. PMID: 25057935. [ Links ]
11. Ripollés-Melchor J, Aldecoa C, Alday-Muñoz E, Del Río S, Batalla A, Del-Cojo-Peces E, et al. Intraoperative crystalloid utilization variability and association with postoperative outcomes: A post hoc analysis of two multicenter prospective cohort studies. Rev Esp Anestesiol Reanim (Engl Ed). 2021;68(7):373-83. doi: https://doi.org/10.1016/j.redare.2021.07.004. [ Links ]
12. Martin D, Mantziari S, Demartines N, Hübner M, Group ES. Defining major surgery: A Delphi Consensus Among European Surgical Association (ESA) Members. World J Surg. 2020;44(7):2211-9. doi: https://doi.org/10.1007/s00268-020-05476-4. [ Links ]
13. Ostermann M, Cennamo A, Meersch M, Kunst G. A narrative review of the impact of surgery and anaesthesia on acute kidney injury. Anaesthesia. 2020;75 Suppl 1:e121-e33. doi: https://doi.org/10.1111/anae.14932. [ Links ]
14. Ying T, Chan S, Lane S, Somerville C. Acute kidney injury post-major orthopaedic surgery: A single-Centre case-control study. Nephrology (Carlton). 2018;23(2):126-32. doi: https://doi.org/10.1111/nep.12942. [ Links ]
15. O'Connor ME, Kirwan CJ, Pearse RM, Prowle JR. Incidence and associations of acute kidney injury after major abdominal surgery. Intensive Care Med. 2016;42(4):521-30. doi: https://doi.org/10.1007/s00134-015-4157-7. [ Links ]
16. Wang Y, Bellomo R. Cardiac surgery-associated acute kidney injury: risk factors, pathophysiology and treatment. Nat Rev Nephrol . 2017;13(11):697-711. doi: https://doi.org/10.1038/nrneph.2017.119. [ Links ]
17. Mas-Font S, Ros-Martínez J, Pérez-Calvo C, Villa-Díaz P, Aldunate-Calvo S, Moreno-Clari E, et al. Prevention of acute kidney injury in Intensive Care Units. Med Intensiva. 2017;41(2):116-26. doi: https://doi.org/10.1016/j.medin.2016.12.004. [ Links ]
18. Levey AS, James MT. Acute kidney injury. Ann Intern Med. 2017;167(9):ITC66-ITC80. doi: https://doi.org/10.7326/AITC201711070. [ Links ]
19. Hoste EAJ, Vandenberghe W. Epidemiology of cardiac surgery-associated acute kidney injury. Best Pract Res Clin Anaesthesiol. 2017;31(3):299-303. doi: https://doi.org/10.1016/j.bpa.2017.11.001. [ Links ]
20. Hoste EA, Bagshaw SM, Bellomo R, Cely CM, Colman R, Cruz DN, et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study. Intensive Care Med . 2015;41(8):1411-23. doi: https://doi.org/10.1007/s00134-015-3934-7. [ Links ]
21. Romagnoli S, Ricci Z, Ronco C. Perioperative acute kidney injury: Prevention, early recognition, and supportive measures. Nephron. 2018;140(2):105-10. doi: https://doi.org/10.1159/000490500. [ Links ]
22. Park JT. Postoperative acute kidney injury. Korean J Anesthesiol. 2017;70(3):258-66. doi: https://doi.org/10.4097/kjae.2017.70.3.258. [ Links ]
23. Kim M, Brady JE, Li G. Variations in the risk of acute kidney injury across intraabdominal surgery procedures. Anesth Analg. 2014;119(5):1121-32. doi: https://doi.org/10.1213/ANE.0000000000000425. [ Links ]
24. Chaudery H, MacDonald N, Ahmad T, Chandra S, Tantri A, Sivasakthi V, et al. Acute kidney injury and risk of death after elective surgery: Prospective analysis of data from an international cohort study. Anesth Analg. 2019;128(5):1022-9. doi: https://doi.org/10.1213/ANE.0000000000003923. [ Links ]
25. Grams ME, Sang Y, Coresh J, Ballew S, Matsushita K, Molnar MZ, et al. Acute kidney injury after major surgery: A retrospective analysis of veterans health administration data. Am J Kidney Dis. 2016;67(6):872-80. doi: https://doi.org/10.1053/j.ajkd.2015.07.022. [ Links ]
26. Chertow GM, Burdick E, Honour M, Bonventre JV, Bates DW. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. J Am Soc Nephrol. 2005;16(11):3365-70. doi: https://doi.org/10.1681/ASN.2004090740. [ Links ]
27. Mehta RL, Cerdá J, Burdmann EA, Tonelli M, García-García G, Jha V, et al. International Society of Nephrology's 0by25 initiative for acute kidney injury (zero preventable deaths by 2025): a human rights case for nephrology. Lancet. 2015;385(9987):2616-43. doi: https://doi.org/10.1016/S0140-6736(15)60126-X. [ Links ]
28. Hobson C, Ozrazgat-Baslanti T, Kuxhausen A, Thottakkara P, Efron PA, Moore FA, et al. Cost and mortality associated with postoperative acute kidney injury. Ann Surg. 2015;261(6):1207-14. doi: https://doi.org/10.1097/SLA.0000000000000732. [ Links ]
29. Kheterpal S, Tremper KK, Englesbe MJ, O'Reilly M, Shanks AM, Fetterman DM, et al. Predictors of postoperative acute renal failure after noncardiac surgery in patients with previously normal renal function. Anesthesiology. 2007;107(6):892-902. doi: https://doi.org/10.1097/01.anes.0000290588.29668.38. [ Links ]
30. Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA. 2005;294(7):813-8. doi: https://doi.org/10.1001/jama.294.7.813. [ Links ]
31. Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120(4):c179-84. doi: https://doi.org/10.1159/000339789. [ Links ]
32. Kellum JA, Romagnani P, Ashuntantang G, Ronco C, Zarbock A, Anders HJ. Acute kidney injury. Nat Rev Dis Primers. 2021;7(1):52. doi: https://doi.org/10.1038/s41572-021-00284-z. [ Links ]
33. Kheterpal S, Tremper KK, Heung M, Rosenberg AL, Englesbe M, Shanks AM, et al. Development and validation of an acute kidney injury risk index for patients undergoing general surgery: results from a national data set. Anesthesiology . 2009;110(3):505-15. doi: https://doi.org/10.1097/ALN.0b013e3181979440. [ Links ]
34. Park S, Cho H, Lee S, Kim K, Yoon HJ, Park J, et al. Simple Postoperative AKI Risk (SPARK) Classification before noncardiac surgery: A prediction index development study with external validation. J Am Soc Nephrol . 2019;30(1):170-81. doi: https://doi.org/10.1681/ASN.2018070757. [ Links ]
35. Whitman GJR PC. Commentary: The dangers of postoperative acute kidney injury- Vulnerability despite early resolution. J Thorac Cardiovasc Surg. 2021;161(2):689-90. doi: https://doi.org/10.1016/j.jtcvs.2019.10.107. [ Links ]
36. Turan A, Cohen B, Adegboye J, Makarova N, Liu L, Mascha EJ, et al. Mild acute kidney injury after noncardiac surgery is associated with long-term renal dysfunction: A retrospective cohort study. Anesthesiology . 2020;132(5):1053-61. doi: https://doi.org/10.1097/ALN.0000000000003109. [ Links ]
37. Engelman DT KJT. The difficulty of predicting postoperative acute kidney injury from preoperative clinical data. J Thorac Cardiovasc Surg . 2018;156(3):1124. doi: https://doi.org/10.1016/j.jtcvs.2018.03.071. [ Links ]
38. Meng ZT, Mu DL. [Impact of oliguria during lung surgery on postoperative acute kidney injury]. Beijing Da Xue Xue Bao Yi Xue Ban. 2020;53(1):188-94. doi: https://doi.org/10.19723/j.issn.1671-167X.2021.01.028. [ Links ]
39. Aaen AA, Voldby AW, Storm N, Kildsig J, Hansen EG, Zimmermann-Nielsen E, et al. Goal-directed fluid therapy in emergency abdominal surgery: a randomised multicentretrial. Br J Anaesth. 021;127(4):521-31. doi: https://doi.org/10.1016/j.bja.2021.06.031. [ Links ]
40. McIlroy DR, López MG, Billings FT. Perioperative clinical trials in AKI. Semin Nephrol. 2020;40(2):173-87. doi: https://doi.org/10.1016/j.semnephrol.2020.01.008. [ Links ]
41. Myles PS, Bellomo R, Corcoran T, Forbes A, Peyton P, Story D, et al. Restrictive versus liberal fluid therapy for major abdominal surgery. N Engl J Med. 2018;378(24):2263-74. doi: https://doi.org/10.1136/bmjopen-2016-015358. [ Links ]
42. Bampoe S, Odor PM, Dushianthan A, Bennett-Guerrero E, Cro S, Gan TJ, et al. Perioperative administration of buffered versus non-buffered crystalloid intravenous fluid to improve outcomes following adult surgical procedures. Cochrane Database Syst Rev. 2017;9:CD004089. doi: https://doi.org/10.1186/s13741-018-0108-5. [ Links ]
43. Krajewski ML, Raghunathan K, Paluszkiewicz SM, Schermer CR, Shaw AD. Meta-analysis of high- versus low-chloride content in perioperative and critical care fluid resuscitation. Br J Surg. 2015;102(1):24-36. doi: https://doi.org/10.1002/bjs.9651. [ Links ]
44. Pérez-Valdivieso JR, Monedero P, García-Fernández N, Vives M, Lavilla FJ, Bes-Rastrollo M, et al. [Blood transfusion during heart surgery. A retrospective nested case-control study]. Rev Esp Anestesiol Reanim . 2013;60(2):79-86. doi: https://doi.org/10.1016/j.redar.2012.10.002. [ Links ]
45. Jonasson H, Fredriksson I, Pettersson A, Larsson M, Strömberg T. Oxygen saturation, red blood cell tissue fraction and speed resolved perfusion - A new optical method for microcirculatory assessment. Microvasc Res. 2015;102:70-7. doi: https://doi.org/10.1016/j.mvr.2015.08.006. [ Links ]
46. Despotis G, Eby C, Lublin DM. A review of transfusion risks and optimal management of perioperative bleeding with cardiac surgery. Transfusion. 2008;48(1 Suppl):2S-30S. doi: https://doi.org/10.1111/j.1537-2995.2007.01573.x. [ Links ]
47. Saied NN, Helwani MA, Weavind LM, Shi Y, Shotwell MS, Pandharipande PP. Effect of anaesthesia type on postoperative mortality and morbidities: a matched analysis of the NSQIP database. Br J Anaes th. 2017;118(1):105-11. doi: https://doi.org/10.1097/01.sa.0000521852.56248.f4. [ Links ]
48. Motayagheni N, Phan S, Eshraghi C, Nozari A, Atala A. A review of anesthetic effects on renal function: Potential organ protection. Am J Nephrol. 2017;46(5):380-9. doi: https://doi.org/10.1159/000482014. [ Links ]
49. Fukazawa K, Lee HT. Volatile anesthetics and AKI: risks, mechanisms, and a potential therapeutic window. J Am Soc Nephrol . 2014;25(5):884-92. doi: https://doi.org/10.1681/ASN.2013111215. [ Links ]
50. Conzen PF, Nuscheler M, Melotte A, Verhaegen M, Leupolt T, Van Aken H, et al. Renal function and serum fluoride concentrations in patients with stable renal insufficiency after anesthesia with sevoflurane or enflurane. Anesth Analg . 1995;81(3):569-75. doi: https://doi.org/10.1097/00000539-199509000-00026. [ Links ]
51. Cai J, Xu R, Yu X, Fang Y, Ding X. Volatile anesthetics in preventing acute kidney injury after cardiac surgery: a systematic review and meta-analysis. J Thorac Cardiovasc Surg . 2014;148(6):3127-36. doi: https://doi.org/10.1016/j.jtcvs.2014.07.085. [ Links ]
52. Bang JY, Lee J, Oh J, Song JG, Hwang GS. The influence of propofol and sevoflurane on acute kidney injury after colorectal surgery: A retrospective cohort study. Anesth Analg . 2016;123(2):363-70. doi: https://doi.org/10.1213/ANE.0000000000001274. [ Links ]
53. Kim BR, Yoon S, Song GY, Lee S, Bahk JH, Nam K. The impact of total intravenous anesthesia versus inhalation anesthesia on acute kidney injury after major abdominal surgery: a propensity score analysis. J Anesth. 2021;35(1):112-21. doi: https://doi.org/10.1007/s00540-020-02882-9. [ Links ]
54. Hsing CH, Lin CF, So E, Sun DP, Chen TC, Li CF, et al. α2-Adrenoceptor agonist dexmedetomidine protects septic acute kidney injury through increasing BMP-7 and inhibiting HDAC2 and HDAC5. Am J Physiol Renal Physiol. 2012;303(10):F1443-53. doi: https://doi.org/10.1152/ajprenal.00143.2012. [ Links ]
55. Luo C, Yuan D, Li X, Yao W, Luo G, Chi X, et al. Propofol attenuated acute kidney injury after orthotopic liver transplantation via inhibiting gap junction composed of connexin 32. Anesthesiology . 2015;122(1):72-86. doi: https://doi.org/10.1097/ALN.0000000000000448. [ Links ]
56. Snoeijs MG, Vaahtera L, de Vries EE, Schurink GW, Haenen GR, Peutz-Kootstra CJ, et al. Addition of a water-soluble propofol formulation to preservation solution in experimental kidney transplantation. Transplantation. 2011;92(3):296-302. doi: https://doi.org/10.1097/TP.0b013e3182247b78. [ Links ]
57. Bignami E, Landoni G, Biondi-Zoccai GG, Boroli F, Messina M, Dedola E, et al. Epidural analgesia improves outcome in cardiac surgery: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth. 2010;24(4):586-97. doi: https://doi.org/10.1053/j.jvca.2009.09.015. [ Links ]
Recibido: 25 de Marzo de 2023; Aprobado: 04 de Octubre de 2023; Aprobado: 14 de Diciembre de 2023











 texto em
texto em