Introducción
Las displasias músculo esqueléticas son alteraciones en el desarrollo del tejido óseo y/o cartilaginoso, con un comportamiento genéticamente heterogéneo1. El consenso del Comité de Nosología de la Sociedad Internacional de la Displasia Esquelética ha descrito 461 tipos diferentes de esta enfermedad, clasificados en 42 grupos según fenotipos clínicos, criterios radiográficos y/o moleculares, con variantes patogénicas que pueden afectar cerca de 437 genes diferentes2,3.
La displasia tanatofórica (DT) pertenece al grupo de las condrodisplasias debidas a la mutación del factor de crecimiento fibroblasto^ (FGFR3), en el cromosoma 4p16.3, con un patrón de herencia autosómico dominante. Las displasias tanatofóricas tipo I (DTI) y tipo II (DTII) son sus principales variaciones alélicas y fenotípicas2,3. En general, se encuentra presente en 0,2 a 0,5 casos por cada 10 000 nacidos vivos; de estos, se estima que el 20 % de la totalidad de los casos se deben a DTII4,5 6 7, cuya incidencia se describe en 1 caso por cada 20 000-40 000 nacidos vivos y muertos o en 1 caso por cada 33 000-47 000 nacidos vivos en el mundo6. En Colombia, se desconoce su prevalencia, sin embargo, las displasias esqueléticas son poco frecuentes, pues se han encontrado presentes en 4,4 casos por cada 10 000 nacidos en regiones como Risaralda, Colombia8.
La DT es una patología considerada incompatible con la vida extrauterina, debido a que los defectos ocasionados durante la formación osteocondromuscular intrauterina producen insuficiencia cerebral o respiratoria9,10 11; entre estos, la DTI se caracteriza fenotípicamente por el aumento global del tamaño craneal (mayor del percentil 90), displasia del lóbulo cerebral temporal, megalencefalia, ventriculomegalia, holoprosencefalia, disgenesia del cuerpo calloso, hipoplasia del tronco encefálico, malformaciones del desarrollo cortical, hipoplasia medio facial, puente nasal plano, hipoplasia pulmonar o tórax estrecho, ensanchamiento metafisario y micromelia con fémures cortos y arqueados. La suma de los hallazgos anteriores, junto con la presencia de craneosinostosis con afectación de las suturas metópica, coronal, sagital y lambdoideas que simulan un cráneo con aspecto de hoja de trébol, y a excepción de la presentación de huesos arqueados, la presentación de huesos cortos y rectos, permite distinguir característicamente la DTII. Adicionalmente, ambas presentaciones pueden cursar con la presencia de polihidramnios8.
El hallazgo en su totalidad de estas alteraciones fenotípicas mencionadas mediante ultrasonografía (USG) o resonancia magnética fetal, y de forma característica el hallazgo de cráneo en trébol y las extremidades cortas y rectas, permite realizar el diagnóstico de DTII en el segundo o tercer trimestre del embarazo, en un 70 % de los casos, y amerita estudio y manejo interdisciplinario por ginecología, perinatología, genética, psicología, entre otros11,12,13,14.
Diagnósticos más precisos se podrían realizar mediante la tomografía computarizada helicoidal con reconstrucción tridimensional12 o el análisis genético molecular no invasivo del gen FGFR3, mediante técnicas como la amplificación basada en PCR o la secuenciación de nueva generación; esta última, de forma costo efectiva e incluida en el Plan de Beneficios de Salud de Colombia, permite la lectura de millones de secuencias de ADN de forma masiva y paralela en un menor lapso de tiempo12, lo cual evidencia, particularmente en esta entidad, mutaciones en la sustitución del aminoácido cisteína por arginina en la posición 248 de la proteína "Arg248Cys" en DTI, y en DTII se ha descrito la mutación en la sustitución de lisina por el ácido glutámico en la posición 650 de la proteína "Lys650Glu" del gen FGFR313,14.
El objetivo de este artículo es evidenciar el caso de una displasia tanatofórica tipo II en nuestro medio y, con este, reconocer las ayudas diagnósticas, pronóstico y alternativas terapéuticas que tienen las gestantes, así como aportar un registro que ayude a estimar la incidencia de esta inusual enfermedad en el país.
Presentación del caso
Paciente de 19 años G3P1C1V2, migrante, con reciente estadía en Colombia, pareja estable de 22 años, ama de casa, tipo de sangre O, Rh positivo, con antecedente de cesárea previa hace dos años por ruptura prematura de membranas a los 7 meses; niega consumo de medicamentos, alcohol, tabaco u otras sustancias psicoactivas; sin antecedentes familiares de malformaciones u otros de importancia.
Consulta a hospital de primer nivel para iniciar sus controles prenatales una semana después de conocer estado de embarazo confirmado por USG básica de segundo trimestre, por lo cual se estima al momento de la consulta con edad gestacional de 20 semanas y 4 días; esta describe presencia de feto en presentación podálico, longitudinal, dorso izquierdo, placenta grado I, índice de líquido amniótico: 13,6 cc, acortamiento general de las extremidades y disminución de la osificación general, que concluye en displasia músculo esquelética a estudio y se sugiere valoración por perinatología. Al examen físico se documenta sobrepeso con índice de masa corporal de 28,52 kg/m2, sin otras alteraciones. Por lo anterior, se dieron recomendaciones sobre cuidado del embarazo y se ordenó inicio de micronutrientes esenciales del embarazo, ordenes de vacunación, perfil STORCH, y se derivó a hospital de tercer nivel para ser valorada por el servicio de ginecología y medicina materno fetal.
En tercer nivel toman USG de detalle anatómico que evidenció embarazo por biometría fetal para 17 semanas y 5 días creciendo en percentil menor de 1, placenta corporal anterior, cordón con inserción de 3 vasos y líquido amniótico de aspecto normal; a nivel de sistema nervioso central se evidenció cráneo en trébol con prominencia frontal, cierre de sutura metópica, disgenesia del cuerpo calloso, hueso nasal hipoplásico, retrognatia, tórax hipoplásico con hipoplasia pulmonar; micropene y evidencia de acortamiento generalizado de las extremidades de apariencia recta (micromelia) (Figura 1); estos hallazgos se consideran compatibles con DTII y RCIU severo.
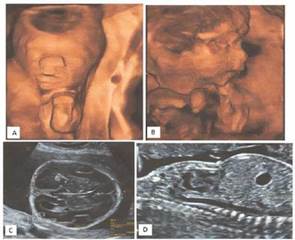
Fuente: autores
Figura 1 A-B. Se evidencia a nivel central el hallazgo de cráneo en trébol con prominencia frontal, hueso nasal hipoplásico, retrognatia y acortamiento generalizado de las extremidades de apariencia recta. C. Se evidencia cierre de sutura metópica, disgenesia del cuerpo calloso. D. Se evidencia tórax hipoplásico con hipoplasia pulmonar..
Con el resultado anterior, y teniendo en cuenta el riesgo social de la paciente y su familia al ser migrante con pobre introspección del cuidado de su embarazo y dificultad en el acceso a los servicios de salud, el servicio de perinatología informa a la paciente que los hallazgos en el feto son incompatibles con la vida, por lo que le brindan la posibilidad de interrumpir de forma voluntaria el embarazo (IVE), bajo la Sentencia C-355 del 2006 de la corte constitucional de Colombia, a la cual la paciente accede en esta valoración, posterior a dialogar la situación con su pareja y familiares, por lo que decide autónoma y voluntariamente no continuar con demás exámenes ni ecografías de gestación actual.
La IVE se realizó el mismo día de la valoración por medicina materno fetal en el hospital de tercer nivel, recibió manejo intrahospitalario con misoprostol 200 mcg, una tableta vía oral y 200 mcg vía intravaginal cada 6 horas, con posterior legrado de la cavidad uterina; se obtuvieron la placenta y restos ovulares, derivados a servicio de patología. Fue dada de alta con indicaciones de reclamar el resultado de patología y con programación de cita médica para valoración de planificación familiar con ginecología. Sin embargo, pese a la búsqueda, la muestra de patología fue extraviada, por lo que se desconoce el resultado de esta.
Discusión
Pese al inusual reporte de esta patología, por la limitante de la escasez de literatura médica y estudios epidemiológicos publicados16,17,18,19,20 y el patrón de herencia autosómico dominante, se conoce que la mayoría de los casos ocurren en personas sin antecedentes familiares de DT y en edades extremas maternas (alrededores de los 18 o 35 años)21, 22 y paternas (mayores de 40 años)10,23, como ocurrió en el caso de la paciente presentada y en casos como los reportados en Nicaragua y Chile17,20, con la diferencia de que en estos últimos la gestante contaba con edad avanzada17,20. Por el lado del padre, en el caso presentado no se contó con este factor de riesgo, ya que tenía 22 años. Muchos de los casos reportados en el mundo suceden durante el curso de la primera gestación, mientras que el caso presentado ocurrió durante la tercera gestación, lo cual lo hace menos común10,13,23 (Tabla 1).
En cuanto a las características fetales, se ha descrito predominio del doble de género masculino sobre femenino8,13, siendo evidente la predisposición en este caso, pero de forma comparativa en los casos descritos vemos igualdad en la presentación16,17,18,19,20 (Tabla 1).
Tabla 1 Casos clínicos de displasia tanatofórica tipo 2 en los últimos 10 años.
Fuente: autores
Por lo general, el diagnóstico de DT es realizado por USG durante el segundo trimestre, dado que durante las semanas 18-24 de gestación la relación entre el líquido amniótico y el cuerpo fetal es óptima para que el ecografista pueda evidenciar y tipificar las alteraciones fenotípicas fetales, lo cual le otorga una adecuada sensibilidad13, como ocurrió en el presente caso y en los casos comparativos reportados en el mundo15,16,17,18,19, los cuales fueron tamizados en una USG básica y posteriormente hallados en una USG con biometría fetal o de detalle anatómico en la semana 17 de gestación. En algunos casos es posible identificar un acortamiento generalizado de las extremidades y un aumento de la translucencia nucal en la ecografía de primer trimestre, sin embargo, dado el pequeño tamaño fetal, y considerando que la USG es un método de tamizaje operador dependiente, los estudios evidencian que su identificación puede estar limitada, por lo que su sensibilidad es reducida en comparación con la de segundo o tercer trimestre13.
Adicionalmente, la literatura describe que esta entidad también podría ser tamizada en exploraciones posteriores durante el tercer trimestre con la ayuda de la morfología esquelética fetal, la cual tendría utilidad en pacientes con pobre acceso a la salud que límite su oportuno ingreso al plan de control prenatal y por lo cual su primera ecografía obstétrica sea realizada durante el tercer trimestre1,6 14.
El diagnóstico depende de los hallazgos fenotípicos de cada una de las clasificaciones de la DT en la USG. La DTII se caracteriza por presentar fémures rectos y frecuentemente un cráneo de hoja de trébol trilobal, sumado al acortamiento simétrico marcado de las extremidades con pliegues cutáneos redundantes, acortamiento de manos y pies, macrocefalia con protuberancia frontal, puente nasal deprimido, tórax pequeño, abdomen grande y protuberante y un tronco de longitud relativamente normal13,14, lo cual se encontró tanto en la USG de segundo trimestre de la paciente presentada como en el abordaje de los casos clínicos comparadores16,17,18,19,20 (Tabla 1).
En comparación, el caso de Taiwán fue el único con diagnóstico por ecografía de primer trimestre, con el hallazgo de aumento de la translucencia nucal, que permitió sospechar posible aneuploidía19, pues en múltiples estudios se ha relacionado el aumento de la translucencia nucal con displasias esqueléticas, entre ellas la DT24,25,26. El caso presentado no pudo ser diagnosticado en primer trimestre, ya que la madre cursó con su primer control prenatal de forma tardía y no contaba con USG temprana, sin embargo, el diagnóstico se realizó al igual que en los demás casos mencionados de la manera óptima evidenciada por la literatura16,17,18,19,20.
Posteriormente, el diagnóstico puede ser confirmado mediante histopatología, biopsia o análisis genético; sin embargo, en este caso no pudo confirmarse, pues la muestra fue extraviada en el laboratorio pese a los esfuerzos de búsqueda de la misma, lo que constituyó una limitante para la confirmación del diagnóstico del presente caso. En el caso de Taiwán19 sí se pudo confirmar dicho diagnóstico mediante análisis genético molecular del gen FGFR3, a través de amniocentesis con muestra para hibridación fluorescente in situ o técnica FISH y cariotipo fetal15,27,28.
Pese a la consideración anterior, por los hallazgos en la USG del caso presentado, no se consideraron como posibles diagnósticos otras condrodisplasias como la DTI, acondroplasia homocigótica, la acondrogenia tipo 2, el síndrome de SADDAN, las displasias esqueléticas platispondílicas, la displasia campomélica o la displasia disegmentaria tipo Silverman-Handmaker, dado que ninguna de las anteriores cuenta con el hallazgo característico de la DTII del cráneo en trébol y el acortamiento generalizado de las extremidades de apariencia rectas, sumado a las alteraciones neurológicas y pulmonares descritas; además, entre los hallazgos no se describieron anomalías escapulares ni en los huesos iliacos, lordosis, cifosis, química sanguínea alterada, entre otras29.
Dada la letalidad de la DTII por la maduración prematura de las estructuras óseas y los consecuentes desenlaces mencionados, su pronóstico es considerado malo29,30,31, por lo tanto, entre las alternativas terapéuticas para diciembre del 2020 se encontraba la IVE. En Colombia, la Corte Constitucional emitió la sentencia C-355 de 2006 mediante la cual despenalizó el aborto en tres condiciones: cuando peligra la vida o la salud de la madre, cuando se presenta malformación del feto incompatible con la vida o cuando el embarazo es producto de abuso, violación, incesto, transferencia de óvulo o inseminación no consentida31,32. En el presente caso, la paciente recibió asesoría médica, y, a partir de la segunda de las causales mencionadas, se realizó procedimiento con previo consentimiento, sin complicaciones. En el contexto del grupo de trastornos FGFR3, la evidencia disponible afirma que la terapia para garantizar la vida posnatal para la DT sigue siendo muy poco probable en la actualidad14.
Conclusiones
La displasia tanatofórica tipo II es una de las patologías que destaca la importancia de la USG de primer trimestre, así como el seguimiento ecográfico durante la gestación, ya que permite considerar inicialmente su diagnóstico y, con base en su mal pronóstico, brindar alternativas terapéuticas a las gestantes que busquen mantener la salud materna y de su núcleo familiar.
Así mismo, es importante continuar con las campañas y la educación de forma pública y durante la consulta médica, con el fin de superar o mitigar las barreras económicas y políticas para que toda mujer en gestación o con deseo de la misma pueda asistir de forma oportuna a la consulta preconcepcional y consiguientes controles prenatales, para prevenir malformaciones fetales o enfermedades propias del embarazo que podrían poner en riesgo la vida de la madre o del feto a lo largo del embarazo.
Adicionalmente, se necesitan más estudios que abarquen con mayor fiabilidad la epidemiología de este trastorno de la gestación, en especial en nuestro país, dada la diferencia estimada entre la prevalencia regional y la cifra estimada en el mundo, encaminados a buscar factores de riesgo de peso relacionados, en busca de prevenir esta afección médica.














