Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad de Odontología Universidad de Antioquia
versão impressa ISSN 0121-246X
Rev Fac Odontol Univ Antioq vol.27 no.2 Medellín jan./jul. 2016
https://doi.org/10.17533/udea.rfo.v27n2a9
Articles
MICROSOMÍA HEMIFACIAL. REVISIÓN DE LA LITERATURA2
Assistant Professor
1 DDS, Intern in Craniofacial Malformation, Universidad de Chile School of Dentistry. Email: sebastianvelizm@gmail.com
2 Orthodontist. Hospital Luis Calvo Mackenna, Chile
3 Assistant Professor. Universidad de Chile School of Dentistry. Orthodontist. Hospital Luis Calvo Mackenna, Chile
La microsomía hemifacial corresponde a la segunda malformación congénita en prevalencia, luego de la fisura labiopalatina, y se describe como una alteración congénita del primer y el segundo arcos branquiales. Al ser una entidad en espectro, presenta características de expresión variable y por tanto los tratamientos son acordes a su individualidad. En esta revisión de tema se analizan su etiología, clasificaciones, características y tratamiento quirúrgico mandibular.
Palabras clave: asimetría facial; anomalías craneofaciales; microsomía hemifacial
Hemifacial microsomia is the second congenital malformation in prevalence, after cleft lip and palate, and is described as a congenital alteration of the first and second branchial arches. As a condition of wide spectrum, its characteristics are expressed in many different ways and therefore treatments are usually individualized. This topic review discusses its etiology, classification, characteristics, and treatment with mandibular surgery.
Key words: facial asymmetry; craniofacial anomalies; hemifacial microsomia
INTRODUCCIÓN
La microsomía hemifacial (MHF) corresponde a un espectro de malformaciones congénitas craneofaciales caracterizadas por la hipoplasia de los tejidos derivados embriológicamente del primer y el segundo arcos branquiales. Su manifestación es altamente variable, presentando defectos incluso a nivel cardiaco, vertebral y del sistema nervioso central.
Es la segunda malformación craneofacial más común después de la fisura de labio y paladar, con una incidencia estimada de 1/5.600 nacidos vivos.1) Se presenta unilateral en un 70% de los casos, y cuando aparece en forma bilateral, se presenta en forma asimétrica, afectando más a un lado que otro.2
Al ser una alteración compleja y heterogénea, los pacientes con alteraciones pertenecientes a este espectro han recibido distintos diagnósticos, como Síndrome de Goldenhar, espectro óculo-aurículo-vertebral, síndrome del primer y el segundo arcos branquiales, microsomía craneofacial, entre otros. Aún no se ha establecido un criterio diagnóstico común para dicha entidad.3
Su patogénesis obedece a un carácter heterogéneo explicado por diferentes teorías.4) Una de ellas es la propuesta por Poswillo, para quien la causa sería una disrupción vascular que produce una hemorragia durante la formación embriológica de la arteria estapedial, lo que se asocia con alteraciones en el desarrollo del primer y el segundo arcos branquiales. El tamaño del hematoma y la lesión del tejido resultante explicarían la morfología y las diferentes variaciones de MHF en los modelos experimentales, ya que, a mayor tamaño, mayores alteraciones en el desarrollo de estos arcos branquiales.5) Otra de las teorías es la postulada por Johnston,6) para quien el factor causal sería una alteración en la migración de las células de la cresta neural hacia la formación del ganglio trigeminal. Esta falta en la migración, y por ende la ausencia de interacción entre las células de la cresta neural y el mesénquima celular, también se ha asociado a otros problemas observados en pacientes con MHF, como la microdoncia y la hipodoncia,7) la fisura palatina y problemas cardiacos.8
Otros autores sugieren esta relación entre falta de migración de las células de la cresta neural y MHF debido a que en ausencia de estas células existe menor factor de crecimiento vascular endotelial (VEGF, por sus iniciales en inglés). Este factor de crecimiento promueve la proliferación del cartílago de Meckel y, en ausencia de VEGF, existe una correlación con hipoplasia mandibular.9
Si bien aún no hay claridad sobre su etiología, se han reconocido distintos factores ambientales y genéticos. Dentro de las causas ambientales, se han observado diversos factores de riesgo asociados a su presencia durante el embarazo, como el consumo de medicamentos vasoactivos,10) sangrado vaginal durante el segundo trimestre, gestaciones múltiples,11) el uso materno de tecnología reproductiva asistida 12) y diabetes preexistente o gestacional.13)(14
M. Werler ha publicado distintos estudios sobre la relación entre MHF y el consumo de drogas vasoactivas por la madre durante el embarazo. Uno de ellos es un estudio retrospectivo de casos y controles, en el que se analizaron diversos factores a los que estaba expuesta la madre durante el embarazo, entre ellos drogas vasoactivas como la pseudoefedrina, la fenilpropanolamina, le aspirina y el ibuprofeno. Se encontró que el uso de medicación vasoactiva en el primer trimestre, particularmente en combinación con el consumo de cigarrillos, se asociaba con un aumento del riesgo de MHF; también se asociaron otros eventos como gestaciones múltiples, diabetes, sangrado durante el segundo trimestre y fuerte consumo de alcohol.15
Dentro de las causas genéticas, si bien la mayoría de los casos son esporádicos, en algunos casos se ha observado un componente genético autosómico dominante (asociado al cromosoma 14),16)(17) un componente autosómico recesivo 18) y alteraciones cromosómicas, principalmente en los cromosomas 5 (deleción de 5p), 18 (trisomía) y 22 (deleción de 22q11.2), entre otros.19)(20
Clasificaciones
Las clasificaciones utilizadas en pacientes con MHF han evolucionado con el tiempo, abarcando cada vez más los aspectos propios de la patología.
1. Sistema de clasificación de Pruzansky (1969)
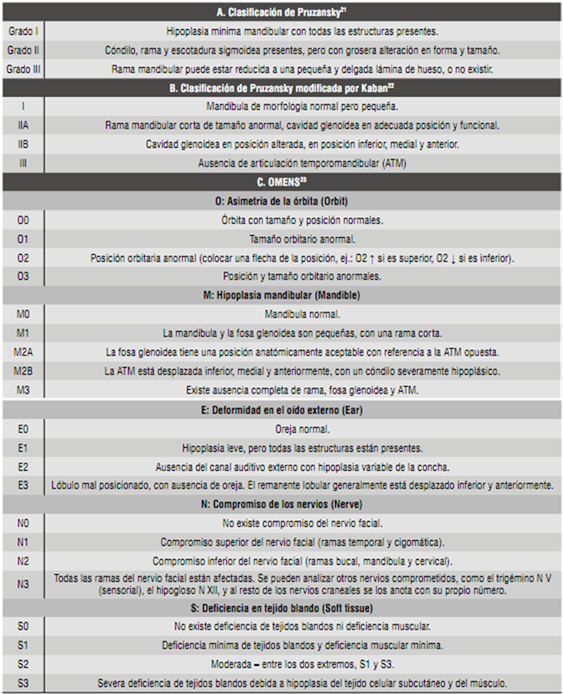
La primera clasificación utilizada en pacientes con MHF fue realizada por Samuel Pruzansky en 1969,21) a partir de radiografías de mandíbulas de pacientes con dicha condición. En su clasificación, Pruzansky observó tres tipos de hipoplasias mandibulares, desde una mandíbula relativamente completa (Grado I) hasta una muy pequeña y cuya deformidad empeoraba con el tiempo (Grado III) (Tabla 1-A). Esta clasificación cumple sólo con la descripción de la mandíbula, por tanto, al ser utilizada en pacientes con MHF, quedan fuera muchos aspectos propios de la patología.
2. Clasificación de Pruzansky modificada por Kaban et al (1988)
En 1988, Kaban et al 22) modificaron la clasificación de Pruzansky, añadiendo la descripción de las deformaciones vistas en telerradiografías de la articulación temporomandibular. La gran diferencia se observa en el Grado II, el cual presenta dos subclasificaciones dependiendo de la posición de la cavidad glenoídea, la cual puede estar normal (IIA) o alterada (IIB) (Tabla 1-B).
3. OMENS (1991)
Dada la gran variabilidad en la expresión fenotípica de esta malformación, en 1991 se postuló la clasificación OMENS,23) hecha con base en tres criterios, pensando en que una clasificación para MHF debía ser inclusiva y versátil, que los componentes anatómicos se analizaran por separado y que los datos se expresaran en escala numérica para que fuesen útiles clínicamente. La sigla OMENS corresponde a un acrónimo de las siglas en inglés para las cinco principales manifestaciones de la MHF: O: Asimetría de la órbita (Orbit); M: hipoplasia mandibular (Mandible); E: Deformidad en el oído externo (Ear); N: Compromiso de los nervios (Nerve); S: Deficiencia en tejido blando (Soft Tissue) (Tabla 1-C).
3.1. Modificaciones a la OMENS
OMENS+ (1995): Postulada con el fin de ampliar la expresión fenotípica de los pacientes con MHF hacia las alteraciones extracraneales.24
Representación pictográfica de la OMENS+: En 2007 se introdujo una representación pictográfica de la OMENS+,25 la cual fue luego modificada en 2011,26) con el fin de facilitar su comprensión en la práctica clínica, en la docencia y en la estandarización de la clasificación de pacientes con MHF
4. CFDS (Craniofacial Deformity Scoring)27 (2001)
Corresponde a la suma de MDS-Mandibular Deformity Scoring (valoración de la deformidad mandibular) + CDS-Cranial Deformity Scoring (Valoración de la deformidad craneal). A través del uso de tomografía computarizada, se analizan diferentes estructuras óseas y se les asignan valores de acuerdo con el grado en que están comprometidas; los máximos valores son 16 puntos para MDS y 19 para CDS.
Características clínicas
Al ser esta una anomalía del primer y el segundo arcos branquiales, la mayoría de las alteraciones están asociadas a estructuras desarrolladas a partir de dichos arcos,28) presentando una gran variación fenotípica. Se puede observar compromiso de:
Mandíbula y ATM: Desarrollo asimétrico mandibular por hipoplasia, ausencia de estructuras mandibulares (cóndilo y rama), ausencia o anquilosis de la articulación temporomandibular (ATM). Estudios publicados recientemente mostraron que los pacientes con MHF presentaron retrusión tanto de la mandíbula como del maxilar, en comparación con el grupo control, junto con un aumento del componente vertical; estos patrones fueron más marcados en el lado afectado y aumentaron de acuerdo a la severidad.29) La altura mandibular siempre fue menor a lo largo del crecimiento, pero el patrón de crecimiento fue similar en ambos grupos.30) En cuanto a la ATM, se ha visto que el grado de displasia de la mandíbula no se corresponde con el grado de displasia del disco, los cuales varían entre cada individuo; mientras que el lado no afectado no presenta mayores alteraciones.31
Órbita: distopía orbitaria (mala posición), dermoides epibulbares, anoftalmia/microftalmia, blefaroptosis, coloboma retinal o coroidal, entre otras anomalías menos frecuentes.32
Oídos: microtia, anotia, pérdida de la audición, hipoacusia, alteraciones del oído medio.
Nervios craneales: compromiso del nervio facial y, en casos más severos, de los nervios trigémino e hipogloso.
Dental: agenesias,7) hipoplasias dentales,33) microdoncia y maloclusiones. Retraso en el desarrollo dental en pacientes con MHF tipo IIB y III,34) siendo principalmente afectados los dientes más posteriores.35
Maxilofacial: fisura labio-palatina,36) macrostomía, hipoplasia de los tercios faciales, inclinación del plano oclusal (muy variable en angulación), hipoplasia de los músculos masticatorios,37) insuficiencia velofaríngea.38
Alteraciones extracraneales: principalmente a nivel renal, pulmonar, cardiaco, gastrointestinal, esqueletal y del sistema nervioso central (SNC).24
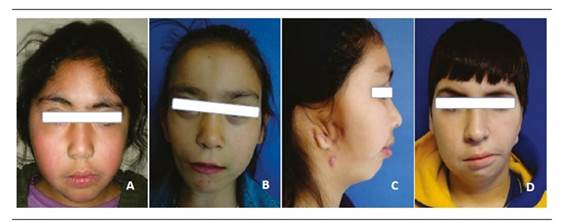
Debido a esto, en el diagnóstico es necesario establecer el grado de compromiso de las estructuras involucradas, tanto anatómica como funcionalmente, para así realizar las derivaciones en forma oportuna a los especialistas en cada una de las áreas comprometidas (Figura 1).
Se observan distintos pacientes con grados variables de MHF. En la imagen A, la paciente presenta una alteración mandibular izquierda Grado I, con leve desviación del tercio inferior. La imagen B corresponde a una alteración Grado IIA, presentando alteración de la simetría, tanto a nivel del tercio inferior como de las órbitas. En la imagen C se aprecia una alteración del tercio inferior, con compromiso completo del pabellón auricular derecho, correspondiente a una paciente con anomalía tipo IIB. La imagen D corresponde a un paciente con alteración tipo III del lado izquierdo.
Otros aspectos estudiados en pacientes con MHF hacen referencia a una mayor frecuencia en la internalización de problemas, competencias sociales pobres y menor aceptación por los pares -lo cual se observó más en las mujeres con madres jóvenes al momento de nacer y con otras alteraciones además de la mandíbula.39) También se ha visto una mayor frecuencia de ronquidos y otros síntomas de trastornos respiratorios del sueño.40
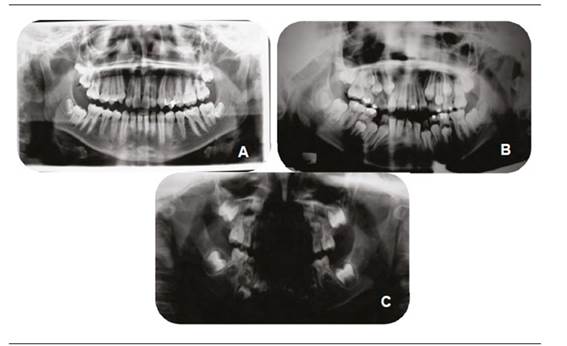
Si bien el diagnóstico es principalmente clínico, diversos exámenes complementarios permiten un mejor análisis de la patología. La ortopantomografía (Figura 2) permite un análisis inicial de las estructuras mandibulares y maxilofaciales, evaluando ambos lados en una misma imagen. Una telerradiografía de perfil permite evaluar, a través de la cefalometría, las relaciones entre maxilar y mandíbula, mientras que una telerradiografía frontal permite observar el grado de asimetría y desviación mandibular. Una radiografía oclusal otorga una visión apropiada de la bóveda palatina en caso de fisura labio-palatina.
En las imágenes se observan or topantomografías de pacientes con MHF, todas del lado derecho, pero con distintos grados de severidad (imagen A: Grado I; imagen B: Grado II e imagen C: Grado III). Se puede observar cómo, a medida que aumenta la severidad, la simetría entre las ramas y otras estructuras mandibulares se va reduciendo, y se pierde completamente la forma condilar en la imagen C.
Una forma alternativa de evaluar la MHF es a través de la tomografía computarizada en 3D (TC3D). Si bien permite una visión más realista y detallada, esta técnica requiere aplicar una gran cantidad de radiación sobre el paciente. Un estudio de Takahashi y colaboradores en 2013 sugiere el uso cuidadoso de ambos métodos (radiografía panorámica y TC3D), debido a que la primera tenía una buena fiabilidad en casos de pacientes con MHF Grado I de Pruzansky, mientras que en pacientes Grado II la fiabilidad era baja, por lo que el uso de TC3D era preferible.41) Otra herramienta utilizada en pacientes con MHF es la fotogrametría, que permite una aproximación no invasiva en la planificación quirúrgica.42
Los protocolos fotográficos también son útiles durante el diagnóstico del paciente y en la evaluación de los avances del resultado postratamiento. Un estudio publicado en 2013 por Birgfeld y colaboradores 43) arrojó que era factible establecer el fenotipo de pacientes con MHF tanto con imagenología 2D como con 3D, las cuales presentaban diversas ventajas y desventajas. La fortaleza de las técnicas 2D consistía en que para los clínicos era más fácil trabajar debido a su familiaridad con ellas; mientras que su debilidad era que dependía mucho de la cooperación del paciente y de las habilidades del fotógrafo; además, no se podía girar y se necesitaba estandarizar correctamente las fotografías, debido a que las leves inclinaciones dificultaban determinar correctamente el grado de asimetría. La ventaja de las imágenes en 3D era que permitía girar las imágenes y ver el aspecto facial desde distintos ángulos; además era más rápido que seguir un protocolo fotográfico. Su principal desventaja era la falta de definición a nivel del oído y los párpados, y la interferencia del pelo, lo que se traducía en pérdida de información.
Diagnóstico diferencial
Hipoplasia hemimandibular con colapso condilarcoronoídeo: cuadro generalmente no diagnosticado al nacimiento, sin alteraciones de tejidos blandos y caracterizado principalmente por desviación del mentón por hipoplasia del cóndilo, proceso coronoides y rama mandibular, siempre en presencia de fosa temporal (cavidad glenoídea).44)(45
Síndromes: La MHF, al ser clínicamente variable, debe ser descartada por un genetista de síndromes que comprometen también el macizo maxilofacial. Síndromes como Treacher-Collins, Miller-Dieker, Townes-Brocks, CHARGE, branquio-oto-renal, Parry-Romberg, entre otros, presentan características similares a la MHF, como alteraciones mandibulares, colobomas o alteraciones palpebrales y malformaciones del oído externo.3
Tratamiento
En general, se acepta que la mejor forma de tratar a pacientes con MHF es a través de equipos interdisciplinarios,46) cuya diversidad de especialidades permita, a través de un trabajo conjunto, el tratamiento apropiado para cada paciente acorde a sus necesidades.
La planificación del tratamiento se hará dependiendo del tipo de malformación y la severidad en la expresión de ésta, siempre tomando en cuenta las expectativas del paciente y la familia en cuanto a los resultados.
Con el tratamiento, principalmente de cirugía ortognática/ plástica y ortodoncia, se debe buscar mejorar la funcionalidad, junto con una simetría facial óptima, con el fin de:47)(48
1. Aumentar el tamaño del lado mandibular afectado y su tejido blando asociado.
2. Crear una articulación que simule la ATM en los casos en los que ésta esté ausente.
3. Corregir deformidades secundarias en el maxilar.
4. Establecer una oclusión funcional, así como una apariencia estética facial y dentaria.
5. Mejorar y horizontalizar el plano de oclusión.
6. Obtener apertura bucal cuando ésta se presenta limitada.
El tratamiento ortodóntico convencional puede comprender inicialmente aparatología funcional con el uso de activadores rígidos de acrílico, individualizados según el caso. Estos aparatos permiten la expansión del tejido afectado, aprovechando el crecimiento fisiológico del paciente. En ocasiones pueden tener planos de altura en el lado sano, permitiendo la compensación vertical de la zona afectada, siempre teniendo presente mantener centrada la línea media facial con la dentaria. Posteriormente se puede complementar con ortodoncia fija convencional.
Tratamiento quirúrgico mandibular
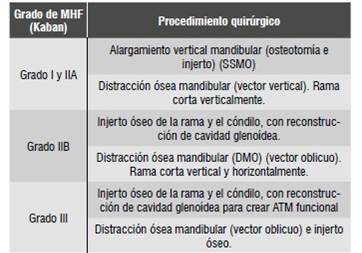
Si bien la literatura es amplia en cuanto a técnicas y tiempos quirúrgicos, el tratamiento de los pacientes con MHF se puede dividir en dos grupos, según la clasificación de Kaban-Prusansky: los pacientes Grado I y Grado IIA se tratan de la misma forma, mientras que los pacientes Grado IIB y Grado III se tratan de manera similar entre ellos, pero distinta al primer grupo.49 (Tabla 2).
Tabla 2 Procedimiento quirúrgico de acuerdo al tipo de microsomía hemifacial según la clasificación de Kaban, según Liu y colaboradores, 201249
El manejo quirúrgico mandibular es esencial, y la distracción ósea mandibular tiene diversas ventajas sobre el injerto costocondral. Entre ellas está aumentar el largo vertical de la mandíbula, mejorar la asimetría del tejido blando, producir menor pérdida de sangre, tener un mejor control del vector de avance y obtener una mejora sustancial en la biomecánica de la mandíbula.50
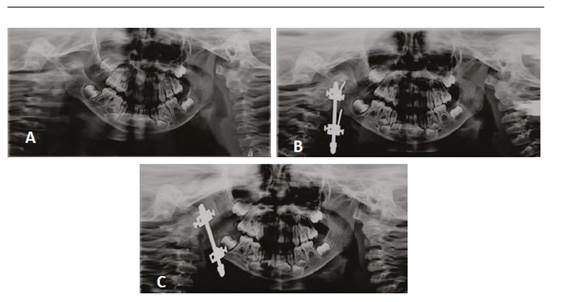
La distracción ósea se basa en el principio de tensión-estrés para permitir el alargamiento óseo y de tejidos blandos a partir de la separación controlada de segmentos óseos (Figura 3). Para ello existen diversos tipos de distractores, los cuales se pueden categorizar en dos áreas. De acuerdo a su ubicación, los distractores pueden ser extraorales e intraorales; mientras que, según la cantidad de vectores con los cuales trabajan, éstos pueden ser univectorial o unidireccional, o bidireccional (plano horizontal y vertical) o multidireccional (plano horizontal, vertical y transversal).51
En las imágenes se observan las ortopantomografías de una paciente de 3 años de edad con MHF tipo II durante la distracción ósea con aparato extraoral. La imagen A corresponde a la radiografía inicial. La imagen B corresponde a la radiografía de control una vez instalado el distractor. La imagen C se tomó luego de un mes de distracción. Nótese el cambio de inclinación del distractor, el aumento en la simetría mandibular y la mejor relación de las piezas dentarias.
La elección del aparto de distracción dependerá de diversos factores, entre ellos la edad del paciente, el grado de severidad de la malformación y la necesidad de movilidad de los segmentos. En general, los aparatos extraorales requieren una cirugía menos compleja, pueden lograr distancias de distracción más largas y permiten manejar la distracción en los tres sentidos del espacio, pero dejan cicatrices en la piel, son más visibles y pueden llegar a ser más pesados, presentando molestias para el paciente. Los aparatos intraorales son menos visibles y no dejan cicatriz facial, pero tienen un limitado rango de movilidad en el espacio, y su cirugía es más compleja tanto para su inserción como para su remoción. Recientemente se han desarrollado dispositivos reabsorbibles que permiten la distracción mandibular en una etapa, logrando avances de entre 15 y 30 mm.52 De todas formas, la simulación quirúrgica en un modelo sólido puede ayudar a lograr mejor simetría mandibular, especialmente en distracción ósea con multivector.53
Es importante recalcar la necesidad de tomar en cuenta, más allá del estadio del crecimiento del paciente, las necesidades de tratamiento que éste tiene, ya que varían entre los pacientes, y por tanto cada caso debe ser analizado como único.
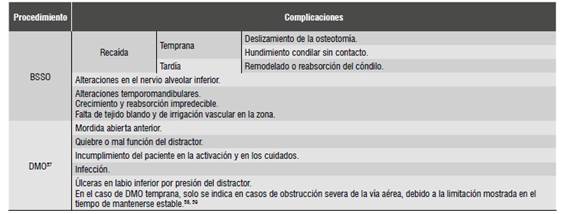
Complicaciones
Una revisión de la literatura en 2009 54) comparó la estabilidad y las complicaciones de la distracción ósea y el injerto costocondral. Encontró que ambas técnicas tienen una tasa de recidiva similar cuando se realiza un avance mandibular de entre 6 y 10 mm. Las principales complicaciones se muestran en la Tabla 3. Dicha revisión, si bien sugiere que la distracción ósea mandibular es menos susceptible a grandes complicaciones, es blanco de complicaciones menores que también causan morbilidad en el paciente, además de estar afectada por otros factores como la larga fase de consolidación, el costo del distractor, el cumplimiento del paciente en activar el distractor y la necesidad de realizar una segunda cirugía para extraer el distractor.
Otras cirugías
Al ser una malformación con gran variación fenotípica, los pacientes con MHF pueden necesitar otras cirugías, dependiendo de las estructuras comprometidas. Una revisión de la microsomía craneofacial realizada por Birgfeld y Heike en 2012 55) muestra una línea de tiempo como guía en el manejo médico-quirúrgico de los pacientes con MHF, propuesta por los miembros del Centro Craneofacial en el Hospital de Niños de Seattle, contemplando su avance desde el nacimiento hasta la adultez. Dependiendo del paciente, puede ser necesario realizar:
Órbita:Puede involucrar cirugías de dermoides epibulbares y coloboma del párpado. En casos de alteraciones en tamaño o posición de la órbita, la reposición se realiza alrededor de los 3 o 4 años de edad.
Oídos:Tubos de ventilación timpánica (colleras). En caso de alteración del oído externo, la cirugía varía de acuerdo al compromiso del pabellón auricular, desde la remodelación del cartílago en caso de hipoplasias leves, hasta la reconstrucción completa a través de injertos autólogos o aloplásticos, como el polietileno poroso de alta densidad. En pacientes con pérdida auditiva, se debe evaluar la posibilidad de reparación de atresia del canal auditivo.
Nervio facial:En casos de parálisis del nervio, se debe evaluar la zona y el grado de compromiso, que puede ser superior (afecta a la zona temporal y cigomática), inferior (zona bucal, mandibular y cervical) o total. En caso de compromiso bucal, se debe evaluar la necesidad de realizar reanimación facial. En caso de alteración del movimiento palpebral, se debe considerar algún tipo de tratamiento con el fin de evitar queratitis corneal por exposición.
Tejidos blandos:Cierre de fisuras orofaciales, corrección de vía aérea, cirugía de aumento de tejidos blandos e injertos de grasa.
En Chile no existen protocolos de tratamiento publicados para la microsomía hemifacial, patología que tampoco está cubierta por el sistema público de salud, por lo que la mayoría de los pacientes realiza sus tratamientos en forma privada, siendo condicionados por diversos factores como el acceso a especialistas con conocimiento en MHF, costo de los procedimientos, previsión de salud, entre otros.
En Latinoamérica sólo existe un protocolo de seguimiento,56) publicado en Argentina, pero no existe ningún protocolo de tratamiento.
CONCLUSIONES
La microsomía hemifacial es una enfermedad heterogénea, variable y de expresividad única en cada sujeto, tanto en su etiología, como en su severidad y por ende en su tratamiento. Al ser una alteración en espectro, afecta diversas estructuras del individuo de acuerdo a su gravedad. Es por ello que en estos pacientes es de vital importancia el trabajo interdisciplinario muy bien coordinado, ya que pueden presentar incluso alteraciones psicosociales y extracraneales, que deben ser exploradas y tratadas a tiempo.
REFERENCES
1. Cohen MM Jr, Rollnick BR, Kaye CI. Oculoauriculovertebral spectrum: an updated critique. Cleft Palate J 1989; 26(4): 276-286. [ Links ]
2. Mielnik-Blaszczak M. Hemifacial microsomia. Review of the literature. Dent Med Probl 2011; 40(1): 80-85. [ Links ]
3. Heike CL, Luquetti DV, Hing AV. Craniofacial microsomia overview. In: Pagon RA, Adam MP, Bird TD editors. GeneReviews®[Internet]. Seattle: University of Washington, Seattle; 1993-2013. Disponible en:http:// www.ncbi.nlm.nih.gov/books/NBK5199/ [ Links ]
4. Hartsfield JK. Review of the etiologic heterogeneity of the oculo-auriculo-vertebral spectrum (Hemifacial Microsomia). Orthod Craniofac Res 2007; 10(3): 121-128. [ Links ]
5. Poswillo D. The pathogenesis of the first and second branchial arch syndrome. Oral Surg Oral Med Oral Pathol 1973; 35(3): 302-328. [ Links ]
6. Johnston MC, Bronsky PT. Animal models for human craniofacial malformations. J Craniofac Genet Dev Biol 1991; 11(4): 277-291. [ Links ]
7. Maruko E, Hayes C, Evans CA, Padwa B, Mulliken JB. Hypodontia in hemifacial microsomia. Cleft Palate Craniofac J 2001; 38(1): 15-19. [ Links ]
8. Sulik KK, Cook CS, Webster WS. Teratogens and craniofacial malformations: relationships to cell death. Development 1988;103 (Suppl): 213-231. [ Links ]
9. Wiszniak S, Mackenzie FE, Anderson P, Kabbara S, Ruhrberg C, Schwarz Q. Neural crest cell-derived VEGF promotes embryonic jaw extension. Proc Natl Acad Sci U S A. 2015; 112(19): 6086-6091. [ Links ]
10. Werler MM, Sheehan JE, Hayes C, Mitchell AA, Mulliken JB. Vasoactive exposures, vascular events, and hemifacial microsomia. Birth Defects Res A Clin Mol Teratol 2004; 70(6): 389-395. [ Links ]
11. Werler MM, Sheehan JE, Hayes C, Padwa BL, Mitchell AA, Mulliken JB. Demographic and reproductive factors associated with hemifacial microsomia. Cleft Palate Craniofac J 2004; 41(5): 494-450. [ Links ]
12. Wieczorek D, Ludwig M, Boehringer S, Jongbloet PH, Gillessen-Kaesbach G, Horsthemke B. Reproduction abnormalities and twin pregnancies in parents of sporadic patients with oculo-auriculo-vertebral spectrum/Goldenhar syndrome. Hum Genet 2007; 121(3-4): 369-376. [ Links ]
13. Ewart-Toland A, Yankowitz J, Winder A, Imagire R, Cox VA, Aylsworth AS et al. Oculoauriculovertebral abnormalities in children of diabetic mothers. Am J Med Genet ; 2000 90(4): 303-309. [ Links ]
14. Wang R, Martinez-Frias ML, Graham JM Jr. Infants of diabetic mothers are at increased risk for the oculoauriculo- vertebral sequence: A case-based and casecontrol approach. J Pediatr 2002; 141(5): 611-617. [ Links ]
15. Werler MM, Starr JR, Cloonan YK, Speltz ML. Hemifacial microsomia: from gestation to childhood. J Craniofac Surg 2009; 20 (Suppl 1): 664-669. [ Links ]
16. Tasse C, Majewski F, Bohringer S, Fischer S, Ludecke HJ, Gillessen-Kaesbach G et al. A family with autosomal dominant oculo-auriculo-vertebral spectrum. Clin Dysmorphol 2007; 16(1): 1-7. [ Links ]
17. Kelberman D, Tyson J, Chandler DC, McInerney AM, Slee J, Albert D et al. Hemifacial microsomia: progress in understanding the genetic basis of a complex malformation syndrome. Hum Genet 2001; 109(6): 638-645. [ Links ]
18. Brady AF, Winter RM, Wilson LC, Tatnall FM, Sheridan RJ, Garrett C. Hemifacial microsomia, external auditory canal atresia, deafness and Mullerian anomalies associated with acro-osteolysis: a new autosomal recessive syndrome? Clin Dysmorphol 2002; 11(3): 155-161. [ Links ]
19. Choong YF, Watts P, Little E, Beck L. Goldenhar and cridu- chat syndromes: a contiguous gene deletion syndrome? J AAPOS 2003; 7(3): 226-227. [ Links ]
20. Derbent M, Yilmaz Z, Baltaci V, Saygili A, Varan B, Tokel K. Chromosome 22q11.2 deletion and phenotypic features in 30 patients with conotruncal heart defects. Am J Med Genet A 2003; 116A(2): 129-135. [ Links ]
21. Pruzansky S. Not all dwarfed mandibles are alike. Birth Defects 1969; 1: 120-9. [ Links ]
22. Kaban LB, Moses MH, Mulliken JB. Surgical correction of hemifacial microsomia in the growing child. Plast Reconstr Surg 1988; 82(1): 9-19. [ Links ]
23. Vento AR, LaBrie RA, Mulliken JB. The O.M.E.N.S. classification of hemifacial microsomia. Cleft Palate Craniofac J 1991; 28(1): 68-76. [ Links ]
24. Horgan JE, Padwa BL, LaBrie RA, Mulliken JB. OMENSPlus: analysis of craniofacial and extracraniofacial anomalies in hemifacial microsomia. Cleft Palate Craniofac J 1995; 32(5): 405-412. [ Links ]
25. Gougoutas AJ, Singh DJ, Low DW, Bartlett SP. Hemifacial microsomia: clinical features and pictographic representations of the OMENS classification system. Plast Reconstr Surg 2007; 120(7): 112e-120e. [ Links ]
26. Birgfeld CB, Luquetti DV, Gougoutas AJ, Bartlett SP, Low DW, Sie KC et al. A phenotypic assessment tool for craniofacial microsomia. Plast Reconstr Surg 2011; 127(1): 313-320. [ Links ]
27. Huisinga-Fischer CE, Zonneveld FW, Vaandrager JM, Prahl-Andersen B. CT-based size and shape determination of the craniofacial skeleton: a new scoring system to assess bony deformities in hemifacial microsomia. J Craniofac Surg 2001; 12(1): 87-94. [ Links ]
28. Sze RW, Paladin AM, Lee S, Cunningham ML. Hemifacial microsomia in pediatric patients: asymmetric abnormal development of the first and second branchial arches. AJR Am J Roentgenol 2002; 178(6): 1523-1530. [ Links ]
29. Ongkosuwito EM, van Neck JW, Wattel E, van Adrichem LN, Kuijpers-Jagtman AM. Craniofacial morphology in unilateral hemifacial microsomia. Br J Oral Maxillofac Surg 2012; 51(8): 902-907 [ Links ]
30. Ongkosuwito EM, van Vooren J, van Neck JW, Wattel E, Wolvius EB, van Adrichem LN et al. Changes of mandibular ramal height, during growth in unilateral hemifacial microsomia patients and unaffected controls. J Craniomaxillofac Surg 2013; 41(2): 92-97. [ Links ]
31. Kitai N, Murakami S, Takashima M, Furukawa S, Kreiborg S, Takada K. Evaluation of temporomandibular joint in patients with hemifacial microsomia. Cleft Palate Craniofac J 2004; 41(2): 157-162. [ Links ]
32. Gorlin RJ, Cohen MM Jr, Hennekam RCM. Syndromes of the head and neck. 4 ed. New York: Oxford University Press; 2001. [ Links ]
33. Farias M, Vargervik K. Tooth size and morphology in hemifacial microsomia. Int J Pediatr Dent 1998; 8(3): 197- 201. [ Links ]
34. Ongkosuwito EM, de Gijt P, Wattel E, Carels CE, Kuijpers-Jagtman AM. Dental development in hemifacial microsomia. J Dent Res 2010; 89(12): 1368-1372. [ Links ]
35. Seow WK, Urban S, Vafaie N, Shusterman S. Morphometric analysis of the primary and permanent dentitions in hemifacial microsomia: a controlled study. J Dent Res 1998; 77(1): 27-38. [ Links ]
36. Fan WS, Mulliken JB, Padwa BL. An association between hemifacial microsomia and facial clefting. J Oral Maxillofac Surg 2005; 63(3): 330-334. [ Links ]
37. Heude E, Rivals I, Couly G, Levi G. Masticatory muscle defects in hemifacial microsomia: a new embryological concept. Am J Med Genet A 2011; 155A(8): 1991-1995. [ Links ]
38. Funayama E, Igawa HH, Nishizawa N, Oyama A, Yamamoto Y. Velopharyngeal insufficiency in hemifacial microsomia: analysis of correlated factors. Otolaryngol Head Neck Surg 2007; 136(1): 33-37. [ Links ]
39. Dufton LM, Speltz ML, Kelly JP, Leroux B, Collett BR, Werler MM. Psychosocial outcomes in children with hemifacial microsomia. J Pediatr Psychol 2011; 36(7): 794-805. [ Links ]
40. Cloonan YK, Kifle Y, Davis S, Speltz ML, Werler MM, Starr JR. Sleep outcomes in children with hemifacial microsomia and controls: a follow-up study. Pediatrics 2009; 124(2): e313-321. [ Links ]
41. Takahashi-Ichikawa N, Susami T, Nagahama K, Ohkubo K, Okayasu M, Uchino N et al. Evaluation of mandibular hypoplasia in patients with hemifacial microsomia: a comparison between panoramic radiography and three-dimensional computed tomography. Cleft Palate Craniofac J 2013; 50(4): 381-387. [ Links ]
42. Jayaratne YS, Lo J, Zwahlen RA, Cheung LK. Threedimensional photogrammetry for surgical planning of tissue expansion in hemifacial microsomia. Head Neck 2010; 32(12): 1728-1735. [ Links ]
43. Birgfeld CB, Saltzman BS, Luquetti DV, Latham K, Starr JR, Heike CL. Comparison of two-dimensional and three-dimensional images for phenotypic assessment of craniofacial microsomia. Cleft Palate Craniofac J 2013; 50(3): 305-314. [ Links ]
44. Meazzini MC, Brusati R, Diner P, Gianni E, Lalatta F, Magri AS et al. The importance of a differential diagnosis between true hemifacial microsomia and pseudohemifacial microsomia in the post-surgical long-term prognosis. J Craniomaxillofac Surg 2011; 39(1): 10-16. [ Links ]
45. Meazzini MC, Brusati R, Caprioglio A, Diner P, Garattini G, Gianni E et al. True hemifacial microsomia and hemimandibular hypoplasia with condylar-coronoid collapse: diagnostic and prognostic differences. Am J Orthod Dentofacial Orthop 2011; 139(5): e435-447. [ Links ]
46. Association AC-P-C. Parameters for the Evaluation and treatment of patients with cleft lip/palate or other craniofacial anomalies. Revised Edition 2009. Original Publication Cleft Palate-Craniofacial Journal 1993; 30 (Suppl 1). [ Links ]
47. Ohtani J, Hoffman WY, Vargervik K, Oberoi S. Team management and treatment outcomes for patients with hemifacial microsomia. Am J Orthod Dentofacial Orthop 2012; 141 (Suppl 4): S74-81. [ Links ]
48. Vargervik K, Oberoi S, Hoffman WY. Team care for the patient with cleft: UCSF protocols and outcomes. J Craniofac Surg 2009; 20 (Suppl 2): 1668-1671. [ Links ]
49. Liu SYC, Good P, Lee JS. Chapter 94 - Surgical care of the hemifacial microsomia patient. Current therapy in oral and maxillofacial surgery. Saint Louis: W.B. Saunders; 2012, p. 828-834. [ Links ]
50. Reina-Romo E, Sampietro-Fuentes A, Gomez-Benito MJ, Dominguez J, Doblare M, Garcia-Aznar JM. Biomechanical response of a mandible in a patient affected with hemifacial microsomia before and after distraction osteogenesis. Med Eng Phys 2010; 32(8): 860-866. [ Links ]
51. Lo J, Cheung LK. Distraction osteogenesis for the craniomaxillofacial region. Part 2: a compendium of devices for the mandible. Asian J Oral Maxillofac Surg. 2007; 19(1): 6-18. [ Links ]
52. Burstein FD. Resorbable distraction of the mandible: technical evolution and clinical experience. J Craniof Surg 2008; 19(3): 637-643. [ Links ]
53. Sakamoto Y, Ogata H, Nakajima H, Kishi K, Sakamoto T, Ishii T. Role of solid model simulation surgery for hemifacial microsomia. Cleft Palate Craniofac J 2013; 50(5): 623-626. [ Links ]
54. Ow A, Cheung LK. Skeletal stability and complications of bilateral sagittal split osteotomies and mandibular distraction osteogenesis: an evidence-based review. J Oral Maxillofac Surg 2009; 67(11): 2344-2353. [ Links ]
55. Birgfeld CB, Heike C. Craniofacial microsomia. Semin Plast Surg 2012; 26(2): 91-104. [ Links ]
56. Lara-García TU, Ulfe I, Rodriguez JC, Dogliotti PLV. Protocolo de seguimiento de pacientes con microsomía hemifacial. Prensa Med Argent 2002; 89(5): 414-423. [ Links ]
57. Van Strijen PJ, Breuning KH, Becking AG, Perdijk FBT, Tuinzing DB. Complications in bilateral mandibular distraction osteogenesis using internal devices. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003; 96(4): 392-397. [ Links ]
58. Meazzini MC, Mazzoleni F, Bozzetti A, Brusati R. Comparison of mandibular vertical growth in hemifacial microsomia patients treated with early distraction or not treated: follow up till the completion of growth. J Craniomaxillofac Surg 2012; 40(2): 105-111. [ Links ]
59. Gursoy S, Hukki J, Hurmerinta K. Five year follow-up of mandibular distraction osteogenesis on the dentofacial structures of syndromic children. Orthod Craniofac Res 2008; 11(1): 57-64 [ Links ]
Recibido: 03 de Diciembre de 2013; Aprobado: 15 de Septiembre de 2015











 texto em
texto em