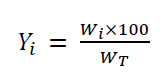Introducción
Las ceras son ingredientes que se adicionan a formulaciones cosméticas o farmacéuticas (Robles, 2011), las cuales se pueden clasificar como naturales, minerales y sintéticas (Fei & Wang, 2017; Pirow et al., 2019). Las ceras sintéticas obtenidas del petróleo constituyen la principal fuente de ceras en el mercado mundial (Saji, 2020), sin embargo, el agotamiento de las reservas de petróleo y las fluctuaciones de su precio han impulsado la búsqueda de alternativas sostenibles para su producción (Yadav et al., 2020). En este sentido, los aceites vegetales son una fuente promisoria para la producción de ceras biodegradables y sustentables (Alam et al., 2014).
El aceite de palma (Elaeis guineensis) es el aceite vegetal de mayor producción en el mundo (Lye Chew et al., 2021), dado que puede producir hasta 8 ton de aceite/hectárea-año en algunas regiones, sin embargo, el promedio actual de rendimiento en Indonesia está en 3,3 ton de aceite/hectárea-año (Hariyadi, 2020). Esta productividad es mucho mayor cuando se la compara con otras oleaginosas como la semilla de soya (0,4 ton/hectárea-año) y la semilla de girasol (0,5 ton/hectárea-año) (Hariyadi, 2020). Además de su mayor productividad, la palma también tiene la mayor vida productiva, superando los 25 años (Woittiez et al., 2017) y un bajo costo USD 169/ton (Hariyadi, 2020). En Colombia, la palma se encuentra sembrada en 161 municipios y genera 185.000 empleos (Fedepalma, 2022), lo que confirma el interés en esta materia prima.
El proceso de extracción del aceite a partir de los frutos de palma comprende diferentes etapas en las que se utilizan elevadas temperaturas, entre las que se encuentra digestión, prensado y clarificación, entre otras. Además, del fruto de la palma se puede obtener aceite del mesocarpio y de la almendra. Al igual que otros aceites utilizados para consumo humano (Pratik & Surekha, 2018) o aplicaciones industriales como producción de biodiesel (Dey et al., 2021), el aceite de palma es sometido a procesos como neutralización, desgomación, blanqueamiento y desodorización, donde la suma de estos cuatro pasos es conocida como el proceso de refinación (Pratik & Surekha, 2018) y el aceite refinado recibe el nombre de aceite de palma RBD (refinado, blanqueado y desodorizado).
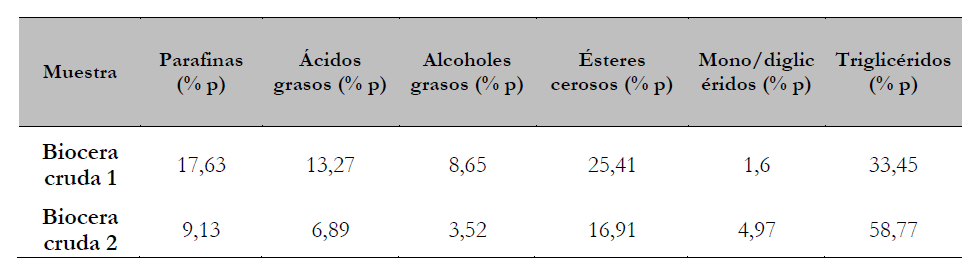
Previamente, se reportó que el hidrotratamiento de aceite de palma puede ser usado para la producción de bioceras (Fei & Wang, 2017; Gunawan & Suhendra, 2008; Lee, 2008; Susanto et al., 2014), el cual tiene varias ventajas: bajos costos de procesamiento y bajo consumo de energía en los procesos de separación de los productos de reacción (Zikri & Aznury, 2020). Para este proceso, se inyecta hidrógeno a 4-9 MPa en presencia de catalizadores heterogéneos de NiMo/Al2O3 a temperaturas entre 280 °C y 380 °C (Susanto et al., 2014). Según Guzmán et al. (2010), la biocera obtenida por hidrotratamiento del aceite de palma está compuesta por ácidos grasos, parafinas, alcoholes cerosos, ésteres cerosos y glicéridos, donde de estas familias, la biocera puede contener hasta un 40 % en peso de compuestos livianos como los ácidos grasos libres y las parafinas (Guzmán et al., 2010), elementos que no le permiten alcanzar los valores de punto de fusión y dureza requeridos por estándares de calidad (Icontec, 1988).
Por su parte, los procesos convencionales de separación utilizados a nivel industrial, como la destilación a presión atmosférica o la destilación a presión reducida, no permiten la remoción individual de parafinas y ácidos grasos de las ceras; por otro lado, el proceso de cristalización sin solventes sí permite obtener ceras sintéticas con un promedio de 30 carbonos, con remoción de hasta el 50 % en peso de los alcanos de bajo punto de fusión (Kuszlik et al., 2010). Además, los procesos de cristalización para la producción de ingredientes cosméticos y farmacéuticos han logrado mejoras significativas en características como distribución de tamaño de cristales, forma polimórfica, morfología y pureza, entre otras (Gao et al., 2017).
A pesar de que los procesos de cristalización han sido ampliamente empleados previamente en ceras sintéticas (Edwards, 1957; Ferris & Cowles, 1945; Louanate et al., 2020), no se encuentran reportes en los que se analicen los resultados de caracterización por DSC o DRX de bioceras obtenidas del aceite de palma, información que es clave a la hora de seleccionar las temperaturas a las cuales se deben desarrollar los procesos de cristalización con el fin de aumentar los rendimientos de refinación, por lo tanto, el objetivo de esta investigación es aumentar la temperatura de fusión de dos muestras de biocera de palma utilizando un proceso de cristalización sin solvente y describir los resultados. Para ello, se realizó la caracterización fisicoquímica de las bioceras crudas y las fracciones obtenidas en el proceso de cristalización, así como el análisis de calorimetría diferencial de barrido (DSC), difracción de rayos X (DRX), punto de fusión y pruebas titulométricas.
Materiales y métodos
Materias primas
Las dos muestras de biocera de aceite de palma utilizadas en esta investigación fueron suministradas por el Instituto Colombiano del Petróleo (ICP).
Las dos muestras se obtuvieron por hidrotratamiento de aceite de palma refinado RBD a diferentes condiciones operacionales. Para determinar la composición de las familias químicas presentes en las dos muestras, se utilizó cromatografía de gases según la metodología ASTM D2425-17. Las composiciones de las dos muestras se presentan en la Tabla 1.
Calorimetría diferencial de barrido (DSC)
El análisis de calorimetría diferencial de barrido se realizó utilizando un equipo TA Instruments (modelo Discovery) y el análisis DSC se realizó en atmósfera de nitrógeno desde -80 ºC hasta 100 ºC, con una velocidad de calentamiento de 10 ºC/min. Posteriormente, la muestra se enfrió desde 100 ºC hasta -80 ºC con una velocidad de enfriamiento de 10 ºC/min, y, finalmente, se calentó desde -80 ºC hasta 500 ºC, con una velocidad de calentamiento de 10 ºC/min (Kuszlik et al., 2010).
Difracción de rayos X (DRX)
El análisis DRX se realizó utilizando un equipo Bruker D8 Advance con geometría DaVinci, un voltaje de 40 kV, una corriente de 40 mA y una rendija de divergencia de 0,6 mm, con el cual se realizaron mediciones a 25 ºC y 50 ºC para la biocera 1, y a 25 ºC y 35 ºC para la biocera 2 (Kuszlik et al., 2010).
Punto de fusión
Para la determinación del punto de fusión de las muestras de biocera se utilizó el equipo Hanon MP-420, de acuerdo con la metodología de la norma NTC 213 y se determinó el promedio entre las temperaturas de fusión inicial y final.
Pruebas titulométricas
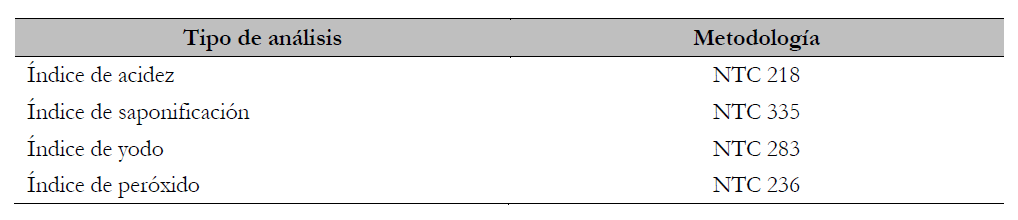
Las pruebas de caracterización titulométricas realizadas se presentan en la tabla 2.
Cristalización sin solvente
Las temperaturas de cristalización se determinaron previamente a partir de los análisis DSC, siendo de 40 °C para la biocera cruda 1 y de 30 °C para la biocera cruda 2. El cristalizador se conformó por un vaso de vidrio equipado con una chaqueta de calentamiento, un termómetro y un sistema de agitación. En este se cargaron 10 g de la muestra de biocera y se calentó hasta los 70 ºC. Después se disminuyó la temperatura a una velocidad de 1 ºC/min hasta alcanzar la temperatura de cristalización (40 °C para la biocera cruda 1 y 30 °C para la biocera cruda 2), manteniendo la disminución constante durante una hora. Posteriormente, la muestra se centrifugó a 8000 rpm durante 20 min y las fracciones (líquida y sólida) obtenidas fueron separadas por decantación y pesadas por separado. Para la determinación del rendimiento de la fracción sólida (en porcentaje) se utilizó la siguiente ecuación:
Donde Yi es el rendimiento másico (en porcentaje) de la fracción sólida, Wison los gramos de fracción sólida obtenidos en el experimento i y WT es el peso de biocera cruda (en gramos).
Resultados y discusión
Calorimetría diferencial de barrido (DSC)
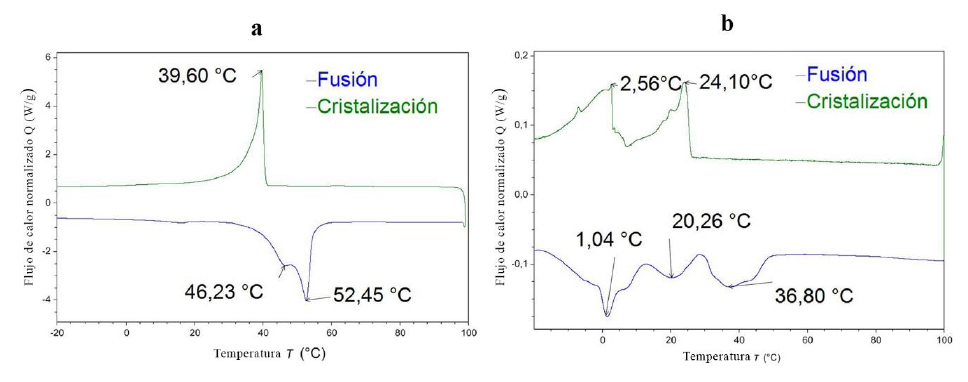
En la figura 1 se muestran las curvas de calentamiento (línea en color azul) y enfriamiento (línea en color verde) para el análisis de calorimetría diferencial de barrido de las muestras de biocera cruda de palma. La principal diferencia entre las muestras es que la biocera cruda 2 presenta múltiples picos endotérmicos antes del punto fusión (esos picos también aparecen en la curva de enfriamiento para la misma muestra). Kuszlik et al. (2010) encontraron la presencia de más de un pico endotérmico para muestras de ceras parafínicas macrocristalinas y explicaron este comportamiento por la presencia de transiciones de fase sólido-sólido. Durante el proceso de enfriamiento, inicialmente se forma una fase-α con mayor espaciamiento entre moléculas y a continuación se obtiene una fase ortorrómbica con menor espaciamiento (Kuszlik et al., 2010). El cambio entre las dos fases sólidas cristalinas se ve reflejado en las curvas DSC como un pico endotérmico posterior a la transición líquido-sólido durante el enfriamiento. Para la muestra de biocera 2, en el proceso de enfriamiento estos dos picos se forman a 24,10 °C y 2,56 °C.
Fuente: Elaboración propia
Figura 1. Termogramas DSC para las muestras de biocera a 10 K/min en atmósfera de nitrógeno (a: biocera 1 y b: biocera 2)
De igual forma, Agarwal y Sarviya, (2017), reportan que durante el enfriamiento se presentaron dos fases sólidas cristalinas en la curva DSC de enfriamiento, mientras que al realizarse el proceso inverso de calentamiento también se presentaron dos picos, pero en esta ocasión exotérmicos (Agarwal & Sarviya, 2017). Sato (2018) explica que este polimorfismo es una propiedad característica de la cristalización de grasas, aceites y ceras, donde dependiendo de la composición y el tipo de triglicéridos pueden presentarse entre dos y cinco fases sólidas cristalinas distintas (Sato, 2018).
La muestra de biocera cruda 1 tiene un índice de yodo (6,3 g I2/100 g) menor que la muestra de biocera cruda 2 (49,02 g I2/100 g), donde esta diferencia es muy importante porque sugiere que la biocera cruda 1 tiene un mayor contenido de familias químicas con enlaces saturados (por ejemplo: triglicéridos). Sato (2018) reportó que para la cristalización de triglicéridos saturados como la tripalmitina se presentan normalmente tres fases cristalinas polimórficas conocidas como α, β` y β, y su formación depende de factores como temperatura, presión, solvente, velocidad de cristalización, impurezas, etc. Resultados similares fueron encontrados por Larsson (1966), quien halló las tres fases (α, β` y β) en la cristalización de la monoestearina.
Las insaturaciones presentes en la muestra de biocera cruda 2 (49,02 g I2/100 g) pertenecen a diferentes familias insaturadas, incluyendo a los ácidos grasos. Bayés-García et al. (2020) encontraron que para los ácidos grasos se pueden presentar hasta cinco fases sólidas cristalinas diferentes: α, γ, β`, β1 y β2. Este comportamiento no se observa para la muestra de biocera cruda 1, donde la curva DSC de enfriamiento tiene un pico bien definido con un máximo en 39,6 ºC.
Según el análisis DSC, para la muestra de biocera cruda 1 no hay cambios de fase posterior a la cristalización, por lo que cualquier temperatura de cristalización inferior a 39,6 ºC permitirá obtener el mismo resultado de separación. Por otro lado, para la muestra de biocera cruda 2, el análisis DSC muestra que existen diferentes picos endotérmicos que sugieren cambios de una fase cristalina a otra durante el proceso de enfriamiento. En la misma figura 1b se aprecia que existen dos zonas de cristalización bien definidas (zona 1 de 25 °C a 5 °C, y zona 2 de 5 °C a - 20 °C); además, el intervalo de cristalización de ambas zonas es lo suficientemente amplio para llevar a cabo procesos de cristalización diferenciados.
Según los resultados presentados por Kuszlik et al. (2020), es recomendable iniciar el proceso de cristalización en los puntos máximos de la curva endotérmica, que para este caso en particular serían de 24,10 °C; a esta temperatura los resultados sugieren que se logra una mayor separación de los compuestos de menor peso molecular que, a temperatura ambiente, están en forma líquida como los ácidos grasos y las parafinas.
Difracción de rayos X (DRX)
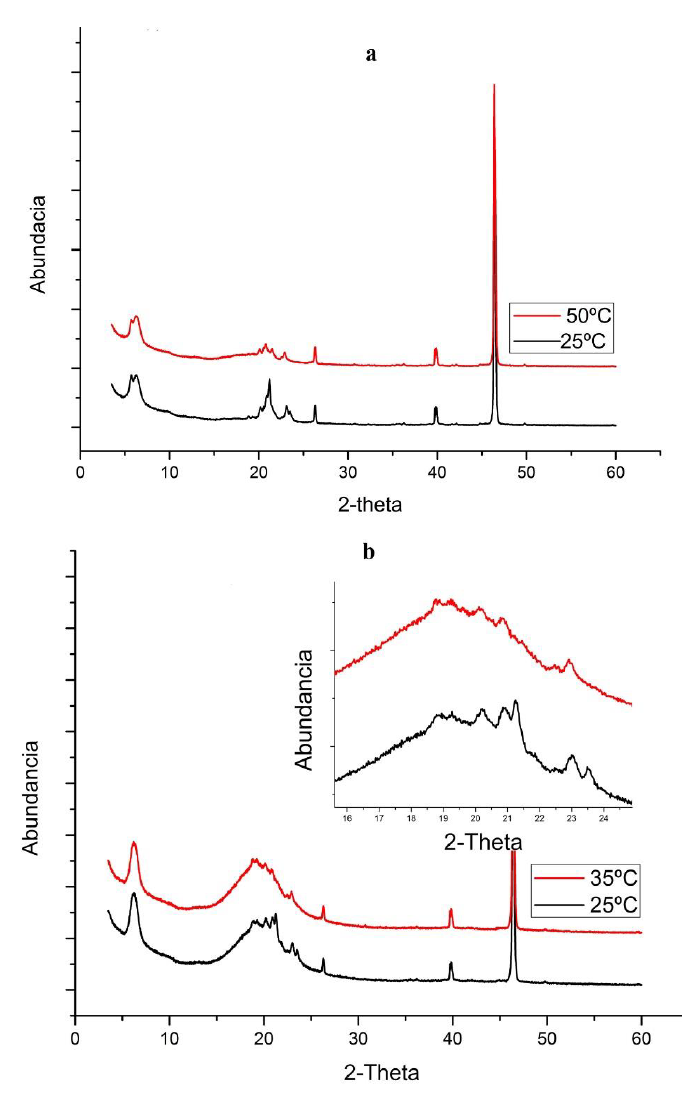
Para nuestro caso, los resultados de difracción de rayos X para las dos muestras de biocera se presentan en la figura 2 y en la investigación se encontró que Bayés-García et al. (2020) hallaron que para triglicéridos sólidos formados por combinaciones del ácido esteárico se forman dos estructuras ortorrómbicas intermedias β`1 y β`2, que son muy parecidas en sus patrones de difracción. Este mismo comportamiento se evidenció para la muestra de biocera cruda 1 a 25 ºC, la cual presentó picos para ángulos 2θ = 21,1 grados y 2θ = 23, 3 grados.
Fuente: Elaboración propia
Figura 2. Difracción de rayos X para las muestras de biocera de palma (a: biocera 1 y b: biocera 2)
En cera de abejas, Basson y Reynhardt (1988) reportaron que para los ángulos 2θ entre 18 y 25 grados son explicados por las refracciones de los planos 110 y 200 de una estructura β`1 (ortorrómbica), formadas por triglicéridos con cadenas de ácidos grasos saturados.
Para la biocera cruda 1, a 50 ºC el pico de reflexión a 2θ = 23, 3 grados se mantiene, pero el pico a 2θ = 21,1 grados se divide en 2θ = 20,4 grados, 2θ = 21,0 grados y 2θ = 21,6 grados. Para triglicéridos sólidos formados por combinaciones del ácido esteárico, Bayés-García et al. (2020) encontraron el aumento del número de picos en el patrón de difracción para ángulos 2θ entre 18 y 23 grados. Kellens et al. (1990) explican que el aumento en el número de picos de difracción indica un aumento de la asimetría en la estructura cristalina, evidenciando el cambio de fase desde β`1 hasta β`2.
En la muestra de biocera cruda 2 se observa que a 25 ºC están presentes las fases α (con un pico en 2θ = 21,1 grados) y la fase γ (con los picos en 2θ = 19 grados y 2θ = 23 grados). Al igual que lo reportado por Bayés-García et al. (2020) y Sato (2018) para muestras que contienen triacilglicéridos con mezclas de ácidos grasos saturadas e insaturadas, ya que durante el calentamiento hasta 35 ºC decae la intensidad de la fase α y aumenta la intensidad de los picos asociados a la fase γ.
Cristalización
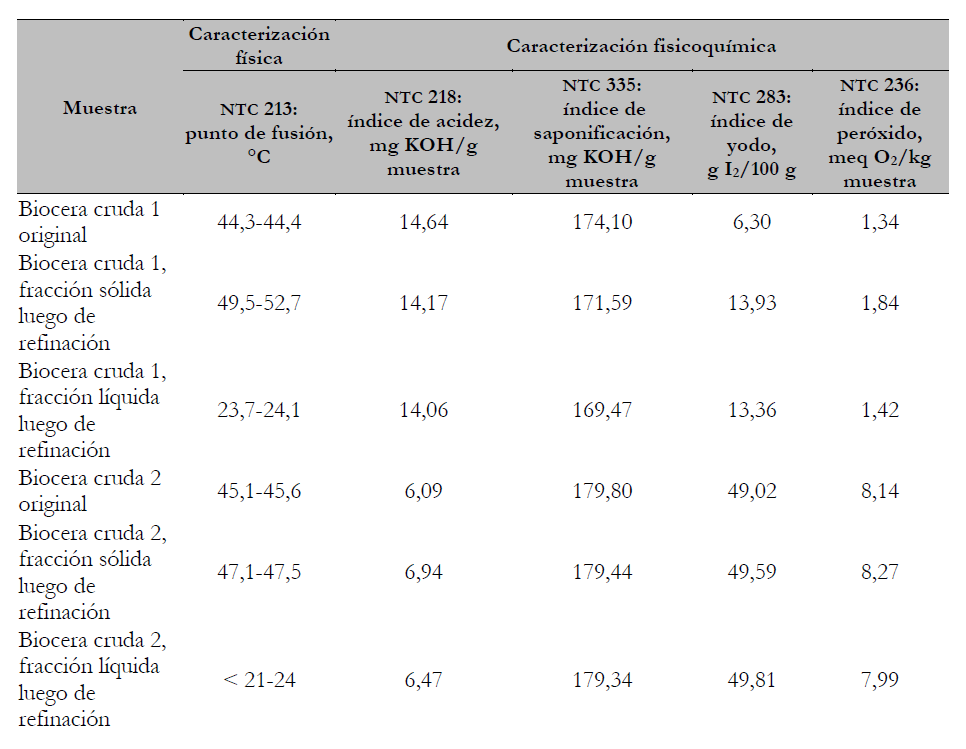
En la tabla 2 se observa la caracterización de las fracciones obtenidas después de realizar el proceso de cristalización sin solvente de las muestras de biocera estudiadas. El fraccionamiento permitió aumentar el punto de fusión de la fracción sólida obtenida para la muestra de biocera cruda 1 desde 47 °C hasta 49 °C, mientras que para la muestra de biocera cruda 2 fue desde 45 ºC hasta 47 ºC. Las fracciones líquidas obtenidas tienen puntos de fusión mucho menores que las bioceras crudas y a pesar de que la cristalización permitió aumentar la temperatura de fusión en las fracciones sólidas, esta no tuvo efecto sobre los otros parámetros: índice de acidez, índice de saponificación, índice de yodo o índice de peróxido (tabla 3).
Estos resultados sugieren que las fracciones obtenidas durante la cristalización están compuestas por las mismas familias químicas y la diferencia entre la fracción líquida y la sólida estaría en los pesos moleculares promedio de cada una de las fases. Así, por ejemplo, el índice de yodo obtenido para las fracciones líquidas (13,36 g I2/100 g) y sólidas (13,9 I2/100 g) de la biocera cruda 1 indicarían que se mantiene la relación de compuestos insaturados, tanto en las familias de compuestos de bajo peso molecular (ácidos grasos, parafinas) como los de alto peso molecular (acilglicéridos, alcoholes cerosos y ésteres cerosos).
En la industria de hidrocarburos se reportan procesos de cristalización extractiva para remoción de familias como las parafinas de mezclas complejas utilizando solventes. As’ad et al. (2015) realizó una cristalización a -15 °C con metil-etil-cetona en una relación másica solvente:muestra de 15:01 y logró obtener una fracción enriquecida en parafinas que representa el 27,9 % en peso de la muestra original. Para la cera de caña de azúcar se ha estudiado su fraccionamiento utilizando extracción por fluidos supercríticos y obteniéndose un extracto de alcoholes cerosos con 78,24 % de pureza, comparado con un 22 % de pureza obtenido por extracción con solvente (de Lucas et al., 2007). La utilización de estas técnicas mejora la separación de las familias presentes en las bioceras y permite concentrar las parafinas y los alcoholes cerosos, los cuales son de gran interés para la industria cosmética (Fernández-Arche et al., 2009).
Tabla 3. Parámetros de caracterización física y fisicoquímica realizados según normas NTC para las muestras de biocera antes y después de la cristalización sin solvente.
Fuente: Elaboración propia
Guzmán et al. (2010) estudió la influencia de las condiciones de operación en el hidrotratamiento de aceite de palma utilizando un catalizador NiMo/γAl2O3, donde el modelo generado por el simulador Aspen Plus predice la disminución de parafinas con 15 y 17 carbonos al aumentar la presión de reacción. El continuar con estudios experimentales en diferentes condiciones de operación del hidrotratamiento de aceite de palma podría permitir el aumento en la temperatura de fusión de la biocera.
Para las ceras utilizadas en las industrias cosmética, farmacéutica y de alimentos, se utilizan procesos de refinación adicionales como la destilación fraccionada (Mackerer et al., 2003), la percolación (Soliman, 2020), la neutralización (Dijkstra, 2013), el lavado (Gharby, 2022), la decoloración (Pirow et al., 2019) y la extracción con solvente (As’ad et al., 2015). Complementar la cristalización con estas técnicas podría mejorar los demás parámetros de calidad de la biocera, diferentes al punto de fusión (índice de acidez, índice de yodo, índice de saponificación e índice de peróxido).
Se debe tener en cuenta que el aceite de palma es una fuente prometedora para producir ceras renovables debido a su biodegradabilidad y disponibilidad, por lo que es necesario seguir investigando sobre tecnologías de refinación para encontrar las características deseables por los mercados. También es importante mejorar el entendimiento de las estructuras químicas, la composición, la microestructura y las interacciones entre las diferentes familias presentes en las bioceras obtenidas de aceite de palma.
Conclusiones
Los análisis DSC y DRX permitieron confirmar la existencia de más de una fase cristalina en la muestra de biocera cruda 2, donde el proceso de cristalización sin solvente permitió la separación de dos fases (una líquida y una sólida) para las dos muestras de biocera analizadas, pero no se evidenció una separación representativa de las familias químicas que conformaban la biocera cruda. Para futuras investigaciones, se recomienda evaluar técnicas más selectivas como cristalización con solvente o extracción con fluidos supercríticos para mejorar el punto de fusión.
Contribución de los autores
Andres Fernando Ramírez Quintero: Cristalización de biocera, interpretación de los resultados, redacción del manuscrito; Debora Alcida Nabarlatz: Diseño metodológico, interpretación de los resultados, redacción del manuscrito; Carlos Jesus Muvdi Nova: Diseño metodológico, interpretación de los resultados, redacción del manuscrito; Laura Liliana Garzón Fuentes: Diseño metodológico, escritura de manuscrito; Cristian Jahir Murillo Méndez: Pruebas titulométricas, redacción del manuscrito; Luis Javier López Giraldo: Diseño metodológico, interpretación de los resultados, redacción del manuscrito.