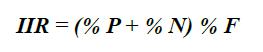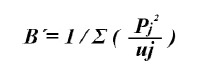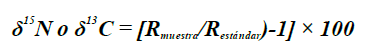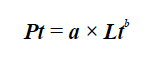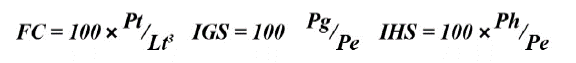Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.1 Santa Marta jan./jun. 2022 Epub 01-Ago-2022
https://doi.org/10.25268/bimc.invemar.2022.51.1.1087
Articulos de Investigación
Biología y ecología del pez león (Pterois volitans) en el Parque Nacional Natural Corales de Profundidad, Caribe colombiano
1Área de Ciencias Biológicas y Ambientales, Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano, Sede Santa Marta, Carrera 2 # 11-68, El Rodadero, Santa Marta, Colombia. adolfo.sanjuan@utadeo.edu.co
2Área de Ciencias Biológicas y Ambientales, Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano, Sede Santa Marta, Carrera 2 # 11-68, El Rodadero, Santa Marta, Colombia. dmbustosmo@unal.edu.co
3Área de Ciencias Biológicas y Ambientales, Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano, Sede Santa Marta, Carrera 2 # 11-68, El Rodadero, Santa Marta, Colombia. carlosj.polos@utadeo.edu.co
4Programa de Biología. Universidad de Cartagena. Sede San Pablo. Zaragocilla, carrera 50 # 24-120. Cartagena de Indias, Colombia. henaocastro.alejandro@gmail.com
5Parques Nacionales Naturales de Colombia, Parque Nacional Natural Corales de Profundidad. Bocagrande, calle 4 # 3-204, Cartagena de Indias, Colombia. milena.marrugo@parquesnacionales.gov.co
6Laboratorio de Biogeoquímica de Isótopos Estables, Instituto Andaluz de Ciencias de la Tierra (CSIC-UGR), Granada, España. antonio.delgado@csic.es
7Departament Biologia Evolutiva, Ecologia i Ciències Ambientals, Facultat Biologia, Institut de Recerca de la Biodiversitat (IRBio), Universitat de Barcelona (UB), Avda. Diagonal 643, Barcelona 08028, Spain. d.vinyoles@ub.edu
8Instituto de Estudios en Ciencias del Mar (Cecimar), Universidad Nacional de Colombia Sede Caribe. Calle 25 2-55, Rodadero Sur, Playa Salguero, Santa Marta, Colombia. aacerop@unal.edu.co
Lionfish was studied in the mesophotic environment. 237 specimens were observed, most in the upper mesophotic zone. Males were larger than females and differences between sexes in growth models were found. Sixteen prey items were identified, the most important being the teleost families Acanthuridae and Monacanthidae, and the crustacean Penaeidae. The mean of δ13C was -17.08 ± 0.36 ‰ and δ15N was 8.68 ± 0.46 ‰, with no differences between sexes. Lionfish occupies a less extensive isotopic niche in mesophotic environment than in shallow sectors; there is an isotopic niche overlap between sexes. Likewise, lionfish has specialized trophic habits. All specimens were mature and in females regression phase predominated. In females, condition factor (CF), gonadosomatic index (GSI) and hepatosomatic index (HSI) increased with gonadal development, reaching peak in the active spawning phase, and decreasing in regression. Males had a condition factor similar to spawning females, but IGS and IHS were lower.
Key words: Trophic ecology; reproduction; biological invasion; mesophotic environment; stable isotopes
En el ambiente mesofótico se observaron 237 especímenes de Pterois, mayoritariamente en la zona mesofótica superior. Los machos fueron más grandes que las hembras con modelos de crecimiento diferenciados. Se identificaron 16 ítems de presas, siendo los peces Acanthuridae y Monacanthidae y los camarones Penaeidae las más importantes. La media de δ13C fue -17,08 ± 0,36 ‰ y la de δ15N fue 8,68 ± 0,46 ‰, no detectándose diferencias entre sexos. La especie ocupa un nicho isotópico menos extenso que en sectores someros, tiene traslapo entre sexos y hábitos tróficos especialistas (Levin = 0,22). En hembras el factor de condición (FC), el índice gonadosomático (IGS) y el índice hepatosomático (IHS) aumentaron con el desarrollo gonadal alcanzando pico en fase de desove activo, y disminuyendo en regresión. Los machos tuvieron un FC similar al de hembras en desove, pero el IGS y el IHS fueron menores.
Palabras clave: Ecología trófica; reproducción; invasión biológica; ambiente mesofótico; isótopos estables.
INTRODUCCIÓN
Las invasiones de especies exóticas se han convertido en una gran amenaza para los sistemas marinos a nivel mundial (Mooney y Cleland, 2001). El pez león (Pterois volitans) es una de las especies invasoras con mayores impactos negativos, pues modifica la organización estructural y funcional de los ecosistemas que invade, compitiendo con especies mesodepredadoras nativas por recursos alimentarios y espacio (Rojas-Vélez et al., 2019), y causando disminución de la biodiversidad en los ecosistemas marinos por depredación sobre especies nativas (Albins y Hixon, 2008; Muñoz et al., 2011; Acero P. et al., 2019), especialmente en arrecifes coralinos (Arias-González et al., 2011; Acero P. et al., 2019). El éxito del pez león se debe a su rápido crecimiento, altas tasas de reproducción y alimentación y ausencia de depredadores naturales (Côté et al., 2013; Tornabene y Baldwin, 2017; Acero P. et al., 2019; Bustos-Montes et al., 2020).
El pez león tiene estrategias de caza efectivas (Green et al., 2011; Albins, 2015; Tornabene y Baldwin, 2017) generando un efecto negativo sobre el reclutamiento y, por ende, sobre la densidad poblacional y estructura de las comunidades de peces nativos arrecifales (Albins y Hixon, 2008; Albins, 2015). Con isótopos estables (δ15N y δ13C) se ha establecido que es un depredador generalista que se alimenta de cientos de especies (Acero P. et al., 2019; Eddy et al., 2020). Adicionalmente, en diferentes estadios de vida y a distintas profundidades se adapta a cambios de la estructura de la comunidad de presas (Muñoz et al., 2011; Pimiento et al., 2013; Eddy et al., 2020).
El pez león ha tenido una gran dispersión en el Atlántico occidental, el Caribe, Golfo de México (Schofield, 2010), llegando incluso a la provincia brasileña (Ferreira et al., 2015; Luiz et al., 2021). Fue observado por primera vez en Florida en 1985, y desde 2000 inició una expansión sin precedentes en rapidez y magnitud en el Atlántico americano (Whitfield et al., 2002; Schofield, 2009, 2010). En Colombia se observó en la isla de Providencia en 2008 (Schofield, 2009) y un año después en el Caribe continental (González et al., 2009). La alta riqueza de presas consumidas por esta especie en el Caribe colombiano evidencia que potencialmente tiene un efecto negativo, representando una amenaza de extinción local para algunas especies de importancia comercial y ecológica (Acero P. et al., 2019).
Se ha estudiado al pez león en arrecifes coralinos someros del Caribe, pero poco se conoce sobre su biología y ecología en ecosistemas de corales mesofóticos (ECM). Andradi-Brown (2019) sugiere que la invasión en los ECM puede ser incluso más perjudicial, disminuyendo significativamente la abundancia y diversidad íctica, debido a que alcanza mayor tamaño y por tanto demanda más recursos. Los estudios sobre esta especie en distintos estratos de profundidad han evidenciado una distribución vertical en el Caribe occidental entre 0 y 304 m (Andradi-Brown et al., 2017; Andradi-Brown, 2019).
En Colombia, el primer registro en un ambiente mesofótico fue en 2014 en la montaña submarina Bajo Frijol situada en el Parque Nacional Natural Corales de Profundidad -PNNCP- (Sánchez et al., 2016). La máxima profundidad de observación fue 140 m y todos los ejemplares tuvieron tamaños superiores a 10 cm (Henao-Castro et al., 2016). Dada la marcada expansión que ha tenido el pez león y sus potenciales efectos negativos sobre los ecosistemas arrecifales, es necesario ampliar el conocimiento sobre su biología y ecología en ambientes profundos. El objetivo de este trabajo fue describir la distribución, tamaño, dieta y reproducción del pez león en ambientes mesofóticos del PNNCP, como insumo para la adopción de medidas de manejo en el área protegida que ayuden a mitigar su efecto.
ÁREA DE ESTUDIO
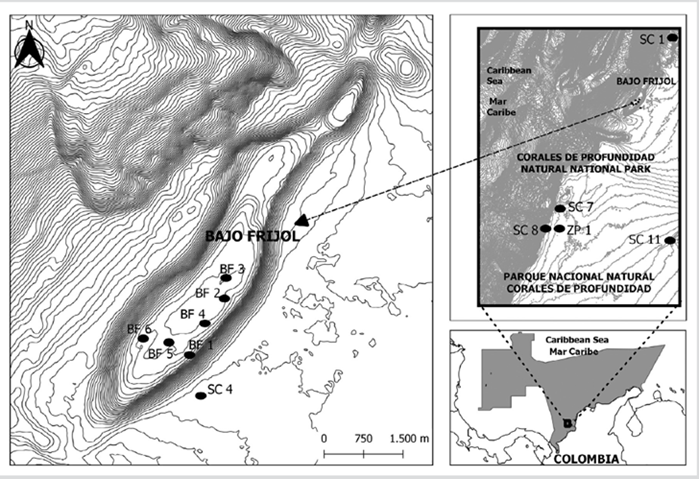
El Parque Nacional Natural Corales de Profundidad es un área protegida completamente sumergida, con una extensión de 142192,15 ha y ubicada en el Caribe colombiano (9° 43’ 16,6”-10° 07’ 30,3” N y 76° 0’ 16,2”-17’ 41,1” W) a una distancia de 32 km del punto más cercano al continente (Figura 1). La profundidad oscila entre 34 y 1240 m. Se caracteriza por estar dominado por tres condiciones oceanográficas generales: la corriente del Caribe de superficie hasta 160 m de profundidad aproximadamente, la contracorriente del Darién con intensidades variantes según profundidad y la corriente profunda del Caribe que es un lento movimiento hacia oriente sobre el talud y fondo abisal (Marrugo y Martínez, 2016; Morales-Giraldo et al., 2017).
La región está sujeta al régimen de los alisios y la zona de convergencia intertropical que propician tres épocas climáticas: (a) seca (diciembre-abril), con desplazamiento de las masas de agua hacia el suroccidente, (b) lluviosa (septiembre-noviembre) con debilitamiento de alisios y vientos predominantes del suroriente o suroccidente y (c) transición (mayo-agosto) con temperatura elevada y lluvias de poca intensidad (Pujos et al., 1986; Andrade-Amaya, 2001). En el sector nororiental del Parque se encuentra Bajo Frijol o Frijolito que es una montaña submarina con elevación de 116,0 m, 8,2 km de largo y 1,4 km de ancho (Morales-Giraldo et al., 2017). Se caracteriza por ser un ambiente mesofótico único, con 13 especies de escleractinios, una alta biomasa de peces arrecifales, presencia de tiburones y especies de interés comercial de las familias Lutjanidae y Serranidae (Marrugo y Martínez, 2016; Sánchez et al., 2016).
MATERIALES Y MÉTODOS
Muestreo de campo
Se muestrearon 12 estaciones entre 35 y 160 m de profundidad (Figura 1). Los peces león se capturaron en campañas de monitoreo del PNNCP y en jornadas de extracción abarcando los tres estratos de ECM (Kahng et al., 2010; Rocha et al., 2018): zona mesofótica superior (ZMS: 30-60 m), zona mesofótica media (ZMM: 61-90 m) y zona mesofótica inferior (ZMI: ˃ 90 m). Los ejemplares fueron capturados con arpones tipo hawaiano durante inmersiones con buceo técnico de circuito cerrado (rebreather), se retiraron las espinas dorsales, anales y pélvicas con tijeras y se guardaron en una nasa de pesca. En la embarcación se almacenaron en bolsas térmicas en una nevera con hielo. Se anotaron las características del fondo y se contabilizaron los peces león filmados por la cámara de un vehículo de operación remota o una de deriva.
Procedimiento de laboratorio
Los peces se codificaron y se registró la longitud total (Lt) y peso total (Pt). Se realizó un corte longitudinal en la región ventral en sentido posteroanterior y se extrajo el aparato digestivo que se pesó en una balanza analítica (+ 0,0001 g). El contenido se vació en un colador, el material obtenido se lavó con agua de mar eliminando los jugos gástricos y se almacenó en tarros plásticos rotulados. Las presas se separaron por grupos taxonómicos, preservándolas en etanol al 70 % para su identificación. Cuando fue posible, las presas fueron medidas (Lt) y pesadas individualmente. Las presas que se encontraron deterioradas o despedazadas fueron clasificadas en ítems generales como restos de crustáceos y restos de peces, vértebras, huesos y escamas. El material con un alto grado de digestión se categorizó como materia orgánica no identificable (MONI).
Para análisis isotópico de cada ejemplar se extrajo ≈ 1 cm3 de músculo que se almacenó en un vial que se colocó en un horno a 60 °C durante 48 h para desecar las muestras. Para extraer los lípidos cada muestra fue colocada en 25 mL de éter petróleo, se agitó con un sonicador por 15 min y finalmente se centrifugó tres veces a 2200 r.p.m. a baja temperatura. Posteriormente fueron lavadas tres veces con agua desionizada y colocadas nuevamente en el sonicador durante 10 min para eliminar urea (Kim y Koch, 2012). Cada muestra se maceró en mortero de vidrio para homogenizar el tejido. Se obtuvo una submuestra (0,6-1,0 mg), pesada en una balanza analítica (+ 0,0001 g) y almacenada en cápsula de estaño (8 × 5 mm). Los isótopos de carbono y nitrógeno fueron determinados en un analizador elemental Carlo Erba NA 1500 NC con una interfaz ConFlo III conectado un espectrómetro de masas Delta Plus XP (EA-IRMS; ThermoQuest) en el Instituto Andaluz de Ciencias de la Tierra en Granada, España.
Se extrajeron y pesaron las dos gónadas y el hígado, y se pesó el pez eviscerado. Se fijó en formalina al 4 % una fracción de tejido de la parte media de las dos gónadas que posteriormente fueron sometidas a técnicas de deshidratación, impregnación, penetración, corte y tinción en sucesivas soluciones de hematoxilina de Harris-eosina (Martoja y Martoja-Pierson, 1970). Se determinó microscópicamente el sexo y a las hembras se les asignó el estado de desarrollo (Brown-Peterson et al., 2011). Considerando que la especie es desovadora parcial asincrónica (Morris et al., 2011; Fogg et al., 2017; Eddy et al., 2019), el estado de madurez más avanzado observado en los oocitos definió el estado reproductivo asignado. Los machos se categorizaron como maduros e inmaduros.
Análisis de datos
Se calcularon medidas de tendencia central (media aritmética) y dispersión (error estándar, coeficiente de variación, valores máximo y mínimo). Se evaluó el ajuste de datos a la distribución normal con la prueba de Shapiro-Wilk y la homogeneidad de varianzas con la prueba de Levene (Zar, 2010). Se evaluaron diferencias de la talla y el peso entre sexos con la prueba de Mann-Whitney (datos sin normalidad pero con homogeneidad de varianzas) y de las señales isotópicas de carbono (δ13C) y nitrógeno (δ 15N) mediante la prueba t-Student dado que se cumplieron los supuestos de normalidad y homogeneidad de varianzas (Zar, 2010; McDonald, 2014).
La composición alimentaria de la especie se describió usando índices numérico -% N-, gravimétrico -% P- y frecuencia -% F- (Hyslop, 1980). Para corroborar la importancia de cada componente alimentario se utilizó el índice de importancia relativa -IIR- (Pinkas et al., 1971):
Para determinar si el pez león es depredador especialista o generalista se aplicó el índice estandarizado de Levin (Krebs, 1999):
Fluctúa entre 0 y 1. Valores menores a 0,6 indican que la especie tiende a ser especialista y mayores a 0,6 generalista (Labropoulou y Eleftheriou, 1997).
Los valores de los isótopos estables (δ) se calcularon mediante la formula
siendo R muestra la proporción entre los isótopos 15N/14N para δ15N y la proporción de los isótopos 13C/12C para δ13C (Park y Epstein, 1961). Utilizando la función SIBER (Stable Istope Bayesian Ellipses in R) se determinó la amplitud isotópica del pez león por sexo a través de elipses estandarizadas (Jackson et al., 2011). La estimación de traslapo isotópico se estimó utilizando la función nicheROVER en R (Lysy et al., 2015), la cual se basa en el método bayesiano que calcula probabilidad de traslapo utilizando información multidimensional como indicadores del nicho. Esta función se calculó con 104 iteraciones y 95 % de probabilidad de datos de cada grupo (i.e. machos vs hembras y hembras vs machos) que se encuentra en el espacio isotópico.
Para cada sexo se determinó relación talla-peso ajustando los datos al modelo:
donde Pt es peso total, Lt longitud total, a el intercepto y b el coeficiente de crecimiento (Csirke, 1989). Se evaluó si coeficiente de crecimiento era significativamente diferente de 3, con una prueba t-Student (Pauly, 1984) considerándose crecimiento isométrico si b no es significativamente diferente a 3 y alométrico en caso contrario.
Como indicadores de condición física de los peces se calcularon el índice gonadosomático (IGS), el índice hepatosomático (IHS) y el factor de condición de Fulton (FC) expresados en porcentaje (Lloret et al., 2014):
donde Pt es peso total (g), Lt longitud total (cm), Pg peso húmedo de la gónada (g), Pe peso eviscerado (g) y Ph peso húmedo del hígado (g). Estos índices se analizaron por sexo y estado de madurez gonadal.
RESULTADOS
Abundancia y características de los fondos
Se observaron 237 ejemplares de pez león entre 35 y 160 m de profundidad, 228 se encontraron en la ZMS, principalmente con el método de buceo de circuito cerrado. En ZMM y ZMI se evidenciaron cuatro y cinco individuos respectivamente, seis se observaron por medio de ROV, dos con cámara de deriva y uno capturado incidentalmente en una nasa.
Los estratos de profundidad presentaron fondos con diferentes tipos de relieves generalmente con agregaciones de peces juveniles. En ZMS se observaron esponjas grandes tipo barril, fondos duros cubiertos de algas y montículos rocosos con presencia de corales (BF1-BF6 y SC4). En ZMM se registraron grandes rocas con fauna asociada (SC1 y SC11). ZMI se caracterizó por fondos blandos con fauna dispersa (SC4, SC7 y SC8), con rocas pequeñas o medianas (Figura 2; Tabla 1).

Figura 2 Sitios en los que fueron observados peces león en el PNNCP. ZMS (a y b), ZMM (c y d); y ZMI (e y f). Foto a (Deibis Seguro). Fotos b, c, d y e (Cedeño-Posso et al., 2015). Foto f (Cedeño-Posso et al., 2017).
Tabla 1 Características de las estaciones y abundancia del pez león. ZMS: zona mesofótica superior. ZMM: zona mesofótica media. ZMI: zona mesofótica inferior. BF: Bajo Frijol. ZP: zona de pesca. SC: sector del PNNCP.
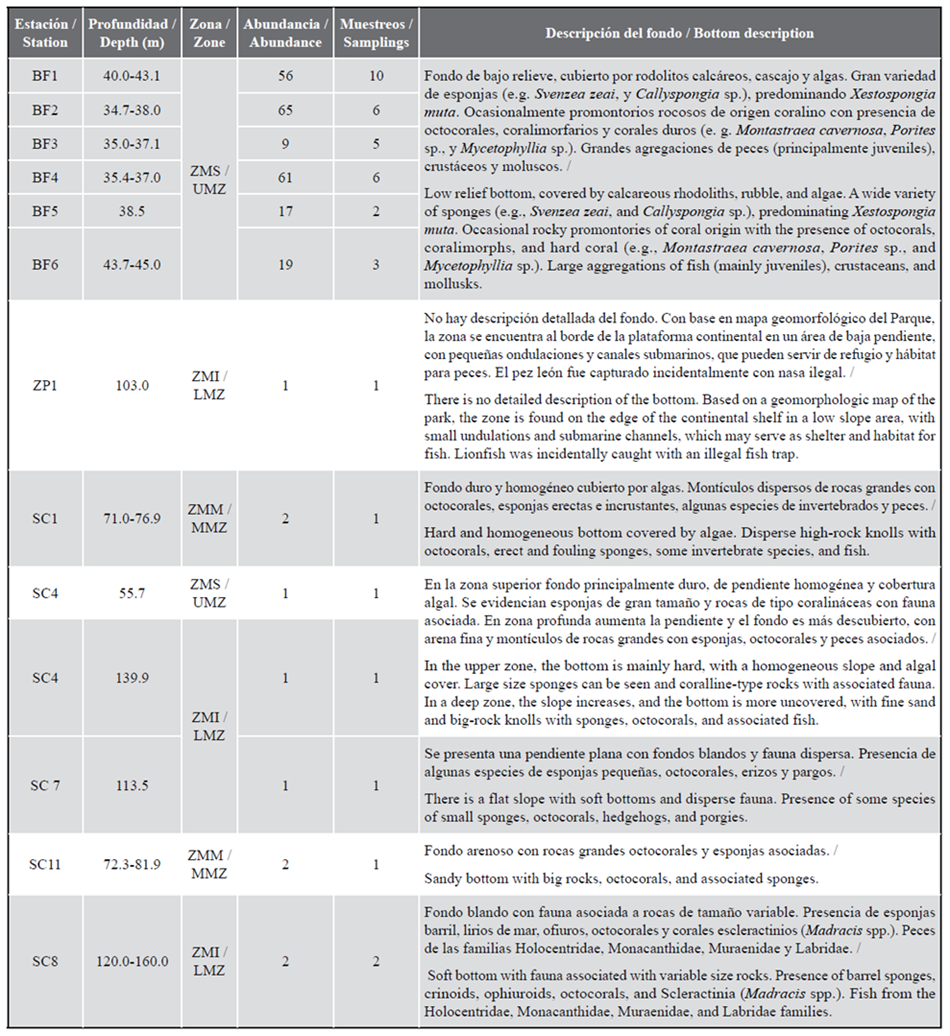
En SC8 se observó un pez león a 160 m, asociado a fondo blando con rocas, siendo el ejemplar en el PNNCP registrado a mayor profundidad. En esa estación se registró presencia del coral Madracis sp. y gran variedad de equinodermos, corales y octocorales (Figura 2f).
Características morfológicas y relación talla-peso
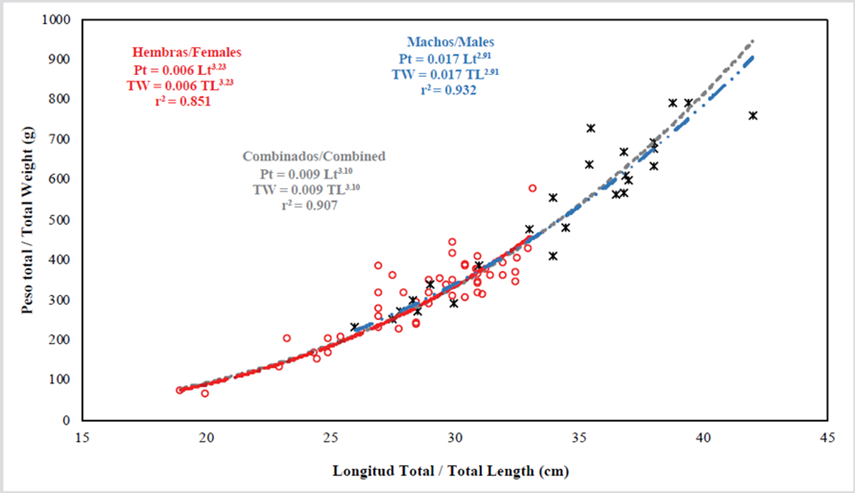
Se capturaron 75 individuos de P. volitans con una talla (¯x ± EE) de 30,5 ± 3,5 cm y un peso de 376,5 ± 43,5 g. El pez más pequeño midió 19,0 cm y el más grande 42,0 cm, y el peso osciló entre 61 y 790 g. Los machos fueron significativamente más grandes (prueba de Mann-Whitney, U11;39 = 396,0; P < 0,001) y pesados (prueba de Mann-Whitney, U11;39 = 404,5; P < 0,001) que las hembras. Las relaciones entre longitud y peso estimadas fueron isométricas para hembras (prueba t, t1 = 1,16; P = 0,25), machos (prueba t, t1 = 0,89; P = 0,57) y sexos combinados (prueba t, t1 = 0,56; P = 0,37) (Figura 3). Sin embargo, la comparación de los modelos obtenidos indica que el crecimiento entre sexos es diferente (Ancova, F3;71 = 235,4; P < 0,001).
Hábitos alimentarios
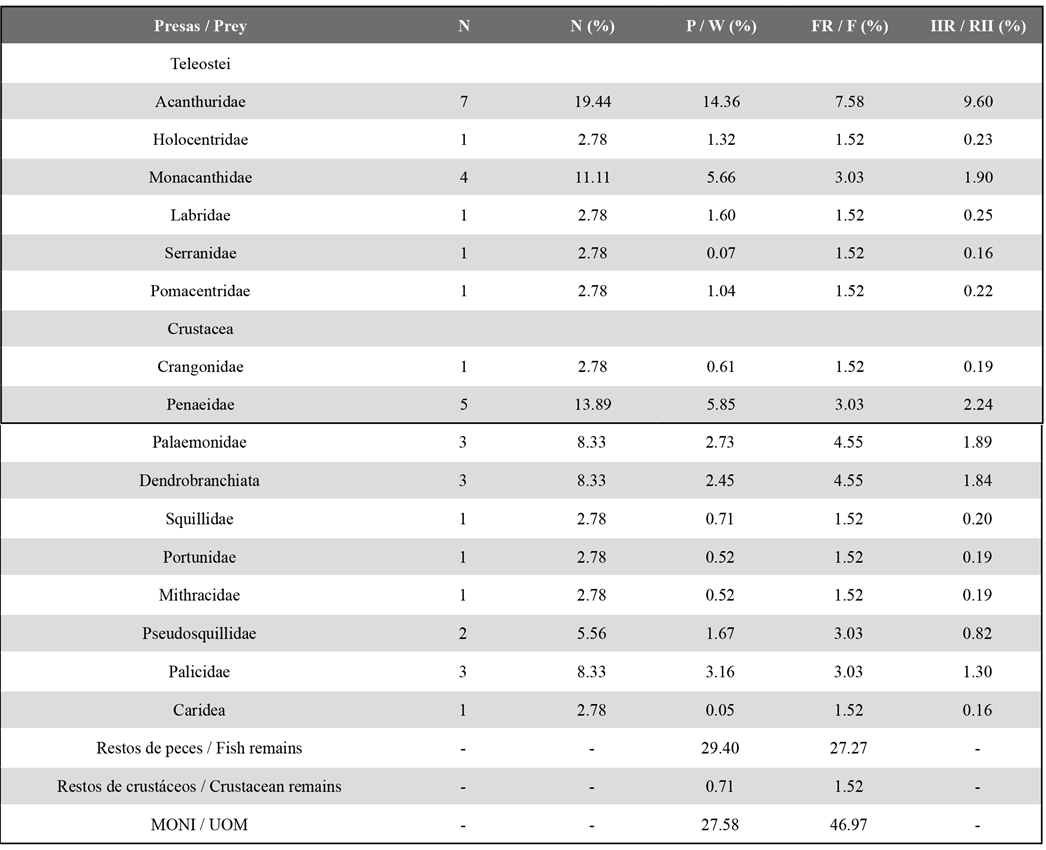
De 75 estómagos analizados 66 (88 %) presentaron alimentos o restos de presas parcialmente digeridas y 9 estuvieron vacíos (12 %). Se identificaron 16 componentes alimentarios, siendo los crustáceos la categoría con mayor número de componentes (S = 10) en la dieta. Los restos de peces y MONI presentaron los mayores % P y % F (Tabla 2). De acuerdo con % N y % P las familias más importantes de teleósteos fueron Acanthuridae y Monacanthidae. Asimismo, esas dos fueron las de mayor frecuencia en el grupo de los peces (Tabla 2). Entre los crustáceos las familias con mayor % N y % P fueron Penaeidae y Palicidae, y con mayor % F fueron Palaemonidae y suborden Dendrobranchiata. De acuerdo con el % IIR, Acanthuridae fue la familia de mayor importancia, seguida por familias Penaeidae y Monacanthidae. La amplitud de nicho trófico del pez león en este ambiente es baja (Bi = 0,22).
El análisis de isótopos estables de carbono (δ13C) y nitrógeno (δ15N) fue realizado a 19 hembras (30,5 ± 4,4 cm) y a 11 machos (35,6 ± 3,6 cm). En general, la media de δ13C fue de -17,08 ± 0,36 ‰ (de -17,96 a -16,74 ‰) y el de δ15N fue de 8,68 ± 0,46 ‰ (de 7,38 a 9,66 ‰). Los machos tuvieron un enriquecimiento de carbono (-17,06 ± 0,27 ‰ de δ13C) similar al de hembras (-17,15 ± 0,50 ‰ de δ13C), sin diferencias significativas (t-Student, t28 = 1,2 × 10-3; P = 0,17). Igualmente, los machos presentaron similar enriquecimiento de nitrógeno (8,85 ± 0,35 ‰ de δ15N) que hembras (8,60 ± 0,54 ‰ de δ15N), no detectándose tampoco diferencias significativas (t-Student, t28 = 1,4; P = 0,17).
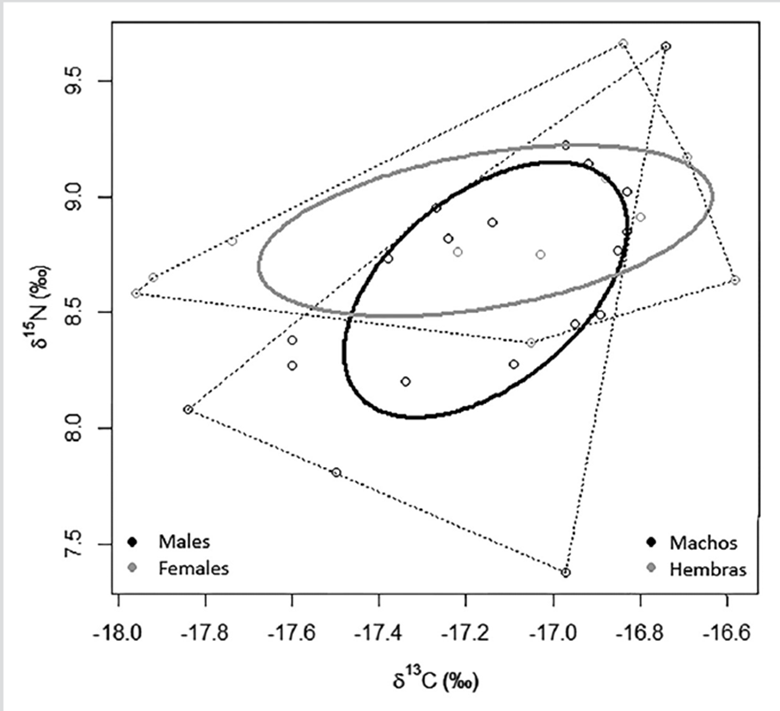
El área de la elipse (SEAc) calculada mediante un modelo bayesiano fue de 0,49 ‰ en machos y 0,52 ‰ en hembras (Figura 4) consumiendo presas con un estrecho intervalo de δ13C (≈ 1,4 ‰) y δ15N (≈ 2,3 ‰). Se evidencia traslapo de nicho isotópico entre sexos (machos vs hembras: 74,9 % y hembras vs machos: 76,8 %) indicando que a pesar de las diferencias de tamaño no hay un uso diferencial significativo de recursos o consumo de especies distintas como presas principales.
Tabla 2 Índices tróficos porcentuales de las presas de Pterois volitans identificadas. N: número de individuos. % N: porcentaje en número. % P: porcentaje en peso. % FR: frecuencia relativa. % IIR: porcentaje del índice de importancia relativa. MONI: Materia orgánica no identeificada.
Reproducción
Con base en la inspección visual de las gónadas, de los 75 peces colectados 50 fueron hembras y 25 machos. Se analizaron preparaciones histológicas de 50 individuos encontrando que todos eran maduros, 78 % eran hembras (19-33 cm, 61-440 g) y 22 % machos (29-42 cm, 338-760 g). En hembras predominó la fase de regresión (n = 15), seguida de desove activo (n = 10), desove (n = 9) y desarrollo tardío (n = 5). Los peces en desarrollo fueron clasificados como tardíos ya que eran observables oocitos en crecimiento primario, alveolo cortical y vitelogenados (primarios y secundarios). En fase de desove eran evidentes oocitos vitelogenados terciarios, así como folículos postovulatorios; aquellos casos donde se observó migración o ruptura de la vesícula germinal fueron asignados como desove activo. Las gónadas en regresión se caracterizaron por la presencia no solo de folículos postovulatorios sino también de atresias. Por su desarrollo ovocitario asincrónico pueden observarse varias etapas de la ovogénesis en el mismo ovario en desove activo (Figura 5). En todos los casos, las asignaciones realizadas macroscópicamente por inspección visual de las gónadas correspondieron con las microscópicas.
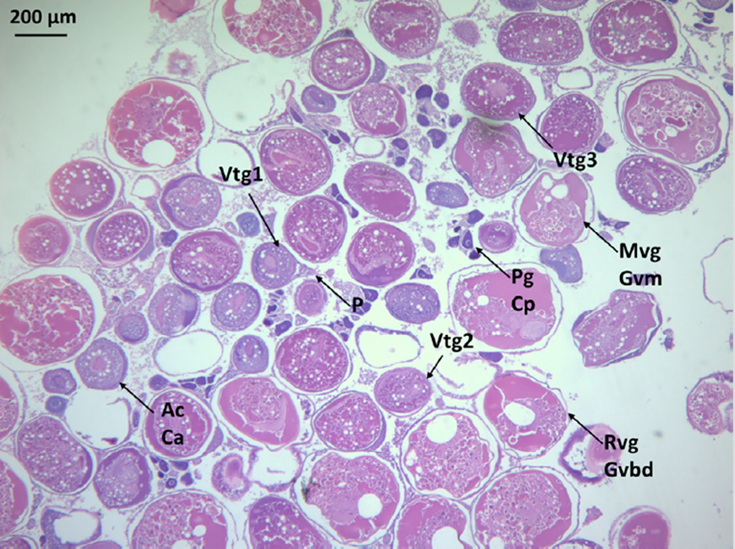
Figura 5 Microfotografía de la fase de desove activo de una hembra de Pterois volitans. Cp: crecimiento primario. P: pedúnculo. Ac: alveolo cortical. Vtg1: vitelogénesis primaria. Vtg2: vitelogénesis secundaria. Vtg3: vitelogénesis secundaria. Mvg: migración de la vesícula germinal. Rvg: rompimiento de vesícula germinal.
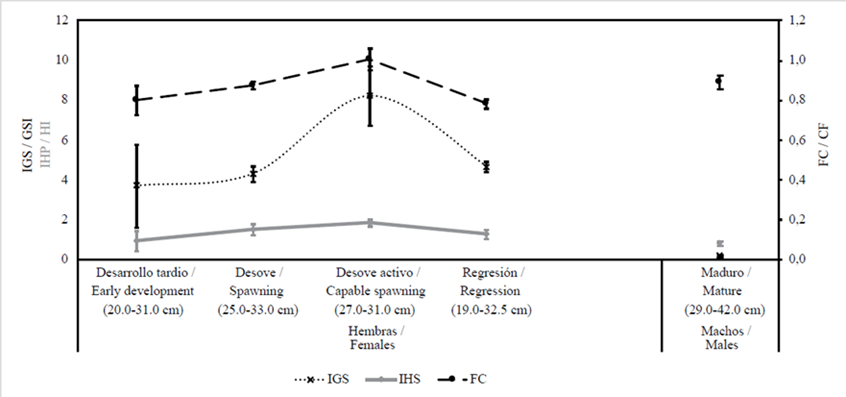
Condición corporal de los peces y ciclo gonadal
El factor de condición (FC) e índices gonadosomático (IGS) y hepatosomático (IHS) se muestran en la Figura 6. En hembras, el FC aumentó con el desarrollo gonadal (a medida que aumentó IGS) y alcanzó un pico en fase de desove activo, para ir disminuyendo después en regresión. El FC de machos maduros fue alto y similar al de las hembras durante el período de desove, mientras que IGS e IHS fueron bajos comparativamente. Los estados de madurez avanzados (desove y desove activo) se presentaron en hembras entre 25 y 33 cm Lt, aunque hubo registro de un individuo de 19 cm Lt en fase de regresión.
DISCUSIÓN
La presencia del pez león en las tres zonas ecológicas de los ECM del PNNCP (35-160 m de profundidad), coincide con lo encontrado en otros sectores del mar Caribe (Andradi-Brown, 2019) e indica el éxito de la colonización en ambientes mesofóticos del Caribe colombiano. La mayor cantidad de avistamientos en ZMS es consistente con registros en el Caribe occidental (Andradi-Brown, 2019), aunque también se debe considerar la mayor tecnología necesaria y la menor posibilidad de tiempo de buceo a mayor profundidad.
Por lo tanto, en las ZMM y ZMI del Parque existe una mayor dificultad para controlar la población del pez león mediante actividades extractivas, a lo que se suma que hay menor impacto de la pesca (Goodbody-Gringley et al., 2019), debido a que la pesca con línea de mano (arte más utilizado en zonas mesofóticas y profundas) tiene baja tasa de captura para esta especie. La nasa, que es el método que mayor frecuencia de capturas proporciona (Merlano-Cera y García-Urueña, 2018), es un arte de pesca prohibido dentro del PNNCP.
Por tanto, en el área protegida se requiere la implementación de métodos de captura específicos para ecosistemas coralinos mesofóticos y profundos, dirigidos exclusivamente a esta especie (Harris et al., 2020). La ampliación de la profundidad máxima de avistamiento en el PNNCP, hasta 160 m, corrobora la capacidad de invasión del pez león en ambientes mesofóticos, con las implicaciones que eso podría tener sobre su funcionalidad (Barbour et al., 2011; Brightman-Claydon et al., 2012; Agudo y Klein-Salas, 2014), teniendo en cuenta que estos ecosistemas han sido considerados de gran importancia para la conservación y protección debido a su alta riqueza íctica (Pinheiro et al., 2016).
La abundancia del pez león en las zonas mesofóticas también está asociada al hábitat y disponibilidad de recurso alimentario, como ha sido evidenciado en otras zonas del Caribe (Agudo y Klein-Salas, 2014; Nuttall et al., 2014). El PNNCP, por estar retirado de la costa (˃32 km) y por tener un amplio intervalo de profundidad (34-1240 m), ofrece unas condiciones adecuadas para la proliferación del pez león en ambientes mesofóticos. La mayoría de avistamientos se dieron en sitios con esponjas de gran tamaño, agrupaciones de corales, octocorales y grandes rocas; la teoría afirma que la densidad del pez león en ECM es aparentemente afectada por complejidad del hábitat, lo que genera un nicho adecuado para esta especie (Andradi-Brown, 2019; Hunt et al., 2019).
Adicionalmente, Pterois comparte el hábitat con muchas especies de peces e invertebrados de importancia ecológica y económica y busca alimento en lugares con agregaciones de peces, predominantemente de tallas pequeñas (Schmahl et al., 2008). Esto coincide con lo observado en ZMS del Parque y en otras zonas mesofóticas y profundas (Nuttall et al., 2014; Whitfield et al., 2014), sustentando la idea de que Pterois impacta las poblaciones de peces nativos del Parque, ya sea por consumo de peces juveniles y especies pequeñas, como por competencia con especies mesodepredadoras nativas por presas o refugios (Goodbody-Gringley et al., 2019; Hunt et al., 2019).
Los especímenes capturados tuvieron una talla media mayor a la registrada en arrecifes someros del Caribe colombiano (Abril-Torres, 2012; Muñoz-Escobar y Gil-Agudelo, 2012; Gómez-Pardo, 2014; Pabón y Acero P., 2016; Romero-Arteaga, 2017; Merlano-Cera y García-Urueña, 2018). Además, también superan en tamaño a los descritos en la mayoría de estudios realizados en Atlántico occidental (ver revisión en Acero P. et al., 2019), exceptuando lo encontrado por Eddy et al. (2016) en Bermuda (33,5 ± 0,2 cm) y Muñoz et al. (2011) en Carolina del Norte, EE. UU. (30,9 ± 0,5 cm). Esto concuerda con la tendencia descrita en el área invadida de que los peces león tienden a ser más grandes a mayor profundidad (Andradi-Brown, 2019; Bustos-Montes et al., 2020), lo que se relaciona con que (a) las capturas se hacen primordialmente en sectores someros, lo que disminuye tamaño y peso promedio con el paso del tiempo (Frazer et al., 2012; Henly, 2017) y (b) puede haber migraciones ontogénicas de ecosistemas someros a profundos (Barbour et al., 2010; Biggs y Olden, 2011; Brightman-Claydon et al., 2012).
Las estimaciones de las relaciones longitud-peso obtenidas no coinciden con el crecimiento alométrico registrado antes para esta especie (Barbour et al., 2011; Darling et al., 2011; de León et al., 2013; Fogg et al., 2013; Edwards et al., 2014; Sandel et al., 2015; Aguilar-Perera y Quijano-Puerto, 2016; Sabido-Itzá et al., 2016; Villaseñor-Derbez y Fitzgerald, 2019; Chasqui et al., 2020); sin embargo, se confirmó que los machos alcanzan mayores tallas (Edwards et al., 2014). Fogg et al. (2019) afirman que el manejo de poblaciones de pez león requiere realizar estimaciones de las características del ciclo reproductivo y las tasas de crecimiento localmente, ya que en el caso de relación talla-peso existen diferencias significativas en estimaciones de biomasa calculadas a partir de la longitud de los peces cuando se están usando coeficientes diferentes a los de cada región en particular. Lo anterior, destaca la importancia de los hallazgos realizados, pionero en ambientes mesofóticos en Colombia, para el manejo y control de esta especie invasora en los ecosistemas locales. De este modo se podrá evaluar la efectividad de los programas asociados y el impacto sobre los ecosistemas, así como realizar futuras estimaciones de biomasa de esta especie.
Hábitos alimentarios
La alta proporción de presas en avanzado estado de digestión dificultó su identificación. Esto estuvo influenciado por el tiempo que se tardó entre captura y procesamiento de los ejemplares a causa de restricciones logísticas asociadas al muestreo en ambientes mesofóticos alejados de la costa. Por tanto, es necesario seguir analizando ejemplares de pez león, para conocer de forma más extensa y acertada su dieta en el Parque. En Bermudas también encontraron gran cantidad de estómagos con presas muy digeridas, infiriéndose que posiblemente la riqueza de presas del pez león podría ser mucho más amplia que la registrada (Eddy et al., 2016). Además, la menor riqueza de presas en el PNNCP puede ser consecuencia a que en ambientes mesofóticos hay menor riqueza de especies con respecto a los someros, como lo registraron en Puerto Rico (Bejarano et al., 2014), Curazao (Pinheiro et al., 2016) y una revisión global de publicaciones entre 1968 y 2010 (Pyle et al., 2019). A esto se añade que se ha encontrado menor diversidad y biomasa en los estratos más profundos en Bermudas (Stefanoudis et al., 2019a).
Los ítems alimentarios encontrados en los análisis estomacales han sido previamente hallados en Estados Unidos, Bahamas, Bermudas, Golfo de México y el Caribe, donde la dieta del pez león está constituida principalmente por teleósteos y crustáceos (Morris et al., 2009; Muñoz et al., 2011; Dahl y Patterson, 2014; Sandel et al., 2015; Eddy et al., 2016; Acero P. et al., 2019). Las familias de peces con mayor la importancia, Acanthuridae y Monacanthidae, han sido también registradas como presas en otros estudios en el Caribe, pero con una menor importancia numérica (Muñoz et al., 2011; Pantoja-Echevarría et al., 2017; Acero P. et al., 2019), posiblemente debido a que se encontraban en menor frecuencia en los estómagos. Estas dos familias tienen especies que son observadas en el PNNCP con abundancias de ocasionales a comunes (Chasqui-Velasco y González-Corredor, 2019). La importancia de la familia Penaeidae en la dieta del pez león, coincide con lo encontrado en otros estudios (Pantoja-Echevarría et al., 2017; Acero P. et al., 2019). En Cuba, se encontró que los individuos de tallas grandes consumieron principalmente camarones penéidos (Pantoja-Echevarría et al., 2017).
La amplitud del nicho trófico calculada fue contraria a las halladas en otros estudios en el Caribe, en los que el pez león se ha considerado como una especie generalista oportunista capaz de consumir gran cantidad de presas, llegando a superar las 200 especies (Acero P. et al., 2019). Esta habilidad de adaptarse a diferentes ambientes ha permitido el éxito poblacional de P. volitans llegando en algunos lugares a diezmar poblaciones de especies nativas de Haemulidae, Labridae y Pomacentridae (Albins y Hixon, 2008; Morris y Akins, 2009; Green et al., 2012).
En el PNNCP, las razones isotópicas de carbono y nitrógeno en el pez león fueron menores a las registradas en estudios desarrollados a latitudes más altas, tanto en ambientes someros (Muñoz et al., 2011; Layman y Allgeier, 2012; Arredondo, 2016; Curtis et al., 2017) como profundos (Eddy et al., 2020), así como en arrecifes coralinos someros del Caribe colombiano (Acero P. et al., 2019). El único estudio que tiene concentraciones similares de ambos isótopos fue realizado en Bahamas (O’Farrell et al., 2014). Las menores concentraciones de isótopos en el ambiente mesofótico colombiano coinciden con lo encontrado recientemente en Bermudas (Eddy et al., 2020). Las diferencias isotópicas entre zonas someras y profundas pueden ser reflejo de cambios en la estructura de la comunidad arrecifal en diversos taxones y de su baja conectividad (Stefanoudis et al., 2019a, 2019b), y por lo tanto, puede cambiar la disponibilidad de presas para el pez león (Eddy et al., 2020). Es importante destacar que macroalgas y pastos marinos no son comunes en aguas profundas, por lo cual los valores de δ13C en presas del pez león pueden disminuir con la profundidad a medida que las fuentes de carbono se vuelven más planctónicas y pelágicas (Eddy et al., 2020).
Los bajos intervalos de δ13C (1,22 ‰) y δ15N (2,28 ‰) coinciden con la amplitud de nicho de Levin en cuanto a que, en el PNNCP, Pterois tiende a comportarse como especialista, lo cual ha sido observado en algunas regiones del Gran Caribe como Cuba y Bahamas donde fue evidente en individuos de gran tamaño (Green et al., 2012; Rojas-Vélez et al., 2019). En este contexto, en el PNNCP se puede estar reflejando una especialización alimentaria, ya que en decenas de especies ícticas se ha evidenciado que las generalistas pueden presentar una segregación trófica a nivel de subgrupos de individuos en nichos pequeños (Bolnick et al., 2003). Si esto es así, debe tenerse en cuenta que los grupos especializados de una especie generalista pueden afectar a presas de manera similar a las especialistas en cuanto a la reducción e incluso extinción local de las mismas (Araújo et al., 2011). Sin embargo, los resultados de este estudio pueden estar influenciados, en mayor o menor medida, por el bajo tamaño muestral, por lo que se requeriría realizar más análisis para describir completamente la dieta de este depredador.
Reproducción
El desarrollo ovocitario observado histológicamente en hembras de P. volitans en PNNCP coincide con la descripción realizada en el Golfo de México y en Cuba (Fogg et al., 2017; Cruz-López et al., 2020). El hecho de que las hembras capturadas estuvieran sexualmente maduras a pesar de haberse recolectado en diferentes épocas del año, es un indicio del potencial reproductor de la especie y de su capacidad para mantenerse reproductivamente activa durante un largo período e incluso durante todo el año, como se ha descrito en otras regiones (Gardner et al., 2015; Fogg et al., 2017).
Este predominio de hembras maduras en ambientes profundos, coincide con lo encontrado en Bermudas (Eddy et al., 2019) y sugiere que ambientes mesofóticos podrían ser lugares importantes para el ciclo de vida de esta especie, especialmente en lo concerniente a la reproducción. El patrón en el FC de las hembras durante la gametogénesis sugiere que hay una transferencia de energía (expresada en peso) para el desarrollo de ovarios. El IGS se incrementa durante la ovogénesis reflejando el aumento del peso relativo de gónadas, mientras que las reservas de grasa acumuladas en hígado se movilizan a los ovarios y el IHS disminuye rápidamente (Costa, 2013; Domínguez-Petit et al., 2017); sin embargo, en este estudio los comportamientos de IGS e IHS son similares entre estados, lo que evidencia que en el Pterois la movilización de energía para la ovogénesis es rápida.
Esto coincide con las diferencias en tamaño encontradas entre los dos sexos, ya que de la energía obtenida las hembras asignan una mayor proporción a la formación de productos gonadales (Gadgil et al., 1970) que al crecimiento somático. El pez león madura entre el primer y el segundo año de vida (Fogg et al., 2017; Bustos-Montes et al., 2020), y tiene alta tasa de mortalidad (Bustos-Montes et al., 2020), por lo que su estrategia energética debe ser suficientemente eficiente como para mantener tasas reproductivas altas y constantes, que compensen el gasto reduciendo su crecimiento con la maduración (Fogg et al., 2019), al igual que se ha comprobado en otros teleósteos (Reznick, 1983; Roff, 1983). En el caso de los machos, el hecho de alcanzar mayores tallas aumenta sus posibilidades de éxito en la competencia intrasexual y sus oportunidades de apareamiento (Shine, 1989; Fogg y Faletti, 2018). Los resultados de este primer estudio sobre la biología y ecología del pez león en el ambiente mesofótico del PNNCP resaltan la necesidad de continuar realizando esfuerzos de monitoreo y observaciones en todo el intervalo de profundidad del Parque, y la implementación de estrategias novedosas para control y manejo del pez león.
AGRADECIMIENTOS
Se agradece a la Universidad Jorge Tadeo Lozano (Utadeo), Parques Nacionales Naturales y al Parque Nacional Natural Corales de Profundidad (PNNCP) por su apoyo y financiación. Los resultados son producto de los proyectos de UTADEO “Ecología y biología del pez león en dos ambientes contrastantes del Caribe colombiano. Fase V (código 822-15-17)” e “Invasiones biológicas en ambientes tropicales marinos: el caso del pez león (código 901-17-18)” y en el marco del subprograma de Manejo de Especies Invasoras del PNNCP. A Deibis Seguro de Scuba Cartagena y a la División de Buceo y Salvamento de la Armada Nacional por su apoyo en las jornadas de captura. Las observaciones con ROV y cámara de deriva fueron realizadas en los proyectos PRY-BEM-012-14 y “Mapeo de la distribución del ensamblaje de Madracis spp.” financiados por Invemar, ANH y Parques Nacionales. A Gabriel Navas Suárez y Adriana Bermúdez Tobón por su apoyo en los laboratorios de la Universidad de Cartagena. Christian Díaz Sánchez elaboró la cartografía. A los estudiantes de pregrado y posgrado que colaboraron en el procesamiento de muestras, especialmente a Nireth Sierra Sabalza, Shirly Bello Escobar, María Castellanos Jiménez, Margui Almario García, María Rodríguez y Zuleima Vides Pedrozo. ASM recibió financiamiento de Minciencias [convocatoria 860 de 2019]. DBM recibió financiamiento de Minciencias [convocatoria 647-2014] y de CEMarin [Convocatoria 5 de 2015]. Contribución No. 520 del Cecimar de la Universidad Nacional de Colombia, sede Caribe.
REFERENCIAS
Abril-Torres, A. 2012. Aspectos de la biología y ecología trófica y reproductiva del pez león, Pterois volitans (Linnaeus 1758), en San Andrés isla, Reserva de la Biosfera Seaflower, Caribe colombiano.Trabajo de grado Biología. Universidad Nacional de Colombia. Bogotá. 33 p. [ Links ]
Acero P.A , D. Bustos-Montes, P. Pabón-Quintero, C.J. Polo-Silva and A. Sanjuan-Muñoz. 2019. Feeding habits of Pterois volitans: A real threat to Caribbean coral reef biodiversity: 269-314. In: Makowski, C. and C. Finkl (Eds). Impacts of invasive species on coastal environments. Coastal Research Library, Springer Publishing Company Inc., Cham, Switzerland. 482 p. [ Links ]
Agudo, E.A. and E. Klein-Salas. 2014. Lionfish abundance, size structure and spatial distribution along the venezuelan coast (Pterois volitans, Pteroinae: Scorpaenidae). Rev. Biol. Trop., 62: 151-158. [ Links ]
Aguilar-Perera, A. and L. Quijano-Puerto. 2016. Relations between fish length to weight, and otolith length and weight, of the lionfish Pterois volitans in the Parque Nacional Arrecife Alacranes, southern Gulf of Mexico. Rev. Biol. Mar. Oceanogr., 51 (2): 469-474. [ Links ]
Albins, M.A. 2015. Invasive pacific lionfish Pterois volitans reduce abundance and species richness of native Bahamian coral-reef fishes. Mar. Ecol. Prog. Ser., 522: 231-243. [ Links ]
Albins, M.and M. Hixon. 2008. Invasive Indo-Pacific lionfish Pterois volitans reduce recruitment of Atlantic coral-reef fishes. Mar. Ecol. Prog. Ser., 367: 233-238. [ Links ]
Andrade-Amaya, C.A. 2001. Las corrientes superficiales en la cuenca de Colombia observadas con boyas de deriva. Rev. Acad. Col. Cienc. Ex. Fís. Nat., 25 (96): 321-335. [ Links ]
Andradi-Brown, D.A. 2019. Invasive lionfish (Pterois volitans and P. miles): Distribution, impact, and management: 931-941. In: Loya, Y., K.A., Puglise and T. Bridge (Eds.) Mesophotic coral ecosystems. Corals of the World Springer International Publishing, Cham. 1003 p. [ Links ]
Andradi-Brown, D.A., M.J.A. Vermeij, M. Slattery, M. Lesser, I. Bejarano, R. Appeldoorn, G. Goodbody-Gringley, A.D. Chequer, J.M. Pitt, C. Eddy, S.R. Smith, E. Brokovich, H.T. Pinheiro, M.E. Jessup, B. Shepherd, L.A. Rocha, J. Curtis-Quick, G. Eyal, T.J. Noyes, A.D. Rogers and D.A. Exton. 2017. Large-scale invasion of western Atlantic mesophotic reefs by lionfish potentially undermines culling-based management. Biol. Inv., 19 (3): 939-954. [ Links ]
Araújo, M., D.I. Bolnick and C.A. Layman. 2011. The ecological causes of individual specialisation. Ecol. Lett., 14 (9): 948-958. [ Links ]
Arias-González, J.E., C. González-Gándara, J. Luis Cabrera and V. Christensen. 2011. Predicted impact of the invasive lionfish Pterois volitans on the food web of a Caribbean coral reef. Env. Res., 111 (7): 917-925. [ Links ]
Arredondo, A.T. 2016. Comparación trófica del pez león, Pterois volitans (Linnaeus, 1758) con tres especies de peces arrecifales del Caribe mexicano: a través del uso de isótopos estables y contenido estomacal. Maestría en Ciencias del Agua. Centro de Investigación Científica de Yucatán, A. C. Cancún.108 p. [ Links ]
Barbour, A.B., M.L. Montgomery, A.A. Adamson, E. Díaz-Ferguson and B.R. Silliman. 2010. Mangrove use by the invasive lionfish Pterois volitans. Mar. Ecol. Prog. Ser., 401: 291-294. [ Links ]
Barbour, A.B., M.S. Allen, T.K. Frazer and K.D. Sherman. 2011. the potential efficacy of invasive lionfish (Pterois volitans) removals. PLoS ONE, 6 (5). [ Links ]
Bejarano, I., R.S. Appeldoorn and M. Nemeth. 2014. Fishes associated with mesophotic coral ecosystems in La Parguera, Puerto Rico. Coral Reefs, 33 (2): 313-328. [ Links ]
Biggs, C.R. and J.D. Olden. 2011. Multi-scale habitat occupancy of invasive lionfish (Pterois volitans) in coral reef environments of Roatan, Honduras. Aquat. Inv., 6 (3): 347-353. [ Links ]
Bolnick, D.I., R. Svanbäck, J.A. Fordyce, L.H. Yang, J.M. Davis, C.D. Hulsey and M.L. Forister. 2003. The ecology of individuals: Incidence and implications of individual specialization. Am. Nat., 161 (1): 1-28. [ Links ]
Brightman-Claydon, J.A., M.C. Calosso and S.B. Traiger. 2012. Progression of invasive lionfish in seagrass, mangrove and reef habitats. Mar. Ecol. Prog. Ser., 448: 119-129. [ Links ]
Brown-Peterson, N.J., D.M. Wyanski, F. Saborido-Rey, B.J. Macewicz and S.K. Lowerre-Barbieri. 2011. A standardized terminology for describing reproductive development in fishes. Mar. Coastal Fish., 3 (1): 52-70. [ Links ]
Bustos-Montes, D., M. Wolff, A. Sanjuan-Muñoz and A. Acero p. 2020. Growth parameters of the invasive lionfish (Pterois volitans) in the Colombian Caribbean. Reg. Stud. Mar. Sci., 38: 1-9. [ Links ]
Cedeño-Posso, C., D. Alonso, M. Vides, V. Rocha, D. Morales, M. Bastidas, J.C. Aguirre, L. Chasqui, D. Ballesteros, A. Henao-Castro, M. Marrugo, C. Martínez, R. Preziosi y L. Barrios. 2015. Caracterización de las comunidades coralinas del Parque Nacional Natural Corales de Profundidad en el Caribe colombiano: Una aproximación a la conservación de su biodiversidad. Inf. Técn. Final Invemar, Santa Marta. 212p. [ Links ]
Cedeño-Posso, C., D. Alonso, D. Ballesteros, V. Yepes-Narváez, V. Rocha, A. Cardenas, L. Tavera, A. Polanco, G. Borrero, M. Garrido-Linares, A. Henao, M. Molina y D. Hernández. 2017. Mapeo de la distribución del ensamblaje de Madracis spp., en el Parque Nacional Natural Corales de Profundidad. Inf. Técn. Final Invemar. Santa Marta. 61 p. [ Links ]
Chasqui, D. Ballesteros, A. Henao-Castro, M. Marrugo, C. Martínez, R. Preziosi y L. Barrios. 2015. Caracterización de las comunidades coralinas del Parque Nacional Natural Corales de Profundidad en el Caribe colombiano: Una aproximación a la conservación de su biodiversidad. Inf. Técn. Final Invemar, Santa Marta. 212 p. [ Links ]
Chasqui, L., N. Rincón-Díaz and M.J. Vanegas. 2020. Abundance of the invasive lionfish Pterois volitans in the coastal coral reefs from Colombian Caribbean. Bol. Invest. Mar. Cost., 49 (1): 157-170. [ Links ]
Costa, A.M. 2013. Somatic condition, growth and reproduction of hake, Merluccius merluccius, in the Portuguese Coast. Open J. Mar. Sci., 3 (1): 12-30. [ Links ]
Côté, I.M., S.J. Green and M.A. Hixon. 2013. Predatory fish invaders: Insights from Indo-Pacific lionfish in the western Atlantic and Caribbean Biol. Cons., 164: 50-61. [ Links ]
Cruz-López, C., A. Sanz-Ochotorena, Y. Rodríguez-Gómez, R. Lara-Martínez, M. Segura-Valdez y L. Jiménez-García. 2020. Morfología de las gónadas maduras del pez león (Pterois volitans: Pisces, Scorpaenidae ) en el litoral oeste de La Habana. Rev. Invest. Mar., 40 (2): 25-42. [ Links ]
Csirke , B.J. 1989. Introducción a la dinámica de poblaciones de peces. FAO, Roma. 79 p. [ Links ]
Curtis, J.S., K.R. Wall, M.A. Albins and C.D. Stallings. 2017. Diet shifts in a native mesopredator across a range of invasive lionfish biomass. Mar. Ecol. Prog. Ser., 573: 215-228. [ Links ]
Dahl, K. A. and W.F. Patterson. 2014. Habitat-specific density and diet of rapidly expanding invasive red lionfish, Pterois volitans, populations in the northern Gulf of Mexico, PLoS ONE, 9 (8): e105852. [ Links ]
Darling, E.S., S.J. Green, J.K. O’Leary and I.M. Côté. 2011. Indo-Pacific lionfish are larger and more abundant on invaded reefs: A comparison of Kenyan and Bahamian lionfish populations. Biol. Inv., 13 (9): 2045-2051. [ Links ]
de León, R., K. Vane, P. Bertuol, V. Chamberland, F. Simal, E. Imms and M. Vermeij. 2013. Effectiveness of lionfish removal efforts in the southern Caribbean. Endang. Spec. Res., 22 (2): 175-182. [ Links ]
Domínguez-Petit, R., A. Anastasopoulou, L. Cubillos, H.D. Gerritsen, P. Gonçalves, M. Hidalgo, J. Kennedy, M. Korta, G. Marteinsdottir, C. Morgado, M. Muñoz, I. Quincoces, M. Saínza, A. Thorsen and F. Vitale. 2017. Maturity: 1-47. In: Domínguez-Petit, R., H. Murua, F. Saborido-Rey and E. Trippel (Eds.) Applied fisheries reproductive biology for stock assessment and management. CSIC. Vigo. [ Links ]
Eddy, C., J. Pitt, J.A. Morris, S. Smith, G. Goodbody-Gringley and D. Bernal. 2016. Diet of invasive lionfish (Pterois volitans and P. miles) in Bermuda. Mar. Ecol. Prog. Ser., 558: 193-206. [ Links ]
Eddy, C., J. Pitt, K. Oliveira, J.J.A. Morris, J.C. Potts and D. Bernal. 2019. The life history characteristics of invasive lionfish (Pterois volitans and P. miles) in Bermuda. Env. Biol. Fish., 102: 887-900. [ Links ]
Eddy, C., J.M. Pitt, J. Larkum, M.A. Altabet and D. Bernal. 2020. Stable isotope ecology of invasive lionfish (Pterois volitans and P. miles) in Bermuda. Front. Mar. Sci., 7: 1-14. [ Links ]
Edwards, M.A., T.K. Frazer and C.A. Jacoby. 2014. Age and growth of invasive lionfish (Pterois spp.) in the Caribbean Sea, with implications for management. Bull. Mar. Sci., 90 (4): 953-966. [ Links ]
Fogg, A.Q. and M.E. Faletti. 2018. Invasive lionfish (Pterois sp.) agonistic behavior observations. Bull. Mar. Sci., 94 (1): 1-2. [ Links ]
Fogg, A.Q., E.R. Hoffmayer, W.B. Driggers, M.D. Campbell, G.J. Pellegrin and W. Stein. 2013. Distribution and length frequency of invasive lionfish (Pterois sp.) in the northern Gulf of Mexico. Gulf Carib. Res., 25: 111-115. [ Links ]
Fogg, A.Q., N.J. Brown-Peterson and M.S. Peterson. 2017. Reproductive life history characteristics of invasive red lionfish (Pterois volitans) in the northern Gulf of Mexico. Bull. Mar. Sci., 93 (3): 1-24. [ Links ]
Fogg, A.Q., J.T. Evans, M.S. Peterson, N.J. Brown-Peterson, E.R. Hoffmayer and G.W. Ingram. 2019. Comparison of age and growth parameters of invasive red lionfish (Pterois volitans) across the northern Gulf of Mexico. Fish. Bull., 117 (3): 125-139. [ Links ]
Frazer, T.K., C.A. Jacoby, M.A. Edwards, S.C. Barry and C.M. Manfrino. 2012. Coping with the lionfish invasion: Can targeted removals yield beneficial effects? Rev. Fish. Sci., 20 (4): 185-191. [ Links ]
Gadgil, M. and W.H. Bossert. 1970. Life historical consequences of natural selection. The Am. Nat., 104 (935): 1-24. [ Links ]
Gardner, P.G., T.K. Frazer, C. A. Jacoby and R.P.E. Yanong. 2015. Reproductive biology of invasive lionfish (Pterois spp.). Front. Mar. Sci., 2: 1-10. [ Links ]
Gómez-Pardo, H.M. 2014. Ecología trófica del pez león Pterois volitans (Linnaeus, 1758) en tres formaciones coralinas del Caribe colombiano. Trabajo de grado Biología Marina. Univ. Jorge Tadeo Lozano. Bogotá. 57 p. [ Links ]
González, J., M. Grijalba-Bendeck, A. Acero P. and R. Betancur-R. 2009. The invasive red lionfish, Pterois volitans, in the southwestern Caribbean Sea. Aquat. Inv., 4 (3): 381-384. [ Links ]
Goodbody-Gringley, G., C. Eddy, J.M. Pitt, A.D. Chequer and S.R. Smith. 2019. Ecological drivers of invasive lionfish (Pterois volitans and Pterois miles) distribution across mesophotic reefs in Bermuda, Front. Mar. Sci., 6: 1-12. [ Links ]
Green, S.J., J.L. Akins and I.M. Côté. 2011. Foraging behaviour and prey consumption in the Indo-Pacific lionfish on Bahamian coral reefs. Mar. Ecol. Prog. Ser., 433: 159-167. [ Links ]
Green, S., J. Akins, A. Maljković and I. Côté. 2012. Invasive lionfish drive Atlantic coral reef fish declines. PLoS ONE, 7 (3): 1-3. [ Links ]
Harris, H.E., A.Q. Fogg, S.R. Gittings, R.N.M. Ahrens, M.S. Allen and W.F. Patterson. 2020. Testing the efficacy of lionfish traps in the northern Gulf of Mexico. PLoS ONE, 15: 1-20. [ Links ]
Henao-Castro, A., M. Marrugo y M.P. Molina. 2016. Invasión del pez león (Pterois volitans) en ecosistemas profundos del Caribe colombiano: Parque Nacional Natural Corales de Profundidad. La Timonera, 25: 61-63. [ Links ]
Henly, L. 2017. Impacts of culling invasive lionfish (Pterois spp.) on native reef fish assemblages in Honduras. Plymouth Stud. Scien., 10 (1): 22-40. [ Links ]
Hunt, C.L., G.R. Kelly, H. Windmill, J. Curtis-Quick, H. Conlon, M.D.V. Bodmer, A.D. Rogers and D.A. Exton. 2019. Aggregating behaviour in invasive Caribbean lionfish is driven by habitat complexity. Scient. Rep., 9 (1): 1-9. [ Links ]
Hyslop, E.J. 1980. Stomach contents analysis-a review of methods and their application. J. Fish. Biol., 17: 411-429. [ Links ]
Jackson, A.L., R. Inger, A.C. Parnell and S. Bearhop. 2011. Comparing isotopic niche widths among and within communities: SIBER-Stable Isotope Bayesian Ellipses in R. J. Anim. Ecol., 80 (3): 595-602. [ Links ]
Kahng, S.E., J.R. García-Sais, H.L. Spalding, E. Brokovich, D. Wagner, E. Weil, L. Hinderstein and R.J. Toonen. 2010. Community ecology of mesophotic coral reef ecosystems. Coral Reefs, 29 (2): 255-275. [ Links ]
Kim, S.L. and P.L. Koch. 2012. Methods to collect, preserve, and prepare elasmobranch tissues for stable isotope analysis. Env. Biol. Fish., 95 (1): 53-63. [ Links ]
Krebs, C.J. 1999. Ecological methodology. Harper & Row Publishers, New York. 836 p. [ Links ]
Labropoulou, M. and A. Eleftheriou. 1997. The foraging ecology of two pairs of congeneric demersal fish species: Importance of morphological characteristics in prey selection. J. Fish. Biol., 50(2): 324-340. [ Links ]
Layman, C.A. and J.E. Allgeier. 2012. Characterizing trophic ecology of generalist consumers: A case study of the invasive lionfish in the Bahamas. Mar. Ecol. Prog. Ser., 448: 131-141. [ Links ]
Lloret, J., G. Schulman and M.R. Love. 2014. Condition and health indicators of exploited marine fishes. Wiley, Chichester. 247 p. [ Links ]
Luiz, O.J., W.C.R. dos santos, A.P. Marceniuk, L.A. Rocha, S.R. Floeter, C.E. Buck, A.G.C.M. de Klautau and C.E.L. Ferreira. 2021. Multiple lionfish (Pterois spp.) new occurrences along the Brazilian coast confirm the invasion pathway into the Southwestern Atlantic. Biol. Inv., 8: 1-7. [ Links ]
Lysy, M., A.D. Stasko and H.K. Swanson. 2015. Package ‘nicheROVER’. 21 p. [ Links ]
Marrugo, M. y C. Martínez. 2016. Plan de manejo del Parque Nacional Natural Corales de Profundidad 2016-2017. Sistema de Parques Nacionales Naturales, Cartagena. 202 p. [ Links ]
Martoja, R. and M. Martoja-Pierson. 1970. Técnicas de histología animal. Barcelona. 350 p. [ Links ]
McDonald, J. 2014. Handbook of biological statistics. Parky House Publishing. Baltimore. 305 p. [ Links ]
Merlano-Cera, M.M. y R. García-Urueña. 2018. Captura incidental en nasas del pez león Pterois volitans (Scorpaeniformes: Scorpaenidae) en el Caribe colombiano. Rev. Biol. Trop., 66 (3): 1197-2007. [ Links ]
Mooney, H.A. and E.E. Cleland. 2001. The evolutionary impact of invasive species. Proc. Nat. Acad. Sci. USA, 98 (10): 5446-5451. [ Links ]
Morales-Giraldo, D.F., V.L. Rocha-Gutiérrez y B.O. Posada-Posada. 2017. Geomorfología de los fondos submarinos del Parque Nacional Natural Corales de Profundidad, mar Caribe colombiano. Bol. Invest. Mar. Cost., 46 (2): 73-90. [ Links ]
Morris, J.A. and J.L. Akins. 2009. Feeding ecology of invasive lionfish (Pterois volitans) in the Bahamian archipelago. Env. Biol. Fish., 86 (3): 389-398. [ Links ]
Morris, J.A., J. Akins, A. Barse, D. Cerino and D. Freshwater. 2009. Biology and ecology of the invasive lionfishes, Pterois miles and Pterois volitans. Proc. 61st Gulf Carib. Fish. Inst., 61: 1-6. [ Links ]
Morris, J.A., C. V. Sullivan and J.J. Govoni. 2011. Oogenesis and spawn formation in the invasive lionfish, Pterois miles and Pterois volitans. Scient. Mar. 75 (1): 147-154. [ Links ]
Muñoz, R.C., C.A. Currin and P.E. Whitfield. 2011. Diet of invasive lionfish on hard bottom reefs of the southeast USA: Insights from stomach contents and stable isotopes. Mar. Ecol. Prog. Ser., 432: 181-193. [ Links ]
Muñoz-Escobar, L. y D.L. Gil-Agudelo. 2012. Composición dietaria del pez león, Pterois volitans (Pisces: Scorpaenidae), en Santa Marta y el Parque Nacional Natural Tayrona. Bol. Invest. Mar. Cost., 41 (2): 471-477. [ Links ]
Nuttall, M.F., M.A. Johnston, R.J. Eckert, J.A. Embesi, E.L. Hickerson and G.P. Schmahl. 2014. Lionfish (Pterois volitans [Linnaeus, 1758] and P. miles [Bennett, 1828]) records within mesophotic depth ranges on natural banks in the northwestern Gulf of Mexico. BioInv. Rec., 3 (2): 111-115. [ Links ]
O’Farrell, S., S. Bearhop, R.A.R. Mcgill, C.P. Dahlgren, D.R. Brumbaugh and P.J. Mumy. 2014. Habitat and body size effects on the isotopic niche space of invasive lionfish and endangered Nassau grouper, Ecosphere, 5 (10): 1-11. [ Links ]
Pabón, P. y A. Acero P. 2016. Ecología trófica del invasor pez león Pterois volitans en el Caribe colombiano: impacto sobre familias ícticas de Santa Marta y San Andrés: 50-74. En: Campos C., N.H. y A. Acero P. (Eds.). Contribuciones en Ciencias del Mar de la Universidad Nacional de Colombia. Universidad Nacional de Colombia, Bogotá. [ Links ]
Pantoja-Echevarría, L.M., P.P. Chevalier-Monteagudo, D. Cabrera-Guerra, R.I. Corrada-Wong, D. Cobián-Rojas, H. Caballero-Aragón, A. García-Rodríguez y R.A. Fernández Osoria. 2017. Superposición de la dieta del pez león Pterois volitans (Teleostei: Scorpaenidae) con la de peces nativos de nivel trófico similar en Cuba. Bol. Invest. Mar. Cost., 46 (2): 115-134. [ Links ]
Park, R. and S. Epstein. 1961. Metabolic fractionation of C13 & C12 in plants. Plant Physiol., 36 (2): 133-138. [ Links ]
Pauly, D. (1984). Fish population dynamics in tropical waters: A manual for use with programmable calculators. ICLARM Studies and Reviews 8. Philippines: International Center for Living Aquatic Resources Management-ICLARM. [ Links ]
Pimiento, C., J.C. Nifong, M.E. Hunter, E. Monaco and B.R. Silliman. 2013. Habitat use patterns of the invasive red lionfish Pterois volitans: A comparison between mangrove and reef systems in San Salvador, Bahamas. Mar. Ecol., 36 (1): 28-37. [ Links ]
Pinheiro, H.T., G. Goodbody-Gringley, M.E. Jessup, B. Shepherd, A.D. Chequer and L.A. Rocha. 2016. Upper and lower mesophotic coral reef fish communities evaluated by underwater visual censuses in two Caribbean locations. Coral Reefs, 35 (1): 139-151. [ Links ]
Pinkas, L., M.S. Oliphant and I.L.K. Iverson. 1971. Food habits of albacore, bluefin tuna, and bonito in California waters. Fish Bull., 152: 1-105. [ Links ]
Pujos, M., J.L. Pagliardini, R. Steer, G. Vernette y O. Weber. 1986. Influencia de la contracorriente norte colombiana para la circulación de las aguas en la plataforma continental: su acción sobre la dispersión de los efluentes en suspensión del río Magdalena. Bol. Cient. CIOH, 6: 3-16. [ Links ]
Pyle, R.L., R.K. Kosaki, H.T. Pinheiro, L.A. Rocha, R.K. Whitton and J.M. Copus. 2019. Fishes: Biodiversity: 749-777. In: Loya, Y., K.A., Puglise and T. Bridge (Eds.). Mesophotic coral ecosystems. Corals of the World 12. Springer International Publishing, Cham, Switzerland. 1003 p. [ Links ]
Reznick, D. 1983. The structure of guppy life histories: the tradeoff between growth and reproduction. Ecology, 64 (4): 862-873. [ Links ]
Rocha, L.A., H.T. Pinheiro, B. Shepherd, Y.P. Papastamatiou, O.J. Luiz, R.L. Pyle and P. Bongaerts. 2018. Mesophotic coral ecosystems are threatened and ecologically distinct from shallow water reefs. Science, 361: 281-284. [ Links ]
Roff, D.A. 1983. An allocation model of growth and reproduction in fish. Can. J. Fish. Aquat. Sci., 40: 1395-1404. [ Links ]
Rojas-Vélez, S., J. Tavera and A. Acero P. 2019. Unraveling lionfish invasion: Is Pterois volitans truly a morphologically novel predator in the Caribbean?. Biol. Inv., 21: 1921-1937. [ Links ]
Romero-Arteaga, D.A. 2017. Dieta del pez león Pterois volitans en dos ambientes del Caribe colombiano. Trabajo de grado Biología Marina, Univ. Jorge Tadeo Lozano. Santa Marta. 67 p. [ Links ]
Sabido-Itzá, M.M., A. Aguilar-Perera and A. Medina-Quej. 2016. Length-weight and length-length relations, and relative condition factor of red lionfish, Pterois volitans (Actinopterygii: Scorpaeniformes: Scorpaenidae), from two natural protected areas in the Mexican Caribbean. Acta Ichthyol. Piscat., 46 (4): 279-285. [ Links ]
Sánchez, J.A., L.F. Dueñs, F. González, M. Gómez y J. Andrade. 2016. Primeras exploraciones en los arrecifes mesofóticos del PNN Corales de Profundidad mediante recirculadores (CCR Trimix), Caribe colombiano. Univ. Andes, Bogotá. 24 p. [ Links ]
Sandel, V., D. Martínez-Fernández, D. Wangpraseurt and L. Sierra. 2015. Ecology and management of the invasive lionfish Pterois volitans/miles complex (Perciformes: Scorpaenidae ) in southern Costa Rica, Rev. Biol. Trop., 63 (1): 213-221. [ Links ]
Schmahl, G.P., E.L. Hickerson and W.F. Precht. 2008. Biology and ecology of coral reefs and coral communities in the Flower Garden Banks region, northwestern Gulf of Mexico: 221-261. In: Riegl, B. and R. Dodge (Eds.) Coral Reefs of the USA. Coral Reefs of the World, vol 1. Springer, Dordrecht. 803 p. [ Links ]
Schofield, P.J. 2009. Geographic extent and chronology of the invasion of non-native lionfish (Pterois volitans [Linnaeus 1758] and P. miles [Bennett 1828]) in the western north Atlantic and Caribbean Sea. Aquat. Inv., 4 (3): 443-449. [ Links ]
Schofield, P.J. 2010. Update on geographic spread of invasive lionfishes (Pterois volitans [Linnaeus, 1758] and P. miles [Bennett, 1828]) in the Western North Atlantic Ocean, Caribbean Sea and Gulf of Mexico. Aquat. Inv., 5 (1): 117-122. [ Links ]
Shine, R. 1989. Ecological causes for the evolution of sexual dimorphism: A review of the evidence. Q. Rev. Biol., 64 (4): 419-461. [ Links ]
Stefanoudis, P.V., E. Gress, J.M. Pitt, S.R. Smith, T. Kincaid, M. Rivers, D.A. Andradi-Brown, G. Rowlands, L.C. Woodall and A.D. Rogers. 2019a. Depth-dependent structuring of reef fish assemblages from the shallows to the rariphotic zone. Front. Mar. Sci., 6: 1-16. [ Links ]
Stefanoudis, P. V., M. Rivers, S.R. Smith, C.W. Schneider, D. Wagner, H. Ford, A.D. Rogers and L.C. Woodall. 2019b. Low connectivity between shallow, mesophotic and rariphotic zone benthos. R. Soc. Open Sci., 6: 1-13. [ Links ]
Tornabene, L. and C.C. Baldwin. 2017. A new mesophotic goby, Palatogobius incendius (Teleostei: Gobiidae), and the first record of invasive lionfish preying on undescribed biodiversity. PLoS ONE, 12 (5): 1-20. [ Links ]
Villaseñor-Derbez, J.C. and S. Fitzgerald. 2019. Spatial variation in allometric growth of invasive lionfish has management implications, PeerJ, 2019 (4):2-15. https://peerj.com/articles/6667/ [ Links ]
Whitfield, P.E., T. Gardner, S.P. Vives, M.R. Gilligan, W.R.C. Jr, G.C. Ray and J.A. Hare. 2002. Biological invasion of the Indo-Pacific lionfish Pterois volitans along the Atlantic coast of North America. Mar. Ecol. Prog. Ser., 235:289-297. [ Links ]
Whitfield, P.E., R.C. Muñoz, C.A. Buckel, B.P. Degan, D.W. Freshwater and J.A. Hare. 2014. Native fish community structure and Indo-Pacific lionfish Pterois volitans densities along a depth-temperature gradient in Onslow Bay, North Carolina, USA. Mar. Ecol. Prog. Ser., 509: 241-254. [ Links ]
Zar, J.H. 2010. Biostatistical analysis. Prentice Hall, New Jersey. 921 p. [ Links ]
Recibido: 21 de Agosto de 2020; Aprobado: 26 de Agosto de 2021











 texto em
texto em