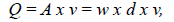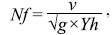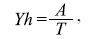Introducción
Los ecosistemas acuáticos tropicales de montaña en Suramérica albergan una gran variedad de especies de flora y fauna bajo condiciones ambientales extremas (Lewis, 2008; Jacobsen, 2008). Al norte de los Andes, específicamente, los ríos y arroyos muestran una variación estacional del régimen de flujo por lo que el caudal es poco estable en la época de lluvias comparada con la seca (Jacobsen & Encalada, 1998; Ríos-Touma, et al., 2011). Dichos patrones de estacionalidad cambian las proporciones de los mesohábitats del río por el arrastre de sedimentos finos y gruesos y materia orgánica y afectan la estructura y el funcionamiento del ecosistema y de las comunidades biológicas en los períodos de caudal alto (Poff & Zimmerman, 2010; Tamarís-Turizo & Rodríguez-Barrios, 2015).
Uno de los grupos bióticos con mayor distribución en los ecosistemas lóticos son los macroinvertebrados acuáticos (Domínguez & Fernández, 2009). Por su estrecha relación con el medio acuático son un indicador eficaz de la calidad biológica del agua (Acosta, et al., 2009; Villamarín, et al., 2013). Sin embargo, en las últimas décadas se ha dado un mayor énfasis al estudio de macroinvertebrados por su sensibilidad a los cambios en las condiciones del flujo (Brooks, et al., 2005; Kennen, et al., 2010; Mesa, 2010). Por ejemplo, si las condiciones del flujo se vuelven extremas, algunos taxones de la comunidad de macroinvertebrados presentan adaptaciones de resiliencia, como la migración y la búsqueda de refugios o estados de latencia (Rosser, et al., 2018; Herbst, et al., 2019). Otros organismos, en cambio, presentan adaptaciones que les confieran resistencia a dichas condiciones, lo que, a su vez, depende de sus rangos de tolerancia a los valores extremos de las variables hidráulicas (velocidad, profundidad y rugosidad del sustrato), y de otras variables ambientales (Brooks, et al., 2005; Konrad, et al., 2008.)
Las variables hidráulicas y de sustrato constituyen factores claves en la estructura y función de la comunidad de macroinvertebrados y su interacción sinérgica contribuye a la creación de patrones a escala fina del flujo cercano al lecho que influyen en la retención de materia orgánica y la distribución de organismos bentónicos (Rempel, et al., 2000; Brooks, et al., 2005; Mesa, 2010; Vimos-Lojano, et al., 2019). Según Mesa (2010), esta distribución espacial de los diferentes taxones sería un reflejo de su ajuste morfológico y trófico a las condiciones hidráulicas particulares y de la disponibilidad de recursos alimenticios dentro de cada hábitat.
En quebradas de montaña hay variedad de oferta alimenticia, lo que se relaciona con la presencia de ciertos grupos funcionales de macroinvertebrados (Tomanova, et al., 2006). Estos grupos se definen en torno a un conjunto de características morfológicas (especiali-zación de sus piezas bucas) y mecanismos de comportamiento (formas de alimentación) que confieren ventajas de adaptación a un hábitat. Los grupos funcionales alimentarios (GFA) se organizan en cinco categorías: los fragmentadores (FR), que se alimentan de materia orgánica gruesa en partículas (MOPG) gracias a estructuras bucales que les permitan cortar; los colectores-recolectores (CR) y los colectores filtradores (CF), que consumen materia orgánica fina en partículas (MOPF) y presentan estructuras bucales con flecos finos de recolección o abaníco de filtración; los raspadores (RA) de perifiton y biopelículas gracias a sus estructuras bucales en forma de cepillos, y los depredadores (DE) que consumen otros animales y presentan estructuras bucales en forma de daga (Merrit & Cummins, 2008). Por otra parte, la mayoría de estudios sobre la influencia de las variables hidráulicas en la estructura y la función de la comunidad de macroinvertebrados se han hecho en las zonas templadas (Brooks, et al., 2005; Kennen, et al., 2010; Mesa, 2010). En cambio, en sistemas lóticos de montaña tropical, y específicamente en los Andes colombianos, los estudios se han enfocado en la influencia del ciclo hidrológico sobre la comunidad (Longo, et al., 2010; Ríos-Pulgarín, et al., 2016; Mantilla, et al., 2018). Sin embargo, la información detallada de las respuestas y los rangos de tolerancia de la comunidad de macroinvertebrados a la estacionalidad de las variables hidráulicas en escalas espaciales finas es escasa (Ríos-Touma, et al., 2011; Cardona, 2012; Vimos, et al., 2019). Además, muy pocos de estos estudios han abordado el comportamiento de los GFA de la comunidad en relación con las variables hidráulicas (Jacobsen & Encalada, 1998; Tomanova, et al., 2006; Ramírez & Gutiérrez-Fonseca, 2014; Tamaris-Turizo, et al., 2018).
Ciertamente, el conocimiento de la autoecología de los taxones y umbrales de tolerancia de los organismos nos permitiría establecer los rangos de condiciones de hábitat idóneas, lo que, a su vez, sería un indicativo de la flexibilidad de la comunidad ante variaciones en las condiciones de flujo. Esta información tendría aplicaciones en el establecimiento de los caudales ecológicos, la restauración y la conservación de estos ecosistemas (Bunn & Arthington, 2002).
En este sentido, el objetivo de este estudio fue evaluar la respuesta de la composición, la estructura y la función de la comunidad de macroinvertebrados frente a la variación hidráulica temporal en el río Agua Blanca, específicamente en lo relativo a: a) la descripción de la variación temporal de las condiciones hidráulicas; b) la variación temporal de la composición, la estructura y los GFA de la comunidad de macroinvertebrados, y c) la determinación de las relaciones entre las variables hidráulicas y la abundancia de taxones de macroinvertebrados.
Materiales y métodos
Area de estudio
Se establecieron dos tramos (réplicas) de monitoreo de 100 m cada uno, ubicados antes y después de una bocatoma (separación ~40 m) en la quebrada Agua Blanca en la micro-cuenca del río Meta, subcuenca del río Lengupá, municipio de Berbeo, departamento de Boyacá, Colombia (cordillera oriental de los Andes), en las coordenadas 5° 15' 49" Norte y 73° 05' 47'' Oeste, a una altitud de 2.007 m. En cada tramo se realizaron dos campañas de muestreo en las épocas de transición de sequia a lluvia (abril) y de lluvia (junio) en el 2016 (Figura 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1023/2761).
La microcuenca se caracteriza por formaciones vegetales del tipo de bosque subandino y andino húmedo secundario y fragmentos de bosque primario (Ministerio de medio ambiente, vivienda y desarrollo territorial - MAVDT, et al., 2006; Sistema Municipal de Áreas Protegidas - SIMAP, 2015). La mayor parte de la cobertura vegetal corresponde a bosque denso (40 %), seguido de pastos limpios (28 %) y mosaicos de cultivo, espacios y pastos naturales (16 %) (SIMAP, 2015). El ancho del bosque de ribera en los dos tramos fue mayor a 10 m, con una vegetación predominantemente arbórea (50 %) seguida de la arbustiva (30 %) y la herbácea (20 %) (EOT, 2006). La temperatura media anual es de 23 °C, con valores de precipitación media anual que oscilan entre los 1.450 y los 1.960 mm.
Diseño de muestreo
Variables biológicas. Se recolectaron un total de 60 muestras de macroinvertebrados (15 muestras x dos tramos, repeticiones x dos campañas) con el uso de una red Surber (área de 900 cm2, ojo de malla de 0,3 mm) mediante un muestreo aleatorio estratificado (Cardona, 2012) (Figura 2S,https://www.raccefyn.co/index.php/raccefyn/article/view/1023/2762) según las proporciones de los mesohábitats observados en el tramo. Las muestras recolectadas se almacenaron en frascos plásticos con alcohol al 70 % para su preservación y posterior traslado al laboratorio (Wetzel & Likens, 2000). La identificación taxonómica se hizo empleando un estereomicroscopio hasta el nivel más bajo de determinación (usualmente género) y mediante claves taxonómicas (Epler, 2001; Merrit & Cummins, 2008; Domínguez & Fernández, 2009), excepto para los taxones Dryopidae, Ceratopogonidae, Ephydridae, Simuliidae, Tipulidae, Crambidae, Sericostomatidae, Acari, Asellidae, Ostracoda, Planorbidae, Naididae, y Lumbriculidae, debido al escaso conocimiento en la región o su compleja taxonomía.
Variables abióticas. En cada tramo se estimó visualmente la proporción de meso-hábitats para calcular el número de muestras que debían recolectarse de forma aleatoria en ellos. Los mesohábitas determinados fueron: rápido (alta velocidad y flujo turbulento: 35 % de las muestras), corriente (alta velocidad y superficie de flujo sin mayores turbulencias: 43 % de las muestras), y poza (nula o baja velocidad de flujo: 22 % de las muestras) (Parasiewicz, 2007).
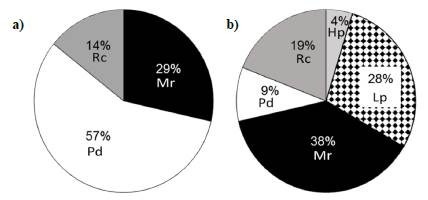
En cada punto de muestreo biológico se midieron in situ la velocidad (m.s-1) y profundidad (m) con la ayuda de un aforómetro (Global Water FP211). Además, se establecieron en cada tramo tres secciones transversales para la categorización visual de la proporción de los cinco tipos de sustratos determinados por Wadeson (1994): roca (Rc: diámetro de >300 mm), piedra (Pd: diámetro de <300 mm), hojarasca (Hp), limo-piedras (Lp) y musgo-roca (Mr).
Por último, se midió el ancho del canal en cinco puntos en cada tramo, con el fin de estimar el caudal mediante la relación entre el área de sección y la velocidad de flujo (Wetzel & Likens, 2000), con la ecuación
donde Q es el caudal (m3 s1), A es el área de la sección transversal del río (m), v la velocidad (m s-1), w la anchura del lecho (m), y d la profundidad o calado (m).
Pretratamiento de datos
En cada muestra biológica se calcularon las siguientes métricas de la comunidad: riqueza total, riqueza de Margalef, diversidad de Shannon-Wiener, y riqueza y abundancia de Ephemeroptera, Plecoptera y Trichoptera (EPT) con el programa PAST 3.13 (Moreno, 2001). Además, se determinó el número de individuos por cada grupo alimentario (FR, CR, CF, RA y DE) con base en la información secundaria de Tomanova, et al. (2006), Merrit & Cummins (2008), y Chará-Serna, et al. (2010).
Con base en las mediciones realizadas in situ, se calculó el Fr a partir de la ecuación:
donde v es la velocidad media, g es la aceración de la gravedad y Yh es el calado medio igual a:
donde A es el área y T es el ancho del canal. El valor resultante es un número adimensional que relaciona el efecto de las fuerzas de inercia y las fuerzas de gravedad que actúan sobre el fluido, en este caso, el agua. Los valores se categorizaron en tres grupos: valores <1 (flujo subcrítico), valores = 1 (flujo crítico) y valores >1 (flujo supercrítico) (Robert, et al., 2003).
Análisis estadístico
Para describir el comportamiento estadístico de las variables hidráulicas, se emplearon medidas de tendencia central y dispersión (media aritmética, varianza y coeficiente de variación). Asimismo, con el fin de conocer las diferencias ambientales entre épocas, se hizo una prueba de Kolmogorov-Smirnov para cada una de las variables hidráulicas estudiadas (Guisande, et al., 2011) mediante el programa PAST 3.13. Además, se realizaron gráficos circulares para mostrar las proporciones de los tipos de sustrato por época.
Por otra parte, se determinó si existía variación en la composición y la estructura de la comunidad de macroinvertebrados entre las dos épocas hidroclimáticas mediante las pruebas ANOSIM y SIMPER según Bray-Curtis, con 9.999 permutaciones usando el programa PRIMER 6 (Clarke, 1993).
Con el fin de determinar la influencia de las variables ambientales en las abundancias de los taxones, se hizo un análisis de correspondencia canónica (CCA). Previamente, se exploraron los datos mediante un análisis de correspondencias sin tendencias (DCA) para estimar la longitud del gradiente. Se obtuvo un gradiente con 6,4 unidades de desviación estándar correspondiente a un modelo unimodal seleccionado para el análisis (Leps & Smilauer, 2003). Por otro lado, las abundancias de individuos por cada taxón se transformaron con log10 (x + 1) y se ponderaron los taxones raros (abundancias de <10 individuos del total) para el análisis. Con el fin de evitar el error de tipo I en los datos, se aplicó la corrección de Bonferroni (Leps & Smilauer, 2003). Por último, antes de los análisis, las variables hidráulicas autocorrelacionadas se descartaron con un valor de Spearman (rho) de 0,8. Todos estos análisis se hicieron con el programa CANOCO 5 y PAST 3.13.
Asimismo, con el propósito de detectar relaciones entre las abundancias de los taxo-nes, las métricas de la comunidad y las variables abióticas, se hicieron análisis de correlaciones lineales mediante la prueba de Spearman con el programa PAST 3.13. Además, se construyeron curvas de preferencia de hábitat para los taxones que tuvieron una relación significativa con las variables hidráulicas. Para esto, se calcularon intervalos de los valores de la variable ambiental y se estimó el promedio de la abundancia de cada taxón en cada intervalo (Cardona, 2012). A continuación, las abundancias de los taxones se estandarizaron de 0 a 1, donde 0 es una preferencia nula y 1 es la mayor preferencia por parte del taxón. Estos resultados se plasmaron en un gráfico de dispersión al cual se le ajustó una curva polinomial de segundo orden. Construidas las curvas, se definieron los rangos de las variables hidráulicas en los cuales los macroinvetebrados alcanzaron una preferencia de hábitat de >0,8.
Por último, a partir de análisis preliminares se descartó la influencia de la bocatoma ubicada entre los dos tramos en estudio con respecto a la composición y la estructura de la comunidad (ANOSIM; R=0,005, p=0,002).
Resultados
Variación temporal en las variables hidráulicas
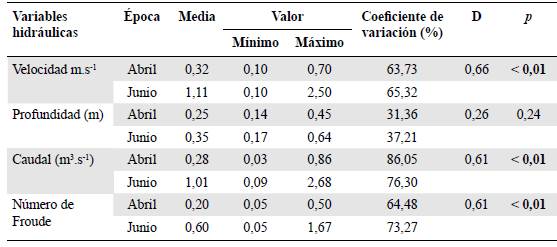
Se obtuvo una variación temporal de la velocidad (D=0,66; p<0,01), el caudal (D=0,61; p<0,01) y el Fr (D=0,61; p<0,01), con un incremento en el promedio y en los valores mínimos y máximos en el mes de junio. Por otro lado, el coeficiente de variación de estas variables fue alto, especialmente en la época de lluvias (Tabla 1). Por otro lado, se registró una diferencia en los tipos de sustrato inorgánico y orgánico: en abril predominó el Pd, y en junio el Mr y el Lp (Figura 1) y se encontraron, también, Lp y Hp.
Tabla 1 Resultados estadísticos descriptivos y de dispersión de las variables hidráulicas mediante la prueba de Kolmogorov-Smirnov. D: valor de distancia en Kolmogorov-Smirnov; p: valor de significación
Variación temporal en la composición, estructura y función de la comunidad de macroinvertebrados
Se recolectaron 732 individuos pertenecientes a 57 taxones, principalmente de los ordenes Coleóptera (16), Díptera (12) y Trichoptera (11). La mayor riqueza de taxones se obtuvo en las familias Chironomidae, con ocho géneros, y Elmidae, con nueve subfamilias. En cuanto a la variación temporal, en abril se presentó el mayor número de taxones (49) e individuos (482) comparado con el mes de junio (42 taxones y 250 individuos) (Tabla 1S,https://www.raccefyn.co/index.php/raccefyn/article/view/1023/2760).
Los resultados del ANOSIM (R=0,159; p<0,001) evidenciaron una composición de la comunidad y la abundancia de macroinvertebrados acuáticos diferente en las dos épocas de muestreo. Así, los taxones que contribuyeron en mayor grado a estas disimilitudes temporales fueron Leptohyphes, Smicridea, Helicopsyche, Nanomis y Marilia, con mayor abundancia en abril, y Simuliidae, Sericostomatidae, en junio (Figura 2). En cuanto a los índices de diversidad, solo se observaron diferencias temporales significativas en el índice de riqueza de Margalef (D=0,308; p=0,03), con una disminución en junio (Figura 3).
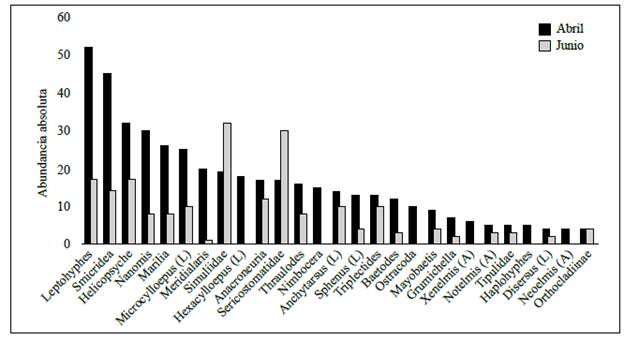
Figura 2 Abundancia absoluta (número de individuos) de los macroinvertebrados más representativos de la quebrada Agua Blanca en las dos épocas de muestreo en Berbeo, Boyacá. Estado: (A) adulto, (L) larva.
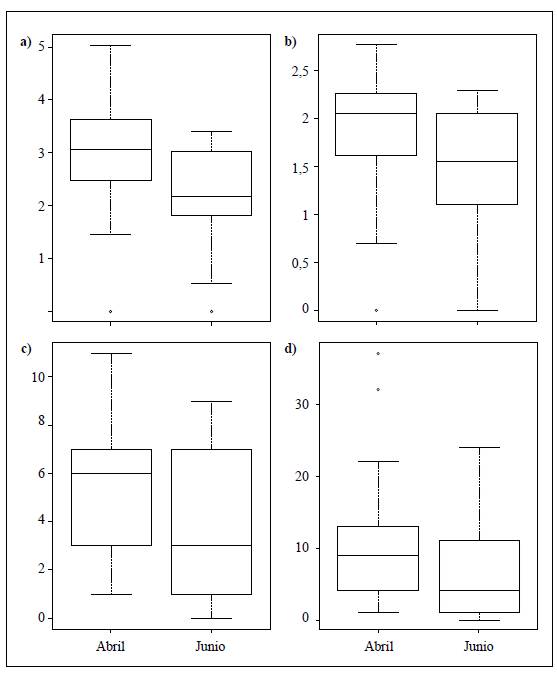
Figura 3 Diagrama de cajas de las métricas de la comunidad en las dos épocas de muestreo (prueba de Kolmogorov). a) Riqueza de Margalef (D=0,308; p=0,03). b) Diversidad de Shannon (D=0,343; p=0,08. c) Riqueza de EPT (D=0,321; p=0,07). d) Abundancia de EPT (D=0,252; p=0,257)
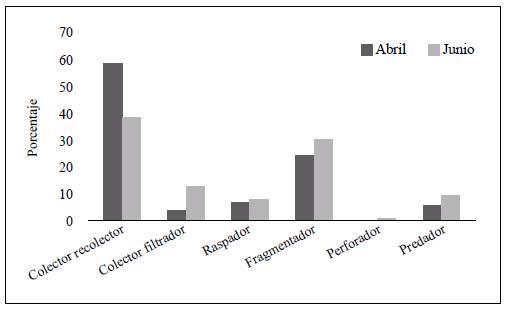
Se determinaron seis GFA dominados por CR y FR. En abril la mayor abundancia de organismos correspondió a los CR, en tanto que en junio se registró un incremento del 10 % de organismos FR y CF, en comparación con abril (Figura 4).
Relación entre los macroinvertebrados y las variables hidráulicas
Según las correlaciones lineales, en general no se detectaron asociaciones significativas entre las variables hidráulicas y las métricas de la comunidad. Sin embargo, la profundidad estaría inversamente relacionada con la riqueza de Margalef, con p=0,08.
En cuanto a los resultados del CCA, el primer eje explicó el 33,58 % de la varianza y el segundo, el 27,23 %, con una significación de p<0,005 según la prueba de permutación de Monte Cario (Figura 5). Se obtuvieron relaciones positivas de la familia Simuliidae y el género Metrichia (Trichoptera) con la profundidad, del ancho del cauce con el género Mayobaetis (Ephemeroptero), y de la familia de Sericostomatidae (Trichoptera) con las variables de velocidad y Fr. Por otra parte, los grupos Ostracoda, Meridialis (Ephemeroptero) y Triplectides (Trichoptero) se relacionaron de forma negativa con la velocidad y el ancho del canal.
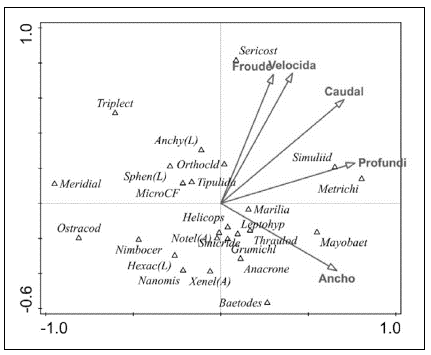
Figura 5 Análisis de correspondência canónica entre la abundância de los taxones y las variables abióticas
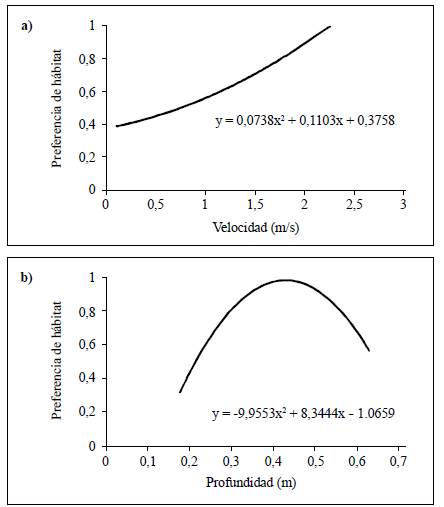
Los resultados de la correlación de Spearman evidenciaron que la familia Simuliidae (r=0,45; p<0,05) tuvo una relación significativa con la profundidad, y la familia Sericos-tomatidae (r=0,78; p<0,01) con la velocidad. Por otra parte, la curva de preferencia de la familia Sericostomatidae con respecto a la velocidad presentó valores óptimos para los valores de 1,8 m s1 a 2,3 m s1, con una tendencia a registrar valores mayores (Figura 6a). Asimismo, la curva de preferencia para la familia Simuliidae indicó que estos organismos prefirieron establecerse en profundidades entre los 0,3 m y los 0,55 m (Figura 6b).
Discusión
Variación temporal en las variables hidráulicas
En este estudio se hallaron diferencias relevantes en las variables hidráulicas entre la época de transición de sequía a lluvias y la de lluvias en las cuales la velocidad, el caudal y el Fr (flujo supercrítico) se relacionaron con una mayor precipitación en junio. Cabe recalcar que el tamaño pequeño de la cuenca genera una respuesta rápida al aumento de flujo y, por ende, una estacionalidad marcada en dichas variables, incluso entre la época de transición de sequía a lluvias y de lluvias (Ministerio de medio ambiente, vivienda y desarrollo territorial - MAVDT, et al, 2006; Lewis, et al, 2008).
Se observó, también, una variación temporal en los tipos de sustrato del río. Así, en la época de lluvias hubo una mayor heterogeneidad del sustrato debido al incremento en la proporción de la MOPG (hojarasca y musgo) y del limo, comparada con la época de transición. Esto se explicaría por la dinámica de fluidos bajo condiciones de altas velocidades en la época de lluvias, lo que genera un área de protección contra la fuerza de arrastre de la corriente en el sotavento de las rocas grandes, la cual produce el almacenamiento de sedimentos finos, MOPG y MOPF (Tamarís-Türizo & Rodríguez-Barrios, 2015; Elgueta-Astaburuaga & Hassan, 2019). En contraste, en la época de transición a las lluvias, cuando las velocidades son medias, no se crean estas áreas de protección y, en consecuencia, se produce un lavado del limo y la materia orgánica acumulada durante la época seca (Roll, et al, 2012). Este fenómeno de transporte pudo causar la ausencia de estos dos tipos de material durante la transición a las lluvias.
Variación temporal en la composición y estructura de la comunidad de macroinvertebrados
La riqueza total de macroinvertebrados encontrada en la quebrada fue alta comparada con la hallada en otros estudios de la región norte de la cordillera de los Andes, específicamente de la subcordillera oriental de los Andes colombianos (Posada-García, et al., 2008; Gil, et al., 2015; Zambrano & Zambrano, 2016; Motta-Díaz, et al., 2016). En general, la mayor abundancia reportada en este estudio de los ordenes Coleóptera, Díptera y Trichoptera se considera habitual en los sistemas de montaña andinos (Domínguez & Fernández, 2009; Vásquez-Ramos & Reinoso, 2012; Roldán, et al., 2014).
Por otra parte, la disminución de la riqueza total y de la abundancia (~50 %) de macroinvertebrados en la época de lluvias (caudal alto), se puede explicar por el incremento del efecto de arrastre de la corriente y la poca adaptación hidromorfológica de ciertos invertebrados (Brooks, et al., 2005). Esto coincide con estudios realizados en ríos andinos de media y alta montaña (Tomanova & Usseglio-Polatera, 2007; Ríos-Touma, et al, 2012; Vimos-Lojano, et al., 2019) en los que se registró una relación inversa entre la abundancia y la riqueza de taxones de invertebrados acuáticos y la presencia de eventos de precipitación. Cabe mencionar que la riqueza y la abundancia de EPT fueron similares en las dos épocas, lo que indicaría que dentro de estos órdenes existen diferentes géneros que presentan estrategias morfológicas (estructuras de adhesión al sustrato o formas hidrodinámicas) o comportamentales (búsqueda de refugios) que les ayudan a adaptarse a las condiciones encontradas tanto en el mes de transición como en el de lluvias (Domínguez & Fernández, 2009; Statzner & Beche, 2010; Ríos-Touma, et al., 2011), lo que coincide con lo hallado en el estudio de Vimos-Lojano, et al. (2019), quienes reportan cambios temporales en los mesohábitas rápidos que afectan en mayor grado a los organismos que no son insectos.
En general, se encontró que la composición y la estructura de la comunidad de macro-invertebrados fue diferente en la época de transición y en la de lluvias: el flujo medio registrado durante la época de transición favoreció el establecimiento de organismos de los géneros Leptohyphes, Smicridea, Helicopsyche, Nanomis y Marilia en los mesohábitats de pozas y corrientes, pero cuando el flujo y las condiciones hidráulicas cambiaron en la época de lluvia, la abundancia de estos taxones disminuyó. Dichas condiciones hidráulicas se acercan al umbral de tolerancia de estos organismos, por lo que, aunque los géneros Leptohyphes y Nanomis posean adaptaciones específicas a la corriente (dentículos en las uñas), es inevitable que algunos individuos sean arrastrados por la fuerza de la corriente (Ríos-Touma, et al., 2011; Crespo-Pérez, et al., 2016; Forero-Céspedes, et al., 2016). En cambio, otros organismos de los géneros Smicridea, Helicopsyche y Marilia, que prefieren mesohábitas tipo poza para su establecimiento, no poseen adaptaciones específicas contra la fuerza de arrastre; sin embargo, tienen otras estrategias de resiliencia para evitar dichas condiciones al ubicarse a sotavento de los sustratos de gran tamaño donde la velocidad es baja (Vaughn, 1987; Reynaga & Rueda, 2014; Ríos-Pulgarín, et al., 2016).
Variación temporal en la función de la comunidad de macroinvertebrados
En las dos épocas los organismos CR, que se alimentan de MOPF, fueron abundantes, lo que indicaría que la MOPF puede ser un recurso importante en este sistema y coincide con lo reportado en otros ríos neotropicales en donde se evidencia la importancia de la disponibilidad de este recurso para el mantenimiento de las redes alimentarias (Tomanova, et al., 2006; Tamarís-Turizo & Rodríguez-Barrios, 2015; Motta-Díaz, et al., 2016; Ríos-Pulgarín, et al., 2016).
Asimismo, se resalta la variación temporal en la proporción de los GFA conformados por los FR y los CF, que fueron abundantes en la época de lluvias. Es posible que la mayor disponibilidad de recursos alimenticios de MOPG en la época de lluvias debida al material alóctono (hojarasca) proveniente de la vegetación de ribera y el musgo adherido a las rocas, usualmente consumido por organismos FR de la familia Sericostomatidae (Albariño & Valverde, 1998; Carvalho & Graça, 2007), influyera en estos resultados.
La abundancia en época de lluvias de los FR coincide con lo hallado en estudios llevados a cabo en bajas altitudes de la cordillera Central de los Andes y en sistemas insulares colombianos (Rodríguez-Barrios, et al., 2011; Longo & Blanco, 2014; Ríos-Pulgarín, et al., 2016). En contraste, otros trabajos apoyan la hipótesis de escasez general de FR en las corrientes de montaña en los Andes (Jacobsen, 2008; Mesa, 2010; Vimos, et al., 2020) e, incluso, en corrientes de mediana altitud con aportes grandes de MOPG provenientes de la ribera (Jacobsen & Encalada, 1998; Galeano-Rendón & Mancera-Rodríguez, 2018). Esto quiere decir que la abundancia de FR depende no solo de la presencia de bosque de ribera que aporte MOPG, sino también de las condiciones hidráulicas y biológicas (acción de microorganismos, paleatabilidad de las hojas) que permitan que esta hojarasca este disponible para los FR (Graça, et al., 2015).
Además de los FR, los organismos CF de la familia Simuliidae fueron abundantes en la época de lluvias, resultados similares a lo observado en otros estudios (Oliveira & Nessimian, 2010; Tamarís-Turizo & Rodríguez-Barrios, 2015). La capacidad que tiene esta familia de adherirse al sustrato mediante su anillo de ganchos anales (Pavitra, et al., 2019), le permite alimentarse de MOPF o materia orgánica disuelta (MOD) suspendida en la columna de agua por la acción de la turbulencia, característica de los mesohábitas rápidos y de cascadas.
Relación entre los macroinvertebrados y las variables hidráulicas
En general, las métricas de la comunidad no se correlacionaron con las variables hidráulicas. Cierta relación inversa se observó entre la riqueza de Margalef y la profundidad. Esto sugiere que dichas métricias dependen de otras variables del ecosistema (tipo de sustrato), la escala de análisis (mesohábitas), el período de muestreo o la vegetación de ribera (Buss, et al., 2004), aunque Cardona (2012) observó una mayor diversidad y riqueza de taxones de macroinvertebrados a velocidades de 0,3 a 0,4 m s-1 y profundidades de 0,2 a 0,5 m en ríos andinos de montaña.
En cuanto al papel de las variables hidráulicas evaluadas frente a la presencia de algunos géneros de macroinvertebrados, se observó una asociación de Mayobaetis con un mayor ancho del cauce, lo que responde a su capacidad natatoria gracias a los cercos, el filamento caudal y las setas que le ayudan a dezplazarse en zonas con diferente velocidad e, incluso, en áreas de salpicadura de rocas de gran tamaño (Domínguez, et al., 2006). En contraste, el ancho del canal y la velocidad de la corriente presentaron una asociación negativa con la presencia de Ostrácodos, Meridialis y Triplectides. En efecto, los ostrá-codos prefieren para su establecimiento morfologías escalonadas entre los rápidos y las corrientes lentas en donde puedan recolectar alimento de MOPF del fondo (Pennak, 1989). Asimismo, Meridialis prefiere establecerse en piedras de tamaño mediano ubicadas en sitios de velocidades bajas, con el fin de evitar el arrastre por la acción de la corriente (Domínguez, et al., 2006).
Para el caso de Triplectides, se observó la ocupación de casas vacías de la familia Sericostomatidae (Trichopteros) en hábitats de corriente lenta, estructuras que probablemente fueron arrastradas de sitios rápidos o cascadas. Este organismo aprovecha, así, la hidráulica del río para encontrar refugio y alimentación, fenómeno que ya ha sido reportado en pequeños ríos de Brasil, en donde ocupa casas de Neptopsyche y Sericostomatidae y se le ha asociado con mesohábitats del tipo de pozos (Crisci-Bispo, et al., 2004).
Por otra parte, el género Metrichia y la familia Simuliidae se asociaron con valores altos de la profundidad y la velocidad. En el caso del género Metrichia, se observó que la casa (estuche) estaba unida a los filamentos de algas filamentosas y musgo recolectados en rocas de corrientes rápidas, asociación que podría ser una adaptación contra la fuerza de arrastre y la gran erosión características de hábitats con velocidades altas. Estos hallazgos coinciden con lo reportado por Santos, et al. (2016) en ríos de Brasil. En el caso de Simuliidae, los resultados coinciden con lo reportado por Ríos-Touma, et al. (2011) en ríos andinos de montaña, en donde se observó una preferencia por parches con una alta velocidad de flujo, determinada probablemente por rasgos adaptativos específicos que le permiten sujetarse al sustrato mediante su anillo de ganchos anales (Pavitra, et al., 2019), el cual les permite una mayor cantidad de filtración de MOPF (Wotton, 1986; Currie & Adler, 2008; Domínguez & Fernández, 2009). Además, Palmer & Craig (2000) encontraron una variación morfológica en los abanicos de filtración característicos de esta familia según la velocidad: así, en velocidades altas estos órganos son pequeños y fuertes, en tanto que en velocidades bajas son grandes y débiles, pero más complejos. Otro de las características de la familia Simuliidae es la preferencia de profundidades enre los 0,35 m y los 0,45 m; es posible que a estas profundidades (60 % de la profundidad total) el esfuerzo cortante que ejerce la columna de agua sobre el lecho del río cambie propiedades de transporte de los sedimentos e influya en la disponibilidad de MOPF para la filtración (Gore, 1987).
Por otra parte, la familia Sericostomatidae prefirió valores de velocidad mayores a 2 m s-1 y flujos súpercríticos, generalmente con bajas profundidades. Este organismo estaría adaptado a vivir en ambientes extremos de cascada, en donde la presión por la competencia y la depredación es menor y hay una mayor disponibilidad de alimento proveniente de la vegetación de ribera o el musgo adherido a las rocas, ya que, según Albariño & Valverde (1998), el hábito trófico de esta familia es el de FR, principalmente de hojas o macrófitas. En campo se observaron casas de estos Trichopteros adheridas a las superficies de rocas recubiertas de musgo, así como en acumulaciones de la hojarasca atrapada en los intersticios formados por las rocas en las corrientes rápidas.
Conclusiones
En este estudio se evidenció una variación temporal en las condiciones hidráulicas: la época de lluvias se caracterizó por altas velocidades, caudal y flujo supercrítico, y una mayor heterogeneidad y abundancia del tipo de sustratos, especialmente la MOPG. Además, se encontró que la estructura y la función de la comunidad de macroinvertebrados son diferentes en las dos épocas. Se resalta el papel de las variables hidráulicas evaluadas para la presencia de algunos géneros y grupos funcionales de macroinvertebrados. Así, en la época de lluvias la abundancia de organismos FR y CF se relacionó con la presencia de recursos alimenticios de hojarasca, material alóctono proveniente de aguas arriba y del musgo adherido a las rocas. Se encontró una mayor abundancia de la familia Simuliidae en profundidades entre los 0,35 m y los 0,45 m y de la familia Sericostomatidae en velocidades de >2 m s-1 y flujos súpercríticos. Por último, es necesario hacrer más estudios en diferentes tipos de ríos bajo condiciones hidráulicas y usos de suelo diferentes, con el objeto de verificar y ampliar el conocimiento acerca de la influencia de estas variables y otras de mayor escala en la biota acuática.