Introducción
La Caléndula officinalis es una planta reconocida por sus cualidades terapéuticas y diversos usos, la parte de la planta más empleada son los capítulos florales o pétalos. Entre los metabolitos secundarios que se han aislado se encuentran Triterpenos [1]; saponósidos [2]; aceites esenciales [3]; flavonoides, mono y oligosacáridos del quercetol; polisacáridos; carotenoides; esteroles; ácidos fenoles y vitaminas [4].
Numerosas actividades terapéuticas han sido demostradas por distintas investigaciones entre las que se encuentran la acción antiinflamatoria, antioxidante; antimicrobiana; analgésica; inmunoestimulante; antitumoral; entre otras [5,6,7].
En los estudios farmacológicos realizados con extractos o fracciones a partir de las flores de C. officinalis se han detectado las mismas propiedades, los extractos acuosos de las flores de C. officinalis presentan las propiedades farmacológicas siguientes: cicatrizante, antiinflamatorio, antibacteriano y tranquilizante, lo cual hace de ésta una materia prima natural de interés para la industria farmacéutica que se informan en la medicina tradicional. Así tenemos que Fonseca [8] planteó que los extractos etanólicos al 80 % mostraron actividad antibacteriana especialmente contra Staphylococcus aureus y S. fecalis, Efstratius, et al. [9] realizaron estudios en que se demostró la propiedad antiinflamatoria de extractos de Caléndula, Ghaima, et al. [10] demostraron el poder cicatrizante de los extractos de C. officinalis en animales de experimentación y en humanos y Pommier, et al. [11] plantearon el uso de extracto de polifenoles totales, el cual mostró un marcado efecto colagogo en ratas al ser administrado en dosis de 0,05 g/kg/d y también resultó beneficioso en el tratamiento de hepatitis inducida por tetracloruro de carbono.
Ensayos in vivo de un extracto metanólico de la caléndula y de una fracción butanólica han mostrado una acción hipoglucemiante y gastroprotectora. Además, la fracción butanólica de la caléndula, rica en flavoniodes y terpenoides, presenta una importante actividad antioxidante, que podría explicar las propiedades antiinflamatorias, bactericidas y antisépticas de este extracto [12].
Otros ensayos en los que se estudia su acción antiinflamatoria son los estudios a doble ciego realizados en niños que presentan otalgias asociadas a otitis medias, en los que se ha comparado el tratamiento con gotas de un producto compuesto de extractos de varias plantas (Caléndula Officinalis, Allium Sativum, Verbascum Thapsus, Lavender, Hypericum Perforatum) con anestésicos en gotas convencionales con o sin amoxicilina. El porcentaje de reducción del dolor en el grupo tratado sólo con el extracto es mayor que los grupos tratados con antibióticos y/o anestésicos
Friedman [13] ha estudiado la actividad bactericida de aceites esenciales derivados de caléndula contra Campylobacter jejuni, Escherichia coli, Listeria monocytogenes y Salmonella entérica observando que el aceite de caléndula ha mostrado una potente actividad anti-VIH in vitro sobre la transcripción del virus [14]. Un estudio muestra una acción antiedematosa de triterpenos derivados de la caléndula.
Materiales y métodos
Para la obtención de los extractos se utilizaron capítulos florales de Caléndula provistos por la empresa Diet Natural los que se enviaron al Instituto de Botánica del Nordeste, para su identificación. Las flores fueron reducidas a polvo y se eligieron tres solventes para la obtención de los extractos por el método de maceración simple por 24 h en agitación permanente. Se mezcló 10 g del polvo de flores con 100 mL de alcohol 96º para el extracto alcohólico (EAC), con 100 mL de metanol para el extracto metanólicos (EMC) y con 100 mL de una mezcla hidroalcóholica (EHAC) de 70/30 de alcohol 96º y agua destilada para el extracto hidroalcóholico [15] los que luego fueron filtrados. Los residuos obtenidos de la filtración fueron colocados en estufa a 37 ºC hasta su desecación completa y fueron pesados para su determinar residuos secos y peso seco. Para el rendimiento, los extractos fueron trasvasados cuantitativamente a un matraz aforado de 100 mL y se llevaron a volumen con el solvente de extracción. Se tomaron 50 mL y se colocaron en un balón de destilación previamente pesado, se evaporaron hasta sequedad y se pesaron para obtener el rendimiento. El volumen restante se colocó en frasco color caramelo, con tapa y con capacidad adecuada, protegido de la luz y refrigerado entre 4 a 10 ºC para evitar la evaporación del solvente hasta las determinaciones posteriores.
Las características organolépticas de los extractos se basaron en pruebas sensoriales descriptivas [16], las cuales fueron realizadas por 5 personas con cierto adiestramiento que calificaron los atributos plasmados en una planilla. Para el olor se utilizó una escala de percepciones olfativas utilizando los siguientes ítems: 1= Característico: pétalos de Caléndula officinalis, 2= Levemente modificada: Levemente a pétalos de Caléndula officinalis y 3= Modificada: olor al solvente extractivo. La determinación del color se realizó en base a una escala propia de colores ámbar a partir de parámetros establecidos en una escala tonal según intensidad en orden creciente: 1= ámbar claro translúcido, 2= ámbar claro más opaco, 3= ámbar con tintes amarillo verdoso, 4= ámbar con tintes rojizos y 5= ámbar oscuro. El sabor se basó en la siguiente escala de percepción: 1= dulce, 2= amargo, 3= picante y 4= insípido.
La actividad antioxidante de los extractos se midió mediante el índice de oxidación donde se tomaron 2 mL de los extractos y se mezclaron con 48 mL de agua destilada. A un tubo de ensayo, previamente tratado con una mezcla sulfocrómica, se agregaron 0,5 mL del diluído de los extractos, 0,5 mL de agua destilada y 1 mL de ácido sulfúrico al 20 %. El tubo se sometió a refrigeración en baño de hielo a 18 - 20 °C, luego se adicionaron 50 μL de una solución de KMn4O1N, estandarizada para oxalato de sodio. A continuación, se puso en marcha un cronómetro, que permitió estimar el tiempo en el cual la solución ácida de permanganato se reduce a iones manganeso (Mn2+), lo cual se evidencia por la desaparición de color, la prueba se realizó por triplicado.
Para la determinación de los compuestos fenólicos se utilizó el método de Folin-Cicoalteu [17], con ácido gálico para la curva de calibración, y los resultados fueron expresados como mg de ácido gálico por g de Caléndula.
Para la medición del pH de los extractos se utilizó un pHmetro digital, a partir de la mezcla de 1 g del extracto blando en 10 mL de agua destilada, puesto a agitación continua hasta su completa disolución. Se sumergió el electrodo en la disolución teniendo precaución de que no roce con las paredes ni con el fondo del recipiente, se mantuvo durante 5 min para obtener la lectura y se obtuvo el valor por triplicado.
En el análisis cromatográfico en placa de sílica gel 60 F254 Merck, se usó para la separación de los compuestos dos sistemas de corrida, en la primera se utilizó como fase móvil una mezcla de solventes constituida por acetato de etilo: ácido fórmico: ácido glacial acético: agua destilada (100:11:11:26) y la segunda con cloroformo: ácido glacial acético: metanol: agua destilada (60:32:12:8). Las placas se sembraron con 5 μL de los extractos y se colocaron en la cámara de corrida. Los componentes separados se visualizaron bajo luz UV 365 nM, lámpara UV modelo Sl-58Mineralight Lamp 20 y se revelaron con Vainillina sulfúrica. Como sistema de referencia se utilizó para el primer sistema 1 = Rutin (Rf ˜ 0,4), Acido clorgénico (Rf ˜ 0,5), Hyperosido (Rf ˜ 0,6) y el segundo sistema narcisina [18].
En la marcha fitoquímica para la determinación de metabolitos secundarios se utilizó el Test de Dragendorf para alcaloides, la reacción con FeCL3 para fenoles, la reacción de Libermann-Burchard para determinar esteroides o tripertenos, reacción de Shinoda para flavonoides, Nihidrina 0,1 % en solución alcohólica para aminoácidos, el reactivo de Raymond - Marthoud para glucosidos cardiotónicos, el reactivo de Borntrӓger para antraquinonas y la reacción con gelatina NaCl para taninos.
Resultados
Los resultados de la caracterización organoléptica de los extractos de Caléndula officinalis con los diferentes solventes utilizados, entre ellos metanol, alcohol y mezclas hidroalcohólicas, se exponen el Tabla 1, donde también se encuentran los resultados de residuos secos, rendimiento, índice de oxidación, compuestos fenólicos y pH, observándose mayor extracción en el extracto metanólico (86 ml). El análisis sensorial permitió identificar las características organolépticas, respecto al aroma, en el extracto metanólicos hubo un predominio modificado al solvente percibido por 3 de los participantes, en el extracto alcohólico la opción elegida por todos los participantes fue de intensamente modificada, mientras que el extracto hidroalcohólico se presentó con características propias de las flores de caléndula. El sabor fue identificado en todas las muestras como amargo. En cuanto al color de los extractos, los resultados dan un color ámbar translúcido para el extracto alcohólico, ámbar con tintes amarillo verdoso para el extracto metanólicos y ámbar claro opaco para el extracto hidroalcohólico que se muestra en Figura 1. En la determinación de la actividad antioxidante por el índice de oxidación se pudo establecer diferencias mínimas en cuanto al tiempo cronometrado, evidenciando una capacidad oxidativa similar en los extractos. Los resultados de la cantidad total de polifenoles, donde los resultados muestran una mayor concentración de bioactivos son el EMC, seguido del EHAC y finalmente el EAC. El pH de las muestras estuvo en el rango ácido en todos los extractos. El valor obtenido para el EMC fue de 4 ± 0,29, para el EAC 4,30 ± 0,22 y en el caso del EHAC fue de 3,96 ± 0,16.
Tabla 1 Caracteres organolépticos de los extractos de Caléndula Officinalis: color, olor, sabor, rendimiento [%], índice de oxidación [seg.], compuestos fenólicos [mg/g] y pH. Los resultados representan de media de tres determinaciones y desvió estándar.
| Características organolépticas | Extracto alcohólico de Caléndula | Extracto Hidroalcohólico de Caléndula | Extracto Metanólico |
|---|---|---|---|
| Color | Ámbar claro translúcido | Ámbar claro opaco | Ámbar claro con tintes verdosos |
| Olor | Levemente modificada | Característico a flores de Caléndula | Intensamente modificada |
| Sabor | Amargo | Amargo | Amargo |
| Rendimiento [% ] | 76 | 67 | 70 |
| Índice de Oxidación [seg] | 29,33 ± 1,53 | 30,67 ± 1,53 | 33 ± 2,52 |
| Compuestos fenólicos [mg/g] | 18 ± 0,3 | 25 ± 0,2 | 27 ± 0,5 |
| pH | 4,30 ± 0,22 | 3,96 ± 0,16. | 4 ± 0,29 |

Figura 1 Color de los extractos en las muestras analizadas. 1. Extracto alcohólico de Caléndula (EAC) 2. Extracto metanólico de Caléndula (EMC) 3. Extracto hidroalcohólico de Caléndula (EHAC).
En la Figura 2 y 3 se observa el análisis fitoquímico realizado con placas de TLC para los EMC, EAC y EHAC. La separación de los componentes presentes en los extractos fue adecuada en los dos sistemas de corrida, observándose una serie de compuestos con diferentes polaridades, las bandas más intensas fueron encontradas en las zonas más apolares de la corrida. Teniendo en cuenta el sistema de referencias utilizado en el sistema 1 se observa la presencia de rutina (Rf ̃0,4) en los tres extractos, observándose una banda intensa en el extracto hidroalcohólico. Para el ácido clorogénico (Rf ̃0,5) se encuentran en los tres extractos y para el Hyperósido (Rf˜ 0,6) se encuentra en los tres extractos con una coloración más débil en las bandas. Para el segundo sistema de corrida se utilizó referencia la narcisina (Rf˜ 0,4) observándose en los tres extractos con una coloración intensa en todas las bandas. Resumen de metabolitos identificado en la Tabla 2.
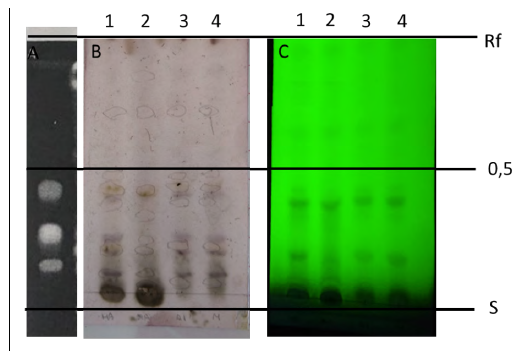
Figura 2 Cromatografía en placa fina de los extractos analizados. Solvente de corrida: acetato de etilo: ácido fórmico: ácido glacial acético: agua (100:11:11:206). Los compuestos separados visualizados con UV 365 nM, revelados con vainillina sulfúrica y sistema de referencia de Rƒ para rutina, ácido clorogénico e hiperóxido. A. Sistema de referencia. B. Placa revelado con vainillina sulfúrica C. Visualización con UV. Los números indican el tipo de extracto 1. EHAC (70/30) 2. EHAC (50/50) 3. EAC 4. EMC.

Figura 3 Cromatografía en placa fina de los extractos analizados. Solvente de corrida: cloroformo: ácido glacial acético: metanol: agua (60:32:12:8). Los compuestos separados visualizados con UV 365 nM, revelados con vainillina sulfúrica y sistema de referencia de Rƒ para narcisina A. Sistema de referencia. B. Placa revelado con vainillina sulfúrica C. Visualización con UV. Los números indican el tipo de extracto 1. EHAC (70/30) 2. EHAC (50/50) 3. EAC 4. EMC.
Tabla 2 Identificación de estándares con sus respectivos Rƒ coincidentes con el valor de los Rƒ de los compuestos presente en los tres extractos y la valoración cualitativa de la intensidad de la banda expresado en +.
| Fitoquímica | Rutina | Ac. clorogénico | Hyperósido | Narcisina |
|---|---|---|---|---|
| Rƒ | 0,4 | 0,5 | 0,6 | 0,4 |
| Alcohólico | ++ | ++ | + | +++ |
| Metanólico | +++ | +++ | + | +++ |
| Hidroalcohólico | +++ | ++ | ++ | +++ |
La presencia de metabolitos secundarios evidenciados a través de la marcha fitoquímica se expresa en la Tabla 3 junto a su valoración cualitativa de cantidad presente.
Tabla 3 Marcha Fitoquímica obtenida por reacción con diferentes reactivos para metabolitos secundarios presente en los extractos. Calificación cualitativa con relación a la intensidad de coloración expresada en +.
| Compuesto analizado | Metanólico | Alcohólico | Hidroalcohólico |
|---|---|---|---|
| Flavonoides | ++ | ++ | +++ |
| Tanino | + | - | - |
| Esteroides y Triterpenos | dudoso | - | - |
| Antraquinonas | + | + | + |
| Alcaloides | + | + | ++ |
| Glucósidos Cardiotónicos | + | + | + |
| Fenoles | +++ | ++ | +++ |
| Aminoácidos | + | + | + |
Discusión
La caracterización organoléptica y fitoquímica de los extractos de Caléndula Officinalis fueron analizados en este trabajo utilizando diferentes solventes, entre ellos metanol, alcohol y mezclas hidroalcohólicas. En cuanto a la coloración se mostraron dentro de la gama de los tonos ámbar: ámbar translúcido para el extracto alcohólico, ámbar claro con tintes verdosos para el metanólico y ámbar claro opaco para el hidroalcohólico. El olor fue levemente modificado al solvente para el extracto alcohólico, intensamente modificado para el metanólico y característico a flores de caléndula para el hidroalcohólico. El sabor se mantuvo amargo en los tres extractos. Didem Sahingil [19] determinó la presencia de compuestos volátiles en las flores de caléndula al que le atribuye el olor característico de los extractos. Mora Anchatuña [20] presentó un trabajo que determinó algunos parámetros para los extractos hidroalcohólicos de caléndula, estableciendo el color como amarillo transparente, el olor propio a la hierba de caléndula y pH de 6,3; además del tamizaje fitoquímico siendo positivo para alcaloides, flavonoides y taninos y negativo para cumarinas, glúcidos y saponinas. Los valores del rendimiento encontrado fueron superiores al 50 % en todas las muestras, mostrando un mayor rendimiento el extracto alcohólico. Los atributos que se encuentran compartidos en estos trabajos evalúan una relación con el contenido de bioactivos presente en los extractos.
El comportamiento oxidativo de los extractos mostró características típicas de presencia de compuestos antioxidantes en los extractos con tiempos cronometrados ideales para cada una de las muestras. Se recurre usualmente a la determinación de polifenoles por el método de Folin Ciocalteu para evaluar la cantidad de este metabolito en los extractos, en este trabajo la mayor extracción se vió en el hidroalcohólico, datos se ponen de manifiesto en otros estudios como el de Bragueto Escher [21] que comparó diferentes extractos y mostró que el extracto hidroalcohólico (50:50 v/v) presentó el mayor contenido fenólico total, flavonoides y actividad antioxidante. El mayor contenido de fenoles totales expresados en mg de ácido gálico/mL, correspondió al extracto hidralcohólico (5,98 mg) [16]. En otras formulaciones [22] realizadas con extractos de CO a.un pH por debajo de 5,5, coincidiendo con el pH de la materia prima empleada para la elaboración de las jaleas que va de 4,5 a 5,5, en todos los casos este valor de pH ligeramente ácido es debido a la presencia de saponinas triterpénicas, flavonoides, ácidos fenólicos, taninos y otros, que por sus características estructurales aportan acidez a la formulación.
El perfil cromatográfico permite diferenciar en forma rápida el perfil fitoquímico de los extractos y son de gran utilidad para la caracterización cualitativa de las muestras, en este trabajo la utilización de dos cámaras de corrida permitieron visualizar una gran variedad de compuestos presentes en toda la corrida de la placa y la comparación de patrones de rutina, hyperósido ácido clorogénico y narcisina fueron positivos en los extractos evaluado. La presencia de estos metabolitos, en su mayoría fenoles y flavonoides, podrían ser utilizados para la terapéutica farmacológica, sin embargo, el mayor inconveniente es la variabilidad en su composición química y esto repercute en su actividad biológica que está en estrecha relación con la cuantificación de los mismos dentro del extracto.
La caracterización fitoquímica de metabolitos secundarios presentes en los extractos evidenció una gran variabilidad de compuestos, encontrando esteroides, flavonoides, fenoles y alcaloides, entre otros [23]. Estos metabolitos coinciden con lo reportado en otros trabajos realizados que muestran la presencia de metabolitos secundarios en extractos hidroalcohólicos de caléndula obteniendo valores positivos a flavonoides, saponinas, taninos, cumarinas, triterpenos, alcaloides y quinonas [24].
Fitoquímicos también importantes fueron reportados [25] y han revelado la presencia de diferentes compuestos químicos que incluyen carbohidratos, aminoácidos, lípidos, carotenoides, terpenoides, flavonoides, aceite volátil, quininas, cumarinas y otros componentes. Estudios realizados en la India [26] , reportaron diferentes compuestos fitoquímicos: caroteno, pigmentos, alcoholes triterpénicos libres y esterificados y ácidos grasos poliinsaturados, como el ácido caléndico, glucósidos de calendulina y ácido oleanólico, α- y βamirina, calenduladiol, coflodiol y manilladiol, y concluyeron que la cantidad y calidad de los compuestos encontrados varían con el suelo composición, madurez de la planta y tiempo de recolección. Otros compuestos en el extracto incluyen proteínas, aminoácidos, hidrocarburos saturados [27,28], vitamina C [29] y sustancias minerales [30]. Además, se reportó presencia de flavonoides principalmente isorhamnetina y quercetina. Las flores contienen compuestos de flavonol farmacológicamente activos como flavoxantina, luteoxantina, licopeno, auroxantina, luteína, β-caroteno, etc. [31], el análisis de extracto hidroalcohólico [32] demuestra la conformación de una mezcla de compuestos presentes en los extractos como biocompuestos activos, se evidencia la presencia de taninos, carotenoides y compuestos fenólicos, entre otros. En otros estudios se expresaron valores cuali y cuantitativos de fenoles totales y flavonoides, revelando la presencia de un contenido de 9,65 a 11,31 mg AG/0,1 g y 1,51 a 2,17 mg Q/0,1 g de fenoles y flavonoides, respectivamente [33].
Conclusiones
Los extractos obtenidos por maceración simple de capítulos florales de Caléndula officinalis utilizados en este trabajo permitieron establecer la presencia de fitometabolitos mediante un análisis cualitativo fitoquímico, donde fueron identificados flavonoides, taninos, triterpenos, alcaloides, carotenoides y fenoles.
La caracterización organoléptica permitió interpretar los resultados obtenidos en cada extracto, dejando al extracto metanólico con mejor performance en cuanto a su contenido de fenoles, bioactivo relacionado con la actividad antioxidante, coincidiendo dicho resultado con la mejor respuesta en el índice de oxidación.
En cuanto a las placas de TLC, las fórmulas de corrida fueron eficaces para la separación de los compuestos, la identificación de fenoles con patrones de ácido clorogénico (Rf 0,5) se encontraron en los 3 extractos así como el patrón Hyperósido (Rf ˜ 0,6) para la identificación de flavoniodes.














