INTRODUCCIÓN
Las emergencias hipertensivas se definen como las elevaciones severas de la presión arterial (PA), mayores a 180/120 mmHg y acompañadas de daño en órgano blanco o empeoramiento de este si ya existía 1.
Según la Carga Global de Enfermedad 1990-2015, el número de individuos con presión sistólica mayor o igual a 140 mm Hg aumentó de 442 millones (95 % intervalos de incertidumbre {UI} = 437-447 millones) en 1990 a 874 millones (95 % UI = 864-884 millones) en el 2015, con un número asociado de muertes en el 2015 de 7,8 millones (95 % UI = 7,0-8,7 millones) y de 143 millones de DALYs (95 % UI = 130,2-157,0) 2.
Aproximadamente, 1 % a 2 % de los pacientes con hipertensión arterial tendrán una emergencia hipertensiva en algún momento de su vida. La frecuencia de hospitalización por esta causa aumentó en los Estados Unidos de 101/100.000 en el año 2000 a 111/100.000 en el 2007 con un incremento promedio de 1,11 %. La mortalidad intra-hospitalaria por cualquier causa descendió del 2,8 % al 2,6 % (odds ratio {OR} = 91, 95 % IC = 0,86-0,96) 3.
El espectro de la diana neurológica en la emergencia hipertensiva incluye ataque cerebrovascular (ACV) isquémico o hemorrágico, hemorragia subaracnoidea aneuris-mática (HSAa), encefalopatía hipertensiva y síndrome de encefalopatía posterior reversible, causantes de una significativa morbimortalidad 4.
Durante el año 2008 en el servicio de urgencias de 1’Hôtel-Dieu de París las crisis hipertensivas fueron responsables del 3,6 % de los motivos de consulta y de ellos un 8 % correspondieron a emergencias hipertensivas ("varies urgences hypertensives") 5.
En una unidad de cuidado intensivo de la India se encontró una prevalencia de 1,22 % (50/4076 admisiones). De estos, 16 pacientes tuvieron órgano blanco cerebro: 7 (14 %) ACV isquémico, 5 (10 %) ACV hemorrágico, 2 (4 %) ataque isquémico transitorio y 2 (4 %) encefalopatía hipertensiva. De estos 50 pacientes, 6 (12 %) tuvieron compromiso de un solo órgano, 28 (56 %) dos órganos y 16 (32 %) en más de dos 6.
Un estudio llevado a cabo en Medellín, Colombia, durante los años 2014 y 2015 en una institución de alta complejidad encontró 156 pacientes con crisis hipertensiva, de los cuales el 22,4 % fue emergencia y un 77,6 % urgencia. De los casos de emergencia hipertensiva, la principal afectación de órgano blanco fue el ataque cerebrovascular isquémico, en 31,4 %, con una mortalidad del 11,4 % 7.
Las manifestaciones de disfunción neurológica en el marco de una emergencia hipertensiva establecen un reto diagnóstico para el médico, en el cual las imágenes por resonancia magnética (IRM) constituyen una herramienta valiosa 8 y son la clave de un óptimo tratamiento para mejorar el pronóstico del paciente.
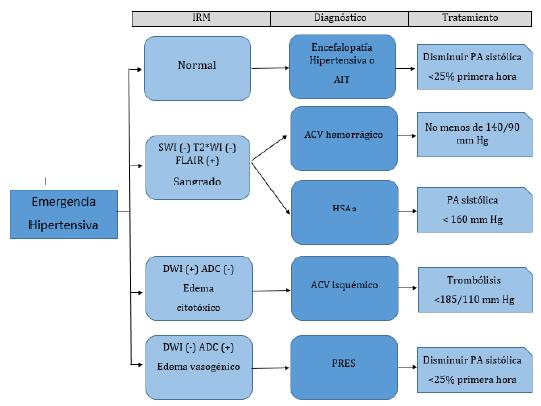
En este artículo se revisan los diferentes escenarios de emergencia hipertensiva neurológica y se propone una aproximación diagnóstica basada en imágenes por resonancia magnética y se revisan las guías de manejo para cada una de ellas.
CARACTERÍSTICAS EN IRM DE LAS LESIONES CEREBRALES EN LAS EMERGENCIAS HIPERTENSIVAS
Las IRM de cerebro nos permiten diferenciar lesiones isquémicas agudas de las antiguas, el edema citotóxico del vasogénico y la presencia de sangre o sus derivados.
En las imágenes por FLAIR (Fluid Attenuated Inversion Recovery) las lesiones parenquimatosas brillan y su aparición en eventos isquémicas tiene lugar más allá de las 4,5 horas 9.
El edema citotóxico en IRM brilla o es hiperintenso en las secuencias de difusión (DWI) y es oscuro o hipointenso en los mapas de coeficiente de difusión aparente (ADC). El vasogénico es hipo o ligeramente hiperintenso en las imágenes en DWI, pero brilla en los mapas ADC 10 (figuras 1 y 2).
Fuente autor.
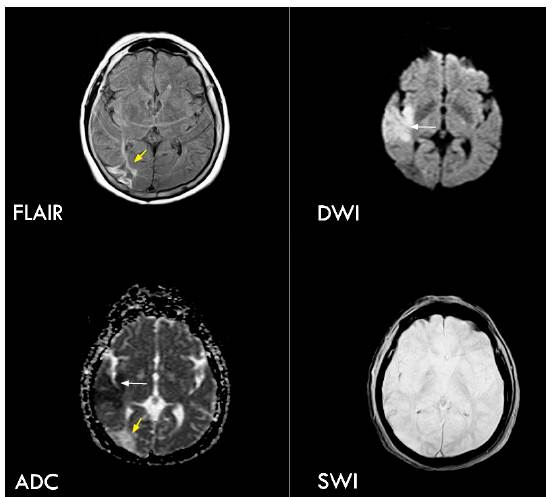
Figura 1 Paciente con ACV isquémico agudo de la arteria cerebral media derecha. Se observa hiperintensidad en las secuencias de DWI (flecha blanca), hipointensidad en los mapas ADC (flecha blanca), sin alteraciones en FLAIR ni evidencia de sangrado en las imágenes de susceptibilidad (SWI). Se observa además infarto antiguo hemodinámico (flecha amarilla).
Fuente autor.
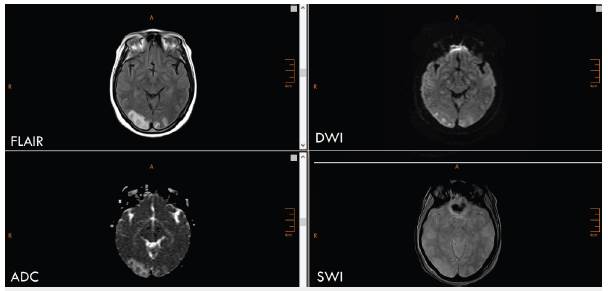
Figura 2 Paciente con diagnóstico de síndrome de encefalopatía posterior reversible. Se aprecia hiperintensidad occipital bilateral de predominio derecho (FLAIR), densidad mixta en las DWI, hiperintensidad en los mapas ADC sin trasformación hemorrágica (SWI).
Las secuencias más comúnmente usadas para la detección de hemorragia son las de gradiente eco (GRE), las T2*WI o las imágenes de susceptibilidad (SWI) donde se aprecia hipointensidad 11.
CLASE DE RECOMENDACIÓN Y NIVEL DE EVIDENCIA
La clase de recomendación (COR) indica la fuerza de esta, abarca la magnitud estimada y la certeza del beneficio en proporción al riesgo. El nivel de evidencia (LOE) califica la calidad de la evidencia científica que soporta la intervención con base en el tipo, la cantidad y la consistencia de los datos de ensayos clínicos y otras fuentes 1 (tablas 1-6).
Tabla 1 Recomendaciones para el manejo de la hipertensión en encefalopatía hipertensiva 1

COR: Clase de recomendación. LOE: nivel de evidencia. NR: Nonrandomized. EO: Expert Opinion.
ENCEFALOPATÍA HIPERTENSIVA
La encefalopatía hipertensiva es una emergencia hipertensiva caracterizada por disfunción neurológica aguda en el marco de un incremento agudo y severo de la presión arterial (típicamente mayor de 180 mm Hg presión sistólica, mayor a 120 mm Hg presión diastólica). Clínicamente hay compromiso del sensorio, confusión, crisis epilépticas y alteraciones visuales. La cefalea por sí sola no avala el diagnóstico de emergencia hipertensiva 12. El término encefalopatía se refiere a disfunción cortical cerebral difusa sin evidencia clínica ni imagenológica de focalización. No hay hallazgos agudos relevantes en las IRM.
En la tabla 1 se presenta el tratamiento de la encefalopatía hipertensiva ajustado a las guías de práctica clínica 2017 para hipertensión arterial en adultos 1 .
La elección del antihipertensivo en la encefalopatía hipertensiva se basa en la farmacología del medicamento, los factores fisiopatológicos de base en la hipertensión del paciente, la severidad de la encefalopatía, la rapidez del decremento de la presión arterial y las comorbilidades presentes 1. No existe evidencia que avale un fármaco o clase de ellos sobre otro en el tratamiento de la emergencia hipertensiva 13; los recomendados son el labetalol y la nicardipina (tabla 2). No se aconseja el uso del nitroprusiato de sodio por el riesgo de aumento en el edema cerebral y la toxicidad por cianuro 6,14.
ATAQUE CEREBROVASCULAR ISQUÉMICO AGUDO
Aproximadamente el 25 % de los pacientes con ACV isquémico agudo presenta PA sistólica por debajo de 140 mm Hg a su ingreso al servicio de urgencias, 60 % entre 140 y 184 mm Hg y solo un 15 % por encima de 185 mm Hg 15. Sin embargo, la historia natural de la enfermedad se caracteriza por un descenso espontáneo de la PA durante la primera semana 5.
Los pacientes con sospecha de ACV isquémico en ventana terapéutica, es decir, menos de 4,5 horas, pueden ser elegibles para terapia de reperfusión inmediata con fibrinolítico (rTPA) y tratamiento endovascular (obstrucción vaso proximal), siempre y cuando su presión arterial no esté por encima de 185/110 mm Hg, escenario en el cual la prioridad es iniciar tratamiento antihipertensivo y así lograr dicha meta establecida por las guías 1,16 (tabla 3).
Tabla 3 Recomendaciones para el manejo de la hipertensión en ACV isquémico agudo 1
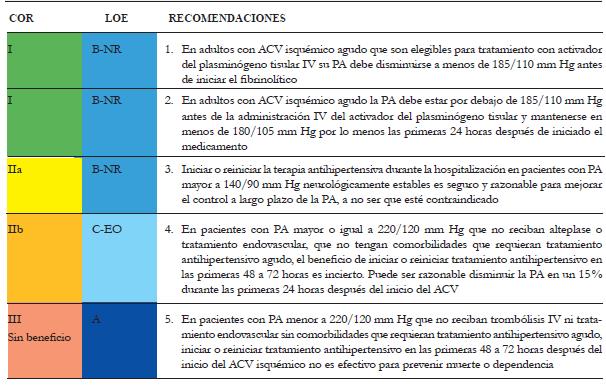
PA: presión arterial. COR: clase de recomendación. LOE: nivel de evidencia. NR: Nonrandomized. EO: Expert Opinion
La organización en la atención prehospitalaria y en los servicios de urgencias ha logrado incrementar el porcentaje de pacientes con ACV isquémico agudo tratados con trombólisis IV de un 4,7 % a un 21,4 % 17.
La PA debe ser tomada cada 15 minutos las primeras dos horas desde el inicio del alteplase, cada 30 minutos las siguientes seis horas y luego cada hora por 16 horas 16.
En las IRM se observa edema citotóxico en la fase aguda con hiperintensidad en la DWI, hipointensidad correspondiente en los mapas ADC e hiperintensidad en ELAIR a partir de aproximadamente 4,5 horas 18 (figura 1).
El labetalol y la nicardipina IV son los fármacos más recomendados para el manejo de la PA en ACV isquémico agudo. Pueden considerarse otros agentes como la nitroglicerina, la hidralazina, el urapidil, el enalaprilat o la clevidipina, aunque muchos de ellos no están disponibles en Colombia) 5,14,19,20 (tabla 4).
Tabla 4 Manejo hipertensión en ACV isquémico agudo 15

PA: presión arterial. COR: clase de recomendación. LOE: nivel de evidencia. EO: Expert Opinion.
*No se recomienda una dosis mayor a 2 mg/mín. de labetalol. N del A.
El estudio Enchanted encontró que el decremento intensivo de la PA, con cifras sistólicas diana de 130-140 mm Hg en una hora, comparadas con el manejo convencional por guías con cifras sistólicas menores a 180 mm Hg durante las primeras seis horas posteriores al inicio de un ACV isquémico leve o moderado y tratados con alteplase, era seguro y disminuía la frecuencia de hemorragia intracraneana, pero sin mejorar los desenlaces clínicos 21.
HEMORRAGIA INTRACRANEAL (HIC)
El 75 % de los pacientes con ACV hemorrágico ingresa al servicio de urgencias con cifras de PA sistólica superiores a 140 mm Hg, 20 % entre 185 y 219 mm Hg y 1-2 % mayor a 220 mm Hg 15. La incidencia de ACV hemorrágico para población hispana es de 19,6 (15,7 - 24,5) por 100.000 personas por año, la mortalidad al mes de 40,4 % (rango 13,1 - 61,0) y solo 12-39 % al año tendrán una puntuación igual o menor a 3 en la escala modificada de Rankin (mRS) 22.
Al igual que el ACV isquémico, la mortalidad temprana al mes y tardía al año describe una forma de U con mayores índices para cifras menores a 120/61 mm Hg y mayores a 220/120 mm Hg 23.
Puede haber expansión del hematoma hasta en un 30 % de los casos y se asocia a peor pronóstico y mortalidad 24. El control intensivo de la PA de manera temprana durante la primera hora logra reducir este crecimiento 25.
El manejo de la PA en ACV hemorrágico es controversial. Asimismo, el área de penumbra isquémica perihematoma es una preocupación permanente. En el estudio ADAPT el flujo sanguíneo cerebral perihematoma no se afectó en pacientes cuyas cifras de PA descendieron a menos de 150 mm Hg con relación a aquellos con cifras menores a 180 mm Hg 26.
Una revisión sistemática y metanálisis comparó el manejo estándar con el intensivo para el descenso de la PA en hemorragia intracerebral espontánea con desenlaces primarios a los 90 días de mortalidad y discapacidad, desenlaces secundarios de deterioro neurológico en las primeras 24 horas, expansión significativa del hematoma entre 24 y 72 horas y eventos adversos serios no fatales a los 90 días, sin que se encuentren diferencias entre los dos grupos en mortalidad, discapacidad y combinación de muerte con discapacidad. De igual manera, el deterioro neurológico temprano, la expansión del hematoma y los eventos adversos serios no fatales fueron similares en los dos grupos 27. Sin embargo, aunque no alcanzó la significancia estadística, se observó una tendencia a un mejor desenlace funcional a los 90 días y un menor crecimiento del hematoma en las primeras 24 para los pacientes en el brazo del tratamiento intensivo, hallazgos que fueron relevantes en el estudio Interact 2 28. Por otra parte, en el estudio Atach-2, en el que únicamente se utilizó la nicardipina, los descensos mayores a 140 mm Hg en la PA sistólica en el brazo de tratamiento intensivo mostraron una mayor incidencia de eventos adversos renales en los primeros siete días 29 (tabla 5).
Tabla 5 Recomendaciones para el manejo de la hipertensión en hemorragia intracerebral (HIC) aguda 1

PA: presión arterial. COR: clase de recomendación. LOE: nivel de evidencia. EO: Expert Opinion.
Las IRM de cerebro tienen buena sensibilidad para la detección de hemorragia intracerebral aguda, especialmente para la detección de microhemorragias y sangrados antiguos. Las imágenes en FLAIR permiten evaluar la extensión del hematoma así como las lesiones adyacentes. Las DWI permiten evaluar isquemia perihematoma y la posible transformación hemorrágica de un ACV isquémico. Las SWI, GRE o T2*WI aparecen hipointensas y permiten ver además con mayor sensibilidad microsangrados (lesiones menores a 10 mm) separadas del hematoma principal 30. La prevalencia de microsangrados en estudios basados en población es alta y aumenta con la edad: de 17,8 % en pacientes entre 60 y 69 años a 38,3 % en mayores de 80 años 31.
SÍNDROME DE ENCEFALOPATÍA POSTERIOR REVERSIBLE
El síndrome de encefalopatía posterior reversible fue descrito por Hinchey y colaboradores en 1996 32 como un síndrome clínico reversible en pacientes agudamente enfermos con cefalea, alteración del sensorio, convulsiones y pérdida visual con evidencia en imágenes diagnósticas de leucoencefalopatía posterior también reversibles. La descripción original contó con 15 pacientes, de los cuales siete tenían PA sistólica igual o superior a 180 mm Hg y tres de ellos PA normal. Posteriormente, y debido al compromiso también cortical cerebral del edema, se modificó el término por el de síndrome de encefalopatía posterior reversible 33.
El síndrome de encefalopatía posterior reversible se refiere a un desorden de edema cerebral vasogénico reversible en pacientes con síntomas neurológicos agudos, en el contexto de falla renal, fluctuaciones en la PA, medicamentos citotóxicos, enfermedades autoinmunes y preeclampsia o eclampsia. Las imágenes cerebrales suelen revelar edema vasogénico subcortical de predominio en regiones parieto occipitales bilaterales, pero puede aparecer en otras localizaciones e incluso como hemorragias o restricción en la difusión 34,35 (figura 2). El edema vasogénico es secundario a lesión endotelial por cambios abruptos en la PA o efecto tóxico de citocinas que llevan a una disrupción en la barrera hematoencefálica (BHE) 34.
Los principales predictores clínicos de aparición para el síndrome de encefalopatía posterior reversible son crisis epilépticas (OR 7,48 {3,48-16,06} p < 0,0001), compromiso del sensorio (OR 3,40 {1,64-7,02} p 0,0010), déficit neurológicos focales (OR 1,60 {0,78-3,29} p 0,2001), cefalalgia (OR 0,70 {0,33-1,46} p 0,3369), alteraciones visuales (OR 1,37 {0,65-2,88} p 0,4149). Y los principales factores de riesgo son hipertensión (OR 4,68 {1,86-11,76} p 0,0010), quimioterapia (2,66 {1,20-5,90} p 0,0163), falla renal (OR 2,09 {1,02-4,26} p 0,0435), inmunosupresión (OR 0,56 {0,26-1,20} p 0,1329) y enfermedad autoinmune (OR 1,22 {0,46-3,23} p 0,6841) 36.
En un 90 % de los casos el cuadro clínico imagenológico del síndrome de encefalopatía posterior reversible es "típico" 8. La emergencia hipertensiva requiere reducción inmediata de la PA, mas no su normalización. Las últimas guías de práctica clínica para hipertensión en adultos no tratan específicamente el síndrome de encefalopatía posterior reversible 1, ni se dispone de ensayos clínicos para ello, por lo que el tratamiento de la hipertensión arterial se dicta por consenso 37. Los estudios no han medido el efecto del control de la PA en la resolución del síndrome de encefalopatía posterior reversible y un 15-20 % de los pacientes son normo o hipotensos 34. Los medicamentos antihipertensivos no han sido estudiados formalmente para el síndrome de encefalopatía posterior reversible y su elección queda a discreción del médico tratante. La PA sistólica no debe reducirse más allá del 25 % durante la primera hora cuadro 1, a 160/100 mm Hg durante las siguientes dos a seis horas y de manera cuidadosa a cifras normales en las siguientes 24 a 48 horas 1. Como toda emergencia hipertensiva, el paciente debe ser tratado en terapia intensiva para la monitorización de PA y evolución neurológica, la infusión continua de antihipertensivo y evitar fluctuaciones pronunciadas en la PA. Otros aspectos en el tratamiento del PRES, como antiepilépticos y la suspensión o no de los inmunosupresores o citotóxicos, están más allá del objetivo de este artículo.
HEMORRAGIA SUBARACNOIDEA ANEURISMÁTICA (HSAA)
La HSA no traumática comprende el 3 % de todos los tipos de ACV. En un 85 % de los casos es secundaria a ruptura de aneurisma intracraneal (HSAa) 38. En las últimas dos décadas la mortalidad por HSAa ha disminuido significativamente debido a un mejor tratamiento hospitalario 39,40, pero la tasa de mortalidad prehospitalaria y a los 30 días continúa siendo alta (15 y 35 %, respectivamente) 38.
El 60 % de los pacientes con HSAa a su llegada a urgencias tiene PA sistólica entre 140 y 184 mm Hg y un 40 % entre 185 y 219 mm Hg 15. No se ha establecido la magnitud en el control de la PA para reducir el riesgo de resangrado, pero es razonable un descenso de la PA sistólica por debajo de 160 mm Hg 41 (tabla 6).
Las IRM son tan sensibles como la tomografía computarizada (TC) de cerebro en la detección temprana de la HSAa, pero en las primeras seis horas las IRM pueden ser ligeramente superiores a la TC 38. Las imágenes en ELAIR fueron superiores a las T2*WI y a la TC en la detección de HSA de bajo grado. El mayor contenido de proteínas en la sangre presente en el líquido cefalorraquídeo (LCR) y el retardo en el paso de oxihemoglobina a desoxihemoglobina por la mayor tensión de oxígeno en LCR producirán imágenes hiperintensas en ELAIR 42.
CONCLUSIONES
El diagnóstico de emergencia hipertensiva neurológica se hace cuando hay evidencia clínica de daño cerebral secundario a cifras tensionales por encima de 180/120 mm Hg 1. Las IRM permiten hacer un diagnóstico diferencial entre encefalopatía hipertensiva o AIT (IRM normal), hemorragia intracraneal (SWI, GRE o T2*WI hipointensas), HSAa (ELAIR hiperintenso, SWI, T2*WI o GRE hipointensas), ACV isquémico agudo (restricción a la difusión con DWI hiperintenso y mapas ADC hipointensos) o el edema vasogénico del síndrome de vasoconstricción reversible (DWI hipointenso y mapas ADC hiperintensos) (figura 3). Solamente un 15 % de los ACV isquémicos entrarían en el diagnóstico de emergencia hipertensiva órgano blanco cerebro, un 22 % de los ACV hemorrágicos y un 40 % de las HSAa 15. El manejo de la hipertensión arterial en cada uno de los escenarios descritos es controversial y se recomienda cautela con descensos intensos de la PA, para evitar empeoramiento de la isquemia o efectos adversos renales severos 1,29.