Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombian Journal of Anestesiology
versão impressa ISSN 0120-3347versão On-line ISSN 2256-2087
Rev. colomb. anestesiol. vol.50 no.1 Bogotá jan./mar. 2022 Epub 18-Jan-2022
https://doi.org/10.5554/22562087.e972
Revisión narrativa
Síndrome posparo cardiaco en pacientes adultos hospitalizados
a Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
b Hospital Universitario Nacional de Colombia, Universidad Nacional de Colombia. Bogotá, Colombia.
El paro cardiaco intrahospitalario en el adulto (IHCA) se define como el cese de circulación ocurrido dentro de las instalaciones hospitalarias. Después de la reanimación cardiopulmonar (RCP) de alta calidad, si se logra el retorno de circulación espontánea (ROSC), aparece entonces el síndrome posparo cardiaco (SPPC). En esta revisión se pretende presentar el estado actual del diagnóstico y tratamiento del SPPC. Para abordar este tema, se realizó una búsqueda bibliográfica mediante la consulta digital directa de la literatura científica publicada entre 2014 y 2020 en inglés y español recogida en las bases de datos MedLine, SciELO, Embase y Cochrane. La búsqueda inicial arrojó 248 artículos, de los cuales se eligieron artículos originales, revisiones sistemáticas, metaanálisis y guías de práctica clínica, para una selección final de 56 documentos. Las etiologías del paro cardiaco intrahospitalario se pueden dividir en cardiacas y no cardiacas, en el 56 % y 44 %, respectivamente. El colapso fisiológico tiene incidencias de hasta 1,6 casos/1.000 pacientes admitidos, y es más frecuente en las unidades de cuidado intensivo (UCI), con una tasa de supervivencia general de 1 año del 13 %. Los componentes principales del SPPC son la lesión cerebral, la disfunción miocárdica y la persistencia de la patología precipitante. Los pilares del manejo del SPPC son la prevención del paro cardiaco, soporte ventilatorio, control de arritmias periparo cardiaco y las intervenciones para optimizar la recuperación neurológica. El conocimiento del SPPC por parte del personal de la salud ofrece mejor sobrevida y futura calidad de vida a los pacientes. Finalmente, se resalta la clara necesidad de ahondar en mayores investigaciones en la población latinoamericana.
Palabras clave: Síndrome posparo cardiaco; Paro cardiaco intrahospitalario; Reanimación cardiopulmonar; Retorno a circulación cardiaca espontanea; Lesión por isquemia reperfusión
Adult In-hospital Cardiac Arrest (IHCA) is defined as the loss of circulation of an in-patient. Following high-quality cardiopulmonary resuscitation (CPR), if the return of spontaneous circulation (ROSC) is achieved, the post-cardiac arrest syndrome develops (PCAS). This review is intended to discuss the current diagnosis and treatment of PCAS. To approach this topic, a bibliography search was conducted through direct digital access to the scientific literature published in English and Spanish between 2014 and 2020, in MedLine, SciELO, Embase and Cochrane. This search resulted in 248 articles from which original articles, systematic reviews, meta-analyses and clinical practice guidelines were selected for a total of 56 documents. The etiologies may be divided into 56% of in-hospital cardiac, and 44% of non-cardiac arrests. The incidence of this physiological collapse is up to 1.6 cases/1,000 patients admitted, and its frequency is higher in the intensive care units (ICU), with an overall survival rate of 13% at one year. The primary components of PCAS are brain injury, myocardial dysfunction and the persistence of the precipitating pathology. The mainstays for managing PCAS are the prevention of cardiac arrest, ventilation support, control of peri-cardiac arrest arrythmias, and interventions to optimize neurologic recovery. A knowledgeable healthcare staff in PCAS results in improved patient survival and future quality of life. Finally, there is clear need to do further research in the Latin American Population.
Keywords: Post-cardiac arrest syndrome; In-hospital cardiac arrest; Cardiopulmonary resuscitation; Return of spontaneous cardiac circulation; Ischemia-reperfusion injury
INTRODUCCIÓN
El paro cardiaco intrahospitalario en el adulto (PCIHA) se define como el cese de circulación ocurrido dentro de las instalaciones hospitalarias en pacientes hospitalizados 1. Dicho evento de colapso fisiológico es de relativa frecuencia, con incidencias informadas hasta de 1,6 casos por cada 1.000 pacientes admitidos, en países desarrollados 2, y es más frecuente en las unidades de cuidado intensivo (UCI). A pesar de los esfuerzos para optimizar el manejo de los PCIHA, estos eventos cursan con altas tasas de morbimortalidad 3. En Estados Unidos, por ejemplo, se describen aproximadamente 200.000 PCIHA al año. Además, una revisión sistemática de 2018, que incluyó más de 1 millón eventos y 39 estudios entre 1992 y 2016, encontró una tasa de supervivencia general de 1 año del 13 % 4,5. Adicionalmente, cabe mencionar la marcada disminución de la calidad de vida, dependencia funcional y costos al sistema de salud que sobrevienen con la rehabilitación y el manejo de las secuelas del evento 6-8. Por tal razón, una adecuada prevención y reconocimiento, así como la actualización y apropiación de los protocolos institucionales que permitan una reanimación exitosa, serán factores determinantes de la sobrevida y pronóstico a largo plazo de estos pacientes 9.
Después de la reanimación cardiopulmonar (RCP) oportuna y de alta calidad, se logra en algunos casos el retorno de circulación espontánea (ROSC) y aparece entonces el síndrome posparo cardiaco (SPPC), llamado así desde 2008 por el Comité Internacional de Enlace sobre Resucitación (IL-COR). Este consiste en una serie de eventos fisiopatológicos que incluyen la lesión cerebral, disfunción miocárdica, una respuesta sistémica por las alteraciones moleculares secundarias a la isquemia/reperfusión y el compromiso funcional de la comorbilidad que ocasionó el paro cardiaco 10,11.
Las guías Utstein han permitido a nivel global una mayor facilidad al momento de publicación y búsqueda de datos estadísticos sobre el paro cardiaco en el adulto 12. No obstante, se hizo una revisión en búsqueda de datos o registros disponibles en Colombia, que no arrojó ningún resultado 13. A pesar de lo anterior, dichas guías cobran suprema importancia en el estudio de la etiología y epidemiología del paro cardiaco en el adulto dadas sus implicaciones directas tanto con el manejo óptimo del paciente con PCIHA como para determinar la sobrevida y el pronóstico neurológico. Sin embargo, persiste la dificultad de consenso para publicación de datos epidemiológicos a tal nivel que han surgido nuevos sistemas de clasificación que cuentan con ventajas y desventajas sobre el estilo Utstein 1. Ahora bien, desde la elaboración de este concepto los avances marcados en las tecnologías y métodos diagnósticos, así como una mayor comprensión de los diferentes mensajeros intra e intercelulares, han incrementado el interés académico frente a esta fase como un determinante de la morbimortalidad asociado al paro cardiaco, lo cual se ve reflejado en el incremento de estudios relacionados en PubMed, que pasaron de 5 en 2008 a 31 en 2017. Estos estudios abren la ventana a nuevas terapéuticas, como las tocantes a la relación entre el IL-6 y el TNF a y el tratamiento vasopresor dirigido, así como los marcadores de daño y activación endotelial han mostrado la posibilidad de ser marcadores de la intensidad del proceso 14.
Los efectos deletéreos en la evolución del SPPC obedecen a la patología de base no resuelta y a la lesión isquemia/reperfusión que se traduce en daño del tejido cerebral, disfunción miocárdica y compromiso de hígado, riñón y demás órganos. La Asociación Americana del Corazón (AHA) en 2010 adicionó el quinto eslabón a la cadena de sobrevida con el fin de que, una vez recuperada la circulación cardiaca espontánea, se concentren todos los esfuerzos en prevenir las consecuencias nefastas de la reperfusión mediante estrategias como una adecuada oxigenación/ventilación, una presión arterial sistólica > 90 mm Hg, y la hipotermia terapéutica, que garantiza la disminución del consumo metabólico de oxígeno y previene la lesión ocasionada por los productos de la acidosis (depresores miocárdicos y cerebrales) 15.
En el marco de los obstáculos ya mencionados, la siguiente revisión narrativa tiene como propósito describir los aspectos epidemiológicos, fisiopatológicos y los concernientes al diagnóstico y manejo de este síndrome bajo la luz de la evidencia e información actual más reciente. Para ello se realizó una búsqueda bibliográfica mediante la consulta digital directa de la literatura científica recogida en las siguientes bases de datos: MedLine (consultado mediante metabuscador PubMed), SciELO, Embase y Cochrane. Los términos MESH en inglés utilizados fueron: "postcardiac arrest syndrome", "postcardiac arrest care" "post-cardiac arrest management", "post cardiac arrest management guidelines"; en español se utilizaron las siguientes palabras clave: "síndrome postparada cardiaca", "síndrome postparo cardiaco".
Mediante la creación de fórmulas de búsqueda conjugando los anteriores términos se revisó la literatura científica publicada entre 2014 y 2020 en el caso de las publicaciones en inglés. Se decidió ampliar el período para los resultados en español abarcando desde 2008, con el fin de incluir literatura regional; sin embargo, solo se encontraron protocolos de manejo, más no datos epidemiológicos a nivel latinoamericano. La búsqueda inicial arrojó 248 artículos, de los cuales se excluyeron aquellos provenientes de literatura gris, artículos duplicados, revisiones aceptadas sin publicar, documentos sin resumen o sin datos suficientes para adquisición y artículos de opinión. Finalmente, entre las categorías de artículos originales, revisiones sistemáticas, metaanálisis y guías de práctica clínica, se revisaron un total de 56 documentos.
PARO CARDIACO EN PACIENTES HOSPITALIZADOS
En general, las etiologías del paro cardiaco intrahospitalario se pueden dividir en cardiacas y no cardiacas, correspondiéndoles clásicamente el 56 % y el 44 %, respectivamente. En la Tabla 1 se relacionan las causas más frecuentes de paro cardiaco intra-hospitalario en orden de importancia. En el caso de las causas no cardiacas, la insuficiencia respiratoria aguda (IRA) se había descrito como la más importante, con una proporción variable entre el 11,6 %-38 % de los casos 1,3,16. Sin embargo, en los últimos meses, tal relación tiende a invertirse como consecuencia de la pandemia por SARS-CoV-2/COVID-19, que se constituye como una causa creciente de mortalidad en el mundo 17. Igualmente, no es despreciable la relevancia del PCIHA secundario a choque séptico, dado el aumento en incidencia de infecciones graves y le atribuyen porcentajes de hasta el 27 % en población adulta hospitalizada 11,18,19.
Tabla 1 Etiologías del paro cardiaco en el adulto.
| Causas cardiacas | Causas no cardiacas | Otras, múltiples o desconocidas |
|---|---|---|
| Síndrome coronario agudo | Insuficiencia respiratoria | 2 causas probables |
| Arritmia por cardiomiopatía | Toxicológica | No se estudió |
| Falla cardiaca derecha | Obstrucción de la vía aérea superior | Otra causa identificada |
| Falla cardiaca izquierda | Alteraciones metabólicas | 3 causas probables |
| Cardiopatía estructural | Choque distributivo | 4 o más causas probables |
| Arritmia congénita | Exanguinación no traumática | Estudio extenso inconcluso |
| Trauma | ||
| Catástrofe neurológica |
FUENTE. Adaptado de Chen et al. 1.
La distribución por servicios es variable, el registro GWTG-Resuscitation 2013 informa que el 80 % de los PCIHA en Estados Unidos ocurren en pisos de hospitalización general y en la UCI y el 20 % restante, en pacientes quirúrgicos 11. Según datos publicados por la NCAA del Reino Unido para el 2011-2013, se tiene una tasa de 1,6 por cada 1.000 y tasas específicas de 1,51-6,28 por cada 1.000 admitidos en hospitales norteamericanos y europeos 3,20-22. La causa probable de la clara fluctuación entre tasas institucionales se debe a la ausencia de consenso al momento de publicar datos y la relación de camas de UCI, unidad de cuidados coronarios (UCC) y laboratorios de cateterismo (LC) con la de pisos de hospitalización general 20.
El análisis estadístico de los estudios epidemiológicos muestra como el paro cardiaco es ligeramente más común en hombres al representar el 58,3 %-66,2 % de todos los casos de PCIHA 1,3,10. Y su incidencia es proporcional a la edad del paciente, con un pico entre los 52 y 77 años 20,21. Al mismo tiempo, existe una relación lineal e inversamente proporcional entre la edad y la sobrevida intrahospitalaria de los pacientes que padecen PCIHA, aunque no se describen diferencias entre los grupos eta-rios con respecto al pronóstico neurológico posterior al ROSC 3,21.
Con relación al ritmo de paro identificado al inicio de la reanimación, en contraposición al paro cardiaco extrahospitalario, en los pacientes institucionalizados son más comunes los ritmos no desfibrilables, es decir, la actividad eléctrica sin pulso (AESP) y la asistolia, descritos en el 62 %-82,6 % de los casos 1,20, lo cual puede atribuirse a la diferencia entre paro cardiaco presenciado y aquel que es detectado accidentalmente por el personal de enfermería durante sus rondas, ya que el colapso pudo haber ocurrido incluso horas antes de ser detectado. Por consiguiente, se ha visto en algunos estudios una correlación entre el pico de detección de paro cardiaco durante el día con las primeras rondas del día 21. En contraste, los ritmos susceptibles de desfibrilación, taquicardia ventricular sin pulso (pVT) y fibrilación ventricular (VF) no son solo más frecuentes en hombres, sino que también se vinculan con mejores desenlaces y sobrevida al momento del egreso hospitalario 3,12,21.
APROXIMACIÓN HISTÓRICA AL CONCEPTO DEL SÍNDROME POSPARO CARDIACO
Aunque el concepto de paro cardiaco se encuentra en la literatura médica desde aproximadamente 1700-1800 y se han elaborado numerosas guías encaminadas al restablecimiento de la circulación espontánea en esta entidad, solo hasta hace relativamente poco se estableció un concepto relacionado con la morbimortalidad en los pacientes que recuperan exitosamente la circulación espontánea, este es el síndrome posparo cardiaco 22.
Esta entidad fue descrita inicialmente en 1972 por el doctor Vladimir Negovsky en su artículo "The second step in resuscitation-the treatment of the post-resuscitation disease", publicado para la Academia de Ciencias Médicas de la URSS. Negovsky, apoyándose en estudios de los desenlaces clínicos y estudios de fisiología experimental en animales, pudo establecer que luego de la recuperación de la circulación corporal espontánea mediante estrategias de reanimación se establecía una nueva entidad nosológica, derivada de la isquemia corporal total, que comprometía la homeostasis y el metabolismo de diferentes sistemas, que desencadenaba una constelación de procesos patológicos, la cual fue denominada por él como enfermedad posresucitación 23.
Se continuaron estudios clínicos que demostraron la alta mortalidad en los pacientes que, pese a recuperar la circulación espontánea, fallecían, y varios estudios experimentales demostraron una fisiopatología común que implicaba el daño de los diferentes órganos blanco posterior a la reanimación exitosa; pero no fue sino hasta el 2008 que el Comité Internacional de Enlace sobre Resucitación (ILCOR) redefinió esta nueva entidad como síndrome posparo cardiaco 11.
SÍNDROME POSPARO CARDIACO
Definición
Se conoce como síndrome posparo cardiaco al conjunto de respuestas fisiológicas sistémicas consecuencia del ROSC. Es una combinación compleja de alteraciones fisiológicas inmunológicas y hematológicas 1, cuyas consecuencias incluyen el daño cerebral posparo cardiaco, la disfunción miocárdica posparo cardiaco y la respuesta sistémica al proceso isquemia/reperfusión 10. Dicho estado se complica a menudo con un cuarto componente: la persistencia del proceso patológico que causó el paro cardiaco 24.
En este síndrome no solo está involucrada la hipoperfusión prolongada a la que se ve sometido el individuo durante el evento, sino que también están implicadas las lesiones adicionales producidas durante y después de las maniobras de reperfusión, las comorbilidades del individuo y las alteraciones orgánicas que dieron lugar al paro cardiaco en primera instancia 25.
Fisiopatología
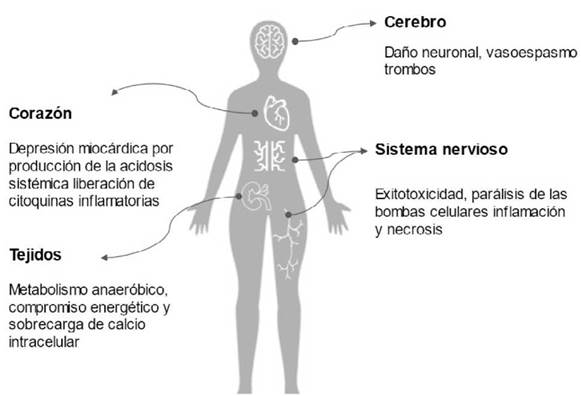
Durante el paro cardiaco se establece un estado de hipoxia acompañado de acidosis generalizada 26. El grado de disfunción celular, lesión y necrosis está influenciado por la magnitud y la duración de la isquemia, así como por la susceptibilidad particular de cada tejido. Por otro lado, aunque la reperfusión es necesaria para restablecer el suministro de oxígeno y nutrientes para apoyar el metabolismo celular y revertir tal estado, puede provocar respuestas fi-siopatológicas que favorecen el aumento de la extensión de la lesión ya establecida como consecuencia de la isquemia a la que se sometió el organismo. Con este evento se produce una liberación de mediadores inflamatorios y radicales libres en el torrente sanguíneo provenientes de los tejidos re-vascularizados, que posteriormente alcanzan órganos remotos, lo que se traduce en lesiones sistémicas 21) (Figura 1).
Respuesta celular
La prevalencia del metabolismo anaeróbico durante la isquemia causa una disminución del pH intracelular. Para amortiguar esta acumulación de hidrogeniones se produce una excreción de los mismos mediante el influjo de Na+. Con el metabolismo anaerobio hay una menor disponibilidad de ATP, lo que induce una activación de las ATPasas, reduce la salida de Ca++ y limita su recaptación por el retículo endoplásmico produciendo una sobrecarga de calcio intracelular. Lo anterior se ha propuesto como un mecanismo inductor de la apertura del poro de la transición de la permeabilidad mitocondrial (MPT), que disipa el potencial de la membrana mitocondrial y compromete aún más la producción de ATP 27-29. En el corazón, estos cambios celulares están acompañados por la activación de proteasas intracelulares (por ejemplo, calpaínas) que dañan las miofibrillas y producen hi-percontractura y necrosis 30,31.
La pronta reperfusión restaura el suministro de oxígeno y de los sustratos necesarios para la generación de ATP aeróbica y normaliza el pH extracelular mediante el barrido de los hidrogeniones acumulados, de tal forma que la reperfusión en sí misma parece ser responsable de lesiones subyacentes multifactoriales que involucran: 1) la circulación de especies reactivas de oxígeno (ROS) que aumenta con la reintroducción de oxígeno molecular cuando se restablece el flujo sanguíneo; 2) sobrecarga de calcio; 3) apertura del poro MPT; 4) disfunción endotelial; 5) fenómenos protrombóticos y 6) respuestas inflamatorias pronunciadas 10.
Etapas del síndrome posparo cardiaco
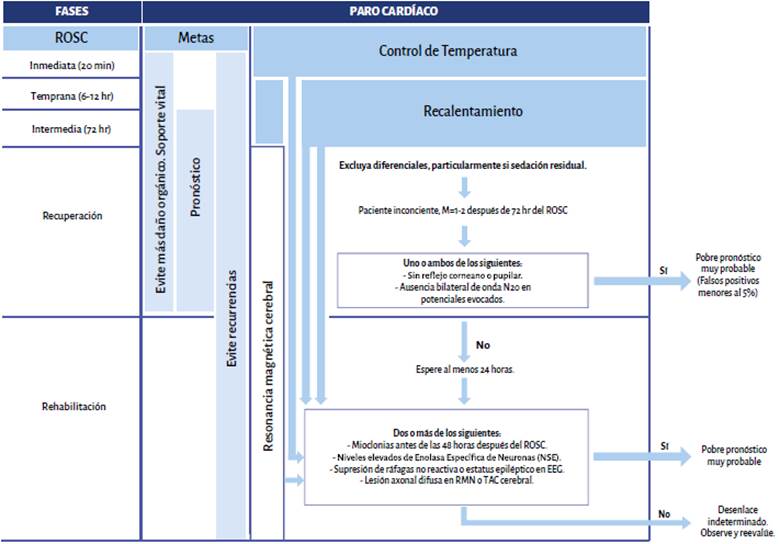
Un enfoque fisiológico para el manejo de los pacientes en paro cardiaco y del posparo implica definir las fases de la atención del evento según el tiempo transcurrido más allá de categorizarlo según si el evento es hospitalario o no. Neumar et al. proponen el esquema descrito en la Figura 2, que permitiría una aproximación confiable al pronóstico del paciente, con mayor capacidad de predicción de los posibles eventos colaterales, mientras que se favorece el manejo guiado por metas 10.
Componentes del síndrome posparo cardiaco
Lesión cerebral
El daño cerebral postanóxico es la complicación más dramática del paro cardiaco. La lesión cerebral es la causa de muerte en aproximadamente el 68 % de los pacientes después de un paro cardiaco fuera del hospital y en el 23 % después de un paro cardiaco en el hospital 10. La vulnerabilidad única del cerebro se atribuye a su limitada tolerancia a la isquemia, sus altos requerimientos de oxígeno (alrededor del 15 % del gasto cardiaco) y su respuesta única a la reperfusión 10,32. Histológicamente, las subpoblaciones de neuronas selectivamente vulnerables se encuentran en el hipocampo, la corteza, el cerebelo, el cuerpo estriado y el tálamo, las cuales se degeneran durante un período de horas, a partir de la isquemia y la apoptosis 10. La duración relativamente prolongada de las cascadas de lesiones y el cambio histológico sugiere una amplia ventana terapéutica para las estrategias neuroprotectoras después de un paro cardiaco 25.
Durante un paro cardiaco cesa el flujo sanguíneo y la presión arterial de oxígeno declina hasta 0 mm Hg; el paro cardiaco prolongado también puede generar un compromiso dinámico de la reperfusión de la microcirculación cerebral, a pesar de una presión de perfusión cerebral (PPC) adecuada 32. La reducción del oxígeno y la glucosa disponibles disminuye la producción aeróbica de ATP, lo que deriva en las alteraciones previamente descritas. Cuando se disminuye el ATP neuronal, hay cese de las bombas sodio-potasio-magnesio ATPa-sa y se facilita la apoptosis celular por entrada de sodio, calcio y cloro y la salida del potasio. Cuando la célula se despolariza se activan los receptores de kainato, quisqua-lato y N-methyl-D-aspartato, y como resultado se abren los canales de sodio y cloro, con liberación de aminoácidos excitatorios, principalmente glutamato, los cuales aumentan aún más la entrada del calcio a la célula y permiten la salida de calcio mito-condrial con el consiguiente aumento del calcio intracelular 33. Todas estas respuestas iónicas conducen a edema celular, activación de enzimas proteolíticas y lipasas, y destrucción celular como consecuencia de la degradación de enzimas citosólicas y liberación de ácido araquidónico, aumento de prostaglandinas y radicales libres de oxígeno y de otros ácidos grasos libres 34.
Después de la reperfusión se produce un daño adicional. Inicialmente se presenta hiperemia, seguida de hipoperfusión multifocal por vasoespasmo, aumento de la presión hística local, congestión capilar por edema del endotelio y perivascular, que consecuentemente puede favorecer la aparición de estados protrombóticos, que se acompaña con un acúmulo de elementos celulares que pueden ocluir vasos sanguíneos alterando la microcirculación en condiciones de bajo flujo e impiden la restauración de la perfusión en ciertas áreas 32,35.
En el periodo de posparo cardiaco se describe que la lesión neurológica definirá principalmente el pronóstico funcional, manifestándose como un amplio espectro de desenlaces: desde una alteración transitoria del estado de conciencia hasta un estado vegetativo posterior a la reanimación 7,8. De los pacientes que sobreviven al paro cardiaco, solo el 37 % recuperan su funcionalidad previa 7. Esto representa una gran carga económica para el sistema de salud, para los pacientes y para las familias, al tiempo que compromete la calidad de vida 6,8.
Disfunción miocárdica
La disfunción miocárdica posterior a un paro cardiaco también es un aspecto contribuyente a la baja tasa de supervivencia después de un paro cardiaco dentro y fuera del hospital 32. Inmediatamente después del retorno de la circulación espontánea, la frecuencia cardiaca y la presión arterial son extremadamente variables, probablemente como consecuencia de un aumento transitorio en las concentraciones locales y circulantes de catecolaminas; igualmente, con la ROSC la contractilidad sistólica y la relajación diastólica están afectadas, este fenómeno se ha descrito como miocardio aturdido, principalmente en síndromes coronarios agudos 36 y su intensidad está determinada por la magnitud del daño isquémico, llegando a generar caídas en el gasto cardiaco hasta un 22 % en modelos animales 10, lo que induce inestabilidad hemodinámica. Estas alteraciones son secundarias, en primera instancia, a la etiología del paro cardiaco, pero también a algunas intervenciones terapéuticas como la desfibrilación y la administración de epi-nefrina 10,32. Además, el paro induce la puesta en marcha del síndrome de respuesta inflamatoria sistémica, con activación de leucocitos y del sistema del complemento que incrementan los niveles de citocinas, que conduce a disfunción endotelial similar a la observada en la sepsis 37.
Durante los primeros minutos de la reperfusión miocárdica, el retículo sarcoplás-mico se encuentra en un entorno de gran sobrecarga de Ca2+ y la reactivación mitocondrial de la síntesis de ATP lo que pone en funcionamiento la Ca2+-ATPasa del retículo sarcoplásmico (SERCA), encargada de la captación del Ca2+ citosólico, incluso a pesar de la persistencia de un flujo de Ca2+ aumentado desde el medio extracelu-lar. Como resultado de ello, se produce una gran acumulación de Ca2+ que excede su capacidad de almacenamiento, por lo que finalmente el Ca2+ es extruido a través de los receptores de rianodina y luego vuelve a ser captado, lo que da lugar a un patrón de oscilaciones rápidas de Ca2+ que se propagan a lo largo de la célula e imponen una fuerza mecánica que puede sobrepasar la capacidad elástica del sarcolema 32.
Las alteraciones más comunes descritas en la literatura abarcan disfunción miocárdica manifestada por taquicardia, presión diastólica final del ventrículo izquierdo elevada, hipotensión y disminución del gasto cardiaco. Esta disfunción global es transitoria y puede evolucionar hacia una recuperación completa. La alteración en la función cardiovascular, evaluada mediante ecografía, alcanza su nadir a las 8 horas después de la reanimación y puede mejorar sustancialmente en las siguientes 24 horas y potencialmente normalizarse a las 72 horas en pacientes que sobrevivieron a un paro cardiaco fuera del hospital 38.
Persistencia de la patología precipitante
La fisiopatología del SPPC se complica por persistencia de la patología que causó o contribuyó al paro cardiaco en sí 10. El diagnóstico y el tratamiento de patologías precipitantes persistentes -como el síndrome coronario agudo (SCA), las alteraciones del equilibrio ácido-base, la hipoxia, las hemorragias, la sepsis y diversos toxi-dromos- son fundamentales, puesto que tales alteraciones pueden ejercer un efecto sumatorio por la fisiopatología simultánea de este cuadro clínico, empobreciendo el pronóstico de los pacientes 25. Cuando el paro cardiaco es causado por insuficiencia respiratoria, la patología pulmonar puede exacerbarse después de la restauración de la circulación. La redistribución de la sangre en la vasculatura pulmonar puede provocar un edema pulmonar agudo o al menos un aumento de los gradientes de oxígeno alveolar-arterial; así mismo, las lesiones cerebrales, entre ellas, el edema, son mayores en el paro cardiaco que cursa con alteraciones en la ventilación 10.
La sepsis, por su parte, es una causa de paro cardiaco, síndrome de dificultad respiratoria aguda y falla multiorgánica. Por lo tanto, existe una predisposición a la exacerbación del síndrome posparo cardiacon después de un paro cardiaco en el contexto de la sepsis. La falla orgánica múltiple es una causa más común de muerte en la UCI después de la reanimación inicial de un paro cardiaco en el hospital. Otras causas precipitantes del paro cardiaco pueden requerir un tratamiento específico durante el período posparo cardiaco. Por ejemplo, las intoxicaciones deben tratarse con sus antídotos específicos, y las causas ambientales, como la hipotermia, pueden requerir un control más activo de la temperatura. El tratamiento específico de estas alteraciones subyacentes debe coordinarse con el apoyo determinado para la disfunción neurológica y cardiovascular posterior a un paro cardiaco 10.
MANEJO DEL SÍNDROME POSPARO CARDIACO
Los cuidados posparo cardiaco tienen el potencial de mejorar la mortalidad precoz derivada de la inestabilidad hemodinámica e insuficiencia de múltiples órganos y sistemas, así como impactar en la morbilidad y la mortalidad tardía, que resultan, entre otros, del compromiso neurológico. Los objetivos principales de estas intervenciones son mejorar la función cardiopulmonar y la perfusión sistémica, proporcionar un rápido traslado a un centro de atención hospitalaria integral o unidad de cuidado intensivo, identificar las causas precipitantes y prevenir la recurrencia del evento. Todo esto en el marco de medidas encaminadas a mejorar el pronóstico de los pacientes a largo plazo, incluida la función neurológica 39.
Prevención del paro cardiaco
El primer vínculo en la cadena de supervivencia hospitalaria es el reconocimiento temprano del deterioro del paciente y la prevención del paro cardiaco. Al respecto, varias fuentes refieren cambios en los signos vitales y comportamiento de los pacientes 8 horas previas al paro cardiaco en hasta un 84 %. Una vez que se produce el paro cardiaco, solo aproximadamente el 20 % de los pacientes que presentan paro cardiaco hospitalario sobreviven y se recuperan hasta el egreso. En la European Resuscitation Council Guidelines for Resuscitation 2015 se sugiere un enfoque para la prevención del paro cardiaco en el hospital que incluya la educación del personal, el monitoreo de pacientes, el reconocimiento del deterioro del paciente, un sistema para pedir ayuda y una respuesta eficaz de la cadena de supervivencia 11. Smith, por su parte, alude a la Primera Conferencia Internacional sobre Equipos de Emergencia Médica, donde describieron las características esenciales de los sistemas de respuesta rápida, utilizando un concepto similar al del arco reflejo neurológico, así: el sistema deberá tener una extremidad aferente (para la detección de eventos y la activación de la respuesta) y una extremidad eferente (la respuesta al deterioro identificado), sumados a otros dos componentes: (a) una extremidad eva-luativa, de seguridad del paciente y de mejora del proceso y (b) una estructura administrativa 40.
La mayoría de los adultos sobrevivientes de paro cardiaco en el hospital presentan fibrilación ventricular y son manejados con desfibrilación inmediata. La causa subyacente del paro en este grupo suele ser la isquemia primaria del miocardio. En comparación, el paro cardiaco en pacientes en áreas no monitorizadas suele ser un evento predecible no causado por una enfermedad cardiaca primaria 41. En este grupo, el paro cardiaco a menudo sigue un período de deterioro fisiológico lento y progresivo que implica hipoxemia e hipotensión no reconocidas o tratadas de manera inadecuada. El ritmo del paro cardiaco subyacente suele ser la asistolia, y la probabilidad de supervivencia al alta hospitalaria es extremadamente baja 42.
El monitoreo regular y el tratamiento temprano y efectivo de los pacientes gravemente enfermos mejoran los resultados clínicos y previenen algunos paros cardiacos. Una atención más cercana a los pacientes con factores de riesgo para paro cardiaco o en quienes se ha evidenciado inestabilidad hemodinámica, aun cuando no requieren soporte vital básico o avanzado, también puede mejorar el resultado, puesto que un tercio de estos pacientes mueren durante su estadía en el hospital 42.
Soporte ventilatorio
Los pacientes con SPPC requieren una administración temprana de volúmenes inspirados de oxígeno, a través de cualquiera de los dispositivos de vía aérea, aunque se prefiere el acceso a una vía aérea definitiva por intubación traqueal para lo cual es preciso tener en cuenta algunas consideraciones. Los pacientes con SPPC tienen un mayor riesgo de desarrollar síndrome de distrés respiratorio agudo, así como una alta tasa de infecciones y lesiones pulmonares. Más del 30 % de los pacientes cursan con estómago lleno, que conlleva a un mayor riesgo de aspiración durante el manejo de la vía aérea. Por otro lado, las compresiones torácicas pueden llevar a contusión pulmonar. Por último, secundario al fenómeno de isquemia-reperfusión, se han descrito aumentos en la tasa de infecciones con la alteración consiguiente de la respuesta inflamatoria, la cascada de la coagulación y la permeabilidad pulmonar 43,44.
Según lo descrito en la literatura, un tratamiento conservador de oxigenoterapia presenta menos episodios de fiebre, shock, falla hepática y bacteriemia que en terapias con concentraciones de oxígeno más altas. Por lo anterior, se recomienda monitorizar frecuentemente los valores de oxígeno y dar un aporte que permita alcanzar una saturación de oxígeno (SO2) entre 92 %-97 % lo que se aproxima a PaO2: 90-100 mm Hg 43.
Existe una compleja relación entre la PaCO2 y los desenlaces neurológicos. La PaCO2, a su vez, se relaciona con los efectos hemodinámicos de la presión ventilatoria positiva, ya que lleva a un incremento en la presión intratorácica que dificulta el retorno venoso y disminuye el gasto cardiaco 43. Adicionalmente la PaCO2 afecta directamente el tejido cerebral, pues por cada mm Hg que esta disminuya, hay un descenso de aproximadamente un 3 % en el flujo cerebral. Por lo anterior, pese a que hasta el momento se está estableciendo su valor clínico, la hipercapnia moderada es decir PaCO2 entre 50-55 mm Hg puede ser una intervención beneficiosa a mediano y largo plazo 45.
Para reducir los cambios en el CO2, aunque no se ha establecido una estrategia que determine los valores óptimos de ventilación artificial, se ha visto que el manejo de una ventilación con un valor de volumen corriente bajo (menor o igual a 6 mL/kg) reduce hasta en un 9 % el riesgo absoluto de mortalidad. Por otro lado, en los pacientes debe hacerse una búsqueda activa de neumonitis e infecciones respiratorias, especialmente en aquellos con eventos de broncoaspiración presenciados por el personal de salud, convulsiones o ventilación mecánica prolongada, con el fin de ofrecer un manejo oportuno 43.
Intervenciones para optimizar la recuperación neurológica
Manejo dirigido de la temperatura
A pesar del bajo nivel de evidencia, el Advanced Life Support Task Force of the International Liaison Committee on Resus-citation hace una recomendación fuerte a favor de que los pacientes que cursen con paro cardiaco intra o extrahospitalario con ritmos desfibrilables y persistan inconscientes después del ROSC (exceptuando a aquellos con infección sistémica grave y coagulopatías preexistentes), sean sometidos a una estrategia de control de la temperatura con metas entre 32 °C-36 °C durante 24 a 72 horas 46. Tal estrategia aumentaría un estimado relativo del 35 % en la supervivencia de los pacientes, así como los desenlaces neurológicos a corto y mediano plazo 47.
Estudios en humanos y modelos animales indican que la inducción de una hipotermia leve tendría un efecto neuroprotector con mejoría en los desenlaces primarios en individuos que han cursado con un periodo de isquemia-hipoxia cerebral global como consecuencia de un paro cardiaco. Fisiopa-tológicamente, estos resultados se explican por una disminución de la tasa metabólica de oxígeno (aproximadamente en un 6 % por cada grado de temperatura corporal reducida), además de la reducción en la liberación de aminoácidos excitatorios y radicales libres previniendo la elevación de calcio intracelular, lo que se traduce en un menor número de activaciones de las vías de muerte celular 11.
Los efectos de la hipotermia controlada no se limitan a lo neurológico. A nivel cardiovascular, por ejemplo, se ha descrito que la disminución de la temperatura conduce a un aumento de la resistencia vascular periférica, lo que se traduciría en un aumento de la presión arterial. Por su parte, en el sistema de conducción, como se describirá más adelante, la principal manifestación de la hipotermia es la bradicardia sinusal que potencialmente se traduce en un aumento del tiempo en diástole, lo que mejoraría la relación entre el aporte y la demanda de oxígeno miocárdico, hallazgo asociado en varios estudios a mejores desenlaces neurológicos 10,48,49. En contraparte, este abordaje de la temperatura supone otros riesgos como alteraciones hidroelectrolíti-cas -hipofosfatemia, hipokalemia, hipo-magnesemia e hipocalcemia-, alteraciones en la hemostasia con un leve aumento en el riesgo de sangrado, aunque hasta el momento sin evidencia de significancia clínica 50 y, por último, una disminución en la respuesta inmune, que algunos estudios han vinculado a mayores tasas de infecciones respiratorias inferiores sin implicar cambios en la sobrevida 51.
La aplicación del manejo dirigido de la temperatura consta de tres fases: inducción, mantenimiento y recalentamiento. La inducción debe ser temprana y algunos autores recomiendan su uso intraparo 46,48. El enfriamiento del paciente puede hacerse por métodos centrales o periféricos; entre los primeros se encuentran la instilación de solución salina enfriada por una vía venosa central o periférica -no recomendado en pacientes con signos de congestión, por el riesgo de edema pulmonar-, el enfriamiento evaporativo transnasal y la ECMO. Los métodos de superficie incluyen la colocación de almohadillas de gel, bolsas de hielo o toallas húmedas en la zona inguinal, cervical y axilar del paciente; este método es poco costoso, pero consume tiempo del personal de enfermería, puede tener más fluctuaciones de temperatura y no permite un recalentamiento controlado 52. La fase de mantenimiento, por su parte, debe incluir la sedación y el bloqueo neuromus-cular como mecanismos de prevención del temblor 46. Debe ponerse especial énfasis en disminuir las fluctuaciones en la temperatura, preferiblemente con dispositivos internos, como los termistores en la vejiga o el esófago. Por último, habiendo completado el periodo de hipotermia, se iniciará la fase de recalentamiento, que deberá hacerse de forma gradual, con el fin de evitar variaciones marcadas en las concentraciones de electrolitos o en el volumen intravascu-lar efectivo, idealmente a tasas de 0,25 °C a 0,5 °C por hora 48.
Control de convulsiones
Las convulsiones son comunes después del paro cardiaco y ocurren en un tercio de los pacientes que persisten comatosos después de la ROSC. Esto puede llevarlos a un estado epiléptico, definido por EEG, en un 23 %-31 % de los casos, con el subsecuente aumento de la tasa metabólica cerebral y la exacerbación de la lesión, lo que puede asociarse a pobre pronóstico neurológico 11. Las presentaciones más comunes son las mioclonías, las convulsiones focales y las crisis tónico-clónicas 53,54. Para su detección se recomienda el uso de EEG intermitente en quienes se sospechan convulsiones, ya que las manifestaciones motoras no son específicas para las crisis y el monitoreo sistemático no ha demostrado ser efectivo en la detección temprana 11,53. Su manejo puede hacerse con valproato de sodio, levetiracetam, fenitoína -no en el caso de las mioclonías, por su inefectividad-, benzodiacepinas, propofol o barbitúricos.
Después del primer evento se debe iniciar terapia de mantenimiento una vez se hayan excluido las causas precipitantes potenciales, como hemorragia intracraneal o desbalances electrolíticos. Se desaconseja el uso de anticonvulsivantes profilácticos después de un paro cardiaco por sus posibles efectos adversos y porque no hay suficiente evidencia que lo soporte 11,53.
Control de glucosa
Existe una fuerte asociación entre valores elevados de glucosa en sangre después del ROSC y un pobre pronóstico neurológico 52. Para su control se han propuesto dos enfoques: un control intensivo de glucosa, que establece como meta un rango entre 81 y 108 mg/dL 11 y un manejo más permisivo en el que solo se intervienen glucemias mayores a 180 mg/ dL. Se ha demostrado que un manejo exagerado de los niveles de hiperglucemia, aún en pacientes no diabéticos, puede aumentar la mortalidad a 90 días, especialmente en pacientes comatosos quienes pueden cursar con hipoglucemias no detectadas. Debe recordarse que la hipotermia leve se ha asociado con episodios de hiperglucemia, lo que implica mayores requerimientos de insulina en los pacientes diabéticos 55.
Arritmias periparo cardiaco
Las arritmias cardiacas son relativamente comunes en el período periparo y pueden preceder a cualquiera de los ritmos de paro o desarrollarse después de una reanimación exitosa. Nielsen et al. observaron que los efectos secundarios más frecuentes en el periodo tras la reanimación son las bradicardias, en un 41 %, y las taquicardias, en un 33 % 56. Los factores de riesgo más importantes para el desarrollo de arritmias son las lesiones persistentes de las arterias coronarias con placa inestable o trombo fresco en pacientes que presentan SCA, las cardiomiopatías, el embolismo pulmonar masivo, las alteraciones del estado ácido-base, electrolíticas y las intoxicaciones 11,57-59.
Como se ha mencionado, el ROSC inicia una cascada de lesión por reperfusión del miocardio que está mediada en parte por ROS y altos niveles de citocinas circulantes 21. Estos procesos crean un estado de inestabilidad eléctrica en el período de 24 a 72 horas después del ROSC, que puede dar lugar a un amplio espectro de arritmias que van desde complejos ventriculares prematuros hasta la taquicardia ventricular (TV), fibrilación ventricular (FV) o el ritmo idioventricular acelerado, clásicamente descrito posterior a la reperfusión en los síndromes coronarios agudos 58.
Varios factores contribuyen a un estado de inestabilidad eléctrica cardiaca después del ROSC. Dentro de estos se incluyen niveles elevados de catecolaminas endógenas, los efectos persistentes de agentes vasoac-tivos, como vasopresina y epinefrina, administrados durante el paro, el uso posterior de agentes inotrópicos y vasopresores. Estos factores aumentan la poscarga ventricu-lar izquierda, pueden inducir vasoespasmo coronario y un aumento en la demanda de oxígeno del miocardio, lo cual predispone a las arritmias 10. Además, la disfunción ventricular izquierda, tanto sistólica como diastólica aguda debido al aturdimiento del miocardio, es común después de un paro cardiaco y también predispone a arritmias recurrentes. Por último, los pacientes sometidos a manejo dirigido de la temperatura como estrategia para minimizar la lesión cerebral hipóxica, pueden cursar con bradicardia y prolongar el QTc (intervalo QT corregido), lo cual predispone a la TV y FV polimórfica 58. Un hallazgo electrocar-diográfico interesante en los pacientes con hipotermia, aún aquellos con hipotermia controlada, es la onda de Osborn, una desviación vertical del punto J en el electrocardiograma, que se ha considerado como un predictor del riesgo de arritmia ventricular. Sin embargo, evidencia reciente sugiere que este hallazgo puede considerarse un fenómeno fisiológico benigno y asociado con menor mortalidad en análisis univa-riables 59.
Con pocas excepciones, el tratamiento de las arritmias posteriores al paro no debe diferir del tratamiento agudo de las arritmias iniciales que llevaron al paro. Se debe hacer todo lo posible para corregir y tratar los factores precipitantes y las causas reversibles, con especial énfasis en la revascularización coronaria en aquellos que presentaron FV 10,58. Con excepción de los pacientes que tienen FV/TV dentro de las 48 horas posteriores a un infarto agudo de miocardio con elevación del ST, las guías actuales de la Sociedad Europea de Cardiología y de la AHA recomiendan la colocación de un desfibrila-dor automático implantable como prevención secundaria en pacientes que sufren un paro cardiaco. El uso coadyuvante a largo plazo de fármacos antiarrítmicos debe reservarse para aquellos pacientes con arritmias ventriculares recurrentes 58.
Identificación y manejo del desencadenante del paro cardiaco
La identificación de las causas potencialmente reversibles del paro cardiaco, para las que existe un tratamiento específico, deben sospecharse y excluirse, si es posible, a lo largo del proceso de reanimación. Clásicamente se han agrupado en dos categorías para facilitar una aproximación sistemática por parte de los profesionales encargados de la atención. Estas son las H y las T, como se describe en la Tabla 2. Si se identifica cualquiera de estas entidades, se debe corregir de forma inmediata, puesto que como se indicó, los pacientes que cursan con persistencia de la patología desencadenante del paro cardiaco en etapas tempranas del síndrome posparo cardiaco, tienen peores desenlaces primarios que aquellos en quienes se ha tratado la causa 60.
TABLA 2 Principales etiologías del paro cardiaco.
| Anormalidad | Factores de riesgo | Manejo | Sobrevida |
|---|---|---|---|
| Categoría H | |||
| Hipoxia | Pacientes con infección por SARS-CoV-2 | Asegurar la vía aérea y administrar oxígeno suplementario | Tasas de supervivencia bajas y pueden cursar con lesiones neurológicas secundarias |
| Obstrucción de la vía aérea por cuerpo extraño (extremos de la vida) | Maniobras de desobstrucción | ||
| Hipocalemia | Quemaduras graves, ostomías, uso prolongado de diuréticos, enfermedad tubular renal | Suplementación de potasio y magnesio | |
| Hipercalemia | Insuficiencia renal, diabetes mellitus, medicamentos ahorradores de potasio, rabdomiólisis | Diagnosticar alteraciones en el electrocardiograma, evitar la despolarización miocárdica, favorecer la entrada de potasio a las células, eliminación de potasio (diálisis) | Varía según el grado de hiperca-lemia las y alteraciones cardiacas concomitantes |
| Acidosis (H+) | Enfermedad renal crónica, sepsis, enfermedad pulmonar obstructiva, tóxicos | Varía según la etiología | Varía según la etiología |
| Hipovolemia | Pérdidas sanguíneas por trauma, heridas cortopunzantes, puerperio. Enfermedad diarreica o emesis en pacientes con poca tolerancia a las pérdidas de volumen o de alto gasto (cólera) | Reemplazo de la volemia según la causa sospechada con líquidos intravenosos o hemoderivados | La hipovolemia no corregida es la principal causa del ritmo de paro denominado Actividad Eléctrica sin Pulso (AESP),muerte |
| Hipotermia | Ahogamiento en aguas heladas | Prevención de arritmias, recalentamiento en el hospital (líquidos endovenosos, mantas térmicas) | En general, altas tasas de sobrevida y buen pronóstico neurológico |
| Hipertermia | Uso de sustancias simpaticomiméticas, choque de calor (ancianos, deshidratación, obesidad, alcoholismo), hipertermia maligna | Enfriamiento desde la detección | Mortalidad entre el 10 y el 50 % en el choque de calor |
| Categoría T | |||
| Taponamiento cardiaco | Herida penetrante en región precordial, derrame pericárdico de causas infecciosas, neoplásicas, inflamatorias | Pericardiocentesis, ventana peri-cárdica | Varía según la causa |
| Trombosis coronaria | Hipertensión arterial, hipercolesterolemia, DM, obesidad, tabaquismo, antecedentes familiares, Enfermedad aterosclerótica: infarto de miocardio previo, enfermedad arterial periférica | Terapia de reperfusión, manejo antiisquémico y estabilizador de placa | La trombosis coronaria es la principal causa de paro cardiaco en el adulto |
| Neumotórax a tensión | Trauma torácico | Descompresión con aguja, toracos-tomía con drenaje cerrado | La sobrevida depende del diagnóstico y manejo precoz |
| Tromboembolismo pulmonar | Trombosis venosa profunda, cáncer, cirugía mayor reciente, inmovilidad, fracturas | Fibrinólisis, anticoagulación, trombectomía, ECMO (oxigenación por membrana extracorpórea) | Bajas tasas de sobrevida en el caso de tromboembolismo pulmonar masivo |
| Intoxicaciones | Accidentes industriales, exposición laboral, trastornos psiquiátricos, víctimas de intento de asalto o abuso sexual | Descontaminación limitar la absorción, favorecer la eliminación, aplicación de antídotos específicos | La tasa de sobrevida depende del diagnóstico y manejo precoz |
FUENTE. Autores, a partir de Soar et al. 60.
PRONÓSTICO NEUROLÓGICO
Según el Advisory Statement on Neurological Prognostication in Comatose Survivors of Cardiac Arrest, hasta un 80 % de los admitidos a UCI presentan lesión hipóxica isquémica; de estos, dos tercios mueren en su mayoría por la detención del tratamiento de soporte vital basado en el pronóstico de un pobre desenlace neurológico 11,61. Por ende, en los pacientes con lesión anóxica grave se debe minimizar el riesgo de una predicción pesimista falsa 62 que puede llevar a la limitación precipitada de esfuerzos terapéuticos.
Dada la gran cantidad de predictores para evaluar el pronóstico neurológico, es necesario un enfoque práctico y sistematizado basado en los predictores más sensibles y específicos y en la mayor evidencia disponible. En aras de la simplificación, el protocolo sugerido por el ERC-ESICM es una excelente herramienta, pues inicia con pruebas pronósticas tempranas con sensibilidad más robusta y no son propensas a factores que pueden inducir interpretaciones erróneas como sedación, bloqueo neuromuscular, hipotermia, hipotensión grave y trastornos metabólicos o respiratorios. Dentro de los predictores se encuentran la ausencia de reflejo pupilar a las 72 horas o más del ROSC y la ausencia de onda N2O SSEP bilateral después del recalentamiento y, luego, en caso de no encontrar estos hallazgos, se tienen en cuenta predictores que, pese a que presentan algunas limitaciones en su análisis, tienen una adecuada sensibilidad y especificidad, como:
Estatus mioclónico antes de 48 h.
Valores altos de enolasa específica de neuronas (NSE) a las 48 a 72 h después del retorno de circulación espontánea (>71 mcg/L).
Patrón no reactivo maligno de EEG (supresión de estallido, estatus epiléptico) después de recalentamiento.
Lesión isquémica difusa en tomografía axial computarizada (TAC) en las 24 horas después de ROSC o 2 a 5 días en resonancia magnética (RM) combinando al menos dos de estos predictores.
Así mismo, resalta la necesidad de continuar con una observación prolongada en los resultados indeterminados, ya que permite identificar "despertares tardíos", es decir aquellos que ocurren entre 48 horas y 10 a 12 días después de la discontinuación de la sedación.
Finalmente, es importante resaltar la existencia de muchas otras herramientas para la adecuada evaluación del pronóstico neurológico, como las escalas de valoración CPC, mRS, GOS y GCS motor score, pruebas de electrofisiología, EEG y potenciales so-matosensoriales de corta latencia 61, las neuroimágenes (TC y RM) y el análisis automatizado; algunas de estas modalidades diagnósticas 11,61 soportadas en el examen físico como fundamento del pronóstico 54, permiten la mejor aproximación a este; no obstante, aún presentan muchos retos, como el establecimiento de un adecuado método de evaluación y definición de valores asociados a pobre desenlace neurológico soportados con ensayos clínicos que proporcionen un adecuado nivel de evidencia para su generalización (Figura 2).
CONCLUSIONES
El concepto de SPPC ha sufrido cambios en el transcurso del tiempo gracias al entendimiento de sus mecanismos fisiopatológicos y al interés científico sobre su investigación a partir de las altas tasas de incidencia del paro cardiorrespiratorio y su impacto en morbimortalidad a corto y largo plazo. En consecuencia, se han propuesto numerosas intervenciones que, según la evidencia reciente, aumentan las tasas de sobrevida y podrían tener un efecto en el pronóstico neurológico de los pacientes. Ante todo, es primordial capacitar a los profesionales de la salud para que sean capaces de identificar y abordar tempranamente las alteraciones que ponen en un mayor riesgo al paciente de cursar con un paro cardiaco, puesto que, la prevención del paro es el pilar que impactará favorablemente el pronóstico. El manejo oportuno de la causa del paro cardiaco es otra de las intervenciones con mayor efecto en la mortalidad, al igual que la ventilación protectora. Otras estrategias, como el control específico de la temperatura, el manejo de las arritmias periparo, la regulación de los niveles de glucemia y el manejo de las convulsiones, si bien tienen sustento fisiológico y evidencia que los respalda, su resultado está más relacionado con el pronóstico neurológico y la reducción de la morbilidad, más que con un aumento de la sobrevida. Se requiere también, la generación de guías de práctica clínica locales, orientadas a las características biológicas, sociales y económicas de cada población, como en el caso de Latinoamérica.
Agradecimientos
Al diseñador industrial Jorge Humberto Reyes Pimiento por la elaboración de las figuras.
REFERENCIAS
1. Chen N, Callaway CW, Guyette FX, Rittenberger JC, Doshi AA, Dezfulian C, et al. Arrest etiology among patients resuscitated from cardiac arrest. Resuscitation. 2018;130:33-40. doi: https://doi.org/10.1016/j.resuscitation.2018.06.024 [ Links ]
2. Mawani M, Kadir M, Azam I, Mehmood A, Mc-Nally B, Stevens K, et al. Epidemiology and outcomes of out-of-hospital cardiac arrest in a developing country-a multicenter cohort study. BMC Emergency Medicine. 2016;16(1). doi: https://doi.org/10.1186/s12873-016-0093-2 [ Links ]
3. Al-Dury N, Rawshani A, Israelsson J, Stromsoe A, Aune S, Agerstrom J, et al. Characteristics and outcome among 14,933 adult cases of in-hospital cardiac arrest: A nationwide study with emphasis on gender and age. Am J Emerg Med. 2017;35(12):1839-44. doi: https://doi.org/10.1016/j.ajem.2017.06.012 [ Links ]
4. Schluep M, Gravesteijn BY, Stolker RJ, Endeman H, Hoeks SE. One-year survival after in-hospital cardiac arrest: A systematic review and meta-analysis. Resuscitation . 2018;132:90-100. doi: https://doi.org/10.1016/j.resuscitation.2018.09.001 [ Links ]
5. Bergum D, Haugen BO, Nordseth T, Mjolstad OC, Skogvoll E. Recognizing the causes of in-hospital cardiac arrest -- A survival benefit. Resuscitation . 2015;97:91-6. doi: https://doi.org/10.1016/j.resuscitation.2015.09.395 [ Links ]
6. Chan P Public health burden in in-hospital cardiac arrest. Institute of Medicine, Committee on the Treatment of Cardiac Arrest [internet]. 2013 [citado: 2019 oct. 23]. Disponible en: Disponible en: http://www.nationalacademies.org/hmd/~/media/Files/Report%20Files/2015/GWTG.pdf . [ Links ]
7. Nichol G, Stiell IG, Hebert P, Wells GA, Vandemheen K, Laupacis A. What is the quality of life for survivors of cardiac arrest? A prospective study. Acad Emerg Med. 1999;6:95-102. doi: https://doi.org/10.1111/j.1553-2712.1999.tb01044.x [ Links ]
8. Hamel MB, Phillips R, Teno J, Davis RB, Goldman L, Lynn J, et al. Cost effectiveness of aggressive care for patients with nontraumatic coma. Crit Care Med. 2002;30:1191-6. doi: https://doi.org/10.1097/00003246-200206000-00002 [ Links ]
9. Riva G, Ringh M, Jonsson M, Svensson L, Herlitz J, Claesson A, et al. Survival in out-of-hospital cardiac arrest after standard cardiopulmonary resuscitation or chest compressions only before arrival of emergency medical services. Circulation. 2019;139(23):2600-9. doi: https://doi.org/10.1161/CIRCULATIONAHA.118.038179 [ Links ]
10. Nolan J, Neumar R, Adrie C, Aibiki M, Berg R, Bõttiger B, et al. Post-cardiac arrest syndrome: Epidemiology, pathophysiology, treatment, and prognostication. Resuscitation . 2008;79(3):350-79. doi: https://doi.org/10.1016/j.resuscitation.2008.09.017 [ Links ]
11. Soar J, Nolan J, Bõttiger B, Perkins G, Lott C, Carli P, et al. European Resuscitation Council Guidelines for Resuscitation 2015. Resuscitation . 2015;95:100-47. doi: https://doi.org/10.1016/j.resuscitation.2015.07.016 [ Links ]
12. Chang SH, Huang CH, Chih CL, Lee CC, Chang WT, Chen YT, et al. Who survives cardiac arrest in the intensive care units? J Critical Care. 2009;24:408-14. doi: https://doi.org/10.1016/j.jcrc.2008.10.006 [ Links ]
13. Navarro-Vargas JR. Registro de paro cardiaco en el adulto. Revista Facultad de Medicina Universidad Nacional de Colombia. 2005;53(3):196-203. [ Links ]
14. Mentzelopoulos S, Zakynthinos S. Post-cardiac arrest syndrome: pathological processes, biomarkers and vasopressor support, and potential therapeutic targets. Resuscitation . 2017;121:A12-4. doi: https://doi.org/10.1016/j.resuscitation.2017.10.013 [ Links ]
15. Jiménez-Castro MB, Cornide-Petronio ME, Gracia-Sancho J, Peralta C. Inflammasome-mediated inflammation in liver ischemia-reperfusion injury. Cells. 2019;8:1131-57. doi: https://doi.org/10.3390/cells8101131 [ Links ]
16. Schein RMH, Hazday N, Pena M, Ruben BH, Sprung CL. Clinical antecedents to inhospital cardiopulmonary arrest. Chest. 1990;98(6):1388-92. doi: https://doi.org/10.1378/chest.98.6.1388 [ Links ]
17. Lai C, Wang C, Wang Y, Hsueh S, Ko W, Hsueh P. Global epidemiology of coronavirus disease 2019 (COVID-19): disease incidence, daily cumulative index, mortality, and their association with country healthcare resources and economic status. Int J Antimicrob Agents. 2020;55(4):105946. doi: https://doi.org/10.1016/j.ijantimicag.2020.105946 [ Links ]
18. Morgan RW, Fitzgerald JC, Weiss SC, Nadkarni VM, Sutton RM, Berg RA. Sepsis-associated in-hospital cardiac arrest: Epidemiology, pathophysiology, and potential therapies. J Crit Care. 2017;40:128-35. doi: https://doi.org/10.1016/j.jcrc.2017.03.023 [ Links ]
19. Tran S, Deacon N, Minokadeh A, Malhotra A, Davis DP, Villanueva S, et al. Frequency and survival pattern of in-hospital cardiac arrests: The impacts of etiology and timing. Resuscitation . 2016;107:13-8. doi: https://doi.org/10.1016/j.resuscitation.2016.07.006 [ Links ]
20. Jones D, Mercer I, Heland M, Detering K, Radford S, Hart G, et al. In-hospital cardiac arrest epidemiology in a mature rapid response system. Br J Hosp Med. 2017;78(3):137-42. doi: https://doi.org/10.12968/hmed.2017.78.3.137 [ Links ]
21. Radeschi G, Mina A, Berta G, Fassiola A, Roasio A, Urso F, et al. Incidence and outcome of in-hospital cardiac arrest in Italy: a multicentre observational study in the Piedmont Region. Resuscitation . 2017;119:48-55. doi: https://doi.org/10.1016/j.resuscitation.2017.06.020 [ Links ]
22. Rozen TH, Mullane S, Kaufman M, Frank-Hsiao YF, Warrillow S, Bellomo R, et al. Antecedentes to cardiac arrests in a teaching hospital intensive care unit. Resuscitation . 2013;85(3):411-7. doi: https://doi.org/10.1016/j.resuscitation.2013.11.018 [ Links ]
23. Negovsky VA. The second step in resuscitation--the treatment of the 'post-resuscitation disease'. Resuscitation . 1972;1:1-7. doi: https://doi.org/10.1016/0300-9572(72)90058-5 [ Links ]
24. Pothiawala S. Post-resuscitation care. Singapore Med J. 2017;58(7):404-7. doi: https://doi.org/10.11622/smedj.2017060 [ Links ]
25. Stub D, Bernard S, Duffy S, Kaye D. Post cardiac arrest syndrome. Circulation. 2011;123(13):1428-35. doi: https://doi.org/10.1161/CIRCULATIONAHA.110.988725 [ Links ]
26. Navarro-Vargas J, Díaz J. Síndrome posparo cardiaco. Colombian Journal of Anesthesiology. 2014;42(2):107-13. doi: https://doi.org/10.1016/j.rca.2014.01.001 [ Links ]
27. Kalogeris T, Baines C, Krenz M, Korthuis R. Cell Biology of ischemia/reperfusion injury. Int Rev Cell Molecular Biol. 2012;(298):229-317. doi: https://doi.org/10.1016/B978-0-12-394309-5.00006-7 [ Links ]
28. Morciano G, Giorgi C, Bonora M, Punzetti S, Pavasini R, Wieckowski M, et al. Molecular identity of the mitochondrial permeability transition pore and its role in ischemia-reperfusion injury. J Mol Cellular Cardiol. 2015;78:142-53. doi: https://doi.org/10.1016/j.yjmcc.2014.08.015 [ Links ]
29. Crompton M. The mitochondrial permeability transition pore and its role in cell death. Biochemical J. 1999;341(2):233. doi: https://doi.org/10.1042/bj3410233 [ Links ]
30. Bukowska A, Lendeckel U, BodeBõger S, Goette A. Physiologic and pathophysiologic role of calpain: implications for the occurrence of atrial fibrillation. Cardiovasc Therapeut. 2010;30(3): e115-27. doi: https://doi.org/10.1111/j.1755-5922.2010.00245.x [ Links ]
31. Momeni HR. Role of calpain in apoptosis. Cell J. 2011;13(2):65-72. [ Links ]
32. López Rodríguez MS. Protección cardiocerebral post paro cardiaco. Rev Cuba Anestesiol Reanim [internet]. 2010 [citado: 2019 ene. 7];9(3):150-60. Disponible en: Disponible en: http://scielo.sld.cu/scielo.php?scrip t=sci_arttext&pid=S1726-67182010000300003&lng=es . [ Links ]
33. Schneider A, Bõttiger BW, Popp E. Cerebral resuscitation after cardiocirculatory arrest. Anesth & Analg. 2009;108(3):971-9. doi: https://doi.org/10.1213/ane.0b013e318193ca99 [ Links ]
34. Cassiani CA, Pérez AE, Vargas MC, Castro E, Osorio AF. Lesión cerebral posterior a paro cardiorrespiratorio. Acta Neurol Colomb. 2013;29(4):255-65. [ Links ]
35. Hernández H, López JB, Pérez JL, et al. Manejo del síndrome posparada cardiaca. Med Intensiva. 2010;34(2):107-26. doi: https://doi.org/10.1016/j.medin.2009.09.001 [ Links ]
36. Camici P, Prasad S, Rimoldi O. Stunning, hibernation, and assessment of myocardial viability. Circulation. 2008;117(1):103-14. doi: https://doi.org/10.1161/CIRCULATIONAHA.107.702993 [ Links ]
37. Hypothermia After Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest [published correction appears in N Engl J Med. 2002346:1756]. N Engl J Med. 2002;346:549-56. doi: https://doi.org/10.1056/NEJMoa012689 [ Links ]
38. Laurent I, Monchi M, Chiche JD, Joly LM, Spaulding C, Bourgeois B, et al. Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest. J Am Coll Cardiol. 2002;40:2110-6. doi: https://doi.org/10.1016/S0735-1097(02)02594-9 [ Links ]
39. Borsari Mauricio EC, Barbosa Teixeira MC, Assayag Batista RE, Pinto Okuno MF, Vancini Campanharo CR. Results of the implementation of integrated care after cardiorespiratory arrest in a university hospital. Rev Latino-Am. Enfermagem. 2018; 26:e2993. doi: https://doi.org/10.1590/1518-8345.2308.2993 [ Links ]
40. DeVita MA, Bellomo R, Hillman K, et al. Findings of the first consensus conference on medical emergency teams. Crit Care Med. 2006;34:2463-78. doi: https://doi.org/10.1097/01.CCM.0000235743.38172.6E [ Links ]
41. Smith G. In-hospital cardiac arrest: Is it time for an in-hospital 'chain of prevention'? Resuscitation . 2010;81(9):1209-11. doi: https://doi.org/10.1016/j.resuscitation.2010.04.017 [ Links ]
42. Smith G, Pitcher D. Prevention of cardiac arrest and decisions about cardiopulmonary resuscitation. Resucitation Council UK; 2010. [ Links ]
43. Johnson N, Carlbom D, Gaieski D. Ventilator management and respiratory care after cardiac arrest. Chest. 2018; 153(6):1466-77. doi: https://doi.org/10.1016/j.chest.2017.11.012 [ Links ]
44. Peberdy M, Callaway C, Neumar R, Geocadin R, Zimmerman J, Donnino M et al. Part 9: post-cardiac arrest care: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2010;122(18 suppl 3):S768-86. doi: https://doi.org/10.1161/CIRCULATIONAHA.110.971002 [ Links ]
45. Eastwood G, Nichol A, Wise M. Targeted therapeutic mild hypercapnia after cardiac arrest. Critical Care. 2017;21(1). doi: https://doi.org/10.1186/s13054-017-1770-6 [ Links ]
46. Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, et al. Targeted temperature management at 33 degrees C versus 36 degrees C after cardiac arrest. N Engl J Med . 2013;369:2197-206. doi: https://doi.org/10.1056/NEJMoa1310519 [ Links ]
47. Salter R, Bailey M, Bellomo R, Eastwood G, Goodwin A, Nielsen N, et al. Changes in temperature management of cardiac arrest patients following publication of the target temperature management trial. Crit Care Med . 2018;46:1722-30. doi: https://doi.org/10.1097/CCM.0000000000003339 [ Links ]
48. Taccone F, Picetti E, Vincent J. High quality targeted temperature management (TTM) after cardiac arrest. Critical Care . 2020;24(1). doi: https://doi.org/10.1186/s13054-019-2721-1 [ Links ]
49. Nielsen N, Friberg H, Gluud C, Herlitz J, Wetterslev J. Hypothermia after cardiac arrest should be further evaluated-- a systematic review of randomised trials with meta-analysis and trial sequential analysis. Int J Cardiol. 2011;151:333-41. doi: https://doi.org/10.1016/j.ijcard.2010.06.008 [ Links ]
50. García J, Jiménez-Brítez G, Flores-Umanzor E, Mendieta G, Freixa X, Sabaté M. Thrombotic and bleeding events after percutaneous coronary intervention in out-of-hospital cardiac arrest with and without therapeutic hypothermia. Revista Española de Cardiología (English Edition). 2019;72(5):433-5. doi: https://doi.org/10.1016/j.rec.2018.04.022 [ Links ]
51. Erath J, Hodrius J, Bushoven P, Fichtlscherer S, Zeiher A, Seeger F, et al. Early-onset-Pneumonien nach prahospitaler Reanimation. Medizinische Klinik - Intensivmedizin und Notfallmedizin. 2016;112(6):519-26. doi: https://doi.org/10.1007/s00 063-016-0228-y [ Links ]
52. Sunde K. Hipotermia terapéutica en la parada cardiaca. Revista Española de Cardiología . 2013;66(5):346-9. doi: https://doi.org/10.1016/j.recesp.2012.10.005 [ Links ]
53. Passi N, Oliver C, Dhadwal K. Hospital management of the post-cardiac arrest patient: priorities and challenges. Br J Hosp Med . 2019;80(2):C22-7. doi: https://doi.org/10.12968/hmed.2019.80.2.C22 [ Links ]
54. Faro J, Coppler P, Dezfulian C, Baldwin M, Molyneaux B, Urban A, et al. Differential association of subtypes of epileptiform activity with outcome after cardiac arrest. Resuscitation . 2019;136:138-45. doi: https://doi.org/10.1016/j.resuscitation.2018.11.022 [ Links ]
55. Ettleson M, Arguello V, Wallia A, Arguelles L, Bernstein R, Molitch M. Hyperglycemia and insulin resistance in cardiac arrest patients treated with moderate hypothermia. J Clin Endocrinol Metabolism. 2014;99(10):E2010-4. doi: https://doi.org/10.1210/jc.2014-1449 [ Links ]
56. Nielsen N, Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, et al. Targeted temperature management at 33 °C versus 36°C after cardiac arrest. N Engl J Med . 2013;369:2197-206. doi: https://doi.org/10.1056/NEJMoa1310519 [ Links ]
57. Pitcher D, Nolan J. Peri-arrest arrhythmias. Resuscitation Council UK. 2015;1:10-5. [ Links ]
58. Jumean M, Link M. Post-cardiac arrest arrhythmias. Oxford Medicine Online. 2016. doi: https://doi.org/10.1093/med/9780199600830.003.0065 [ Links ]
59. Hadziselimovic E, Thomsen J, Kjaergaard J, K0ber L, Graff C, Pehrson S, et al. Osborn waves following out-of-hospital cardiac arrest-Effect of level of temperature management and risk of arrhythmia and death. Resuscitation . 2018;128:119-25. doi: https://doi.org/10.1016/j.resuscitation.2018.04.037 [ Links ]
60. Soar J, Perkins GD, Abbas G, Alfonzo A, Barelli A, Bierens JJ, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 8. Cardiac arrest in special circumstances: electrolyte abnormalities, poisoning, drowning, accidental hypothermia, hyperthermia, asthma, anaphylaxis, cardiac surgery, trauma, pregnancy, electrocution. Resuscitation . 2010;81(10):1400. doi: https://doi.org/10.1016/j.resuscitation.2010.08.015 [ Links ]
61. Soar J, Deakin CD, Nolan JP, Abbas G, Alfonzo A, Handley AJ, et al. European Resuscitation Council guidelines for resuscitation 2005: section 7. Cardiac arrest in special circumstances. Resuscitation . 2005;67:S135-70. doi: https://doi.org/10.1016/j.resuscitation.2005.10.004 [ Links ]
62. Sreedharan J, Gourlay E, Evans MR, et al. Falsely pessimistic prognosis by EEG in post-anoxic coma after cardiac arrest: the border-land of nonconvulsive status epilepticus. Epileptic Disord. 2012;14:340-4. doi: https://doi.org/10.1684/epd.2012.0519 [ Links ]
Fuentes de financiamiento Los autores no recibieron patrocinio para la elaboración de este artículo de revisión.
Recibido: 07 de Septiembre de 2020; Aprobado: 08 de Noviembre de 2020; : 09 de Marzo de 2021











 texto em
texto em