Varias enfermedades de la cavidad bucal, de origen inflamatorio, traumático, neoplásico o congénito, resultan en defectos de la mucosa bucal 1, entre los cuales cabe mencionar las recesiones gingivales, las vestibuloplastias, el paladar hendido, los traumatismos y la extirpación de tumores 2. Aunque se han propuesto diversos procedimientos quirúrgicos para el tratamiento de estos defectos, persiste la necesidad de encontrar sustitutos funcionales, anatómicos y estéticamente similares al tejido que se va a reemplazar, así como soluciones que reduzcan la morbilidad asociada a la obtención de tejido de zonas donantes, lo cual supone un desafío clínico para los periodoncistas y los cirujanos bucales y maxilofaciales 3.
En este contexto, los recientes avances en medicina, odontología y bioingeniería han abierto la puerta a un nuevo tipo de tratamiento que no requiere la utilización de tejidos autólogos y que se basa en la ingeniería tisular, en la cual se recurre a los principios de la biología y la ingeniería para desarrollar sustitutos biológicos que restauren, mantengan o mejoren la función de los tejidos 1.
Mediante esta técnica, es posible cultivar in vitro los queratinocitos y fibroblastos de una mucosa bucal sana, sembrarlos en un soporte y, una vez obtenido el tejido análogo, injertarlo para reconstruir defectos de la mucosa 4, con lo cual disminuiría la duración de las cirugías y se dispondría de más tejido en comparación con otros procedimientos quirúrgicos.
A pesar de esto, son escasos los estudios concluyentes sobre la utilización de aloinjertos como sustitutos eficientes en la reconstrucción de defectos de la mucosa bucal 4, los cuales se proponen como una alternativa novedosa en el campo de la cirugía mucogingival y en la regeneración tisular guiada frente a la morbilidad asociada con otros procedimientos quirúrgicos, a los cuales debe recurrirse dada la poca disponibilidad de materiales de regeneración tisular y de mucosa bucal sana para reemplazar los tejidos lesionados o perdidos 5.
La utilización de aloinjertos análogos de mucosa bucal evitaría el uso de tejido autólogo, con la consecuente reducción de la morbilidad de los tejidos donados, y ofrecería una cantidad considerable de tejido, con lo cual no se necesitarían cirugías múltiples para intervenir áreas mucosas extensas.
La reacción inmunitaria del paciente a los antígenos bucales difiere en algunos aspectos fundamentales de los de otros sitios anatómicos. Las diferencias más llamativas son la gran cantidad de inmunoglobulinas asociadas con los tejidos mucosos, y la tendencia de la inmunización oral con proteínas a inducir la tolerancia de las células T en lugar de su activación, con la consecuente supresión de las reacciones inmunitarias sistémicas humorales y celulares 6.
El objetivo del presente estudio fue determinar la compatibilidad clínica e histológica de aloinjertos análogos de mucosa bucal en ratas no consanguíneas de cepas diferentes, para simular la variabilidad genética entre las especies, y observar su reacción tisular frente al injerto de un solo tipo de células (fibroblastos) y de su cultivo con queratinocitos, con miras a su futura aplicación clínica como posible alternativa terapéutica.
Materiales y métodos
El estudio se desarrolló en tres fases: la primera consistió en la elaboración de los sustitutos de mucosa de ratas Sprague Dawley mediante cultivo in vitro; en la segunda fase, se procedió a implantar las muestras obtenidas artificialmente en ratas Wistar inmunocompetentes y, en la tercera fase, se evaluaron las características clínicas e histológicas del aloinjerto.
Obtención de la muestra
La muestra para elaborar los injertos análogos de mucosa bucal se obtuvo haciendo una herida de espesor total de 0,5 cm en la mucosa bucal de dos ratas Sprague Dawley, específicamente de la encía adherida en la cara vestibular del maxilar superior, en la región ubicada entre los incisivos, anestesiadas con 50 mg/kg de ketamina (Ketamine(r)) combinada con 10 mg/kg de xilacina (Sedazine(r)), administradas por vía intraperitoneal, y con lidocaína al 2 % por infiltración. Se hizo una incisión superficial en el tejido y, después, una disección aguda hasta eliminar el tejido mucoso, preservando el periostio.
La muestra se depositó en un tubo estéril de 15 ml que contenía medio Eagle modificado de Dulbecco completo (D-MEM) (D 5546 Sigma- Aldrich), al cual se le adicionaron 100 U/ml de penicilina, 100 μg/ml de estreptomicina y 2,5 mg/ml de trihidrato de anfotericina B: sc-227265 (Santa Cruz Biotecnology, CA), para su posterior procesamiento.
Con el mismo procedimiento se obtuvo la muestra de control de una rata Wistar, la cual se conservó en formol al 10 % para su posterior procesamiento y análisis histológico.
Cultivo primario de queratinocitos y fibroblastos gingivales
Siguiendo el protocolo de Padrón, et al.7, el tejido epitelial se separó del tejido conjuntivo mecánicamente y los dos se disgregaron en una caja de Petri con la ayuda del bisturí; a continuación, se homogeneizaron con el émbolo de una jeringa estéril, con el fin de obtener fragmentos más pequeños de tejido. La muestra se volvió a suspender en medio D-MEM con suplemento de suero bovino fetal (SBF) (Sigma-Aldrich) al 10 % para los queratinocitos y al 20 % para los fibroblastos. En el caso de los fibroblastos, la suspensión celular se sometió a separación por gradiente de densidad, utilizando solución Ficoll- Hypaque con una densidad de 1,077 (Sigma- Aldrich) para eliminar las células mononucleares presentes en el tejido. Después de la centrifugación a 400g durante 30 minutos, el botón celular ubicado en el fondo del tubo se recuperó, se lavó tres veces y se sembró en medio D-MEM completo. Los cambios del medio se hicieron cada cuatro días. La viabilidad celular se determinó mediante la técnica de coloración con azul de tripano al 0,4 % y, el fenotipo de los fibroblastos, mediante citometría e inmunofluorescencia directa con el marcador específico de fibroblastos del anticuerpo ER-TR7 sc-73355 PE (Santa Cruz Biotecnology, CA).
Desarrollo de los injertos análogos de mucosa bucal
Transcurridas seis semanas del inicio del cultivo de los fibroblastos, se logró una confluencia de 80 %, aproximadamente; las células en suspensión se separaron de las adherentes, y estas últimas se trataron con tripsina (0,25 %) y ácido etilendiamino- tetraacético (EDTA); después se las lavó con medio completo y se centrifugaron durante 10 minutos. El botón celular se recuperó, se volvió a someter a suspensión y se sembró sobre una membrana de colágeno bovino de tipo I (Mem-Lok BiHorizont(r)) de uso clínico odontológico.
Después de dos semanas de la siembra de los fibroblastos, la membrana resultante se dividió en dos porciones: una para la continuación del cultivo de fibroblastos y la otra para el de queratinocitos y fibroblastos. Siguiendo el procedimiento previamente descrito para la recuperación de las células, se procedió a sembrar los queratinocitos sobre una de las mitades de la membrana durante dos semanas más, con el fin de obtener un cultivo de mucosa bucal.
Evaluación in vivo de los aloinjertos análogos de mucosa bucal
Se hizo la valoración clínica periodontal de cada uno de los especímenes de la muestra antes del injerto, con base en los siguientes indicadores periodontales: biotipo, color, contorno, consistencia, textura, posición del margen gingival y sondaje vertical utilizando una sonda periodontal de William marcada con milímetros marca Hu-Friedy(r).
A continuación, los aloinjertos análogos de mucosa bucal se implantaron en colgajos orales en ocho ratas Wistar inmunocompetentes previamente marcadas, de las cuales cuatro se trataron con el colágeno enriquecido con fibroblastos y, las cuatro restantes, con un cultivo de queratinocitos y fibroblastos.
El procedimiento quirúrgico se hizo bajo anestesia (50 mg/kg de ketamina combinada con 10 mg/kg de xilacina por vía intraperitoneal y lidocaína al 2 % por infiltración). Se separó un colgajo de Newman de espesor total utilizando un bisturí Bard Parker con hoja número 15 C y mediante incisiones intracreviculares en la encía adherida en la cara vestibular del maxilar superior (entre los dos incisivos) en cada rata Wistar para la implantación del aloinjerto. En todos los casos, el material injertado se cortó en la cantidad requerida y se inmovilizó mediante puntos simples con sutura no reabsorbible de hilo de seda 4.0. Dicha técnica fue ejecutada por el mismo equipo de cirujanos. Seis semanas después del aloinjerto, se procedió a valorar los injertos con los indicadores periodontales establecidos.
Por último, los animales se sacrificaron mediante una sobredosis inhalada de tiopental (Tiopental(r)). Después de la eutanasia, se recolectaron las muestras de encía mediante biopsia, se conservaron en formol al 10 % y se incluyeron en parafina para, posteriormente, cortarlas y aplicarles coloración con hematoxilina y eosina, con el fin de hacer el análisis histológico, compararlas con la muestra de mucosa bucal de control y evaluar la presencia o ausencia de infiltrado inflamatorio agudo o crónico, o de células gigantes de reacción a cuerpo extraño, así como la organización del tejido.
Resultados
El tratamiento mecánico y enzimático de estos tejidos demostró ser efectivo en las muestras procesadas, pues se obtuvieron suficientes células en todos los casos. En cuanto a su morfología, con el microscopio óptico de fase invertida, estas células se observaron como elementos esféricos de pequeño tamaño (alrededor de 2 μm de diámetro), que permanecían en suspensión en el medio de cultivo durante las primeras horas de su aislamiento.
En el cultivo primario de fibroblastos y de queratinocitos, se observó la proliferación celular en medio D-MEM con suplemento de suero bovino fetal (SBF) al 20 % y al 10 %, respectivamente. Durante la primera semana, la mayor parte de las células se encontraban adheridas al fondo de la placa de cultivo de manera aislada y habían comenzado a aparecer pequeñas prolongaciones. Se evidenció un crecimiento de fibroblastos y queratinocitos entre la segunda y la tercera semanas, los cuales se agruparon en colonias celulares.
En el caso de los fibroblastos, una trama de células fusiformes se configuró a partir de la cuarta semana, formada por células con largas prolongaciones que ocupaban la superficie de la placa de cultivo. Posteriormente, las colonias fueron aumentando de tamaño hasta obtener una confluencia de aproximadamente 80 % en la quinta semana (figura 1, a-c).

Figura 1 Evolución de los cultivos celulares. a-c. Progreso del cultivo de fibroblastos gingivales de rata con medio D-MEM enriquecido con S.F.B al 20 % en la segunda, tercera y cuarta semanas de incubación, respectivamente. d-f. Desarrollo del cultivo de queratinocitos gingivales de rata (con medio D-MEM enriquecido con SFB al 10 %) en la segunda, tercera y cuarta semanas de incubación, respectivamente. Las flechas muestran la ubicación de algunas células
Por su parte, los queratinocitos alcanzaron una confluencia del 80 %, aproximadamente, en la sexta semana. En el análisis con microscopia óptica, se evidenció la existencia de una población celular de queratinocitos configurados en una monocapa en la placa de cultivo, constituida por células irregularmente poliédricas con un núcleo central voluminoso y citoplasma de aspecto hialino (figura 1, d-f).
La elaboración de injertos análogos de mucosa bucal mediante ingeniería tisular se llevó a cabo de manera eficiente. La malla se mantuvo como soporte durante cuatro semanas, tiempo en el cual permaneció inmersa en el medio de cultivo, sin disolverse, lo cual facilitó la proliferación celular.
Debido a su densidad, la membrana no dejó atravesar la luz durante la primera semana de siembra (poco refringente), por lo que fue difícil observar las células, sin embargo, se tornó un poco más porosa a partir de ese momento (figura 2). Los fibroblastos en la periferia permitieron inferir que la superficie semiporosa de la malla permitió la correcta adhesión celular y la subsecuente unión intercelular. Asimismo, se constató la resistencia de la malla Mem-LokBioHorizont(r), por lo cual su manipulación fue fácil a la hora del injerto propiamente dicho.

Figura 2 Microfotografía de la membrana de colágeno comercial. a. Durante el primer día de siembra. b. Al cabo de una semana de la siembra. c. A dos semanas de la siembra
Evaluación in vivo de los injertos análogos de mucosa bucal
En todos los casos, la evaluación de la mucosa bucal de la zona injertada mostró una adecuada integración con el sitio receptor. El procedimiento quirúrgico fue bien tolerado por todos los animales, y no se apreciaron signos clínicos de rechazo o contracción de la cicatriz (figura 3).
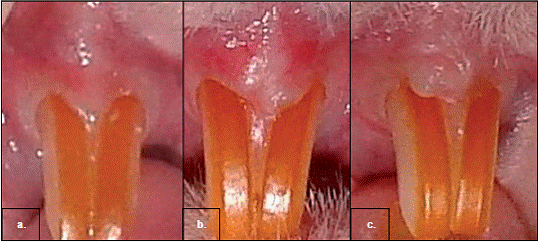
Figura 3 Características clínicas de la mucosa bucal de ratas a las seis semanas del injerto. a. Muestra de mucosa de control sin injerto. b. Mucosa de una rata Wistar con el injerto de fibroblastos cultivados y sembrados sobre soporte de colágeno MEMLOCK. c. Injerto de fibroblastos y queratinocitos cultivados y sembrados sobre soporte de colágeno MEMLOCK
En cuanto a la valoración clínica periodontal inicial de los dos grupos, se evidenciaron características normales de la encía como un biotipo delgado, el color rosado, un contorno festoneado, consistencia firme, textura con el puntillado de cáscara de naranja, posición del margen gingival en el límite amelocementario y un sondaje vertical de 0,5 mm (figura 3a y cuadro 1).
Durante la primera semana del injerto, solo se apreció un ligero eritema en el área; sin embargo, a partir de la segunda semana y en las siguientes evaluaciones, se observó un aumento sostenido del biotipo periodontal (de delgado a grueso), que se evidenció porque el borde de la encía marginal se encontraba más elevado, y la zona injertada más gruesa y con una coloración rosada menos intensa que la mucosa sana circundante, lo cual indicaba una mucosa queratinizada. Los animales que recibieron un injerto combinado con queratinocitos presentaron queratinización más compatible con los patrones normales; en cuanto a las demás características clínicas, estas se mantuvieron dentro de los criterios de normalidad: continuidad con la mucosa adyacente, posición del margen gingival en el límite amelocementario, sondaje vertical de 0,5 mm, textura con el puntillado de cáscara de naranja y consistencia firme, y ausencia de sangrado o contracción de la cicatriz (figura 3, b y c). Estas características se mantuvieron hasta la sexta semana, sin mostrar signos clínicos de rechazo (cuadro 1).
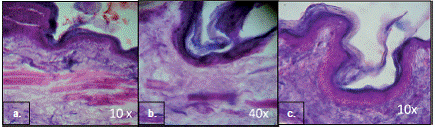
El análisis histológico de las biopsias de encía de los especímenes mostró que, tanto los injertos análogos de mucosa bucal de espesor parcial como los de espesor total, presentaron características similares a las de la muestra de encía de control (figura 4), con una adecuada integración al sitio receptor; se observó una encía tapizada por un epitelio plano estratificado, queratinizado y organizado, de maduración normal. En el corion se observó tejido conjuntivo denso y buena irrigación. En ningún caso se apreció reacción inflamatoria, lo cual indicaba la aceptación del aloinjerto.
Discusión
La ingeniería tisular permite desarrollar diferentes tejidos artificiales en el laboratorio mediante el uso de células vivas, la manipulación del entorno celular, la creación de sustitutos biológicos y su consecuente implantación en el cuerpo 8. El injerto de sustitutos artificiales de tejidos se perfila como uno de los mejores tratamientos alternativos 9.
Por estar constituida de tejidos blandos con características similares a las de la piel, la mucosa bucal ha servido para el desarrollo de sustitutos artificiales de piel y de la misma mucosa bucal 10,11. Mediante los estudios preclínicos y clínicos de estos productos se han podido proponer nuevos métodos para el tratamiento de heridas de la mucosa bucal de espesor parcial y total 10-12. Se han estudiado varios tipos de sustitutos artificiales de mucosa bucal que, según su estructura y composición, pueden utilizarse para: i) reemplazo del tejido epitelial 13; ii) aumento del tejido conjuntivo presente en la lámina propia cuando hay pérdida o reducción de tejido queratinizado 14; iii) reemplazo total de la lámina propia para favorecer la reparación del tejido conjuntivo y estimular la regeneración del epitelio in vivo15, y iv) reemplazo de mucosa bucal de espesor total con tejidos análogos 16-18.
La metodología desarrollada en la presente investigación permitió el aislamiento y el cultivo de fibroblastos y queratinocitos gingivales a partir de biopsias de mucosa bucal de ratas Sprague Dawley, y su posterior utilización para generar equivalentes artificiales de espesor parcial y total sobre un soporte de membrana de colágeno comercial. En otros estudios se han obtenido resultados similares, a pesar de haber empleado una metodología distinta, pues el cultivo de queratinocitos se desarrolló utilizando como soporte una matriz alogénica Alloderm(r) en un medio exento de factores de crecimiento 19,20. En algunos estudios se han utilizado diversos materiales para la obtención de tejidos en el laboratorio, entre los cuales se destacan los de quitosano, colágeno y fibrina, entre otros 21.
Con la obtención de células epiteliales de mucosa bucal mediante el cultivo de explantes de muestras de este mismo tipo de tejido, en el presente estudio se demostró la gran eficiencia de esta técnica para generar cultivos celulares, tal como se reportó en el estudio de Bayar, et al.22.
La evaluación in vivo de los tejidos análogos de mucosa de rata evidenció la adecuada integración de la mucosa bucal artificial en organismos huéspedes (ratas Wistar) inmunocompetentes. Se logró aumentar el biotipo periodontal y crear una zona con mayor queratinización. Desde el punto de vista histológico, el tejido adquirió características similares a las de la muestra de encía de control, con un epitelio plano estratificado y queratinizado de apariencia organizada y maduración normal. En el corion se observó la formación de tejido conjuntivo denso con abundante material eosinofílico, bien irrigado. En ningún caso se detectó reacción inflamatoria.
Estos resultados difieren de los publicados por Junquera, et al.23, en los cuales se reportan tejidos con áreas desestructuradas y degeneración hidrópica, o como los obtenidos por Bello, et al.24, quienes encontraron infiltrado inflamatorio crónico en el injerto de tejido conjuntivo artificial autólogo en conejos.
Los hallazgos permiten inferir que los tejidos análogos de mucosa bucal suministran factores de crecimiento, citocinas y matriz extracelular a las células del huésped 25, y que la porción sin células del aloinjerto (membrana de colágeno), actuaría como un entramado para que las células autólogas migren hacia dentro, lo cual favorece y acelera la formación de epitelio y la curación de la herida en tejidos blandos 16, aumentando la cantidad de mucosa queratinizada, la cual una vez creada o aumentada, puede modificarse y rediseñarse para obtener resultados estéticos y funcionales.
La terapia regenerativa con aloinjertos en la cavidad bucal podría considerarse teóricamente viable, pues debe tenerse en cuenta que la reacción inmunitaria del paciente frente a los antígenos bucales es muy particular y es diferente a la de otros tejidos, especialmente por la gran cantidad de inmunoglobulinas que se produce en asociación con los tejidos mucosos, y la tendencia de la inmunización oral con proteínas a inducir la tolerancia de las células T en lugar de su activación, con la consecuente supresión de las reacciones inmunitarias sistémicas humorales y celulares 6.
El cultivo tisular se proyecta como una posibilidad para la regeneración de tejidos bucales, por lo cual la creación de tejido análogo de mucosa bucal en nuestro laboratorio representa un paso inicial para la implementación de nuevos tratamientos, con el fin de ofrecerles a los pacientes una alternativa en la restitución de tejidos perdidos o dañados, especialmente en la mucosa bucal. Sin embargo, se requieren estudios clínicos para determinar la utilidad de estos tejidos en humanos, aunque se pueden adoptar otras estrategias iniciales, como la combinación de células alogénicas y autólogas para crear tejidos quiméricos inmunológicamente más aceptables.