INTRODUCCIÓN
La leucoencefalopatía multifocal progresiva (LMP) es una enfermedad inusual del sistema nervioso central causada por el virus de John Cunningham, o también conocido como virus JC, que puede llegar a ser fatal o producir secuelas neurológicas incapacitantes en población con compromiso prolongado y profundo del sistema inmune 1.
Presentación del caso
Paciente masculino de 26 años con diagnóstico reciente de infección por virus de la inmunodeficiencia humana (VIH) en estado inmunológico C3, con una carga viral de 66.343 copias/µL y recuento de linfocitos CD4 + de 19/ mm3. El paciente, sin manejo con terapia antirretroviral, asistió al servicio de urgencias por cuadro de 3 meses de evolución de pérdida inexplicada de 10 kg de peso, hemianopsia homónima izquierda de instauración gradualmente progresiva y compromiso motor de sus extremidades superior e inferior izquierdas. Una semana antes de la consulta, presentó cefalea holocraneana insidiosa, pulsátil, de intensidad progresiva asociada con emesis y cuadro confusional con desorientación espacio-temporal y lenguaje intermitente e incoherente. A la revisión por sistemas, presentaba desde hacía 6 meses tos húmeda con expectoración amarillenta no asociada con hemoptisis, disnea ni fiebre.
Al examen físico de ingreso institucional, el paciente se encontraba en regulares condiciones generales, delgado, con atrofia muscular, hemodinámicamente estable, afebril, sin signos de dificultad respiratoria y con fluctuación del estado de conciencia entre estados de alertamiento, confusión y somnolencia. Además, se mostró poco colaborador y en ocasiones se tornaba hostil con el examinador. Estaba orientado en persona, aunque desorientado en tiempo y espacio, hipoproxésico, con pobre producción ideoverbal, bradipsíquico, bradilálico, con prosodia conservada y sin disartria. La praxis y la gnosis no presentaron alteración. El juicio, el raciocinio, el cálculo, la abstracción y la cognición se encontraron alterados. Antes de su ingreso al hospital se había documentado la existencia de una hemianopsia homónima izquierda, objetivada al examen semanas atrás, cuando el paciente aún preservaba un estado de conciencia coherente y obediente. Su fondo de ojo no presentaba alteraciones, las pupilas se encontraban simétricas y fotorreactivas, en tanto que los movimientos oculares no tenían limitaciones aparentes. Se evidenció también hemiparesia izquierda, fuerza 1/5 en miembro superior y 3/5 en miembro inferior. Los reflejos musculotendinosos exhibieron hiperreflexia en hemicuerpo izquierdo y marcha espástica. La respuesta plantar izquierda fue extensora y la derecha neutra. No se hallaron signos de irritación meníngea.
Ante el cuadro clínico y los hallazgos descritos en el examen físico se realizó una imagen de resonancia magnética (IRM) cerebral contrastada (figuras 1-3) en la cual se documentó la presencia de hiperintensidades extensas a nivel subcortical que comprometían la sustancia blanca hemisférica cerebral derecha con una distribución en los lóbulos frontal, parietal y temporal. Adicionalmente, se observó compromiso de la sustancia blanca en la región frontotemporal izquierda que comprometía las fibras en U. No se identificaron áreas de sangrado ni tampoco la presencia de masas ni realces anormales con el medio de contraste.
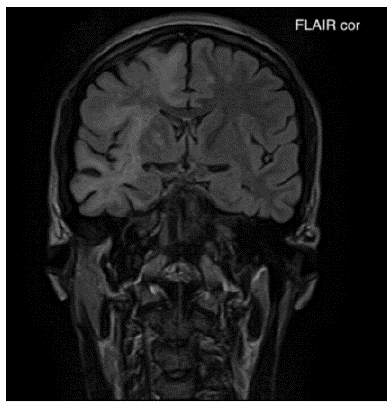
Fuente: autores (Cortesía Hospital Universitario del Valle - Imágenes San José)
Figura 1A Imagen de resonancia magnética cerebral contrastada corte coronal en secuencia FLAIR: Lesiones hiperintensas de extenso compromiso de la sustancia blanca subcortical difusa bilateral de predominio derecho en lóbulo frontal, parietal y temporal.
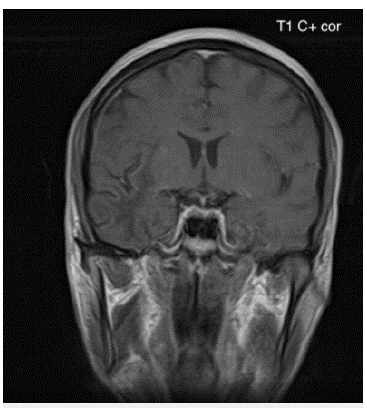
Fuente: autores (Cortesía Hospital Universitario del Valle - Imágenes San José)
Figura 1B Imagen de resonancia magnética cerebral contrastada corte coronal en secuencia T1 al mismo nivel de la figura 1A: Lesiones hipointensas de extenso compromiso de la sustancia blanca subcortical difusa bilateral de predominio derecho en lóbulo temporal.
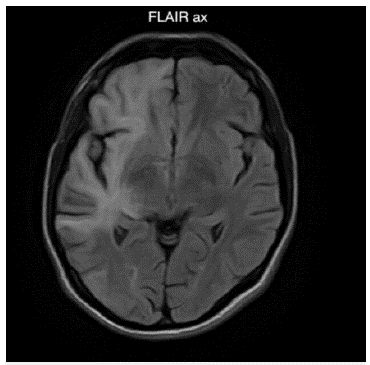
Fuente: autores (Cortesía del Hospital Universitario del Valle - Imágenes San José).
Figura 2: Imagen de resonancia magnética cerebral contrastada corte axial en secuencia FLAIR: Lesiones hiperintensas asimétricas de la sustancia blanca subcortical difusa de predominio derecho, con compromiso en fibras en U yuxtacorticales. No genera efecto de masa ni realce con el medio de contraste.
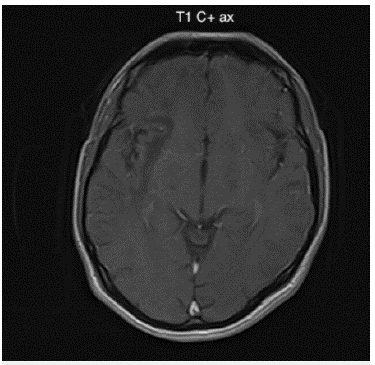
Fuente: autores (Cortesía del Hospital Universitario del Valle - Imágenes San José)
Figura 3: Imagen de resonancia magnética cerebral contrastada corte axial en secuencia T1 al mismo nivel de la figura 3B: Lesiones hipointensas de extenso compromiso de la sustancia blanca subcortical difusa de predominio derecho. No genera efecto de masa ni realce con el medio de contraste.
Se hicieron múltiples estudios para identificar causas etiológicas del cuadro neurológico del paciente, como un hemograma completo que evidenció la presencia de anemia leve microcítica hipocrómica regenerativa, linfopenia y trombocitosis con perfil de ferrocinética sugestivo de enfermedad crónica; los electrolitos no presentaron alteraciones, la función hepática y renal se mostraron conservadas, los hemocultivos resultaron negativos, y el perfil de coinfecciones en suero fue negativo (tabla 1).
Tabla 1 Paraclínicos de perfil infeccioso
| Resultado | Rango de referencia | |
|---|---|---|
| AC VHA | 0,66 | No reactivo <20 |
| AgsHb | 0,13 | No reactivo <0,9 |
| Anti-core HBC | 1,86 | No reactivo 1,2-4,8 |
| Anti-HBS | 6 mUI/M | No reactivo <8 mUI/mL |
| AC VHC | 0,03 | No reactivo <0,9 |
| RPR | 0,06 | Negativo <0,8 |
| IgG CMV | 130,9 UI/mL | Negativo <14 UI/mL |
| IgM CMV | 0,09 UI/mL | Negativo <22 UI/mL |
| IgG para Toxoplasma | 0,5 UI/mL | Negativo < 8 UI/mL |
| IgM para Toxoplasma | 0,3 UI/mL | Negativo < 8 UI/mL |
| Antigeno sérico Cryptoccocus | Negativo | Negativo |
| Coloración Romanowsky | Negativo | Negativo |
| Tuberculina | 0 mm | 0-5 mm |
| Hemocultivos #2 | Negativo | Negativo |
| Cultivos para micosis profunda | Negativo | Negativo |
AC VHA: anticuerpos contra el virus de hepatitis A, AgsHb: antigeno de superficie de hepatitis B; Anti-core HBC: anticuerpos totales contra el core de hepatitis B; Anti-HBS: anticuerpos contra el antigeno de superficie de hepatitis B; AC VHC: anticuerpos contra el virus de hepatitis C; RPR: reagina plasmática rápida; IgG CMV: inmunoglobulina G contra citomegalovirus; IgM CMV: inmunoglobulina M contra citomegalovirus.
Fuente: autores (Por cortesía del Hospital Universitario del Valle)
Se llevó a cabo un estudio completo de líquido cefalorraquídeo (LCR) que reveló lo siguiente: líquido incoloro, presión de apertura de 3 cm de agua, sin pleocitosis, hipo-glucorraquia ni hiperproteinoraquia; se descartó la existencia de patología infecciosa bacteriana o viral por medio de Film Array, gram negativo, KOH negativo, baciloscopia negativa, tinta china negativa, VDRL no reactivo; se postuló una impresión diagnóstica de LPM y se solicitó el estudio la reacción en cadena de la polimerasa (PCR) para virus JC en LCR, cuya positividad confirmó finalmente este diagnóstico.
Por el antecedente de haber presentado síntomas respiratorios de larga data, se realizó una tomografía axial computa-rizada de alta resolución de tórax, la cual reportó la presencia de múltiples micronódulos y áreas en vidrio esmerilado en ambos campos pulmonares; se descartó por tanto infección por tuberculosis mediante la realización de GeneXpert MTB/ RIF en esputo por fibrobroncoscopia y lavado broncoalveo-lar, cuyo resultado fue negativo. Se consideró la posibilidad de un cuadro de neumocistosis, sin criterios indicativos del requerimiento de corticosteroides, por lo que se inició manejo con trimetoprim / sulfametoxazol a una dosis de 15 mg/kg/ día repartido en 3 dosis diarias durante 21 días.
Al descartar otras coinfecciones, se formuló terapia antirretroviral con tenofovir disoproxil-fumarato 300 mg/ emtricitabina 200 mg/día y dolutegravir 50 mg/día. En la estancia hospitalaria se brindó al paciente control sintomático con analgesia parenteral y terapia físico-ocupacional. Luego de comprobarse que había tolerancia a la terapia farmacológica, se dio egreso para continuar seguimiento ambulatorio por infectología y neurología clínica.
Posteriormente, a las 2 semanas de su egreso, el paciente reingresó por cuadriparesia progresiva y pérdida total de su agudeza visual bilateral; la evaluación por oftalmología descartó la existencia de retinopatía por VIH o por otras infecciones oportunistas. El paciente tuvo crisis epilépticas con irradiación bilateral, asociadas con postura tónica y movimientos clónicos generalizados. Adicionalmente, presentó neumonitis por broncoaspiración y bacteriemia por Staphylococcus epidermidis, por lo que requirió manejo antibiótico de amplio espectro y oxígeno suplementario a alto flujo por sistema ventury. A los 30 días del ingreso, después de una evolución tórpida, presentó descompensación hemodinámica y respiratoria por lo cual finalmente falleció.
DISCUSIÓN
La infección por el virus JC se ha descrito ampliamente en la población general desde su primer aislamiento en 1971. Hace parte de la familia Polyomaviridae sin envoltura y con ADN de doble cadena 2. Se ha establecido que es un virus ubicuo que se asocia con una infección asintomática adquirida comúnmente desde la infancia, la cual puede persistir latente por un largo periodo en diferentes tejidos u órganos de huéspedes sanos: riñones, médula ósea, tejido linfoide o sistema nervioso central 1,2. En ciertos casos, cuando el paciente se torna susceptible, secundariamente a un trastorno profundo de su inmunidad celular, se produce una reactivación del virus JC, con consecuente lisis de los oligodendrocitos del cerebro y desmielinización secundaria, lo que da lugar a las graves manifestaciones neurológicas de la LMP 3,4.
Se reconoce a la infección por VIH y la profunda inmunosupresión que puede generar como una asociación directa con el desarrollo de esta enfermedad; el 50-80% de los casos de LMP se asocia con la infección por VIH, a pesar de la instauración de la terapia antirretroviral a finales del siglo XX 5. Al parecer, de acuerdo con estudios in vitro, se ha demostrado que la proteína Tat del VIH promueve la transcripción y replicación del virus JC, lo que conlleva su reactivación secundaria 6.
Los factores de riesgo para el desarrollo de LMP, no asociados con la infección por VIH (25-30% de los casos restantes) se distribuyen en: 10% en pacientes con neoplasias hematológicas tipo linfoma no Hodgkin, sarcoma de Kaposi y leucemia linfoblástica crónica; 10% en pacientes trasplantados, con enfermedades inflamatorias crónicas y enfermedades reumatológicas, y en un 5% en usuarios de anticuerpos monoclonales como el natalizumab 3.
Las manifestaciones clínicas en los pacientes con LMP son muy variables y dependen de la localización de las lesiones a nivel encefálico. Pueden producirse trastornos cognitivos o comportamentales, déficits sensitivos o motores, alteración en la marcha, trastornos del lenguaje, cambios visuales, cefalea o crisis epilépticas 1,2,4,7. Además, infrecuentemente, las lesiones desmielinizantes pueden comprometer la médula espinal y el nervio óptico sin generar una expresión clínica secundaria. Con menor frecuencia se han descrito cuadros clínicos atípicos como la neuronopatía celular granulosa del cerebelo, la encefalopatía fulminante o la meningitis 1,4.
Por medio de la IRM cerebral contrastada, especialmente en la secuenciación potenciada en T2 y recuperación de la inversión atenuada de fluido (FLAIR por sus siglas en inglés), fue posible identificar las lesiones típicas de la enfermedad. Se trata de lesiones múltiples bilaterales, hiperintensas, asimétricas, de morfología irregular, que comprometen la sustancia blanca subcortical y yuxtacortical del cerebro, incluyendo las fibras en U, delineando los bordes de la corteza sin producir efecto de masa ni realce con el medio de contraste 3,8,9. En la secuenciación potenciada en T1 estas lesiones se presentan hipointensas.
En un pequeño subgrupo de pacientes se puede observar una LMP inflamatoria, secundaria al síndrome inflamatorio de reconstitución inmune (SIRI); en estos casos se puede visualizar un punteado perilesional en la substancia blanca cerebral, conocido como patrón de apariencia de "vía láctea", que presenta realce al medio de contraste, edema y efecto de masa 1,8.
Con base en el cuadro clínico del paciente gradualmente progresivo de hemianopsia homónima izquierda, hemipare-sia izquierda, cefalea, alteración de las funciones metales y de la conciencia, los hallazgos imagenológicos por resonancia magnética cerebral, la realización de estudios diagnósticos etiológicos diferenciales y la detección del ADN del virus JC por PCR en el LCR, se determinó el diagnóstico definitivo de LMP, cumpliendo los criterios emitidos por la Academia Americana de Neurología 10.
El citoquímico de LCR puede presentar poca celularidad o hiperproteinorraquia; aun así, resultados dentro de los parámetros de normalidad no descartan la enfermedad 2. Por tanto, en caso de una sospecha diagnóstica presuntiva sin el aislamiento del ADN del virus (a pesar de la alta sensibilidad y especificidad de la PCR), la prueba correspondiente puede ser repetida en LCR después de 24-48 horas. Se puede llevar a cabo una biopsia cerebral que permita confirmar la tríada histopatológica de la enfermedad, consistente en des-mielinización multifocal, astrocitos con núcleos lobulados irregulares y oligodendrocitos con núcleos hipercromáticos alargados 11.
Siempre se debe evaluar los diagnósticos diferenciales en el paciente inmunosuprimido, como lo son la toxoplasmosis cerebral, la encefalitis por varicela zóster o citomegalovirus y el linfoma del sistema nervioso central. De ahí la importancia de un adecuado enfoque diagnóstico, con ayuda de paraclínicos en suero y en LCR, para una detección temprana y una intervención oportuna 2.
Las estrategias de tratamiento se basan en restablecer la inmunidad por medio del inicio temprano de los agentes antirretrovirales en pacientes con VIH. Se debe incluir idealmente el maraviroc, por su efecto antiinflamatorio y buena penetración al sistema nervioso central; en el caso de una LMP asociada con SIRI o en casos de esclerosis múltiple en tratamiento con natalizumab, se debe descontinuar la terapia instaurada y ofrecer esteroides o plasmaféresis 12. En la actualidad no se han desarrollado tratamientos antivirales específicos contra el virus JC que mejoren la supervivencia o reduzcan la discapacidad neurológica de estos pacientes; se están desarrollando algunas terapias que podrían ser prometedoras hacia el futuro: inmunoterapias con células T específicas contra el virus o inhibidores de la proteína de muerte celular programada 1, como el pembrolizumab y el nivolumab, respectivamente 4,13. Asimismo, se deben brindar cuidados sintomáticos y de soporte para la rehabilitación integral de estos pacientes con la participación de un equipo multidisciplinario 2.
El pronóstico es muy pobre cuando no hay un tratamiento oportuno; se alcanzan tasas de mortalidad hasta del 91%. Hoy en día, con la introducción de la terapia antirretroviral, la supervivencia a un año ha pasado de ser de un 10% a un 55%; no obstante, la recuperación funcional completa no es posible en la mayoría de estos pacientes, quienes con frecuencia presentan secuelas neurológicas irreversibles 4,14.
CONCLUSIONES
A pesar de que la infección por el virus JC se puede identificar en gran parte de la población general, se asocia con poca frecuencia a manifestaciones clínicas y neurológicas devastadoras en personas expuestas a inmunosupresión severa. Estos pacientes desarrollarán una enfermedad poco frecuente, pero con altas tasas de morbimortalidad como lo es la LMP. Ante el deterioro neurológico progresivo y catastrófico que presentó el paciente, surgió la necesidad de recordar esta enfermedad. De ahí la importancia de siempre tener la sospecha de esta patología en sujetos con claros factores de riesgo, manifestaciones neurológicas bien reconocidas y hallazgos imagenológicos característicos; se debe procurar la detección temprana del ADN del virus en el LCR para que, con la confirmación diagnóstica correspondiente, se pueda dar inicio a un manejo terapéutico temprano, en aras de la recuperación de la inmunidad sistémica comprometida.














