Introducción
Desde hace años, el cultivo de microalgas se ha llevado a cabo de forma natural o artificial en lagos, estanques abiertos o fotobiorreactores altamente complejos y controlados (Mata et al., 2016). En estos últimos, la energía de la luz es utilizada para generar reacciones metabólicas y así obtener productos como carbohidratos, proteínas, lípidos y pigmentos, los cuales son útiles en el sector agrícola, la química verde y la bioenergía (Veronesi, Ida, D’Imporzano, & Adani, 2015).
Uno de los factores más importantes para lograr una producción de microalgas a escala comercial que sea económica y ambientalmente factible es el desarrollo de sistemas de cultivos sostenibles y rentables (Richmond, 2004), a partir de parámetros como el pH, la temperatura, la intensidad de la luz y la concentración de nutrientes (Moreno-Galván, Rojas-Tapias, & Bonilla, 2012).
Una alternativa viable para algunas especies es el uso de cultivos mixotróficos, en los que la cantidad de luz reduce la producción de CO2 en comparación con los cultivos heterótrofos (Estévez, Barajas, Barajas, & Kafarov, 2013), además de inducir la producción de macromoléculas de alto valor, gracias al efecto regulatorio de la luz (Li, Xu, & Wu, las células de la microalga y se emplea como fuente de nutrientes para mejorar su crecimiento (Devi, Subhash, & Mohan, 2012). Mientras que el fosfato, constituyente del adenosín trifosfato (ATP), aporta la energía necesaria para las actividades metabólicas y contribuye al crecimiento de la microalga.
Lo anterior permite concluir que la concentración de nutrientes en el medio de cultivo de las microalgas es un factor crítico para la obtención de metabolitos de valor agregado. Por tal razón, en este trabajo se diseñaron dos cultivos mixotróficos mediante la modificación simultánea de las concentraciones de nitrógeno y fósforo como fuentes de nutrientes en dos medios suplementados con carbono, a fin de evaluar la producción de biomasa y proteína en Chlorella vulgaris.
Materiales y métodos
Cultivo de microalga
Chlorella vulgaris Beyerinck (Chlorellales: Chlorellaceae), adquirida del cepario de la Universidad de Texas, con código de cultivo UTEX 1803, se cultivó durante 15 días a 25±2 °C, pH 7, en medio Bold Basal modificado (Andersen, Berges, Harrison, & Watanabe, 2005), sin ningún suministro 2007). Sin embargo, aunque este tipo de cultivo es complementario de CO2 y con iluminación de económicamente viable, se requiere de una fuente de carbono de bajo costo y del conocimiento de las concentraciones de experimentación más favorables (Martins et al., 2016), debido a que ciertos cambios en los nutrientes del medio pueden aumentar o inhibir la tasa de crecimiento de las algas (Bhola et al., 2011; Estévez et al., 2013).
Tal es el caso del acetato, que en concentraciones por encima de 1 g/L puede inhibir el crecimiento debido a la intoxicación de las algas, mientras que en concentraciones más bajas estimula el crecimiento y la acumulación de lípidos (Degrenne et al., 2010). De forma similar, el nitrógeno puede incrementar la productividad en la composición de la biomasa, especialmente, de pigmentos y proteínas debido a que este elemento, en forma de nitrato, se asimila en lámparas fluorescentes con un ciclo de luz-oscuridad 12-12 horas.
Se usaron biorreactores rectangulares en vidrio de 2 L (20 cm largo x 20 cm altura x 10 cm ancho), en cuyos extremos inferiores contaban con un suministro de aire continuo por burbujeo (tubo- difusor) con el fin de proveer aire a los cultivos y garantizar que todas las células estuviesen expuestas a la luz y a los nutrientes del medio.
Mejoramiento del cultivo
A fin de mejorar la producción de biomasa y proteínas, se plantearon cultivos mixotróficos con base en diferentes concentraciones de nitrógeno, fósforo y dos fuentes de carbono: acetato de sodio y carbonato de amonio. La concentración de los demás componentes macronutrientes y micro- nutrientes del medio se mantuvo constante según las especificaciones del medio Bold Basal modificado. La tabla 1 presenta la concentración de nitrato de sodio y fosfato de potasio para los cultivos suplementados con acetato de sodio. Este diseño experimental se fundamentó en una composición central no factorial 33 realizada con el software Statistica 7.0 (StatSoft Inc., 2004). Cada uno de los experimentos se realizó por duplicado y tuvo una duración máxima de 15 días. Con la intención de obtener la mayor cantidad de datos estadísticamente viables de cada tratamiento (incluida su réplica), se tomaron muestras por duplicado.
Tabla 1 Diseño experimental para el medio de cultivo con acetato de sodio, nitrato de sodio y fosfato de potasio
| Tratamientos | Acetato de sodio (mM) | Nitrato de sodio (mM) | Fosfato de potasio (mM) |
|---|---|---|---|
| 1 | 10 | 2,94 | 0,57 |
| 2 | 10 | 0,98 | 1,72 |
| 3 | 30 | 2,94 | 1,72 |
| 4 | 30 | 0,98 | 0,57 |
| 5 | 20 | 1,96 | 1,15 |
| 6 | 10 | 2,94 | 1,72 |
| 7 | 10 | 0,98 | 0,57 |
| 8 | 30 | 2,94 | 0,57 |
| 9 | 30 | 0,98 | 1,72 |
| 10 | 3,27 | 1,96 | 1,15 |
| 11 | 36,73 | 1,96 | 1,15 |
| 12 | 20 | 3,6 | 1,15 |
| 13 | 20 | 0,32 | 1,15 |
| 14 | 20 | 1,96 | 0,19 |
| 15 | 20 | 1,96 | 2,11 |
Fuente: Elaboración propia
En el segundo medio de cultivo se empleó carbonato de amonio como fuente de carbono, y se mantuvieron constantes las concentraciones de nitrato y fosfato usadas en el primer experimento (tabla 2).
Tabla 2 Diseño experimental para el medio de cultivo con carbonato de amonio, nitrato de sodio y fosfato de potasio
| Tratamientos | Carbonato de amonio (mM) | Nitrato de sodio (mM) | Fosfato de potasio (mM) |
|---|---|---|---|
| 1 | 1,07 | 2,94 | 0,57 |
| 2 | 1,07 | 0,98 | 1,71 |
| 3 | 3,22 | 2,94 | 1,71 |
| 4 | 3,22 | 0,98 | 0,57 |
| 5 | 2,15 | 1,96 | 1,15 |
| 6 | 1,07 | 2,94 | 1,72 |
| 7 | 1,07 | 0,98 | 0,57 |
| 8 | 3,22 | 2,94 | 0,57 |
| 9 | 3,22 | 0,98 | 1,72 |
| 10 | 0,35 | 1,96 | 1,15 |
| 11 | 3,95 | 1,96 | 1,15 |
| 12 | 2,15 | 3,6 | 1,15 |
| 13 | 2,15 | 0,32 | 1,15 |
| 14 | 2,15 | 1,96 | 0,19 |
| 15 | 2,15 | 1,96 | 2,11 |
Fuente: Elaboración propia
Cuantificación de la biomasa
Para cada uno de los tratamientos se tomaron 5 mL de muestra durante los días 0, 2, 5, 7, 10 y 15 de cultivo, y se midió la absorbancia a 500 nm en un espectrofotómetro Pharo300 Merck. Esta lectura A500 fue correlacionada contra una curva estándar de cantidad de biomasa CB (g/L), de acuerdo con la ecuación 1, la cual fue determinada a partir de biomasa seca del laboratorio. Con la intención de obtener datos estadísticamente fiables se realizaron duplicados por cada tratamiento (incluida su réplica).
CB = 1,316 ×A 500 + 0,173 Ecuación 1
Cuantificación de proteínas
Las proteínas fueron extraídas mediante el método propuesto por Rausch (1981) y empleado por Chen y Vaidyanathan (2012). El proceso fue realizado tres veces, las dos primeras a 80 °C y la última a 100 °C, a fin de extraer completamente las proteínas. Al final, las tres extracciones fueron combinadas y mezcladas antes del análisis. El contenido de proteínas totales en el extracto fue estimado por reacción de Folin-Ciocalteu (Lowry, Rosenbrough, Farr, & Randall, 1951), sistema empleado por Dorey y Dravez (1998). Finalmente, la concentración de proteínas en la muestra se estimó por lectura de la absorbancia en un espectrofotómetro a 750 nm. El calculó del contenido de proteínas en mg de BSA/L se obtuvo a partir de la correlación contra una curva de calibración de solución de proteínas estándar (García-Martínez et al., 2016).
Con la intención de obtener datos estadísticamente fiables se realizaron duplicados por cada tratamiento (incluida su réplica).
Análisis estadístico
Se realizaron diagramas de Pareto con el software Statistica 7.0 (StatSoft Inc., 2004), para conocer la influencia significativa positiva o negativa de las variables de estudio sobre los datos obtenidos con el diseño de experimentos, y se tuvo en cuenta que, cuando las variables cruzan el umbral, existe significancia con un valor p<0,05. Además, se realizaron diagramas de superficie de respuesta de acuerdo con los resultados arrojados por los diagramas de Pareto, y se mantuvieron constantes las mejores condiciones de experimentación, a fin de observar el efecto que tienen las interacciones entre las variables significativas sobre la producción de proteínas.
Resultados y discusión
Concentración de biomasa
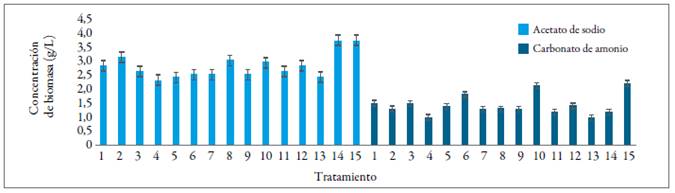
En la figura 1 se presenta la máxima concentración de biomasa obtenida en cada experimento (concentración inicial de 0,2 g/L), en función de la concentración de los nutrientes del cultivo. Se observa que, después de quince días de cultivo con diferentes concentraciones de las fuentes de carbono, nitrógeno y fósforo, en el tratamiento T15 para los experimentos con acetato de sodio y con carbonato de amonio se obtuvieron las mayores concentraciones de biomasa (3,7 y 2,2 g/L respectivamente). De acuerdo con los resultados reportados por Heredia-Arroyo, Wei y Hu (2010) y por Quiao y Wang (2009), el acetato de sodio afecta positivamente la producción de biomasa de especies de Chlorella. Por otra parte, los valores encontrados en este estudio son superiores a los descritos por Devi et al. (2012), quienes reportaron una concentración máxima de biomasa de 1,69 g/L en un cultivo con mecanismo heterotrófico que combinó la modificación de carbono, fósforo y nitrógeno. Así mismo, los estudios de Li et al. (2007) mostraron que la concentración de la biomasa se duplicó cuando el nitrógeno en el medio se agotó. En el presente estudio, las mayores producciones de biomasa se obtuvieron con una concentración de 1,96 mM de nitrato de sodio y altas concentraciones de fosfato (2,11 mM) para ambos experimentos.
Producción de proteínas
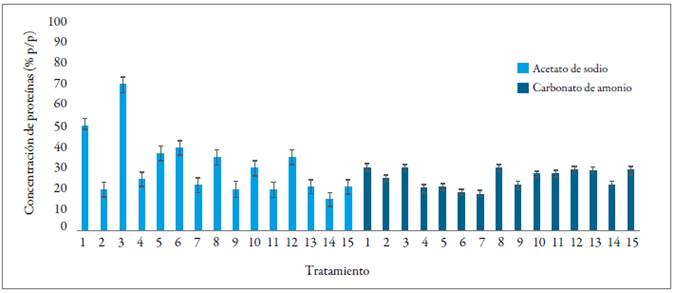
Durante los primeros días de cultivo se obtuvo una baja producción de proteínas con algunos tratamientos, debido a que las microalgas suelen presentar cambios en la composición interna a raíz de la adaptación al nuevo medio de cultivo (Chiranjeevi & Mohan, 2016). La figura 2 muestra el contenido de proteínas totales para cada uno de los experimentos; la mayor producción de proteínas totales se obtuvo en los tratamientos con concentraciones de nitrato de
La concentración de proteínas obtenidas en los experimentos resultó ser mayor a la presentada por Yanna, Nicolas, & Yi (2009), quienes obtuvieron una concentración máxima de proteínas correspon- diente al 32 % de la biomasa, empleando glucosa al 1 % p/v. Sin embargo, Uslu, Isik, Koç, & Göksan (2011) reportaron un aumento en el contenido de proteínas de 8 % a 54 % mediante el aumento en la concentración de nitrógeno, y Porras y Prada (2012) reportaron un rendimiento del 54% p/p.
En la figura 2 también se observa que, para los cultivos suplementados con carbonato de amonio y nitrato de sodio, la mayoría de los tratamientos obtuvo un contenido de proteínas superior al 28 % en la biomasa. En contraste, los estudios realizados por Uslu et al. (2011) indicaron que la deficiencia de nitrógeno en el medio de cultivo causa una reducción en el contenido de proteínas de 53,5 a 5,6%. Otros autores, como Bulut (2009), diseñaron medios de cultivo con deficiencia de nitrógeno y fósforo, y reportaron el menor contenido de proteínas en C. vulgaris (13,01 %) en el cultivo con menor concentración de nitrógeno.
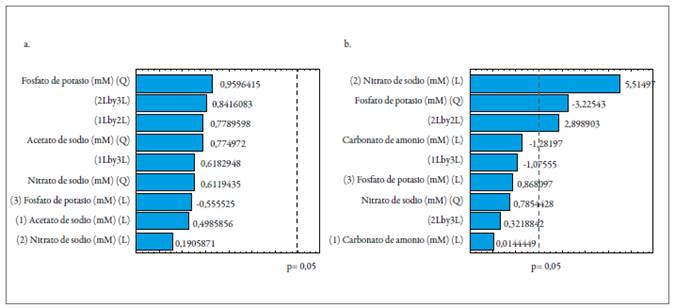
En el diagrama de Pareto de la figura 3A, se observa que en los experimentos realizados con acetato de sodio no existen variables significativas que influyan sobre la producción de proteínas. Mientras que la figura 3B muestra que, para el cultivo con carbonato de amonio, la concentración de nitrato de sodio (5,51497) ejerce una influencia significativa positiva en la producción de proteínas, es decir, a mayor concentración de nitrato, se obtiene una mayor cantidad de este metabolito. Así mismo, el fosfato de potasio ejerce una influencia significativa negativa (-3,22543), pues, a bajas concentraciones de este, se favorece la producción de proteínas. Por último, los resultados demuestran que la fuente de carbono (ya sea acetato o carbonato) no es una variable importante en la deposición de proteínas, aun cuando el carbonato de amonio puede aumentar la concentración final de nitrógeno.
Fuente: Elaboración propia
Figura 3 Diagrama de Pareto obtenido con base en la producción de proteínas. a. Acetato de sodio; b. Carbonato de amonio.
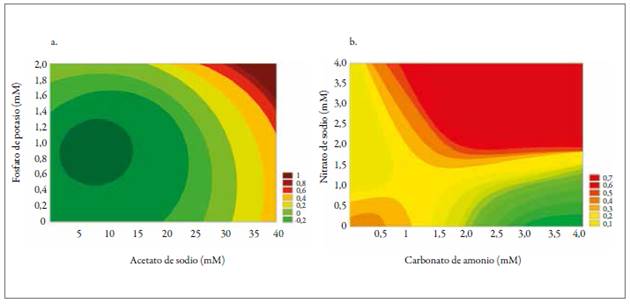
La superficie de respuesta presentada en la figura 4a para la producción de proteínas con acetato de sodio muestra que la mayor producción (1 g/L) se obtiene con 36,73 mM de acetato, 3,6 mM de nitrato y 2,11 mM de fosfato. Sin embargo, pueden obtenerse concentraciones superiores de proteínas usando concentraciones más altas de acetato, nitrato y fosfato. Fábregas, Abalde, & Herrero (1989) realizaron estudios en los que se evidenció que una variación en la concen- tración de nitrato de sodio influye en la producción de proteínas, de manera que esta última siempre será proporcional al nitrato usado como fuente de nitrógeno.
Fuente: Elaboración propia
Figura 4 Superficie de respuesta para la producción de proteínas. a. Acetato de sodio; b. Carbonato de amonio.
Por otra parte, la figura 4b permite observar que la mayor concentración de proteínas (0,5 g/L) se obtuvo con cantidades de 3,947 mM de carbonato de amonio, 3,6 mM de nitrato de sodio y 1,147 mM de fosfato de potasio. Además, las concentraciones de carbonato de amonio y de nitrato de sodio son directamente proporcionales a la producción de proteínas totales en la biomasa. Este resultado concuerda con los estudios realizados por Ördög, Stirk, Balint, Van Staden, & Lovasz (2012), quienes reportaron un incremento en la concentración de proteínas los días en que se contaba con una mayor reserva de nitrógeno.
Conclusiones
En este estudio, la utilización de dos cultivos mixotróficos con diferentes concentraciones de fuentes de nutrientes permitió evaluar la producción de biomasa y proteínas de C. vulgaris. A partir de los resultados, se concluye que el cultivo suplementado con acetato de sodio llevó a la obtención de la mayor producción de biomasa (3,7 g/L) y de proteínas (60 %). Sin embargo, el diagrama de Pareto permitió observar que para este medio de cultivo no existieron variables significativas que influyeran sobre la producción de proteínas, mientras que, para el medio de cultivo con carbonato, el nitrato de sodio y el fosfato de potasio influyeron de manera directa e inversamente proporcional sobre la producción de este metabolito, respectivamente. En general, los resultados demuestran el potencial que tienen las microalgas como fuente principal de materia prima de una biorrefinería basada en cultivos mixotróficos, para la obtención de productos de alto valor agregado.