Introducción
El uso de las biotecnologías de la reproducción asistida tiene como finalidad modernizar la industria ganadera mediante la multiplicación rápida de animales de alto valor genético, y ha sido la base fundamental de la pecuaria mundial (Moore & Hasler, 2017). Varios estudios han encontrado que diversos factores que afectan los programas de producción de embriones in vitro son determinantes de los buenos resultados de dichos procesos (Al-Katanani et al., 2002; Boediono et al., 1995; De Wit et al., 2000; Parrish et al., 1995; Pavlok et al., 1992; Snijders et al., 2000; Torres-Júnior et al., 2008).
La progesterona (P4) tiene un papel importante en la reproducción bovina. Inicialmente fue descrita por Fonseca et al. (1983), quienes evaluaron elevadas concentraciones de la hormona doce días antes de la inseminación artificial e identificaron que tiene una relación con altas tasas de concepción en vacas lecheras. No obstante, se han realizado pocos trabajos que indiquen el efecto de la progesterona plasmática en la calidad ovocitaria y el desarrollo embrionario in vitro. Según Lonergan y Sánchez (2020), aunque la función de la progesterona en la calidad ovocitaria y el desarrollo embrionario no está completamente esclarecido, se considera que tiene un efecto directo en la calidad de los ovocitos, el desarrollo inicial embrionario y fetal, el mantenimiento de la fase lútea y la composición del líquido uterino.
Asimismo, un resultado previo indicó que la administración exógena de progesterona o progestágenos aplicados antes de la aspiración folicular mejoró la competencia para el desarrollo de los ovocitos y la producción de embriones in vitro (Pfeifer et al., 2009). Por su parte, Pirestani et al. (2011) indicaron que la presencia del cuerpo lúteo en el momento de la aspiración folicular no está necesariamente asociada al mejoramiento de la calidad ovocitaria, sino al mejoramiento de la competencia de los ovocitos para la obtención y desarrollo de embriones in vitro.
También se ha observado que una mayor concentración plasmática de progesterona mejora el tamaño embrionario y por ende la tasa de gestación (Lonergan, 2011; Lonergan & Sánchez, 2016; Lonergan, Forde et al., 2016; Lonergan, Woods et al., 2007). En contraste, se determinó que bajos niveles de progesterona incrementan la frecuencia de los pulsos de la hormona luteinizante (LH), estradiol, hormona del crecimiento (GH), la insulina y el factor de crecimiento similar a insulina -1 (IGF-1), aspectos relacionados con la proliferación celular, la esteroidogénesis, el crecimiento folicular, la calidad ovocitaria (El-Sherry et al., 2010) y la reserva ovárica (Evans et al., 2012). Por último, Saad et al. (2019) concluyeron que en ovocitos oriundos de vacas Bos taurus indicus cíclicas, la progesterona ejerce un efecto positivo sobre la calidad ovocitaria, pues mejora las tasas de clivaje y de embriones en relación con vacas acíclicas. Adicionalmente, en vacas Bos taurus taurus, Abreu et al. (2018) concluyeron que la progesterona en concentraciones altas o bajas no presenta efecto sobre el mejoramiento de la calidad ovocitaria.
Específicamente, el objetivo de este estudio fue evaluar el efecto de la progesterona plasmática en la competencia para el desarrollo de embriones in vitro en vacas Bos taurus taurus (Holstein) y Bos taurus indicus (Gyr).
Materiales y métodos
El estudio se desarrolló con base en los siguientes criterios: brindar los cuidados adecuados a los animales según su etología, evitando dolor innecesario, sufrimiento, estrés o lesiones prolongadas. Así mismo, evitando la duplicación o repetición innecesaria de experimentos y reduciendo al mínimo indispensable el número de animales para garantizar la validez de la investigación (Garcés & Giraldo, 2012).
Selección de los animales y lugar
Se utilizaron doce vacas multíparas (Holstein, n = 6, 567 kg ± 43 y Gyr, n = 6, 473 kg ± 51), no lactantes, no gestantes, con edades entre los 4 y los 8 años. Todos los animales fueron mantenidos con pasturas a base de Brachiaria decumbens y Brachiaria brizantha, con suplementación mineral (60 g/día/vaca) y agua ad libitum. El estudio fue realizado en condiciones tropicales con temperatura y precipitación promedio anual de 22 °C y 1.163 mm, respectivamente.
Diseño experimental
Las hembras de ambas razas fueron distribuidas en tres grupos experimentales: grupo control, progesterona baja y alta. Para remover el efecto animal sobre los resultados, todas las vacas pasaron por los tres tratamientos. A cada grupo experimental le fueron realizadas tres repeticiones y el intervalo entre aspiraciones fue de 22 días. Antes de cada aspiración folicular, los animales fueron sometidos a un nuevo protocolo hormonal para sincronizar la onda folicular.
Protocolo de sincronización de la onda folicular
Los animales del estudio fueron previamente sometidos a una sincronización exclusivamente con dos aplicaciones de 150 μg de D-cloprostenol (Prolise®, Tecnopec Ltda., Brasil), en intervalo de once días, con el objetivo de eliminar la síntesis y la secreción de progesterona endógena mediante la regresión del cuerpo lúteo. Tres días después las vacas se asignaron a uno de tres grupos experimentales:
Grupo control (3 sesiones de aspiración folicular guiada por ecografía (OPU)): las donadoras de este grupo fueron sometidas a niveles subluteales (< 1 ng/mL) de progesterona plasmática, motivo por el cual no recibieron implante auricular de norgestomet (Crestar®, Intervet, Brasil) y recibieron una tercera dosis de D-cloprostenol tres días antes de la OPU.
Segundo grupo experimental (progesterona plasmática baja): se realizaron tres sesiones de OPU con los animales y recibieron un implante auricular de norgestomet de segundo uso.
Tercer grupo experimental (progesterona plasmática alta): se realizaron tres sesiones de OPU con los animales y recibieron dos implantes auriculares de norgestomet nuevos.
El protocolo de sincronización de la onda folicular fue complementado con la administración de 2 mg de benzoato de estradiol (RIC-BE®, Tecnopec Ltda., Brasil). Los implantes auriculares de norgestomet fueron removidos 24 horas después de la aspiración folicular, momento en el cual se inició un nuevo protocolo hormonal.
Aspiración folicular guiada por ecografía
La OPU se realizó siete días después del inicio del protocolo de sincronización en folículos con un diámetro de ≥ 3 mm a 9 mm. Para ello se utilizó una aguja desechable de 20 “G” (WTA-Vet, Brasil), acoplada a una línea de teflón con presión negativa de 70 mm/Hg. Previamente a la aspiración, se aplicó anestesia epidural (0,2 mg/kg de Bloc® J. A. Saúde Animal, Brasil) entre la última vértebra sacra y la primera coccígea, y se contaron los folículos de ambos ovarios con ayuda de un ecógrafo (Mindray, DP 2200 VET, China), equipado con transductor microconvexo de 7,5 MHz de frecuencia, acoplado a una guía transvaginal para aspiración folicular.
Se empleó un tubo cónico de 50 mL con 5 mL de D-PBS (D-PBS®, Vitrocell, Brasil), suplementado con 0,1 % de heparina (Liquemine., Roche, Brasil) y 1 % de suero fetal bovino (Gibco BRL, Grand Island, NY), en cada animal para colectar el fluido folicular y los ovocitos. Una vez colectado el líquido folicular, fue transferido a un filtro EmCon (Agtech, USA), adicionando 100 mL de D-PBS para remover los coágulos y las células. Las estructuras restantes CCO (complejos cúmulos-ovocitos) fueron lavadas en TCM 199 tamponado con HEPES (TCM-199; Gibco BRL, Grand Island, NY) más 10 % de suero fetal bovino (Gibco BRL, Grand Island, NY), 16 μg/mL de piruvato sódico y 83,4 μg/mL de amicacina (Instituto Biochimico, Río de Janeiro, Brasil). Se consideraron ovocitos viables para maduración in vitro los CCO grado I (tres o más capas de células del cúmulos) y II (dos capas de células del cúmulos), clasificados de acuerdo con la cantidad de células del cúmulo y aspecto homogéneo del citoplasma. La clasificación de los CCO fue realizada conforme a lo descrito por Sato et al. (1990).
Maduración in vitro
Los CCO viables fueron madurados durante 24 horas en medio TCM 199, suplementado con HEPES (25 mM), 10 % de SFB, 1,0 μg/mL de FSH (Folltropin™, Bioniche Animal Health, Belleville, Canadá), 50 μg/mL de hCG (Profasi™, Serono, São Paulo, Brasil), 1,0 μg/mL de estradiol, 16 μg/mL de piruvato sódico, ITS (5 ug/mL de insulina - transferrina - selenio), 83,4 μg/mL de amikacina y cubiertos con aceite mineral estéril (Sigma-Aldrich Co, Estados Unidos). Las condiciones atmosféricas fueron 38,7 ºC, 6 % de CO2, 5 % de O2 y 89 nitrógeno.
Fertilización in vitro
Después de la maduración, los ovocitos fueron sometidos a fertilización in vitrodurante 15 a 18 horas. Fue utilizado medio FERT-TALP suplementado con 0,6 % de BSA, 10 μg/mL de heparina, 18 μM de penicilamina, 10 μM de hipotaurina, 1,8 μM de epinefrina y cubiertos con aceite mineral estéril.
Las pajillas utilizadas para la fertilización in vitro fueron descongeladas a 35 °C durante 30 segundos, y el contenido fue vertido cuidadosamente sobre el gradiente de Mini - Percoll 45 / 90. La dosis inseminante para cada gota fue de 1,0 x 106 espermatozoides/mL. El semen de la raza Gyr fue utilizado para fertilizar los ovocitos de las vacas Holstein, y el semen de Holstein fue usado para fecundar los ovocitos de las vacas Gyr. Este protocolo de fertilización se realizó con la finalidad de obtener embriones F1.
Cultivo in vitro
Después del periodo de fertilización, los presuntos cigotos fueron transferidos separadamente por donadora a gotas de 100 μL de medio SOF, suplementado con 2,5 % de SFB, 6 mg/mL de BSA, 16 μg/mL de piruvato sódico, 83,4 μg/mL de amikacina, 2,8 mM de mioinositol, 340 μM de citrato de trisodio dihidratado y recubiertas con aceite mineral estéril durante siete días. Cada 48 horas el medio fue removido y sustituido el 50 % del volumen de cada gota. A las 72 a 96 horas posfecundación se evaluó la tasa de clivaje con la formación de dos células. Los embriones fueron clasificados según la Sociedad Internacional de Tecnología de Embriones (Stringfellow & Givens, 2010).
Concentración de progesterona exógena en sangre
Para hacer la cuantificación plasmática de progesterona se colectaron muestras de 5 ml de sangre de la vena coccígea en el día de la aspiración folicular. Las muestras fueron centrifugadas a 3.000 G durante veinte minutos. Una vez obtenido el plasma, este fue almacenado en criotubos hasta su utilización. Los análisis se realizaron en el Laboratorio de Reproducción y Mejoramiento Genético Animal de la Universidade Estadual do Norte Fluminense Darcy Ribeiro (Campos dos Goytacazes, Río de Janeiro, Brasil), mediante la técnica de radioinmunoensayo (RIE) en fase sólida, para lo cual se empleó el kit comercial Coat-A-Count. 17α-OH Progesterone (Siemens, Los Ángeles, EE. UU.). Todos los procedimientos se realizaron de acuerdo con la metodología propuesta por el fabricante. Específicamente, se hicieron tres ensayos, cada uno con sensibilidad de 0,03 ng/mL. El coeficiente de variación interensayo fue de 4,1 % y los coeficientes de variación intraensayos fueron de 5,4 %, 4,3 % y 4,9 %, para los ensayos 1, 2 y 3, respectivamente.
Análisis estadístico
Los datos fueron analizados en el software Statgraphics Centurion XVIII. Para la concentración plasmática de la progesterona, la tasa de recuperación, la tasa de ovocitos viables, la tasa de clivaje y la tasa de blastocistos se calcularon las medias y la desviación estándar (DE), y se compararon usando ANOVA de una sola vía después de realizar pruebas de normalidad para el cumplimiento de dicho supuesto. Variables con efecto significativo (P < 0,05) fueron comparadas por el método LSD de Fisher.
Resultados y discusión
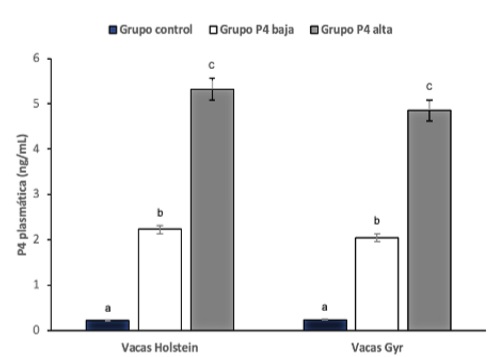
En la figura 1 se presenta la concentración plasmática de la progesterona en las vacas Holstein: grupo control (0,22 ± 0,15 ng/mL), progesterona baja (2,23 ± 0,17 ng/mL) y progesterona alta (5,32 ± 0,22 ng/mL), P < 0,05 entre grupos. Esta misma tendencia se presentó en los grupos de las vacas Gyr: grupo control (0,24 ± 0,19 ng/mL), grupo progesterona baja (2,05 ± 0,17 ng/mL) y grupo progesterona alta (4,85 ± 0,20 ng/mL). Además, en ambos grupos genéticos se observó durante todo el período experimental ausencia de ovulación y formación del cuerpo lúteo.
Fuente: Elaboración propia.
Figura 1 Concentración de progesterona plasmática (ng/mL) en vacas Holstein y Gyr. a, b y c = Grupo racial con letras minúsculas distintas difieren entre sí (P < 0,05).
Estos resultados fueron semejantes a estudios anteriores, los cuales indicaron alta eficiencia del norgestomet en la supresión del comportamiento del estro y de la ovulación (Kesler, Dyson et al., 1997; Kesler, Favero, et al., 1995; Machado & Kesler, 1996; McGuire et al., 1990). Según Wishart (1972), revisado por Machado y Kesler (1996), fueron necesarios diariamente 137 a 140 μg de norgestomet o 45 mg de progesterona para suprimir la manifestación del estro en novillas Bos taurus taurus, motivo por el cual los autores sugieren que el norgestomet es 321 veces más potente que la progesterona natural. Un estudio posterior constató que los receptores de la progesterona presentaron mayor afinidad de unión al norgestomet en relación con la progesterona endógena (14,2 % vs 1,1 %, respectivamente) (Perry et al., 2005).
Existen muy pocos estudios relacionados con el uso de implantes auriculares de norgestomet de segundo uso. No obstante, Maluf et al. (2010) y Uribe et al. (2013) concluyeron que las tasas de gestación no son afectadas en vacas cebuinas cuando son sincronizadas con implantes auriculares de norgestomet de segundo uso.
En cuanto a la concentración de la progesterona del presente estudio, los resultados fueron semejantes a los descritos por Santiago et al. (2001) y Adams et al. (2008), cuyos trabajos determinaron que los niveles de esta hormona desde el día del estro, hasta el tercer día del ciclo estral, fueron menores a 1 ng/mL, momento desde el cual se eleva hasta alcanzar niveles superiores a 4 ng/mL el 14.º día del ciclo estral. De manera similar, Cerri et al. (2011) confirmaron estos hallazgos en vacas Holstein en lactación. No obstante, estos mismos autores presentaron niveles plasmáticos similares entre los grupos progesterona baja y alta, lo cual diverge de los resultados de la presente investigación, pues se observó mayor concentración (P < 0,05) para el grupo de progesterona alta en comparación con el de progesterona baja en ambos grupos raciales.
Paralelamente, otro estudio constató niveles de progesterona menores a 0,5 ng/mL durante el protocolo de sincronización en animales con ausencia de cuerpo lúteo, y en aquellos con presencia de dicha estructura la concentración plasmática fue superior a 2 ng/mL (El-Sherry et al., 2010). Estos hallazgos fueron concurrentes con los de este trabajo, según los cuales las hembras del grupo control que fueron inducidas a la ausencia del cuerpo lúteo presentaron niveles subluteales de progesterona (< 1 ng/mL). Recientemente, Saad et al. (2019), en concordancia con el actual estudio, obtuvieron niveles de progesterona mayores en vacas Bos taurus indicus cíclicas respecto de los animales en estado acíclico (4,2 ± 0,4 vs 0,5 ± 0,2 ng/mL, respectivamente)
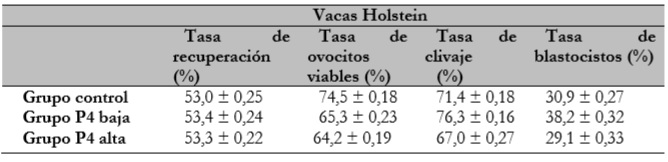
Los valores que se presentan en la tabla 2 evidencia que las vacas de raza Holstein no presentaron efecto (P > 0,05) sobre las variables tasa de recuperación, tasa de ovocitos viables, tasa de clivaje y tasa de blastocistos.
Tabla 2 Efecto de la progesterona plasmática sobre la tasa de recuperación de ovocitos la tasa de ovocitos viables la tasa de clivaje y la tasa de blastocistos en vacas de raza Holstein
Los datos están descritos como media ± DE.
Fuente: Elaboración propia.
Estos resultados son consistentes con los presentados por Abreu et al. (2018), quienes obtuvieron concentraciones altas o bajas de progesterona en donadoras Bos taurus taurus antes de la OPU, sin presentar efecto sobre la calidad ovocitaria.
Es importante indicar que, en condiciones tropicales, el estrés calórico puede generar en este tipo de razas baja calidad de los ovocitos y baja producción de embriones de origen in vitro e in vivo. Si bien es cierto que en el actual estudio no se evaluó el efecto de la temperatura ambiental sobre el desempeño de las hembras Holstein, un estudio reciente fue concluyente en resaltar que la calidad de los ovocitos, el desarrollo embrionario y las tasas de gestación sí son afectadas notablemente por el estrés calórico en donadoras de este grupo genético (Oliveira et al., 2019).
Otro aspecto clave en los programas de producción de embriones in vitro en Bos taurus taurus está relacionado con el día de la aspiración folicular: en este trabajo la técnica se aplicó tres días después de la emergencia de la nueva onda folicular. Según Ferreira et al. (2009) y Gimenes (2010), la asociación del norgestomet y del benzoato de estradiol inducen a la emergencia de una nueva onda folicular aproximadamente cuatro días después del inicio del protocolo hormonal. Por lo tanto, se considera que el mejor momento para la aspiración oscila entre el segundo y quinto día después de la emergencia de la nueva onda folicular (Hendriksen et al., 2004). En este mismo trabajo, los autores también indicaron que la mejor calidad ovocitaria de vacas Holstein la encontraron en ovarios que presentaron cuerpo lúteo menor a tres días de formación; no obstante, la presencia de un cuerpo lúteo funcional no mejoró la calidad de los ovocitos recuperados (Hendriksen et al., 2004).
Estas observaciones son semejantes a las realizadas en la actual investigación, en la cual se encontró que los diferentes niveles de la progesterona plasmática no influyeron la tasa de ovocitos viables, la tasa de clivaje ni la tasa de blastocistos. Esto confirma lo reportado por Chian et al. (2002) y Takuma et al. (2007), en el sentido de que la presencia del cuerpo lúteo en el momento de la aspiración folicular no tiene efecto sobre la producción de embriones in vitro en razas taurinas. Contrario a todas estas observaciones, Machatková et al. (2004) hallaron en bovinos de raza Holstein mayor producción de blastocistos en la fase de crecimiento folicular —con presencia de CL (24,3 %), respecto de la fase de dominancia folicular— sin CL (12,1 %).
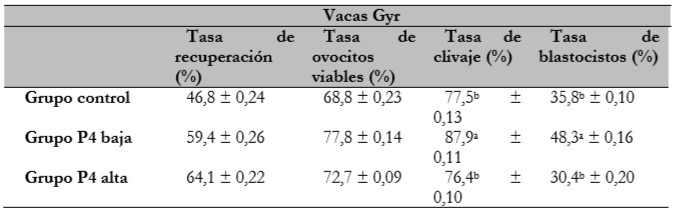
Ahora bien, los resultados de las hembras de raza Gyr (tabla 3) evidencian que hay una diferencia (P < 0,05) entre los tratamientos en las variables tasa de clivaje y tasa de blastocistos del grupo progesterona baja, respecto de los grupos control y progesterona alta.
Tabla 3 Efecto de la progesterona plasmática sobre la tasa de recuperación de ovocitos la tasa de ovocitos viables la tasa de clivaje y la tasa de blastocistos en vacas de raza Gyr
Los datos están descritos como media ± DE.
a,bLetras minúsculas distintas, en la misma columna, difieren entre sí (P < 0,05).
Elaboración propia.
A pesar de que en los resultados del presente trabajo no se observó efecto sobre la tasa de ovocitos viables para ninguno de los tres grupos (control, progesterona baja y alta), los niveles circulantes de progesterona en razas cebuinas sí presentan efecto directo sobre la calidad ovocitaria (Saad et al., 2019). Con base en esto se sabe que la frecuencia de la secreción pulsátil de la GnRH y de la LH es regulada por la progesterona, de manera que a menor concentración de progesterona durante la fase de crecimiento folicular, mayor es la frecuencia pulsátil de la LH (Fair & Lonergan, 2012). Como consecuencia, se considera que la LH es un promotor de la maduración y de la calidad ovocitaria (Chaubal et al., 2007).
Según Pfeifer et al. (2009), bovinos (Bos taurus indicus x Bos taurus taurus) que fueron sometidos a protocolos hormonales con bajos niveles plasmáticos de progesterona presentaron ovocitos de mejor calidad y mayor producción de embriones in vitro. Estos hallazgos son parcialmente similares a los del actual trabajo con las vacas Gyr, en los cuales el grupo de progesterona baja presentó mayor tasa de embriones en relación con los grupos control y progesterona alta. De acuerdo con esto, también es importante resaltar que las vacas Gyr que fueron tratadas para manifestar niveles subluteales de progesterona (grupo control) presentaron tasas óptimas de clivaje (Chauhan et al., 1999) y de blastocistos (Hasler et al., 1998); de hecho, fueron estadísticamente similares a las observadas por el grupo de progesterona alta.
Asimismo, de acuerdo con Fair y Lonergan (2012) y Lonergan y Sánchez (2020), la maduración ovocitaria es la fase más crítica de la producción in vitro de embriones, pues les permite a dichas estructuras alcanzar el potencial de desarrollo para la inducción de numerosos cambios morfológicos y bioquímicos. Algunos trabajos reportaron que la progesterona probablemente está relacionada con un efecto antiapoptótico sobre las células del cúmulos, lo cual favorece que los ovocitos adquieran la competencia para el desarrollo in vitro (Friberg et al., 2009; Salhab et al., 2011). Los resultados en las hembras Gyr indicaron que una alta circulación de progesterona en la sangre no tuvo efecto sobre la producción de embriones. No obstante, las vacas que fueron sometidas a concentraciones bajas de progesterona mostraron mejores tasas de blastocistos, mecanismo asociado con el incremento en la frecuencia de los pulsos de la LH, hormona que posiblemente está relacionada con un efecto antiatrésico, de manera que favorece la competencia ovocitaria y el desarrollo embrionario.
Conclusiones
Los resultados del estudio permiten concluir que la progesterona tiene un efecto en el desarrollo embrionario en vacas de raza Gyr, efecto que no se evidencia en vacas de raza Holstein. Por este motivo es necesario realizar nuevos estudios que puedan determinar el efecto de la progesterona sobre la producción de embriones in vitro en vacas Holstein.















