Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.67 no.1 Medellín Jan./June 2014
https://doi.org/10.15446/rfnam.v67n1.42604
http://dx.doi.org/10.15446/rfnam.v67n1.42604
Evaluación de Insecticidas para el Manejo de Monalonion velezangeli, Carvalho & Costa (Hemiptera: Miridae) en Aguacate
Evaluation of Insecticides for Monalonion velezangeli, Carvalho & Costa (Hemiptera: Miridae) management in Avocado
Jimena Montilla Pérez1; Martha Eugenia Londoño Zuluaga2; Danilo Augusto Monsalve García3 y Guillermo Antonio Correa Londoño4
1 Estudiante Ingeniería Agronómica. Corpoica, C.I. La Selva. Vereda Llanogrande km 7 vía las Palmas, Rionegro, Colombia. <jmontillap@unal.edu.co>
2 Investigador Master.. Corpoica, C.I. La Selva. Vereda Llanogrande km 7 vía las Palmas, Rionegro, Colombia. <mlondono@corpoica.org.co>
3 Investigador Profesional. Corpoica. C.I. La Selva. Vereda Llanogrande km 7 vía las Palmas, Rionegro, Colombia. <damg29@gmail.com>
4 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias - Departamento de Ciencias Agronómicas. A.A. 1779, Medellín, Colombia. <gcorrea@unal.edu.co>
Recibido: Junio 19 de 2012; aceptado: Agosto 29 de 2013.
Resumen. La chinche monalonion, coclicllo o chupanga (Monalonion velezangeli) causa daños en brotes terminales de aguacate, afectando el desarrollo del árbol; en frutos causa secamiento y, por lo tanto, rechazo en la comercialización. Aún no existen estrategias para el manejo de la plaga y los productores utilizan insecticidas sin previa evaluación de su efectividad. Se evaluaron insecticidas con un nuevo modo de acción sobre M. velezangeli bajo condiciones controladas. Se utilizó un diseño de bloques completos al azar, con once tratamientos y cuatro repeticiones. Los tratamientos fueron los insecticidas deltametrina, l-cihalotrina, imidacloprid, thiametoxam, spinosad, spiromesifen, diflubenzurón, diafentiurón, una mezcla de thiametoxam + l-cihalotrina; y además, un testigo relativo (agua) y un testigo absoluto (sin aplicación). La unidad experimental consistió de un arbusto de guayaba común con diez insectos confinados en una jaula de tela tul. Los tratamientos se aplicaron una vez con los insectos confinados en la jaula. Se identificó que deltametrina, l-cihalotrina, thiametoxam, imidacloprid y la mezcla de thiametoxam más l-cihalotrina causan mortalidad entre 85 y 100% sobre M. velezangeli, 24 horas después de ser aplicados y 3 días después la mortalidad alcanza el 100%. Estos productos pueden ser incluidos en un programa de manejo integrado para M. velezangeli. El diafentiurón causa mortalidades entre 51-81%. No se evidenció efecto de diafentiurón, diflubenzurón y spiromesifen sobre la progenie de adultos expuestos, pero ninfas tratadas que alcanzaron el estado adulto, dieron origen a un menor número de ninfas; sin embargo, este efecto debe dilucidarse mejor.
Palabras clave: Piretroides, neonicotinoides, diafentiurón, diflubenzurón.
Abstract. The bug monalonion, coclicllo o chupanga (Monalonion velezangeli) generates damage in avocado end buds, affecting the tree development. When the attack is located on the fruit it causes its drying and therefore its rejection. There are no strategies to manage this plague, so producers use insecticides without any evaluation about their effectiveness. In this research, we evaluated insecticides with a novel mode of action on M. velezangeli under controlled conditions. We used a randomized complete block design, with eleven treatments and four replications. The treatment set was composed by deltamethrin, l-cyhalothrin, imidacloprid, thiamethoxam, spinosad, spiromesifen, diflubenzuron, diafentiuron, a mixture of thiamethoxam + l-cyhalothrin; and additionally, a control treatment with water and a control treatment with no application. The experimental unit was a common guava shrub with ten insects confined within a tul cage. Treatments were applied once with the insects inside the cage. Deltamethrin, l-cyhalothrin, thiamethoxam, imidacloprid and the mixture of thiamethoxam + l-cyhalothrin caused mortalities between 85 and 100% on M. velezangeli 24 hours after being applied; three days after application, mortality is 100%. These products can be included in an integrated pest management program for M. velezangeli. Diafenturion caused mortalities between 51 and 81%. No effect of diafenturion, diflubenzuron or spiromesifen was evidenced on exposed adult progeny, but treated nymphs that became adult originated a lesser quantity of nymphs. This effect should be better elucidated.
Key words: Pyrethroids, neonicotinoids, diafenthiuron, diflubenzuron.
El cultivo de aguacate está en crecimiento en Colombia, gracias a la apuesta exportadora frutícola del Ministerio de Agricultura y Desarrollo Rural (BIRD, 2007). Monalonion velezangeli Carvalho & Costa, 1988 (Hemiptera: Miridae) constituye un problema entomológico limitante en la producción de este cultivo; este insecto causa daño en hojas, frutos, brotes terminales e inflorescencias (Arango y Arroyave, 1991). El insecto, al alimentarse del tejido vegetal, causa una lesión de color café claro con presencia de exudado; con el tiempo, el daño en el fruto a punto de cosecha puede confundirse con una enfermedad fungosa. Si el daño se produce en frutos pequeños estos se pasman y se secan; las hojas, brotes vegetativos e inflorescencias se rajan y se marchitan (Arango y Arroyave, 1991; Londoño, 2008). Se han identificado aproximadamente 16 plantas hospederas de M. velezangeli (Franco y Giraldo, 1999; Ramírez-Cortez et al., 2008; Giraldo et al., 2009; Londoño y Vargas, 2010; Giraldo et al., 2011), siendo la guayaba común el mejor hospedero de este insecto según diferentes parámetros biológicos, como número de huevos emergidos y sobrevivencia de ninfas y adultos (Londoño, 2010). Arango y Arroyave (1991) reportan pérdidas entre el 50 y 80% de la producción en aguacate, pudiendo ascender hasta el 100%. Londoño (2010) encontró pérdidas en fruto entre un 7 a 42% a finales del 2008, y para un precio promedio de $1.700 por kilo (CCI, 2011) representa una pérdida entre 1.500 y 9.300 millones de pesos al año.
La información sobre manejo de este insecto es escasa. En el cultivo de cacao, para el caso de M. dissimulatum, se recomienda el manejo de podas dado que este insecto se ve favorecido por el sombrío; caso contrario ocurre con M. annulipes, pues esta especie se adapta a la alta luminosidad; también se aconseja hacer recolección y destrucción manual de los insectos en sus diferentes estados, o quemarlos mediante flameo con una antorcha en los sitios en donde se agrupan los insectos (Vivas et al., 2005; Pinzón et al., 2008). Pinzón et al. (2008) proponen la aplicación de hongos entomopatógenos como Beauveria bassiana, reportando porcentajes de mortalidad del 94%. En cuanto al manejo de M. velezangeli, en el cultivo de café, en donde ha causado graves daños, Ramírez-Cortez et al. (2008) coinciden con los autores citados anteriormente con la recolección y destrucción manual de los insectos; además, proponen mantener una cobertura de arvenses para que la chinche encuentre otra fuente de alimentación. Arango y Arroyave (1991), Pinzón et al. (2008) y Ramírez-Cortez et al. (2008) se refieren al control químico como una alternativa que ha de usarse exclusivamente cuando los niveles de población causan daños al cultivo, realizando aplicaciones en focos en donde se observe daño fresco. Arango y Arroyave (1991) proponen insecticidas organofosforados, Ramírez-Cortez et al. (2008) proponen utilizar insecticidas químicos, categoría III, haciendo rotación de los siguientes ingredientes activos: malation, pirimifos metil, fenitrotion o clorpirifos, a una dosis comercial de 4 mL L-1, utilizando 300 L por hectárea, lo que equivale a 1.200 mL de producto comercial. Finalmente, Londoño (2008) sugiere el manejo de M. velezangeli en aguacate, mediante la regulación de la copa del árbol; en caso de infestaciones, recomienda la aplicación en rotación de los ingredientes activos lambda-cihalotrina y la mezcla de clorpirifos con cipermetrina, en dosis de 5 mLL-1, cada 15 días, por tres veces consecutivas. La indicación de uso de insecticidas químicos de los autores anteriores obedece a respuestas basadas en su experiencia más que a los resultados de investigaciones. Por lo tanto, la búsqueda de insecticidas químicos eficientes para el manejo de altas poblaciones de M. velezangeli constituye un aporte fundamental para establecer las estrategias de manejo integrado del insecto. Actualmente, existen en el mercado insecticidas que se caracterizan porque utilizan menor cantidad de ingrediente activo por área, logrando un control efectivo sobre el insecto plaga; dentro de ellos se encuentran los piretroides, neonicotinoides, spinosinas, ketoenoles, inhibidores de quitina e inhibidores de síntesis de ATP; los cuales están siendo ampliamente usados por los agricultores.
Los piretroides, los neonicotinoides y las spinosinas afectan el sistema nervioso central (SNC) y periférico de los insectos. Se presume que los piretroides prologan el tiempo en que los canales de sodio (Na) se mantienen abiertos en las membranas neuronales, lo que permite a los iones Na entrar al axón y producir una descarga anormal de neuronas; además afectan los canales de Cloro (Cl) disminuyendo su corriente y potenciando la acción en los canales de Na (Anadón et al., 2009). Los neonicotinoides y las spinosinas actúan sobre los receptores post-sinápticos nicotinérgicos de la acetilcolina; los primeros, simulando la acetilcolina e inhibiendo la acetilcolinesterasa, produciendo un bloqueo irreversible de los receptores (Liu y Casida, 1993; Ishaaya y Degheele, 1997; Ware y Whitacre, 2004); y los segundos, alterando el ligamento de la acetilcolina en los receptores, con lo que se afectan las funciones neuronales (Salgado et al., 1997; Ware y Whitacre, 2004). Sin embargo, en el sistema nervioso central los sitios de unión del spinosad y el imidacloprid son diferentes (Orr et al., 2009). La manifestación de síntomas es similar en los tres grupos de insecticidas; se produce una excitación neuronal, que resulta en contracciones, convulsiones, parálisis y muerte (Liu y Casida, 1993; Salgado, 1998; Ware y Whitacre, 2004, Anadón et al., 2009). El piretroide deltametrina, mostró ser eficiente para el manejo de un amplia gama de insectos plaga (Hungenberg, 2009). El Imidacloprid, un neonicotinoide, es usado para tratamiento del suelo, de semilla y foliar contra insectos chupadores (Ware y Whitacre, 2004). Las spinosinas se usan contra larvas de Lepidoptera, minadores de hoja, trips y termitas, con larga duración residual (Ware y Whitacre, 2004).
Los ketoenoles, son derivados del ácido tetrónico (Liu, 2004); actúan inhibiendo la acetil-CoAcarboxilasa, enzima encargada de la degradación de los ácidos grasos. Estos productos posiblemente causan oviposición de huevos infértiles (Marčić et al., 2011). El spiromesifen, molécula de este grupo, causó mortalidades del 99,6 a 100%, en ninfas de instar I y II de Bemisia tabaci; las ninfas eclosionadas de huevos tratados murieron 7 días después de la aplicación (Liu, 2004), con lo que se presume un efecto de persistencia del producto en campo, que logró causar mortalidad a las ninfas eclosionadas.
Los inhibidores de la síntesis de quitina (benzoilúreas) interfieren en el desarrollo normal de la metamorfosis; son efectivos para larvas de lepidópteros y coleópteros; el diflubenzurón, que pertenece a este grupo, puede producir efectos deletéreos en la progenie (Ware y Whitacre, 2004). El buprofezin, otra molécula de este grupo, también afecta la progenie (Ishaaya et al., 1988). Por la especificidad para usarse en determinados estados de desarrollo del insecto, es necesario comprender la biología de los individuos y el momento adecuado para usarlos (Palumbo et al., 2001).
De los inhibidores de síntesis de ATP, se conoce el diafentiurón, producto que se convierte en una carbodimida por acción de la luz. Este compuesto bloquea la ATPasa mitocondrial, produciendo una reducción de la concentración de ATP y afectando la respiración de los insectos (Ruder y Kayser, 1993). Con este producto, Ishaaya et al. (1993) lograron supresión de B. tabaci hasta un 50%; se evidenció mayor susceptibilidad en estados inmaduros y reducción en la eclosión de huevos entre un 30-35%.
La agroindustria aguacatera colombiana requiere de insecticidas químicos eficientes para el manejo de M. velezangeli cuando esté en poblaciones altas. El objetivo de esta investigación fue identificar insecticidas que causen mortalidad mayor al 70% sobre M. velezangeli, en condiciones controladas como una alternativa dentro del manejo integrado de la plaga.
MATERIALES Y MÉTODOS
Localización. Las pruebas se realizaron en viveros de CORPOICA, C.I. La Selva (W 75°41’88,8''N 6°13’32,6''), en plántulas de guayaba común por ser el mejor hospedero. Las condiciones ambientales del lugar fueron: temperatura promedio de 18 °C, 2.130 m de altitud, humedad relativa entre 55 y 95%.
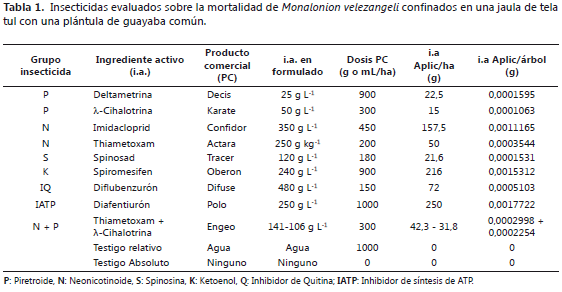
Metodología. Entre abril y agosto de 2011 se evaluó el efecto de diferentes grupos de insecticidas sobre la mortalidad de M. velezangeli. Los insectos utilizados para las pruebas se obtuvieron del pie de cría establecido en las instalaciones de Corpoica, C.I. La Selva. Se utilizó un diseño de bloques completos al azar con 11 tratamientos y cuatro repeticiones. El factor de bloqueo fue el tiempo. La unidad experimental consistió de diez insectos (tres machos, dos hembras y cinco ninfas de instar III, IV o V), confinados en una jaula de tela tul con una plántula de guayaba común. Los tratamientos evaluados se presentan en la Tabla 1.
Los distintos tratamientos químicos se evaluaron en las dosis concertadas con las casas comerciales y se aplicaron una sola vez sobre los insectos confinados en la jaula. Se evaluó la supervivencia a las 1, 24, 48 y 72 h después de la aplicación. Una hora después de aplicados los productos se observó el efecto de caída rápida o "Knock down" de algunos insecticidas. La variable respuesta fue el número de insectos muertos. Para conocer el efecto de protección en la planta se evaluó el daño causado por M. velezangeli sobre las plantas tratadas, para lo cual se utilizó como variable complementaria el número de áreas de reacción en el hospedero después de las 72 h, entendiéndose por área de reacción el sitio de alimentación del insecto que posteriormente se necrosa. Se estimaron el promedio y la varianza de la variable respuesta y de la variable complementaria para cada insecticida evaluado. Para la variable respuesta, se realizó un Análisis de Varianza (ANAVA), bajo el modelo correspondiente al diseño de bloques completos al azar, con un nivel de significancia del 5% (a = 0,05), con medidas repetidas en el tiempo; para el ANAVA, las mortalidades fueron sometidas a la transformación angular Arcsen √M/10, donde M es el número de individuos muertos en la unidad experimental y 10 el número de individuos que componen la unidad experimental. El ANAVA mostró efecto significativo de tratamientos por lo que se aplicaron pruebas de comparación de medias de Dunnett (a = 0,05) contra el testigo relativo, para dilucidar el efecto específico del ingrediente activo y se estimaron intervalos de confianza; posteriormente, a los insecticidas cuyo efecto, acorde con la prueba de Dunnett, fue significativamente superior que el del testigo relativo, se les corrigió el porcentaje de mortalidad con base en la fórmula de Abbott, para constatar que la mortalidad media de tales tratamientos fuera mayor al 70%, caso en el cual se corroboraría la hipótesis de trabajo; si bien es cierto, un insecticida debe lograr porcentajes de mortalidad superiores al 90% en campo, se consideró que si los insecticidas en prueba lograban una mortalidad mayor al 70% no podrían ser descartados y podrían ser utilizados en casos donde las poblaciones del insecto sean bajas o en la rotación de ingredientes activos. Finalmente, se realizaron contrastes entre los grupos que cumplieron la hipótesis para determinar diferencias entre los mismos. Para la variable complementaria, se realizó un ANAVA, bajo el modelo correspondiente al diseño de bloques completos al azar (a = 0,05). Antes de realizar el análisis estadístico, los datos originales se transformaron a Logaritmo de X+1, donde X es número de áreas de reacción. El ANAVA mostró efecto significativo de tratamientos y se aplicaron pruebas de Tukey (a = 0,05), para comparaciones entre las medias de los tratamientos evaluados.
Adicionalmente, se evaluó el efecto de diafentiurón, diflubenzurón y spiromesifen sobre la progenie de insectos expuestos a dichos productos (ninfas y adultos). El montaje para la aplicación fue igual al descrito anteriormente. Se utilizó un diseño de bloques al azar con cuatro tratamientos y cuatro repeticiones, los tratamientos fueron los tres insecticidas y un testigo absoluto. La variable respuesta fue el número de ninfas eclosionadas en cada tratamiento. Con el fin de conocer el tiempo de eclosión de ninfas, se tomaron datos de sobrevivencia desde las 72 h y luego cada dos días hasta que el último individuo muriera. Algunas ninfas alcanzaron el estado adulto y pudieron ser copuladas por machos existentes; por lo tanto, fue preciso esperar a que la última de las hembras formadas muriera. La eclosión de las ninfas se midió desde los 23 días de muerta la primera hembra, hasta los 30 días después de haber muerto la última hembra; estos tiempos están en estrecha relación con la duración del período embrionario. El análisis estadístico consistió en el cálculo del promedio, la varianza y análisis de varianza (ANAVA), bajo el modelo correspondiente al diseño de bloques completos al azar con un nivel de significancia del 5% (a = 0,05). Previo al análisis estadístico, los datos fueron transformados por la fórmula Log X+1, donde X equivale al número de ninfas eclosionadas.
Se utilizó el paquete estadístico SAS® Versión 9.0 para los análisis de varianza, comparación de medias y contrastes. Los intervalos de confianza para la variable mortalidad, se obtuvieron mediante el paquete Statcalc (Krishnamoorthy, 2006).
RESULTADOS Y DISCUSIÓN
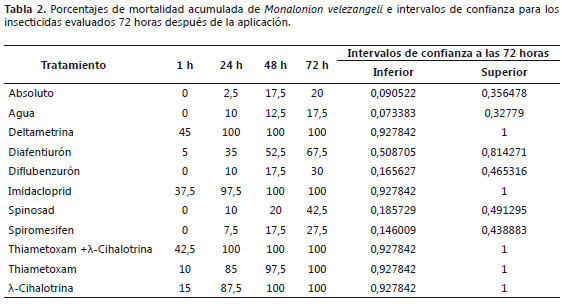
Mortalidad de Monalonion velezangeli. Los insecticidas deltametrina, imidacloprid y la mezcla de thiametoxam + l-cihalotrina tienen efecto "Knock down" sobre M. velezangeli, con mortalidades entre el 37,5 y 45%. El thiametoxam y l-cihalotrina causan mortalidades del 85 y 87,5%, respectivamente, 24 h después de aplicados; mientras que la deltametrina y la mezcla de thiametoxam + l-cihalotrina causaron mortalidad del 100% sobre M. velezangeli. Los porcentajes de mortalidad tanto en el testigo absoluto como en el testigo relativo fueron menores del 20%, lo cual está dentro del rango permitido para bioensayos. 72 h después de aplicados los tratamientos, los insecticidas deltametrina, l-cihalotrina, thiametoxam, imidacloprid y thiametoxam+l-cihalotrina causaron mortalidad sobre M. velezangeli entre el 92,8 y 100%, el diafentiurón causó mortalidad entre 50,9 y 81,4% y los demás insecticidas, entre 7,3 y 49,1% (Tabla 2).
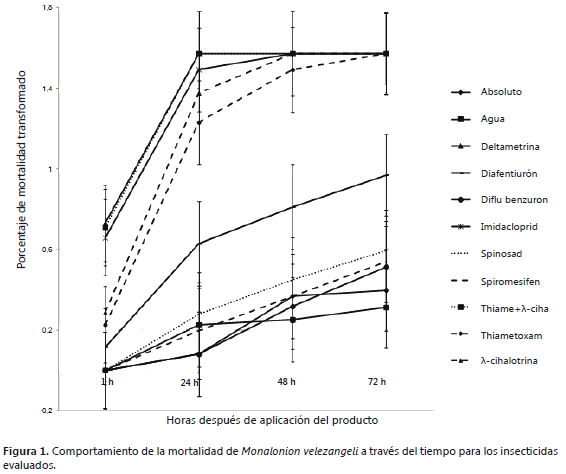
Hubo efecto significativo de los tratamientos, de los tiempos evaluados, así como una interacción significativa entre los tratamientos y los tiempos (P<0,0001), indicando que las diferencias entre tratamientos dependen del tiempo. Una hora después de aplicados los tratamientos, la mortalidad es baja y desde las 24 h, la mortalidad tiende a separarse en grupos. Por lo tanto, se realizó un nuevo ANAVA, excluyendo el primer tiempo de evaluación; en este caso, la interacción entre tratamientos y tiempo no fue significancia (P= 0,0809), lo que permite evaluar los efectos principales de los tratamientos. En la Figura 1, se observan las líneas que representan la mortalidad causada por los insecticidas desde la hora uno (1) hasta las 72 h, después de la aplicación del tratamiento y se distinguen dos grupos de insecticidas; un primer grupo corresponde a deltametrina, l-cihalotrina, thiametoxam, imidacloprid y la mezcla de thiametoxam + l-cihalotrina, los cuales causaron los porcentajes de mortalidad más altos; en el segundo, se incluyen el diflubenzurón, spinosad y spiromesifen, que causaron mortalidades más bajas, el diafentiurón se encuentra entre los dos grupos identificados.
La prueba de Dunnett confirmó que los insecticidas deltametrina, l-cihalotrina, thiametoxam, imidacloprid y thiametoxam+l-cihalotrina causaron una mortalidad significativamente mayor a la del testigo relativo (P<,0001); el diafentiurón también se diferencia estadísticamente del testigo relativo (P=0,0008). Se constató por la corrección de mortalidad por Abbott, que los insecticidas deltametrina, l-cihalotrina, thiametoxam, imidacloprid y la mezcla de thiametoxam + l-cihalotrina causaron porcentajes de mortalidad del 100% satisfaciendo de esta manera la hipótesis de trabajo planteada; por lo tanto, M. velezangeli es altamente susceptible a estos insecticidas que se caracterizan por actuar sobre una amplia gama de insectos además de tener un largo efecto residual (Palumbo et al., 2001; Hungenberg, 2009; Byrne et al., 2010). Los insecticidas piretroides (deltametrina y l-cihalotrina) y neonicotinoides (thiametoxam e Imidacloprid) evaluados no presentaron diferencias estadísticas entre sí (P=0,5579); por lo tanto, estas moléculas insecticidas pueden ser evaluadas en campo para el manejo de monalonion.
El diafentiurón causó una mortalidad corregida de 59,5%, valor inferior al referente preestablecido del 70%; sin embargo, esta molécula tuvo un efecto intermedio en la mortalidad de M. velezangeli.
El diafentiurón actúa sobre procesos esenciales de los insectos como la síntesis de ATP, necesaria para todos los procesos biológicos del individuo. Los valores de mortalidad encontrados en esta investigación coinciden con las investigaciones de Ishaaya et al. (1993) y Cock et al. (1995), quienes encontraron mortalidades entre el 50 y 90% para las moscas blancas B. tabaci y T. vaporariorum.
Los tratamientos diflubenzurón, spinosad y spiromesifen no se diferencian significativamente del testigo relativo (P>0,05), y no son útiles para el manejo de M. velezangeli. Aunque el spinosad actúa de forma similar a los neonicotinoides, el spinosad desestabiliza la unión de la acetilcolina con la célula postsináptica, mientras que los neonicotinoides actúan directamente en la sinapsis (Orr et al., 2009); por lo tanto, interfieren en la fisiología del insecto de forma diferente y en la causa de su mortalidad. El diflubenzurón es una molécula eficaz en larvas de lepidópteros y coleópteros principalmente; no es efectivo sobre estados inmaduros y adultos de insectos chupadores, es posible que su mecanismo de acción no afecte a M. velezangeli. Existen otras moléculas de este grupo, como el buprofezin, que actúan sobre algunos insectos del orden Hemiptera como B. tabaci (Ishaaya et al., 1988), y podrían evaluarse sobre otros hemípteros, que cada vez cobran más importancia como plagas agrícolas. El spiromesifen es un insecticida/acaricida, que no mostró efectos mortales sobre M. velezangeli; estas moléculas fueron descubiertas hace menos de una década y la información es aún escasa sobre modo de acción, resistencia o tolerancia de los insectos. Fountain et al. (2010) encontraron que el spiromesifen solo y con surfactante no disminuyó las poblaciones del ácaro Phytonemus pallidus ssp (Acari: Tarsonemidae) en cultivo de fresa, aunque los autores consideran que la vellosidad de las hojas de fresa puede afectar la movilidad del insecticida; resultado similar encontraron Seal et al. (2006) en plántulas de pimienta var. San Vicente sobre el thrips Scirtothrips dorsalis Hood (Thysanoptera: Thripidae).
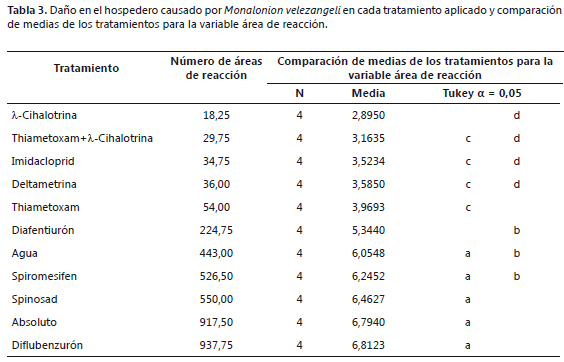
Respecto a la relación del daño producido por el insecto y el efecto de los insecticidas, en la Tabla 3 se indica los valores obtenidos en el número de áreas de reacción en los tratamientos aplicados. El ANAVA muestra diferencias significativas en el número medio de áreas de reacción (P<0,001). Mediante la prueba de comparaciones de medias de Tukey (a=0,05) (Tabla 3), se comprobó que las plantas tratadas con los productos diflubenzurón, spinosad, spiromesifen y diafentiurón, así como las correspondientes a los testigos, presentaron el mayor número de áreas de reacción con una media entre 5,3 para diafentiurón y 6,8 para diflubenzurón, mientras que aquellas tratadas con los productos deltametrina, l-cihalotrina, thiametoxam, imidacloprid y la mezcla de thiametoxam + -cihalotrina, presentaron el menor número de áreas de reacción con medias entre 4,0 y 2,9 para thiametoxam y l-cihalotrina, respectivamente; logrando mayor protección al hospedero del daño del insecto; por lo tanto, la variable número de áreas de reacción se relaciona inversamente con la mortalidad; los insecticidas que causan mayor mortalidad lo hacen en un tiempo corto (24-72 h) y protegen al vegetal del daño de M. velezangeli.
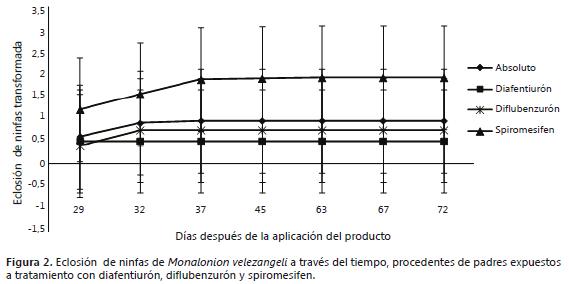
Efectos en la progenie de Monalonion velezangeli de los productos diafentiurón, diflubenzurón y spiromesifen. No hubo diferencias estadísticas en el número de ninfas entre los tratamientos (P=0,4542), tampoco hubo interacción significativa entre tratamientos y tiempo (P=0,1573); por lo tanto, el diafentiurón, diflubenzurón y spiromesifen no causaron efectos deletéreos a la progenie proveniente de adultos tratados (Figura 2). En contraste, Sáenz-de-Cabezón et al. (2007) encontraron que los ácaros depredadores Galendromus occidentalis y Phytoseiulus persimilis (Acari: Phytoseiidae) tratados con spiromesifén redujeron la fecundidad de las hembras y con un efecto residual de diez días. Aunque en M. velezangeli no se presentó este efecto, medido en términos del número de ninfas eclosionadas, no se constató el número de huevos ovipositados, como una medida directa de la afección de la fecundidad. Esta molécula es comúnmente usada como acaricida y es posible que ejerza un mejor control sobre ácaros.
De acuerdo con Londoño y Vargas (2010), la eclosión de ninfas se presenta de los 21 a 31 días después de la oviposición. La eclosión de ninfas se presentó en este tiempo. Cabe resaltar que para el experimento se trataron adultos y ninfas; por lo tanto, las ninfas eclosionadas son progenie de las hembras tratadas en el experimento; de las ninfas tratadas que alcanzaron el estado adulto no se presentaron oviposiciones y por lo tanto no hubo eclosión de ninfas. Esto insinúa un efecto en la progenie de individuos tratados desde su estado ninfal, que logran llegar al estado adulto y posteriormente ovipositar; en cuyo caso, los huevos de esta generación no logra completar su desarrollo. Esto debe aclararse en experimentos posteriores, para dilucidar efectos deletéreos.
Hay diversidad de ingredientes activos en los grupos químicos existentes; por lo tanto es importante realizar investigaciones similares con diferentes moléculas como las avermectinas, para el manejo no sólo de M. velezangeli, sino para otros problemas entomológicos en el cultivo de aguacate. Valdría la pena evaluar el ingrediente activo buprofezín, perteneciente al grupo de los inhibidores de quitina sobre M. velezangeli, pues este producto ha mostrado control de poblaciones de B. tabaci, insecto hemimetábolo como M. velezangeli.
CONCLUSIONES
Se identificaron cinco insecticidas, entre piretroides y neonicotinoides (deltametrina, l-cihalotrina, thiametoxam, imidacloprid y la mezcla de thiametoxam + l-cihalotrina), que causan entre 85 y 100% de mortalidad a M. velezangeli, 24 h después de ser aplicados, llegando a mortalidades del 100% tres días después de su aplicación.
RECOMENDACIONES
Los productos basados en deltametrina, l-cihalotrina, thiametoxam, imidacloprid y la mezcla de los dos últimos, deben evaluarse en fincas productoras para conocer su impacto sobre M. velezangeli y la fauna benéfica en condiciones de campo.
Los insecticidas piretroides y neonicotinoides mencionados, podrían contribuir a la construcción de programas de Manejo Integrado de Plagas del Aguacate en Colombia, que incluyan decisiones con base en niveles de daño económico relacionados con porcentajes de incidencia, estado fenológico del árbol y oportunidad, alternados con aplicaciones de productos biológicos y prácticas culturales, previa validación.
BIBLIOGRAFÍA
Anadón, A., M.R. Martínez-Larrañaga and M.A. Martínez. 2009. Use and abuse of pyrethrins and synthetic pyrethroids in veterinary medicine. Veterinary Journal 182(1): 7-20. [ Links ]
Arango, A. y R. Arroyave R. 1991. Ciclo de vida y hábitos de la chinche del aguacate Monalonion velezangeli (Carvalho & Costa) (Hemiptera: Miridae) en Antioquia. Trabajo de Grado Ingeniero Agrónomo. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia, Medellín. 53 p. [ Links ]
Banco de Iniciativas Regionales para el Desarrollo de Antioquia (BIRD). 2007. Potencial industrial antioqueño. Una mirada general. Gobernación de Antioquia y Escuela de Ingeniería de Antioquia, Medellín. 295 p. [ Links ]
Byrne, F.J., R.D. Oetting, J.A. Bethke, C. Green and J. Chamberlin. 2010. Understanding the dynamics of neonicotinoid activity in the management of Bemisia tabaci whiteflies on poinsettias. Crop Protection 29(3): 260-266. [ Links ]
Corporación Colombia Internacional (CCI). 2011. Servicio de Información Agropecuaria SIA, Búsqueda de precios, http://www.cci.org.co/ccinew/SIA%20PRECIOS.html; consulta: julio 2011. [ Links ]
Cock, De A., I. Ishaaya, Van de M. Veire and D. Degheele. 1995. Response of buprofezin-susceptible and-resistant strains of Trialeurodes vaporariorum (Homoptera: Aleyrodidae) to pyriproxyfen and diafenthiuron. Journal of Economic Entomology 88(4): 763-767. [ Links ]
Fountain, M.T., A.L. Harris and J.V. Cross. 2010. The use of surfactants to enhance acaricide control of Phytonemus pallidus (Acari: Tarsonemidae) in strawberry. Crop Protection 29(11): 1286-1292. [ Links ]
Franco, G. y M.J. Giraldo. 1999. El cultivo de la mora. Corpoica, Comité de Cafeteros del Risaralda, Postobón-Hit. 58 p. [ Links ]
Giraldo, J., F.E. Acevedo, G.C. Villegas y M.P. Benavides. 2009. Evaluación morfológica y molecular de insectos del género Monalonion spp. (Hemiptera: Miridae) alimentándose de cultivos de café. Guayaba, cacao y aguacate. pp. 105. En: Resumenes Congreso de la Sociedad Colombiana de Entomología (SOCOLEN), Medellín. 246 p. [ Links ]
Giraldo, J.M., H.E. Hernández y M.P. Benavides. 2011. Determinación de la adaptación de la chinche Monalonion velezangeli Carvalho & Costa, 1988 (Miridae: Hemiptera) a diferentes especies botánicas en sistemas agroecológicos de Colombia mediante análisis morfométrico de individuos. pp. 91. En: Resumenes Congreso de la Sociedad Colombiana de Entomología, (SOCOLEN). Manizales. 181 p. [ Links ]
Hungenberg, H. 2009. Biological efficacy of the new deltamethrin EC formulation "fLUXX" under controlled conditions. Bayer CropScience Journal 62(2): 250-278. [ Links ]
Ishaaya, I. and D.E. Degheele. 1997. Insecticides with novel modes of action: mechanisms and applications. Springer, Berlín. 289 p. [ Links ]
Ishaaya, I., Mendelson, Z., Melamed-Madjar, V. 1988. Effect of buprofezin on embryogenesis and progeny formation of sweet potato whitefly (Homoptera: Aleyrodidae). Journal of Economic Entomology 81(3): 781-784. [ Links ]
Ishaaya, I., Z. Mendelson and A.R. Horowitz. 1993. Toxicity and growth-suppression exerted by diafenthiuron in the sweetpotato whitefly, Bemisia tabaci. Phytoparasitica 21(3): 199-204. [ Links ]
Krishnamoorthy, K. 2006. Statcalc 2.0. University of Louisiana at Lafayette, http://www.ucs.louisiana.edu/~kxk4695/; consulta: abril 2011. [ Links ]
Liu, M.Y. and J.E. Casida. 1993. High affinity binding of [3H] imidacloprid in the insect acetylcholine receptor. Pesticide Biochemistry and Physiology 46(1): 40-46. [ Links ]
Liu, T. 2004. Toxicity and efficacy of spiromesifen, a tetronic acid insecticide, against sweet potato whitefly (Homoptera: Aleyrodidae) on melons and collards. Crop Protection 23(6): 505-513. [ Links ]
Londoño, Z. 2008. Insectos. pp. 119-153. En: Bernal, E. y D. Díaz. (ed.). Tecnología para el cultivo del aguacate. Corpoica C.I. La Selva. Editorial Produmedios, Bogotá. 242 p. [ Links ]
Londoño, Z. 2010. Informe Técnico de Avance No. 3. "Desarrollo de estrategias para la prevención y manejo de Monalonion velezangeli Carvalho & Costa" para el Ministerio de Agricultura y Desarrollo Rural. Corpoica, C.I. La Selva, Rionegro. 42 p. [ Links ]
Londoño, Z. y M. Vargas. 2010. Monalonion velezangeli Carvalho y Costa (Hemiptera: Miridae). ¿Por qué es una plaga de importancia en cultivos de aguacate? pp. 74. En: Memorias VII Seminario Internacional de Frutas Tropicales. Agroindustria e Innovación. Corporación Colombiana de Investigación Agropecuaria (CORPOICA), Medellín. 101 p. [ Links ]
Marčić, D., P. Perić and S. Milenković. 2011. Capitulo 3: Acaricides-biological profiles, effects and uses in modern crop protection. pp. 37-62. In: Stoytcheva, M. (ed.). Pesticides - formulations, effects, fate. InTech, India. 808 p. [ Links ]
Orr, N., A.J. Shaffner, K. Richey and G.D. Crouse. 2009. Novel mode of action of spinosad: Receptor binding studies demonstrating lack of interaction with known insecticidal target sites. Pesticide Biochemistry and Physiology 95(1): 1-5. [ Links ]
Palumbo, J.C., A.R. Horowitz and N. Prabhaker. 2001. Insecticidal control and resistance management for Bemisia tabaci. Crop Protection 20(9): 739-765. [ Links ]
Pinzón, U., A. Rojas y F. Rojas. 2008. Guía técnica para el cultivo del cacao. Tercera edición. Federación Nacional de Cacaoteros, Fondo Nacional del Cacao, Bogotá. 189 p. [ Links ]
Ramírez, H., A. Bustillo, Z. Gil y P. Benavides. 2008. La chinche de la chamusquina Monalonion velezangeli, una nueva plaga del café en Colombia. pp. 374-380. En: Bustillo, P. (ed.). Los insectos y su manejo en la caficultura colombiana. Cenicafé, Chinchiná. 466 p. [ Links ]
Ruder, F.J. and H. Kayser. 1993. The carbodiimide product of diafenthiuron inhibits mitochondria in vivo. Pesticide Biochemistry and Physiology 46(2): 96-106. [ Links ]
Sáenz-De-Cabezón, F., F. Zalom and P.B. Thompson. 2007. Residual toxicity of acaricides to Galendromus occidentalis and Phytoseiulus persimilis reproductive potential. Biological Control 40(2): 153-159. [ Links ]
Salgado, V.L., G.B. Watson and J.J. Sheets. 1997. Studies on the mode of action of spinosad, the active ingredient in TracerTM insect control. Proceedings Beltwide Cotton Conference 2: 1082-1084. [ Links ]
Salgado, V.L. 1998. Studies on the mode of action of spinosad: insect symptoms and physiological correlates. Pesticide Biochemistry and Physiology 60(2): 91-102. [ Links ]
SAS Institute Inc. [SAS / STAT], versión [9.0]. Cary, NC, EE.UU. [ Links ]
Seal, D.R., M. Ciomperlik, M.L. Richards and W. Klassen. 2006. Comparative effectiveness of chemical insecticides against the chilli thrips, Scirtothrips dorsalis Hood (Thysanoptera: Thripidae), on pepper and their compatibility with natural enemies. Crop Protection 25(9): 949-955. [ Links ]
Vivas, A.M., L.E. Sánchez, A. Moncada y D. Márquez. 2005. Cacao aspectos agronómicos para su cultivo. Fundación para el Desarrollo de la Ciencia y la Tecnología del Estado de Táchira, Táchira, Venezuela. 40 p. [ Links ]
Ware, G.W. and D.M. Whitacre. 2004. Introducción a los insecticidas. Radcliffes el texto mundial de los insecticidas. In: The Pesticide Book. Sixth edition. MeisterPro Information Resources (Meister Media Worldwide Willoughby, Ohio, http://ipmworld.umn.edu/cancelado/Spchapter/W&WinsectSP.htm; consulta: octubre 2010. [ Links ]