Introducción
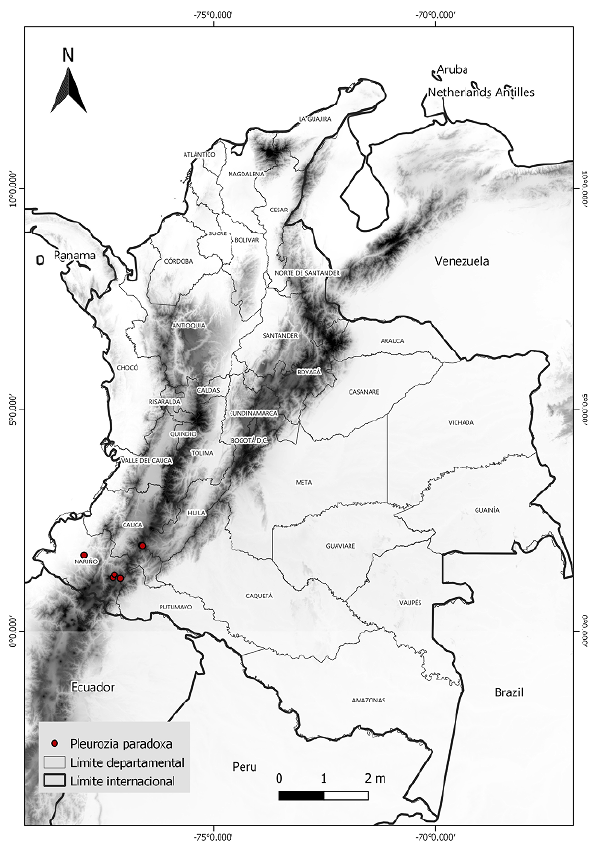
Pleurozia paradoxa (J.B.Jack) Schiffn. (Schiffner, 1893) es una especie de hepática del grupo de las briófitas con distribución restringida a ciertos tipos de suelo y elevaciones por sobre los 3.000 m s.n.m. (Griffin, et al., 1982) en la zona sur de los Andes colombianos. La especie está catalogada en el libro rojo de briófitas de Colombia como vulnerable debido a su escasa presencia y reducida área de ocupación (Linares & Uribe, 2002). El estado de sus poblaciones se desconoce, pero se sabe que también puede encontrarse en Guyana, Venezuela, Ecuador y Chile (Griffin, et al., 1982). En Colombia los registros de P. paradoxa datan de 1878 en Nariño, donde se halla la localidad tipo de la especie. A P. paradoxa también se le conoció como Physotium paradoxum J.B.Jack (Jack, 1886) y Eopleurozia paradoxa (J.B.Jack) R.M. Schust. (Schuster, 1961), pero actualmente Pleurozia paradoxa es el nombre aceptado (Thiers, 1993; Gradstein & Uribe, 2016c).
Pleurozia paradoxa se encuentra en la lista de especies silvestres amenazadas de Colombia contenida en la resolución número 1912 de 2007 del Ministerio de Ambiente y Desarrollo Sostenible, una medida a favor de su conservación y la de otras briófitas que cumplen funciones de gran relevancia ecológica, como la regulación de la humedad y el control de la calidad del agua, entre otras, y que, además, son muy sensibles a los fenómenos de contaminación y deforestación (Churchill & Linares, 1995; Gradstein & Sporn, 2010).
Por tal razón, la aplicación de técnicas como los modelos de distribución de especies (MDE) es verdaderamente útil, pues con ellos es posible predecir las áreas de distribución en una unidad geográfica determinada a partir de registros y atributos ambientales empleados como variables explicativas en la implementación de los algoritmos de modelamiento. Estas predicciones posibilitan la comprensión de los patrones de distribución geográfica de cualquier especie, en este caso de P. paradoxa, la cual se encuentra bajo amenaza por el pequeño número de áreas de ocupación que tiene en el país. Así, los MDE tienen la capacidad de representar la realidad geográfica de una especie en un espacio cartográfico con potenciales usos (Guisan & Zimmermann, 2000), por ejemplo, en la detección de lugares idóneos para la conservación (Martínez-Meyer, et al., 2006), futuras investigaciones (Pearson, et al., 2007), y la detección de alteraciones en la distribución de la especie por cambios climáticos, entre otros. En el caso de especies en peligro, se utilizan para la delimitación de nuevas áreas de protección, el diseño de políticas de protección ambiental e, incluso, la adopción de disposiciones que limiten la entrega de licencias mineras en el contexto del creciente despliegue de la extracción minero-energética en países como Colombia (Cárdenas & Reina, 2008), la cual pone en riesgo la conservación de especies con densidad poblacional reducida.
No se han adoptado medidas de conservación para esta especie de briófitas u otras similares. Sin embargo, en diversos estudios sí se ha hecho el esfuerzo de conocer la riqueza, la diversidad y las amenazas contra las especies de briófitas colombianas. Algunos de estos trabajos son el catálogo de hepáticas y antocerotes de Colombia (Gradstein & Uribe, 2016a, 2016b), la introducción a la flora de musgos de Colombia (Churchill & Linares, 1995), estudios sobre la flora y la vegetación amenazadas (Rangel, 2000) y el libro rojo de las especies de briófitas de Colombia (Linares & Uribe, 2002).
Los MDE generalmente se hacen para otras unidades biológicas con gran número de registros. En las briófitas su uso ha sido innovador, en especial, por su aplicación a su conocimiento biogeográfico (Guisan, et al., 2017; Vanderpoorten &Patiño, 2018). Diversos estudios han revelado la existencia de patrones climáticos distinguibles que pueden explicar la distribución a gran escala de distintos grupos de briófitas (Sérgio, et al., 2005; Hespanhol, et al., 2015; Wierzcholska, et al., 2020), y en algunos se ha modelado la distribución de varios grupos de briófitas, con el fin de ubicarles en espacios geográficos donde potencialmente podrían encontrarse, o donde se han hallado nuevos registros y se desea ampliarlos (Kruijer, et al., 2010; Sandanov & Pisarenko, 2018). En otros estudios sobre briófitas se ha comprobado que los MDE son una herramienta útil para hallar áreas especiales de conservación (Poncet, et al., 2015; Burneo & Benitez, 2020). Los MDE en especies catalogadas como en peligro de extinción son menos comunes, pero con ellos se logran formular e indicar los puntos más relevantes que deben tenerse en cuenta para aplicarlos de manera efectiva en briófitas (Cíhal & Kaláb, 2017) o en otros organismos (Thapa, et al., 2018; Saarimaa, et al., 2019).
En ese contexto, en el presente estudio se los aplicó por primera vez en las briófitas con el objetivo de generar el mapa de distribución potencial de P. paradoxa en Colombia. Con ello se pretende aportar información relevante para esclarecer el verdadero estado de conservación de la especie y, posiblemente, de otras con características similares, además de promover la búsqueda in situ y, así, incrementar el número de presencias registradas.
Materiales y métodos
Coordenadas y variables ambientales
Los datos sobre la presencia de P. paradoxa se obtuvieron del banco de datos sobre bio-diversidad GBIF (http://www.gbif.org/), el catálogo de plantas y líquenes de Colombia (http://catalogoplantasdecolombia.unal.edu.co/es/), así como del proyecto Andean Bryophytes alojado en la página Tropicos del Missouri Botanical Garden (http://legacy.tropicos.org/Project/ANBRY). Los lugares de presencia incluyeron seis registros dentro del territorio colombiano con los límites máximos y mínimos de su distribución en dicha área geográfica (Figura 1). Para el modelamiento de la distribución potencial, se utilizaron 19 capas bioclimáticas en formato ráster obtenidas del repositorio de datos climáticos WorldClim (https://www.worldclim.org/), con una resolución espacial de 30 segundos de arco 9 (~ 1 km) (Hijmans, et al., 2005). Las capas climáticas comprenden tendencias anuales (temperatura media anual y precipitación), de estacionalidad (rango anual de temperaturas y precipitación) y factores ambientales de índole limitante (temperatura y precipitación trimestral) (Hijmans, et al., 2005). Además, se incluyó la capa de elevación de WorldClim, con una resolución igual a las demás.
Modelo de distribución potencial
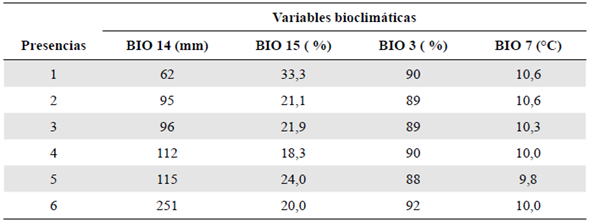
Con el fin de reducir la colinealidad entre las variables (capas) de predicción, se utilizaron dos filtros. El primero, un test de correlación de Pearson entre las capas, y el segundo, el factor de inflación de varianza (VIF), los dos aplicados mediante el lenguaje de programación R v 4.0.0 (R Development Core Team, 2012). Estas estrategias se han implementado en múltiples modelos de distribución (Ranjitkar, et al., 2014a; Ranjitkar, et al., 2014b; Lauria, et al., 2015). La elección de las variables se hizo a partir de los resultados de estos dos filtros. Para el test de correlación de Pearson se eligió una sola variable de un grupo de variables correlacionadas bajo el umbral de 0,85 %, y para el VIF aquellas con resultados menores a 10. Se ha demostrado que el mantener variables con elevada colinealidad afecta fuertemente el rendimiento de cualquier modelo (Quinn & Keough, 2002; Feng, et al., 2009). Finalmente, se obtuvo un juego de cuatro variables ambientales (Tabla 1).
Tabla 1 Variables ambientales seleccionadas y porcentaje de contribución e importancia en el modelo de distribución potencial. Variables obtenidas de WorldClim (Hijmans, et al., 2005).
Para el modelamiento se aplicó el algoritmo de máxima entropía (Maxent 3.4.1), uno de los más utilizados y especialmente eficaz para datos relativos únicamente a la presencia (Elith, et al., 2006; Wisz, et al., 2008; Elith, et al., 2010), con lo que se logró hallar la distribución potencial de P. paradoxa. Se detectaron algunas limitantes con respecto al sesgo de muestreo, el área de modelamiento, la selección de características y la manipulación de los parámetros internos del algoritmo (como el multiplicador de regularización) (Elith, et al., 2010; Kramer-Schadt, et al., 2013; Radosavljevic & Anderson, 2014). Para disminuir cualquier interferencia ocasionada por alguno de estos eventos, se hizo una comparación de modelos con múltiples configuraciones partiendo de una predeterminada y manipulando los valores del multiplicador de regularización desde 0,5 a 5 cada 0,5, para un total de 10 configuraciones. Además, se compararon todas las características disponibles (L: lineal, Q: cuádratica, H: bisagra, P: producto, T: umbral) en diferentes combinaciones siguiendo las recomendaciones de la literatura (Anderson & González, 2011; Muscarella, et al., 2014; Radosavljevic & Anderson, 2014; Su, et al., 2015; Aryal, et al., 2016). Por último, se eligió el mejor modelo de todas las configuraciones usadas para cada una de las especies con base en el criterio de información de Akaike (Akaike information criteria, AIC), priorizando la menor pérdida de información, es decir, los valores más bajos de AIC (Akaike, 1974). Asimismo, se utilizó el área bajo la curva (area under curve, AUC), pero desde un enfoque comparativo, como lo recomiendan van Proosdij, et. al. (2016), dado que la cantidad de sitios de presencia no permite un óptimo entrenamiento y prueba en los modelos. La AUC varía de 0 a 1, donde un AUC > 0,5 indica que el modelo es mejor que uno generado aleatoriamente (Phillips, et al., 2006).
Selección y validación del modelo
Los modelos se seleccionaron a partir del AIC, método superior a otros especialmente utilizado cuando los tamaños de muestra son pequeños (Warren & Seifert, 2011). Cabe resaltar que en dichos casos el enfoque debe ser comparativo, sin asegurar una validez total de los modelos. En la evaluación del AIC se utilizó el paquete ENMeval (Muscarella, et al., 2014) y todos los modelos construidos. A partir del resultado de la evaluación, se eligió el mejor modelo con el valor de AIC más bajo y con base en él se estableció una categorización para definir los niveles de potencialidad de la presencia de la especie en cuatro categorías: nula (0 - 0,44), baja (0,44 - 0,5), moderada (0,5 - 0,8) y alta (0,8 - 1), con base en un umbral logístico del 10 % con respecto a la idoneidad de hábitat predicha. La estrategia de validación de los modelos consistió en la comparación con respecto a las distribuciones conocidas en la literatura y la opinión de expertos. A partir de este cruce, se confirmaron y discutieron los resultados que aquí se presentan.
Evaluación del estado de conservación
Se obtuvo la capa de áreas protegidas de Colombia, la cual se superpuso en el mapa resultante con su respectiva categorización de potencialidad. Se calculó el porcentaje de territorio para cada categoría de potencialidad dentro de las áreas protegidas utilizando la herramienta de cálculo vectorial de QGIS. Con ello, se identificaron las zonas con gran posibilidad de presencia de P. paradoxa y su respectivo estado de protección. Además, se señalaron los sitios de preferencia para la protección o conservación de esta especie que aún no se encuentran en las áreas protegidas de Colombia.
Resultados
Selección del modelo, rendimiento y variables
De los 60 modelos candidatos se eligió el mejor, es decir, el de menor valor de AIC (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1343/2971). Las configuraciones óptimas según el modelo final correspondieron a un regulador de multiplicación de 0,5 y características L: lineal. El valor de AIC fue de 159,07 y el de la AUC en cuanto a la precisión del modelo se ubicó en 0,93, que en los casos de datos abundantes implicaría un rendimiento del modelo por encima de la aleatoriedad y con un margen de precisión muy elevado. Sin embargo, como en este caso el enfoque de validación no permitía una interpretación de este tipo, la única forma de analizarlo fue comparando el AIC con los demás modelos, siendo este el más bajo.
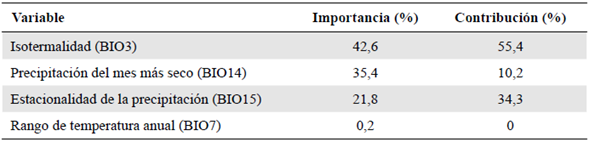
Las variables utilizadas se seleccionaron según los parámetros ya descritos y se señalaron los valores según su contribución e importancia. En primer lugar se ubicó la variable isotermalidad (BIO3), con una importancia del 42,6 %, seguida de la precipitación del mes más seco (BIO14), con 35,4 %, la estacionalidad de la precipitación (BIO15), con 21,8 % y el rango de temperatura anual (BIO7), con 0,2 %, las cuales representaban contribuciones relativas de 55,4, 10,2, 34,3 y 0 %, respectivamente (Tabla 1).
Distribución potencial y áreas protegidas
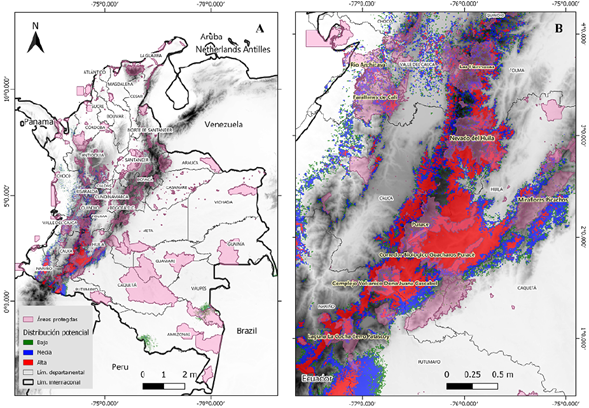
El modelo de distribución potencial predijo un área idónea total de aproximadamente 61 millones de km2, lo que representa cerca del 5 % del territorio colombiano. Las áreas de idoneidad categorizadas como de alta probabilidad se encuentran en las zonas de cordillera de los departamentos de Nariño, Cauca y Huila y corresponden a unos 19 millones de km2, un 1,6 % del territorio. Otros segmentos de gran probabilidad se encuentran en dirección norte en los departamentos de Tolima y Valle del Cauca. Las probabilidades medias conservaron el mismo patrón y aumentaron en rango las áreas de idoneidad esperada, cubriendo cerca de 23 millones de km2, lo que significa hasta un 2 % del área total de Colombia. Las zonas de probabilidad baja presentaron una sección atípica que es notoria al sureste del país, en los departamentos de Amazonas y Vaupés, con 18 millones de km2, 1,5 % del área geográfica nacional (Tabla 2) (Figura 2). Otros fragmentos de probabilidad se apreciaron incluso más al norte, pero se encontraban altamente dispersos.
Tabla 2 Probabilidad de área de idoneidad predicha (km2, %) y cobertura de áreas protegidas (AP) de Pleurozia paradoxa comparadas con el territorio colombiano (COL)
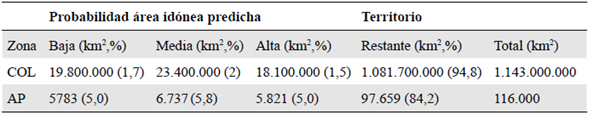
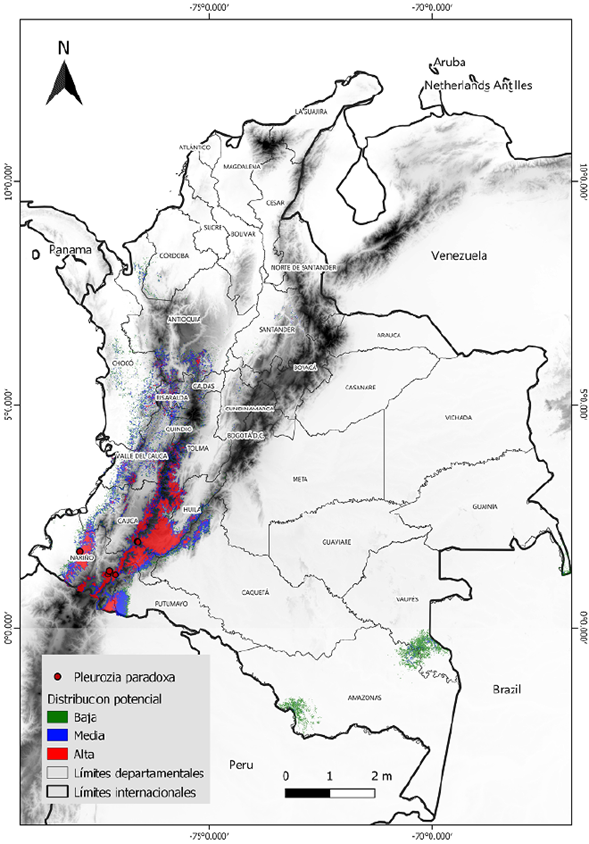
Figura 2 Mapa de distribución potencial de Pleurozia paradoxa bajo la categorización de potencialidad con base en el umbral logístico del 10 %
De las 1.343 áreas protegidas (https://runap.parquesnacionales.gov.co/), solamente 500 quedaron cubiertas por las áreas de idoneidad predichas, por lo menos 18.341 km2, y se distribuyeron así: como de probabilidad alta, 5.821 km2, media, 6.737 km2 y baja, 5.783 km2, es decir, 5, 5,8 y 5 % del total de áreas protegidas en Colombia, respectivamente (Tabla 2) (Figura 3).
Discusión
El proceso de construcción de un MDE conlleva ciertos aspectos que deben tenerse en cuenta. Más allá de la elección de la especie o las variables que serán incluidas, es importante en todo momento que los resultados sean estadísticamente robustos. Para los modelos de poca presencia esto es un reto porque en sí mismos no cuentan con la información suficiente para realizar predicciones sólidas. Sin embargo, se han desarrollado técnicas que, si bien no aseguran su fiabilidad, reducen notablemente la aleatoriedad y permiten seleccionar un mejor modelo. Algunas de ellas, como el AIC, han demostrado ser criterios de selección bastante óptimos cuando el número de presencias es bajo (Warren & Seifert, 2011). Al comparar el resultado del modelo seleccionado con el modelo de mayor AIC, se obtuvo una diferencia de 49 puntos (Tabla 1S, https://www.raccefyn.co/index.php/raccefyn/article/view/1343/2971). El valor más alto fue bastante amplio y se vio castigado por el exceso de parámetros ajustados en demasía. Por este motivo, se seleccionaron modelos con valores de AIC bajos, que representan una menor entropía relativa y, por consiguiente, tienen menores tasas de error, algo que también se conoce como pérdida de información (Akaike, 1974).
Con respecto a las variables, llamó la atención la variable de isotermalidad (BIO3), una variable que representa la razón de variabilidad entre el rango de temperatura diario y el rango de temperatura anual (O'Donnell & Ignizio, 2012). Los valores de este factor en los puntos de presencia de P. paradoxa evidenciaron cómo los cambios concretos en la variabilidad de la temperatura diaria comparada con la anual afectaron directamente su distribución. Así, la isotermalidad (BIO3) se convierte en uno de los parámetros climáticos más importantes para la distribución de P. paradoxa junto con la precipitación del mes más seco (BIO14) y la estacionalidad de la precipitación (BIO15), con un alto grado de relevancia para el modelo (Tabla 3) y una fuerte relación con P. paradoxa. En otros estudios no se ha encontrado un patrón de la contribución específica de alguna variable para el modelamiento general de las especies de briófitas.
La distribución potencial de P. paradoxa fue conservadora y consecuente con las distribuciones ya conocidas (Figura 2). La predicción de alta probabilidad se concentró en los departamentos donde esta especie ya es conocida (Cauca, Huila y Nariño) y donde siempre ha sido reportada (Griffin, et al., 1982; Thiers, 1993; Uribe & Gradstein, 1998; Linares & Uribe, 2002; Gradstein & Uribe, 2018). Dichos reportes ubican a P. paradoxa como una especie usualmente presente en los Andes en ecosistemas de páramo, pero con una gran exigencia frente a parámetros ambientales concretos que la delimitan espacialmente. En trabajos de campo se ha encontrado que P. paradoxa crece específicamente sobre bases de troncos en bosques montanos superiores o en suelos pobres y ácidos sobre rocas areniscas o cristalinas con muy bajo contenido mineral, no en áreas volcánicas (Gradstein, 2020). Por otra parte, el mapa geológico y de unidades cronoestratigráficas de Colombia levantado por el Servicio Geológico Colombiano (https://www.sgc.gov.co/) ubica la presencia de P. paradoxa en otros tipos de suelos. Dado que las capas de suelos no poseen el nivel de detalle, escala y resolución necesarios para ser comparadas, no fue posible confirmar esa hipótesis, o incluirlas en los modelos. Como lo mencionan Furnes & Grime (1982), Convey & Lewis-Smith (2006) y Vanderpoorten & Goffinet (2009), el sustrato y microclima son algunos de los factores imprescindibles en la distribución de las briófitas, siendo incluso más importantes que los factores macroclimáticos y la clasificación de los suelos a gran escala. Surge entonces la necesidad de investigar con el fin de construir capas más detalladas y, quizá, mejor adaptadas para este tipo de organismos. Se sugiere la implementación de dichas capas en áreas geográficas de menor tamaño.
Algunas secciones de la idoneidad predicha que se presentaron fragmentadas o dispersas no deben tenerse en cuenta dada su poca continuidad. En la mayoría de ocasiones, estas representan probabilidades bajas, menores a las del criterio del umbral para la conversión de la probabilidad; un umbral que si se ubica por encima de 0,5 indica una presencia efectiva (Jiménez-Valverde & Lobo, 2007; Kumar & Stohlgren, 2009). Teniendo en cuenta esto, la distribución potencial de P. paradoxa se presume en áreas de alta probabilidad continuas y extensas, en tanto que las secciones dispersas deben considerarse con cautela.
Tomando como referencia el mapa de distribución potencial y superponiendo la capa de áreas protegidas (Figura 3), se establecieron tres sitios importantes de conservación para P. paradoxa: el Parque Nacional Natural Puracé, el Nevado del Huila y el complejo volcánico Doña Juana Cascabel. Estos sitios presentan características ecológicas de preferencia para la especie y se encuentran bajo jurisdicción de parques nacionales naturales de Colombia. Otros sitios de menor trascendencia para la protección de P. paradoxa son el conjunto de parques naturales regionales de los departamentos de Cauca, Huila y Nariño, que poseen un territorio delimitado hasta los 3.000 m s.n.m., como lo son el corredor biológico Guarachos-Puracé, la serranía de Minas, el páramo Las Ovejas-Tauso y el páramo Paja Blanca.
Las áreas de distribución potencial de P. paradoxa en áreas protegidas aparentemente presentan un óptimo estado, lo que permite ver con ilusión el futuro de la especie. No obstante, se hacen necesarias más investigaciones y exploraciones en búsqueda de especímenes de P. paradoxa para evaluar y definir con mayor claridad su estado de conservación y así puntualizar las medidas correctas para protegerla y preservarla.
Dado que esta investigación constituye la primera aplicación de los modelos de distribución potencial en briófitas en Colombia, se recomienda seguir trabajando en la distribución potencial de P. paradoxa y la de otras especies de briófitas, centrándose en el microclima y el sustrato como factores explicativos.