Introducción
La COVID-19 es una enfermedad causada por un nuevo beta coronavirus (SARS-CoV-2) que está estrechamente relacionado con el SARS-CoV detectado en el año 2002. Los primeros casos reportados se asociaron con el mercado de animales vivos en Wuhan, China, lo cual sugiere una antropozoonosis; sin embargo, actualmente su principal mecanismo de transmisión es de persona a persona.
La presentación clínica de la COVID-19 es muy heterogénea y va desde síntomas respiratorios superiores leves, hasta una neumonía grave e insuficiencia respiratoria. El eje fisiopatológico central de la disfunción multiorgánica es la tormenta de citoquinas, la cual es muy similar a la presentada en otro tipo de condiciones como la sepsis de origen bacteriano.
Materiales y métodos
Se realizó una búsqueda avanzada de la literatura en las bases de datos ClinicalKey, Embase, PubMed y Ovid con los términos "COVID-19", "SARS-CoV-2", "Tormenta de citoquinas", "terapias de purificación sanguínea", "sepsis", "hemoadsorción" y "CytoSorb".
Resultados
Se encontraron 246 publicaciones entre artículos originales, reportes de casos, series de casos y revisiones de la literatura. Luego de aplicar los filtros, se seleccionaron 61 artículos que fueron utilizados para la elaboración de la presente revisión de la literatura.
COVID-19: enfermedad por SARS-CoV-2
Los coronavirus son un grupo importante de RNA virus que producen enfermedades en humanos y en animales. En diciembre 2019, en Wuhan, provincia de Hubei, China, se identificó un nuevo coronavirus, llamado inicialmente 2019-nCoV y conocido en la llamado inicialmente 2019-nCoV y conocido en la actualidad como SARS-CoV-2, que es capaz de producir neumonía e insuficiencia respiratoria y es el responsable de la COVID-19, que significa enfermedad por coronavirus 20191,2. Este virus se extendió a otras provincias y generó una epidemia en toda China. Acto seguido comenzaron a aparecer un gran número de casos en otros países del mundo, a tal punto que el 11 de marzo de 2020 la Organización Mundial de la Salud (OMS) declaró la pandemia mundial3.
Hasta el 3 de junio de 2020 se habían reportado 6.416.828 casos de COVID-19 en todo el mundo, con 382.867 muertes confirmadas y 216 países afectados. En Colombia, en donde el primer caso se reportó el 6 de marzo de 2020 en una mujer de 19 años proveniente de Milán, Italia, a esa misma fecha, se habían reportado 33.354 casos con 1.045 muertes Confirmadas y 12.288 pacientes recuperados4-6.
Los primeros casos de este nuevo coronavirus reportados en Wuhan sugieren un contagio inicial de animal a humano; sin embargo, en la actualidad la principal vía de transmisión es el contacto persona a persona, ya sea por producción de gotas al toser, hablar o estornudar; o por contacto con superficies contaminadas como plástico, acero o cartón7.
El SARS-CoV-2 tiene un periodo de incubación que oscila entre 2 y 14 días después de la exposición1, y su presentación clínica es muy heterogénea, incluyendo personas asintomáticas y pacientes con enfermedad leve con síntomas respiratorios superiores y del estado general (fiebre y escalofríos, tos, mialgias, cefalea, hiposmia, disgeusia, odinofagia) o con presentaciones graves con neumonía e insuficiencia respiratoria8.
Los factores de riesgo descritos para COVID-19 grave incluyen enfermedad pulmonar obstructiva crónica o asma moderada a severa, enfermedad cardiaca previa, obesidad, diabetes mellitus, enfermedad hepática crónica, enfermedad renal crónica en grados avanzados, cáncer en tratamiento con quimioterapia, antecedente de trasplante, infección por virus de inmunodeficiencia humana y uso de drogas inmunosupresoras o corticoides9.
Aunque su patogénesis sigue siendo desconocida en gran parte, se demostró la unión del virus con el receptor de carboxipeptidasa relacionada con la enzima convertidora de angiotensina (ACE2), el cual se expresa en mayor medida en el tejido cardiopulmonar y también se encuentra presente en monocitos y macrófagos, haciendo que estos últimos liberen un gran número de citoquinas pro inflamatorias10. En este sentido, la marcada respuesta inflamatoria y la formación de una tormenta de citoquinas desempeñan un papel crucial en las manifestaciones graves de la COVID-19, pues generan niveles muy elevados de interleucina-6 (IL-6), interleucina-10 (IL-10), ferritina, factor de necrosis tumoral alfa (TNF-α) y factores procoagulantes, lo que desencadena disfunción endotelial, trombosis, hipoperfusión tisular, daño orgánico múltiple e incluso la muerte11.
Tormenta de citoquinas
Channappanavar & Perlman12 afirman que la tormenta de citoquinas es la principal causa de complicaciones asociadas a la infección por SARS-CoV y MERS. Además, según Chen et al.13 y Ruan et al.14, los niveles elevados de IL-6 se correlacionan significativamente con el desarrollo de insuficiencia respiratoria, síndrome de distrés respiratorio agudo (SDRA) y desenlaces fatales.
La IL-6 funciona a través de dos vías de señalización: Cis y Trans15. En la señalización Cis, la IL-6 se une a su receptor de membrana específico (mIL-6R) en un complejo con gp130, genera una transducción intracelular mediada por JAK (Janus Quinasas) y STAT3 (transductor de señal y activador de la transcripción 3), lo que tiene efectos pleiotrópicos sobre los linfocitos B y T y en las células de sistema inmune innato (neutrófilos, macrófagos y células NK), y contribuye a la formación de la tormenta de citoquinas11.
En la señalización Trans, la forma soluble de IL-6 se une a la forma soluble de su receptor específico (sIL-6R) y se forma un complejo con gp130. Como consecuencia se libera factor de crecimiento vascular endotelial, proteína quimioatrayente de monocitos -1 (MCP-1), IL8 y más IL6, lo cual perpetúa la tormenta de citoquinas16, fenómeno que aumenta la permeabilidad vascular y genera fuga capilar, siendo este el mecanismo central de la hipotensión y el SDRA. Esta forma de señalización es importante para la activación de las células que no expresan receptor de membrana (mIL-6R) como las células endoteliales.
Dados estos hallazgos han surgido estrategias prometedoras para el manejo de la tormenta de citoquinas mediante el uso de esteroides o anticuerpos bloqueadores de receptores de IL-6/IL-617. Una posible alternativa es el uso de estrategias de purificación sanguínea, las cuales han demostrado beneficio en múltiples escenarios, aunque no existen ensayos clínicos en pacientes con COVID-1918,19. En la Figura 1 se resume la cascada fisiopatológica de la tormenta de citoquinas inducida por COVID-19.
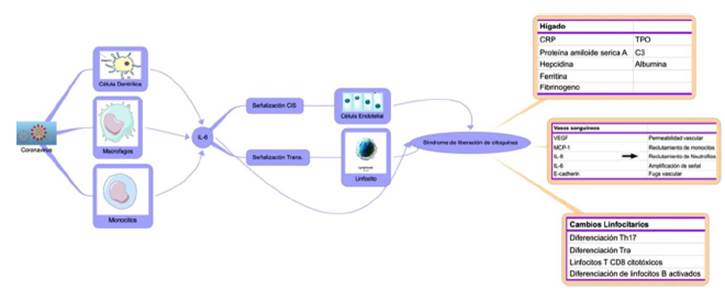
Figura 1 Cascada fisiopatológica de la tormenta de citoquinas inducida por COVID-19. Fuente: Elaboración con base en Moore & June11
Complicaciones renales por COVID-19
Las complicaciones renales en pacientes con COVID-1 9 son muy frecuentes, encontrando proteinuria hasta en el 40 % de los casos al momento de su ingreso hospitalario20. En específico, la lesión renal aguda (LRA) es común y afecta aproximadamente al 20-40 % de los pacientes ingresados a la unidad de cuidados intensivos (UCI), de los cuales cerca del 20 % requiere terapia de reemplazo renal en algún momento de su evolución21. No obstante, podría haber un subregistro de la enfermedad renal en estos pacientes debido a que la creatinina de ingreso puede no reflejar la verdadera función renal inicial y a que los valores de creatinina sérica previos no suelen estar disponibles.
El mecanismo de lesión renal en pacientes con COVID-19 es multifactorial y suele asociarse a factores predisponentes como sepsis, hipovolemia, nefrotóxinas y disfunción ventricular izquierda22. Además, en estudios de autopsia se ha encontrado una franca disfunción endotelial y la presencia de partículas virales en las células endoteliales renales, lo que indica una posible lesión citotóxica directa del virus al riñón23. El SARS-CoV-2 puede infectar directamente el epitelio tubular renal y los podocitos a través de la vía del receptor de la enzima convertidora de angiotensina (ACE), lo que provoca disfunción mitocondrial, necrosis tubular aguda, formación de vacuolas de reabsorción de proteínas, colapso de la glomerulopatía y fuga de proteínas en la cápsula de Bowman22-25.
Mortalidad en pacientes con lesión renal aguda y COVID-19.
La tasa de mortalidad en pacientes con COVID-19 y LRA puede ser hasta del 30 %26, y aunque al menos el 67 % de los pacientes que cursan con LRA asociada a COVID-19 presentan recuperación completa de la función renal, el 19 % continua con requerimientos de hemodiálisis luego del alta hospitalaria26.
Algunas explicaciones a la variabilidad de las cifras reportadas son la definición de LRA empleada, el reporte de poblaciones diferenciales (hospitalizados y pacientes en UCI) y los tiempos de reporte en el curso de la pandemia26,27. Por ejemplo, una definición encontrada se basa en los criterios KDIGO e indica que la LRA corresponde al aumento en los niveles de la creatinina sérica por encima de 0,3 mg/dL en 48 horas o un aumento del más del 30% de esta misma sustancia28, mientras que otra postura incluye, además, el aumento >1,5 veces del valor inicial de este marcador (valor estimado de los siete días previos) o un volumen de orina <0,5 mL/kg/ hora durante 6 horas29.
Al respecto, Pei et al.30 indican que criterios ampliados en el diagnóstico de LRA aumentan la frecuencia de esta condición; además, su definición incluye aumento o disminución de la creatinina sérica en un 50 % durante la estancia hospitalaria (utilizando la concentración de creatinina sérica al ingreso como referencia), con o sin oliguria30. En Colombia aún no hay registro de mortalidad en pacientes con COVID-19 y LRA.
Terapias de purificación sanguínea
Las terapias de purificación sanguínea extracorpórea (PSE) son un tratamiento en el cual al paciente se le extrae la sangre para pasarla a través de una membrana, en donde se eliminan los solutos (productos metabólicos y toxinas), y se conserva el agua.
Aunque su primera utilidad se estableció en los pacientes con insuficiencia renal (terapia de reemplazo renal), desde la década de los 90 se conoce el beneficio de la PSE en la eliminación de productos inflamatorios en los pacientes con síndrome de respuesta inflamatoria sistémica y sepsis31. La mejoría con esta terapia se demostró primero en estudios animales, pero no pasó mucho tiempo hasta encontrar una reducción de mortalidad cuando se utilizaban estas estrategias de eliminación de citoquinas en pacientes sépticos humanos32.
En general, las terapias extracorpóreas son modalidades de tratamiento orientadas a eliminar los factores inflamatorios, aunque se han reportado beneficios en la estabilización hemodinámica, la reducción de lactato y la prevención de daño de órganos en pacientes con enfermedad severa33.
Mecanismos de purificación sanguínea
El eje central fisiopatológico de la sepsis es la producción exagerada de marcadores inflamatorios, lo que genera un síndrome de respuesta inflamatoria sistémica desregulada34. Esto inicia con el reconocimiento antigénico en la superficie de los patógenos, conocidos como patrones moleculares asociados a patógenos (PAMP), tales como las endotoxinas producidas por bacterias gramnegativas. Posterior a esto se activan los leucocitos y se induce la síntesis de citoquinas pro y antiinflamatorias: TNF-α, IL-1, IL-6, IL-8 e IL-1035, mismo mecanismo de tormenta de citoquinas encontrado en COVID-19. Es por esto que las técnicas de PSE pueden contribuir disminuyendo los niveles de citoquinas a un nivel inferior al umbral tóxico35.
Otro objetivo de estas terapias es la eliminación de PAMP antes de que sean identificados por los leucocitos, lo cual evita la respuesta inflamatoria desde el inicio36. Estos mecanismos se logran gracias a que la mayoría de las citoquinas proinflamatorias y los productos patógenos tienen un peso molecular medio (5-50kD), y por tanto pueden ser eliminados por los métodos estándar de PSE: convección, difusión o adsorción37.
A continuación, se presentan las diferentes tecnologías de PSE encontradas en la literatura consultada y sus utilidades, ventajas y desventajas.
Hemofiltración de alto volumen y terapias convectivas
La hemofiltración se produce mediante un espacio convectivo en donde los solutos se transportan a través de una membrana semipermeable; este espacio se asocia con el movimiento del solvente y es consecuencia de gradiente de presión positiva transmembrana. El éxito de esta terapia depende del ultrafiltrado, las características de la membrana y del soluto, y, en menor medida, del tamaño de la molécula de soluto37.
La hemofiltración puede eliminar mediadores inflamatorios teniendo en cuenta su peso molecular medio. Esto hace que, en teoría, sea un método efectivo en la sepsis; sin embargo, la tasa de producción de estos marcadores inflamatorios en la tormenta de citoquinas es muy acelerada, es decir muy superior a la tasa de producción de urea, y por tanto el efecto de la hemofiltración es insuficiente cuando se utilizan flujos de 1-2 L/hora. Por el contrario, la hemofiltración de alto volumen puede ser eficaz eliminando citoquinas proinflamatorias utilizando flujos de hasta 75-120 mL/kg/hora; para esto se necesita una membrana de alta permeabilidad con un área de superficie grande y coeficiente de tamizado cercano a 137.
La hemofiltración de alto volumen ha sido sometida a ensayos clínicos en los que, a pesar de mostrar un posible beneficio en la estabilidad hemodinámica y la ausencia de efectos colaterales, no ha tenido un impacto significativo en la mortalidad38,39. Además, se han registrado posibles efectos no deseables como mayor depuración de antibióticos, trastornos hidroelectrolíticos y pérdida de macronutrientes37. De igual forma, es necesario realizar más investigaciones para tener conclusiones respecto a la rentabilidad y la seguridad de esta terapia38.
En resumen, expertos en purificación de sangre indican que la modalidad más usada en paciente con COVID-19 es la terapia de reemplazo renal continua, cuyo beneficio radica en el mantenimiento de la temperatura corporal, del equilibrio del volumen y de la estabilidad hemodinámica; en la mejora de la eficiencia del aclaramiento de toxinas de pequeño y mediano tamaño, y en la implementación de un soporte nutricional. El uso de esta modalidad implica tasa de flujo de efluente mínima entre 20 y 25 mL/ kg/h cuando se realiza dilución posterior y de entre 25 y 30 mL/kg/h en casos de predilución.
Cuando se considera filtración de sangre de alto volumen, los expertos sugieren usar tasas de flujo >35 mL/kg/h, mientras que en ultrafiltración lenta la tasa de remoción de volumen considerada es de entre 2 y 5 mL/min, dependiendo del estado hemodinámico y del volumen del paciente40,41.
Hemodiálisis convencional de alto flujo
En esta modalidad los solutos se transportan a través de una membrana semipermeable, lo cual es mediado por un gradiente de concentración. La capacidad de aclaramiento la determina el peso molecular del soluto, el gradiente de concentración, la temperatura, el área de superficie de la membrana, su grosor y el tamaño de los poros; la producción de ultrafiltrado la controla una bomba de sangre, y las membranas de diálisis se clasifican según sus coeficientes de ultrafiltración en membranas de alto y bajo flujo37.
La tecnología de diálisis continua de alto flujo posee una membrana que depura sustancias entre 30 a 40 kD, lo que permite eliminar grandes cantidades de mediadores inflamatorios, incluyendo quimiocinas y citocinas de peso molecular medio, sin comprometer de forma significativa los niveles urea; esto demuestra un efecto potencial en la reducción de citoquinas en la sepsis42.
Las modalidades de diálisis continua también pueden usar membranas de corte, la cuales poseen un gran número de poros, permiten la eliminación de moléculas más grandes (30-60kD) y han demostrado beneficios potenciales como mejorar la función de las células inmunes y reducir los niveles de citoquinas y de dosis de vasopresores43. El problema de este método es la pérdida indiscriminada de albumina, aunque esto puede mermarse con el reemplazo de albúmina o mediante el uso de membranas en una modalidad difusa y no convectiva37.
Hemoabdsorción
En la técnica de hemoadsorción la sangre se pone en contacto directo con un agente adsorbente de un circuito extracorpóreo y dicha sustancia atrae a los solutos a partir de diferentes tipos de fuerza: interacciones hidrófobas, atracción iónica, uniones de hidrogeno e interacciones de Van der Waals. Su depuración depende del tamaño de los solutos y su capacidad de atravesar los poros depende de la membrana adsorbente37.
Las membranas adsorbentes como el metacrilato de polimetilo y la AN69ST se han utilizado para eliminar endotoxinas y citocinas y han mostrado buenos resultados clínicos44.
La polimixina B es un antibiótico polipeptídico catiónico con actividad contra bacterias gramnegativas y alta afinidad a la endotoxina, sin embargo su uso intravenoso se ha limitado por su nefrotoxicidad y neurotoxicidad. Este antibiótico se ha fijado e inmovilizado en fibra de poliestireno en un cartucho de hemoperfusión con el fin de eliminar endotoxinas sin generar efectos adversos. Su mecanismo consiste en efectos pleiotrópicos (atrapamiento de células inflamatorias y aclaramiento de IL-6 y TNF-α)37 y su evidencia sigue siendo contradictoria, pues aunque su efectividad ha sido demostrada en diversos ensayos clínicos en los que se ha evidenciado mejoría clínica, hemodinámica y de los parámetros ventilatorios en pacientes con sepsis45-47, en el ensayo clínico más grande publicado de esta terapia (EUPHRATES48) el tratamiento de hemoperfusión de polimixina B más la terapia médica convencional no redujo la mortalidad a los 28 días en comparación con el tratamiento simulado más la terapia médica convencional.
La tecnología con el dispositivo denominado CytoSorb® (CytoSorbents Corporation, Monmouth Junction, NJ, USA) es ideal para el manejo de los pacientes sépticos44. Este es un material biocompatible compuesto por polímeros porosos que logran la unión permanente con moléculas entre 5 y 60 kDa, tales como TNF- α, IL-1 β, IL-6 y IL-1049. El adsorbente consiste en un cartucho de 300 mL precargado con una solución de cloruro de sodio isotónica estéril y altamente biocompatible y la superficie de adsorción activa es extremadamente grande (>45.000 m2 por adsorbente)50. El volumen de sangre dentro del adsorbente es de aproximadamente 150 mL y el flujo sanguíneo recomendado es de al menos 150 mL/min51.
El uso de esta tecnología ha mostrado resultados prometedores en la mejoría de la supervivencia de los pacientes con choque séptico y tormenta de citoquinas a corto y a mediano plazo49,52,53 y en la actualidad cuenta con aprobación de la Food and Drug Adaministration para el manejo de pacientes con tormenta de citoquinas por sepsis y para el manejo de hiperbilirrubinemia y mioglobinemia51.
El registro internacional de CytoSorb® en UCI es un estudio multicéntrico (130 centros en 22 países) que hasta ahora se encuentra reclutando pacientes. El objetivo primario es reducir la mortalidad hospitalaria en comparación con la mortalidad predicha calculada por el puntaje APACHE II y SAPS II; además como objetivos secundarios se pretende evaluar el grado de disfunción orgánica calculada por SOFA; la diferencia de niveles de IL-6, PCR, procalcitonina, mioglobina y hemoglobina libre posterior al tratamiento; el tiempo de estancia en UCI, y la duración de la ventilación mecánica, de la terapia de reemplazo renal y del requerimiento de vasopresores (en días). Se han publicado algunos estudios preliminares en los que, aunque no hubo disminución significativa de las puntuaciones SOFA después del tratamiento, los niveles de IL-6 sí se redujeron notablemente después del tratamiento (mediana 5000 pg/mL antes y 289 pg/mL después del tratamiento) (Tabla 1), lo que denota un gran aclaramiento bioquímico de los marcadores de inflamación sistémica54.
Tabla 1 Resultados preliminares del registro internacional de CytoSorb®.
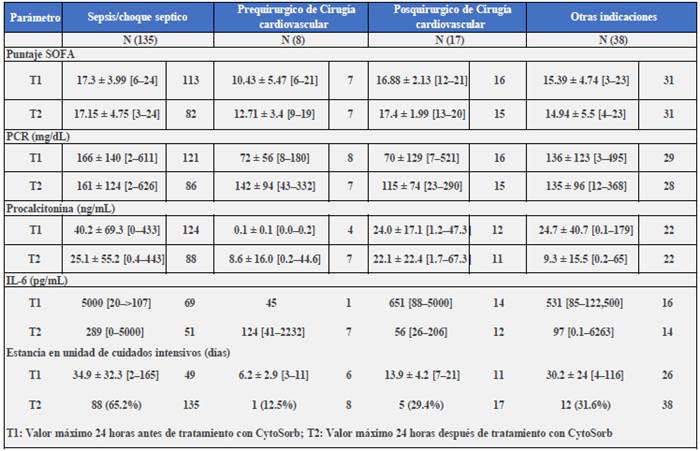
Fuente: elaboración con base en Friesecke et al. 54
Los estudios de CytoSorb® no se limitan a los pacientes sépticos, también se ha encontrado evidencia contradictoria sobre el uso de esta tecnología en pacientes perioperatorios de cirugía cardiovascular para el manejo de la tormenta de citoquinas inducida por el circuito de circulación extracorpórea: hay reportes de pacientes que tuvieron una depuración exitosa de citoquinas proinflamatorias (IL-6) y reducción de dosis de vasopresores, disminuyendo así la duración del choque55; sin embargo, en los ensayos clínicos piloto no se encontró mayor beneficio en la depuración de citoquinas ni en la reducción de la mortalidad56, por tanto, hacen falta más estudios clínicos para poder recomendar el uso rutinario de CytoSorb® en pacientes periopetarorios de cirugía cardiovascular.
Las indicaciones clínicas y de laboratorio propuestas para el uso de la tecnología Cytosorb® incluyen respuesta inflamatoria sistémica activa, choque refractario (requerimiento de noradrenalina >3 mcg/kg/min, doble soporte vasopresor o necesidad de iniciar inotrópicos), niveles de IL-6 >300-500 pg/mL, acidosis metabólica con PH <7,20, pobre aclaramiento del lactato sérico, rabdomiolisis con niveles de mioglobina >10.000 U/L y marcada hiperbilirrubinemia (>200 [imol/L) 50.
En pacientes con tormenta de citoquinas inducida por COVID-19 la tecnología CytoSorb® se postula como una herramienta prometedora y eficaz teniendo en cuenta los resultados en los pacientes sépticos y de otros escenarios con respuesta inflamatoria sistémica, pero aún están pendientes los resultados de sus dos estudios piloto: CYCOV y CYTOCOV-19, los cuales se encuentran reclutando pacientes.
Por su parte, la membrana oXiris® es una tecnología desarrollada para mejorar las propiedades de adsorción de la membrana AN69ST que está hecha de 3 capas diferentes, lo que la provee de las siguientes propiedades: soporte renal, eliminación de citoquinas, eliminación de endotoxinas y tratamiento anticoagulante local57. El uso del hemofiltro oXiris® resulta en una mayor supervivencia observada en comparación con la probabilidad predicha por un puntaje de severidad (SAPS II) para los pacientes con choque séptico, lo que mejora la estabilidad hemodinámica y el nivel de lactatemia, principalmente en pacientes con sepsis abdominal y secundaria a bacilos gramnegativos58.
Terapia plasmática
Dentro de este concepto se incluyen dos terapias: plasmaféresis y recambio plasmático. En la primera se extrae la sangre del paciente y se separan las partes formes del plasma, el cual se deja fluir a lo largo de columnas con materiales adsorbentes para eliminar solutos específicos y es introducido nuevamente en el paciente; la plasmaféresis parece ser útil en el tratamiento de la COVID-19 debido a la afinidad entre la envoltura viral y las lectinas, sin embargo esta modalidad requiere mayor investigación19. En la segunda también se separan las partes formes del plasma, pero a diferencia de la plasmaféresis, en este se reemplaza el plasma del paciente por plasma de donante o por albúmina37.
Históricamente la terapia plasmática ha sido el tratamiento estándar de algunas enfermedades inmunológicas y ha tenido como objetivos depurar anticuerpos circulantes, eliminar citoquinas proinflamatorias, estabilizar membranas endoteliales y restablecer estados hipercoagulables59,60. En el caso de los pacientes sépticos se han publicado ensayos clínicos y metaanálisis que evidencian una posible reducción en la mortalidad, sin embargo hace falta más evidencia para recomendar esta estrategia como tratamiento de rutina en este tipo de pacientes.
Para pacientes con COVID-19, algunos expertos sugieren dosis de recambio plasmático entre 1,5 y 2 veces el volumen plasmático del paciente con duraciones de entre 2 y 4 horas, y uso de tasas de flujo sanguíneo al inicio de entre 50 y 80 mL/ min que van aumentando gradualmente hasta llegar a 100 o 150 mL/min44. Y aunque hasta el momento no hay ensayos clínicos de plasmaféresis o recambio plasmático en pacientes con COVID-19, su uso es prometedor, por lo que es necesario diseñar estudios que permitan indagar más a fondo la utilidad de esta terapia en este grupo de pacientes61. En la Tabla 2 se listan los distintos tipos de terapias de purificación sanguíneas, así como sus principios y parámetros y algunas anotaciones puntales de cada uno.
Tabla 2 Terapias de purificación sanguíneas.
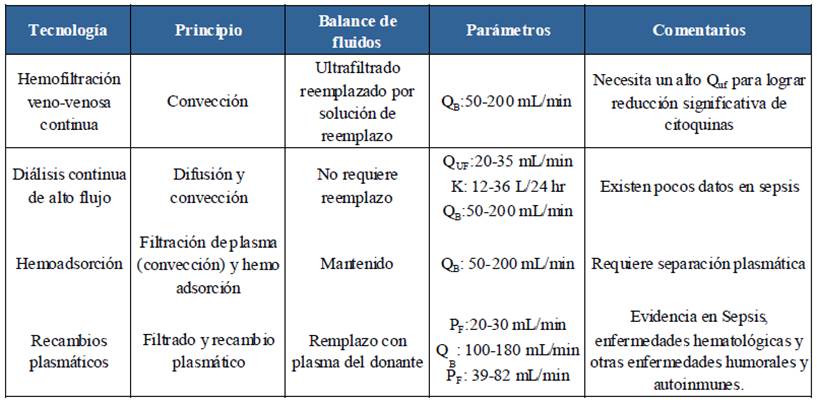
K: aclaramiento de urea; QB: flujo sanguíneo; QD: flujo de diálisis; QUF: flujo de ultrafiltrado; PF: flujo de plasma filtrado. Fuente: elaboración con base en Ronco et al.37.
Conclusiones
Teniendo en cuenta que el eje fisiopatológico central de la disfunción multiorgánica en COVID-19 es la tormenta de citoquinas, la cual es muy similar a la presentada en otro tipo condiciones como la sepsis de origen bacteriano, las terapias de purificación sanguínea (que incluyen técnicas difusivas, convectivas y de hemoadsorción, y terapia plasmática) pueden ser herramientas de tratamiento muy prometedoras en este tipo de pacientes, pues existe una gran evidencia científica que valida el manejo de la tormenta de citoquinas en otros escenarios. Por tanto, es necesario realizar ensayos clínicos de las terapias de purificación sanguínea en pacientes con COVID-19 para evaluar su efectividad y seguridad.















