Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.35 no.1 Bogotá Jan./June 2006
Artículo de investigación
Evaluación de la producción de 1,3-propanodiol por cepas nativas de Clostridium sp. mediante fermentación a partir de glicerol USP y glicerol industrial subproducto de la producción de biodiésel
Evaluating Clostridium sp. native strains1,3-propanediol production byfermentation from glycerol USP and raw glycerol from biodiesel production
Diana Paola Cárdenas, Carolina Pulido, Óscar Leonardo Aragón, Fabio Ancízar Aristizábal1, Zulma Rocío Suárez2 y Dolly Montoya2
1 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C, Colombia.
2 Grupo de Bioprocesos y Bioprospección, Instituto de Biotecnología, Universidad Nacional de Colombia, A.A. 14490, Bogotá D.C, Colombia
Recibido para evaluación: marzo 7 de 2006 Aceptado para publicación: junio 15 de 2006
RESUMEN
Este trabajo tuvo como propósito evaluar la producción de 1,3 propanodiol (1,3-PD) a partir de glicerol en trece cepas nativas de Clostridium spp, aisladas de suelos colombianos. Se evaluaron dos medios de cultivo con glicerol USP (G1A y G1B) con diferentes concentraciones de PABA, biotina y "stock" de minerales; y un medio con glicerol industrial proveniente de la producción del biodiésel y se determinó la productividad volumétrica de 1,3 PD en las cepas nativas, en los tres medios. En promedio se pudo observar que las cepas nativas presentaron una productividad 1,6 veces superior cuando fueron cultivadas en el medio G1B y un rendimiento de 1,3-PD (Yp/s) 128% mas alto con el medio G1B. La cepa nativa IBUN13A presentó una productividad volumétrica 50% superior a la cepa de referencia Clostridium butyricum DSM523 en medio G1A e incrementó su productividad en un 28% en un medio con glicerol industrial (G2). Los resultados de este trabajo sugieren que el glicerol industrial sin purificación podría ser usado para la producción de 1,3-PD a nivel industrial, mediante la optimización de las condiciones de fermentación. La transformación de este residuo en un producto rentable, podría dar valor agregado a la producción de biodiésel en Colombia.
Palabras clave: 1,3-PD, Clostridium, glicerol, productividad volumétrica, biodiésel.
SUMMARY
This work was aimed at evaluating 1,3 Propanediol (1,3-PD) production from glycerol in thirteen Clostridium sp. strains isolated from Colombian soils. Two culture media containing USP glycerol (G1A and G1B) and variable concentration of PABA, biotin and mineral stock, and a third medium containing raw glycerol from biodiesel production were evaluated. Volumetric productivity for 1,3-PD was determined in native strains in three media. In average native strains showed 1,6 greater volumetric productivity and a yield 128% higher when grown in G1B medium in comparison to those obtained in G1A medium. Native IBUN13A strain had 50% greater volumetric productivity (Q1,3 PD= 0,060 mg mL-1 h-1) than the Clostridium butyricum DSM523 reference strain (Q1,3 PD= 0.030 mg mL-1 h-1) and the same parameter was increased by 28% in raw-glycerol medium (G2) regarding that obtained in G1 medium. These results suggest that raw glycerol obtained from the biodiesel process without any purification may be used for producing 1,3-PD at industrial level by optimising fermentation conditions. Transforming this waste into an added-value product should become profitable the biodiesel production process in Colombia.
Key words: 1,3-PD, Clostridium, glycerol, volumetric productivity, biodiesel.
INTRODUCCIÓN
El 1,3 propanodiol (1,3 PD) o trimetilenglicol se emplea para producir polímeros tipo politrimetilentereftalatos (PTT) reconocidos por sus excelentes propiedades de elasticidad (8, 27). Los atributos ideales del PTT se conocen desde 1940 pero los altos costos de producción dificultaron su entrada al mercado. A comienzos de la década del noventa se desarrolló una ruta biotecnológica basada en procesos fermentativos a partir del glicerol que hizo posible la producción de PTT para aplicaciones de alto valor agregado (10). Estos procesos atrajeron la atención de empresas como DuPont, Dow Chemical Company y Tate Lyle’s para desarrollar fibras con propiedades ideales como la suavidad, adaptación, facilidad de tinción y resistencia, que han superado fácilmente al nylon en el desarrollo de cierres, sellos, conectores, cubiertas de extrusión y empaques tipo blister (4, 26, 41). El impacto del desarrollo de aplicaciones y procesos relacionados al 1,3 PD se refleja en las 499 patentes generadas entre 1970 y el 2006, 51 de las cuales se relacionan con su producción por vías biotecnológicas (18).
Adicional a su uso para el PTT, el 1,3 PD puede reemplazar a los glicoles tradicionales en la fabricación de otros sistemas poliméricos, mejorando la estabilidad térmica e hidrolítica sin afectar otras propiedades claves. Entre sus aplicaciones mas frecuentes está el diseño de refrigerantes y tintas acuosas (41). La amplia variedad de aplicaciones ha permitido estimar que para el año 2020 el 1,3 PD tendrá un mercado potencial de 230.000 toneladas métricas por año (18).
El 1,3-PD se ha sintetizado tradicionalmente por vías químicas tales como la hidrólisis de la acroleína y la reacción de óxido de etileno con monóxido de carbono e hidrógeno (12). Sin embargo, además de ser altamente costosas para la industria, estas rutas manejan reactivos tóxicos y generan rendimientos inferiores al 43% (18, 22). Este hecho ha impulsado el estudio de la conversión de glicerol a 1,3-PD por diferentes especies de bacterias, entre las que se encuentran Klebsiella pneumonie, Citrobacter freundii y Clostridium butyricum (figura 1). Para hacer esta ruta económicamente competitiva se requiere tanto de cepas de alto rendimiento como de sustratos económicos, lo cual ha motivado la búsqueda de nuevas cepas capaces de emplear subproductos con alto contenido de glicerol como fuentes de carbono para la fermentación (12, 20, 44).
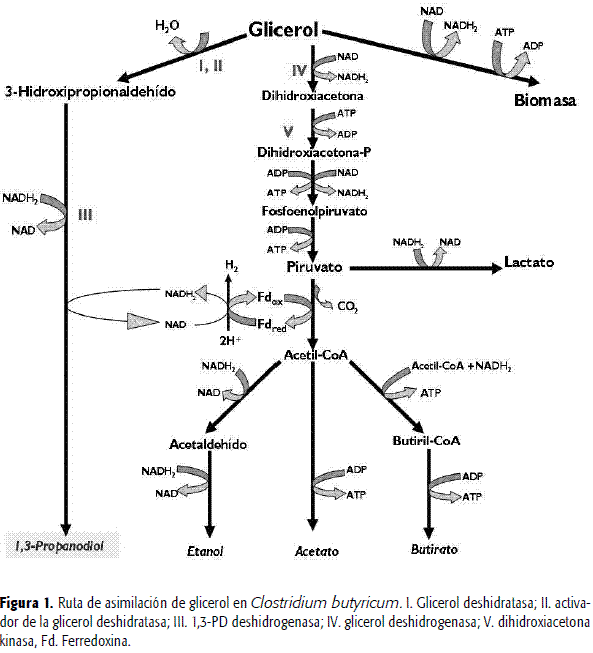
El biodiésel como fuente energética renovable, tiene el 85% del potencial energético del diésel (43) y durante su proceso productivo es posible obtener glicerol como subproducto principal en concentraciones entre 10-40% (20). Esta condición ha posicionado la producción de 1,3-PD y 3-hidroxipropionaldehido (3-HPA) a partir de glicerol como una estrategia para dar mayor valor agregado a los subproductos durante la producción, y de esta forma rentabilizar el proceso (42).
En este trabajo se presentan los resultados de la evaluación del potencial productor de 1,3-PD a partir de glicerol obtenido del proceso de biodiésel por cepas colombianas de Clostridium sp. caracterizadas molecularmente como relacionadas con Clostridium butyricum (5, 24, 33, 40).
METODOLOGÍA
Cepas utilizadas: se evaluaron 13 cepas nativas: IBUN 13A, IBUN 18A, IBUN 18Q, IBUN 18S, IBUN 22A, IBUN 62B, IBUN 62F, IBUN 64A, IBUN 95B, IBUN 125C, IBUN 137K, IBUN 140B, IBUN 158B, las cuales fueron aisladas por su producción de solventes y caracterizadas molecularmente (31, 33). Se incluyeron como cepas de referencia para la producción de 1,3-PD: Clostridium acetobutylicum ATCC 824, Clostridium butyricum DSM 2478 y Clostridium butyricum DSM 523 (1, 11, 19). Todas las cepas fueron cultivadas y conservadas en las condiciones descritas previamente por Montoya y col. (31). Se realizaron las curvas de crecimiento por duplicado, para cada cepa en medio RCM (Merck®) a 200 rpm y 37 °C por 72 horas.
Medios y condiciones de fermentación: el medio de cultivo empleado para la producción de 1,3-PD fue diseñado previamente para la fermentación acetobutílica (31), pero se sustituyó la fuente de carbono por glicerol USP 50g/L (medio G1) o glicerol industrial (68% p/p) proveniente de la producción de biodiésel (medio G2). Se determinó la edad del inóculo para obtener la mayor producción de 1,3-PD. Se probaron tres puntos de la curva de crecimiento en el medio RCM: la fase de crecimiento acelerado (T1), la fase exponencial (T2) y la fase de crecimiento desacelerado (T3). Todos los experimentos se realizaron en las condiciones descritas anteriormente.
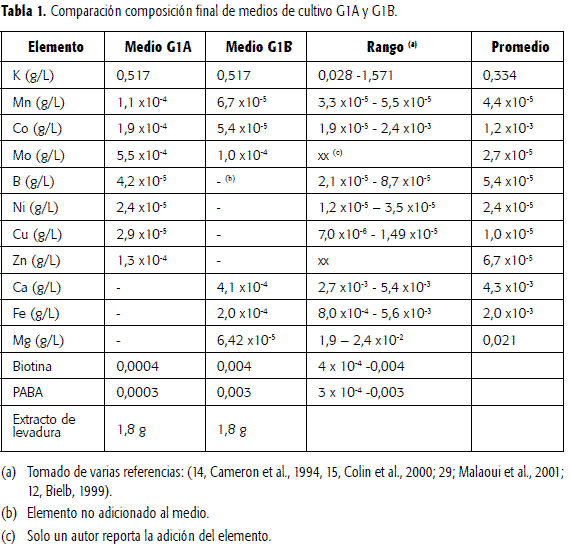
Los medios G1A y G2 se prepararon empleando como fuente de carbono glicerol USP al 50% y glicerol industrial al 68% respectivamente, con la composición descrita a continuación: KH2PO4 1.8 g, extracto de levadura 3 g, biotina 0,4 mg y PABA 0,3 mg, y 4,0 mL del "stock" de minerales preparado con la siguiente composición por litro: ZnCl2 70 mg, MnCl2 .4H2O 100 mg, CoCl2.2H2O 200 mg, H3BO3 60 mg, CuCl2.2H2O 20 mg, NiCl2.6H2O 25 mg, Na2MoO4.2H2O 35 mg, HCl 37% 0.9 mL, de acuerdo a lo descrito por Biebl y Pfenning (9). Para la segunda prueba, en el medio G1B, las concentraciones de PABA y biotina fueron de 3 mg y 4 mg respectivamente y 4 ml del "stock" de minerales preparado con la siguiente composición por litro: MgSO4 · 7H2O 640 mg, CaCl2 · 2H2O 380 mg, FeSO4 · 7H2O 253 mg, MnCl2 · 4H2O 60 mg, CoCl2 · 6H2O 60 mg, NaMoO4 · 2H2O 65 mg de acuerdo a Montoya y col (44). En todos los casos el pH se ajustó a 7,0 con KOH 2N (34).
Se crecieron todas las cepas nativas y de referencia en medio G1A y G1B para seleccionar la cepa mejor productora de 1,3-PD y emplearla en la degradación del glicerol industrial en medio G2. En la Tabla 1 se presentan las composiciones finales de los medios evaluados y se comparan con los rangos y valores promedios de otros trabajos (1, 9,14, 15,16, 29, 31).
Determinación de la fuente de carbono y perfiles de ácidos y solventes: el glicerol, los ácidos acético y butírico, y el 1,3-propanodiol fueron cuantificados por cromatografía de gases (CG). Para ello, las muestras se filtraron por membranas de 0,22 µm y se analizaron en un cromatógrafo VARIAN 3400, empleando una columna semicapilar DB-WAX, con un detector de ionización de llama (FID), con 1,2-propanodiol como estándar interno (500 ppm). Se tomaron 0,2 µL de la mezcla y se inyectaron a una temperatura de 210 ºC y en la columna se utilizó una rampa de temperatura de 50 ºC a 110 ºC a 13,5 ºC/min y de 110 ºC a 215 ºC a 30 ºC/min. Se empleó el programa VARIAN STAR 4.5 para el procesamiento de los datos. La biomasa fue determinada por el método de peso seco con una muestra de 1 mL, la cual se centrifugó a 12.000 rpm por 15 min; se eliminó el sobrenadante y se secó a 59 ºC hasta obtener peso constante. La densidad óptica se determinó a una longitud de onda de 680 nm en un espectrofotómetro VARIAN DMS100.
RESULTADOS Y DISCUSIÓN
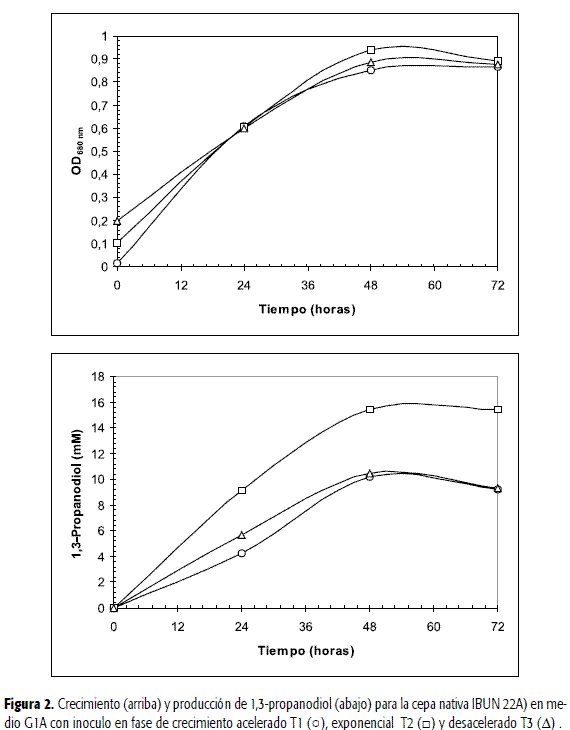
Condiciones del inóculo: Se consideró conveniente establecer la mejor edad para la preparación del inóculo porque se ha demostrado en diferentes especies que la edad del inóculo influye significativamente en el crecimiento, la productividad y la reproducibilidad de la fermentación, debido a que los microorganismos asumen de manera heterogénea las fluctuaciones de pH y las condiciones de estrés que representa el cambio de medio dependiendo de sus estados fisiológicos asociados a su crecimiento (23, 25). Adicionalmente, es conocido que en Clostridium la solventogénesis se dispara diferente dependiendo de la edad del inóculo. Las cepas nativas IBUN 22A, IBUN 64A, IBUN 125C y la cepa patrón Clostridium butyricum DSM 523 fueron seleccionadas para determinar la edad del inóculo. En este trabajo, los resultados mostraron que la mejor fase para inocular es la fase exponencial (T2), puesto que en todas las cepas presentó la mayor tasa de crecimiento y una mayor producción de 1,3-propanodiol en el medio G1A. En la figura 2, se observa este comportamiento para la cepa nativa IBUN 22 A, inoculada en las tres diferentes fases del crecimiento. Estos resultados concuerdan con lo enunciado por Abbad-Andaloussiy col., y Saint Amans et al. (3, 39), quienes sugirieron que el 1,3-PD puede considerarse un metabolito primario al estar asociado al crecimiento.
Producción1,3-PD enmedio de cultivo G1A (glicerol USP): en la tabla 2 se presentan los rendimientos de sustrato en producto (Yp/s) y la productividad volumétrica (QD) de cada una de las cepas nativas y en cada uno de los diferentes medios. Tanto en el medio G1A como en el medio G1B las cepas nativas IBUN 18Q, IBUN 62B e IBUN 62F presentaron un crecimiento muy limitado utilizando glicerol USP como fuente de carbono y energía. Las restantes 10 cepas (IBUN 13A, IBUN 18A, IBUN 18S, IBUN 22A, IBUN 64A, IBUN 95B, IBUN 125C, IBUN 137K, IBUN 140B, IBUN158B) crecieron en ambos medios. En el primero, los valores de productividad de 6 de ellas fueron del mismo orden o superiores a la mejor cepa patrón Clostridium butyricum DSM523 (Q1,3-PD = 0,030 g L-1h-1), con los valores más altos en las cepas IBUN 22A e IBUN 13A. En el medio de cultivo G1B nueve de las 10 cepas nativas presentaron mayor productividad que la mejor cepa patrón, siendo las tres mejores IBUN 137 K, IBUN 13A e IBUN 158 B. En promedio se pudo observar que las diez cepas nativas presentaron una productividad 1,6 veces superior cuando fueron cultivadas en el medio G1B. Respecto al rendimiento del 1,3-PD (Yp/s), el promedio de las 10 cepas nativas pasó de 0,229 a 0,512 mol/mol con el medio G1B. Los anteriores resultados demuestran que las condiciones ofrecidas por el medio G1B son más favorables para que las cepas nativas asimilen el glicerol y produzcan 1,3-propanodiol
.
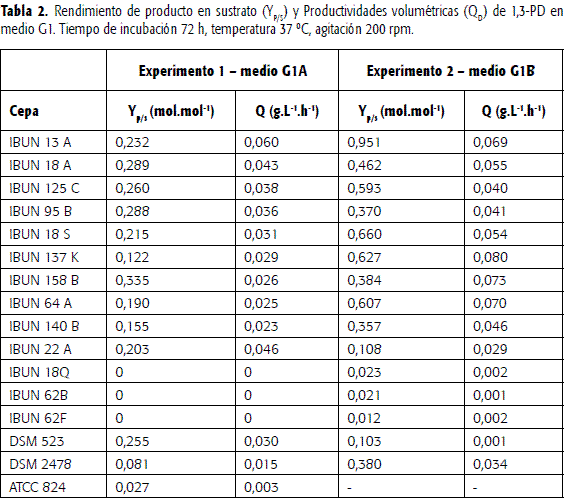
Se evaluaron dos niveles de concentración de PABA de 0,3 a 3 mg/L y de biotina de 0,4 a 4mg/L y el cambio en el "stock" de minerales en los medios G1A y G1B respectivamente (Tabla 1), porque se consideró que estas modificaciones podrían contribuir favorablemente en la producción de 1,3 PD de acuerdo a lo establecido por otros autores (28, 37, 38, 36). Se ha estudiado la actividad de algunas de las enzimas involucradas en la ruta metabólica de asimilación del glicerol y se ha demostrado que la concentración de iones metálicos dentro de la célula, influye en la actividad hidrogenasa y 1,3-propanodiol deshidrogenasa (2, 37, 35). Este hecho motivó la variación de la composición de minerales en el medio G1B con respecto al medio G1A.El medio G1B de mayor producción de 1,3 PD fue preparado con concentraciones más bajas de manganeso, cobalto y molibdeno, y se excluyeron boro, níquel, cobre y zinc con respecto a la composición del medio G1A, pero se adicionó calcio, hierro y magnesio. Los resultados revelaron que la composición del medio G1B puede estar relacionada con un incremento del 124% en la producción de 1,3 PD en las diez cepas productoras con respecto al valor inicial obtenido en los ensayos preliminares con medio G1A (tabla 2). Reimman y col. (38) mostraron resultados similares al determinar que la relación H2/CO2 estaba asociada a la composición de hierro para aumentar la producción de 1,3-propanodiol, y propusieron un valor óptimo en el medio de cultivo de 5 mg/L de FeCl3, aproximadamente 1,7 mg/L de Fe, punto en el cual no se presenta limitación de este elemento para la formación de biomasa (37).
Cinéticas de crecimiento en los medios de cultivo G1A y G1B (glicerol USP): se escogió la cepa nativa IBUN 13A como representativa del comportamiento en cada medio debido a que presentó los mayores valores de rendimiento molar y la productividad volumétrica en medio G1A. La tabla 3 presenta una comparación de las cinéticas de crecimiento de esta cepa en medio G1A y G1B respectivamente con la cepa Clostridium butyricum B593 estudiada por Forsberg en condiciones semejantes a las de este trabajo (19), en cuanto a sus parámetros cinéticos calculados entre la fase de crecimiento acelerado, exponencial y desacelerado inicial y tardía de cada cepa.
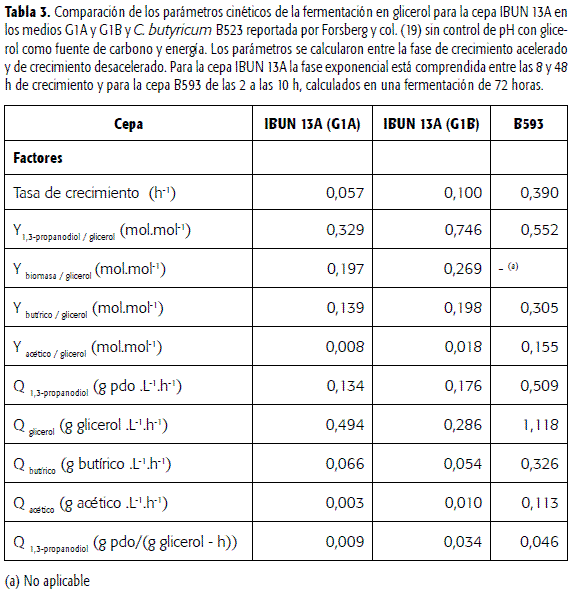
El medio G1A fue diseñado con base en un medio generado para la fermentación acetobutílica, ruta que compite naturalmente con la producción de 1,3-PD (31), mientras que en el medio G1B únicamente se tomaron en consideración los elementos que pudieran afectar la ruta de asimilación del glicerol. Para el caso de la cepa IBUN13A se observó un incremento del 76% en la velocidad de crecimiento y un aumento del 15% en la productividad volumétrica del 1,3-PD que revelan que bajo esta condición no se presenta la inhibición por sustrato que suele ser uno de los principales factores que limitan la productividad del 1,3-PD, según lo reportado por Colin y col. (15) (tabla 3).
La formación de acetato y butirato están involucrados con la producción de ATP y con la liberación de equivalentes reductores NADH2 que son regenerados a través de la ruta del 1,3 PD tipo a NAD (figura 1)(45). Por ello, la relación butirato/acetato es uno de los parámetros metabólicos de mayor incidencia en la fermentación de glicerol a 1,3-propanodiol. Algunos autores sugieren que un incremento en la formación de acetato conlleva a un aumento en el rendimiento molar de 1,3-PD, mientras que un aumento en la formación de butirato produce un incremento en la producción de ATP y biomasa (9, 15, 22). En este trabajo se obtuvo un incremento en la concentración de acetato y una reducción en 65% en la relación butirato/acetato con el cambio de medio G1A a G1B para la cepa IBUN13A, lo cual pudo haber favorecido la producción de 1,3 PD.
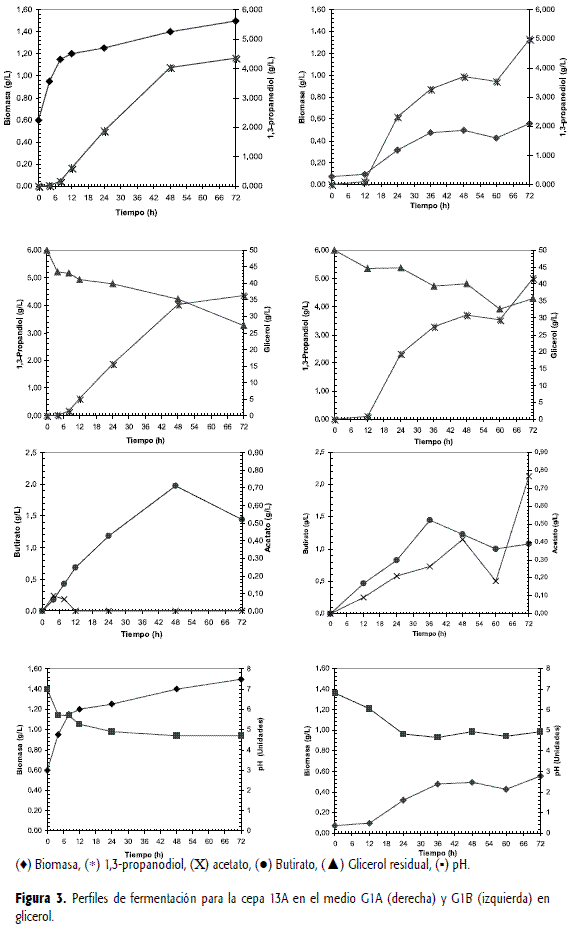
En la figura 3 se presentan los perfiles de producción de ácido acético de la cepa IBUN13A en los dos medios evaluados G1A y G1B. Inicialmente presentó un aumento de la concentración con un valor máximo a las 4 horas de fermentación y posteriormente una disminución acelerada. En las horas siguientes la concentración se mantuvo por debajo del nivel de detección del método analítico. Al cambiar a medio G1B el perfil de formación de acetato fue variable y dependiendo el tiempo de fermentación fue producido o consumido, aunque mantuvo una tendencia creciente de la concentración neta. Este comportamiento puede estar asociado con la actividad de enzimas involucradas en la síntesis del ácido acético, la cual puede ser reversible, abriendo la posibilidad de que sea reasimilado dependiendo de las relaciones de acetil-CoA/CoA y ATP/ADP(39, 45) (figura 3). Este metabolismo adaptativo es una oportunidad para la aplicación de ingeniería metabólica en estas cepas, puesto que se ha establecido que el mayor rendimiento de 1,3-propanodiol se presenta sólo cuando existe producción de ácido acético acompañada de la generación de H2 y CO2 (19), de forma que las dos moléculas de NADH2 que son invertidas en la formación de butirato (34) sean redirigidas hacia la producción del diol de interés
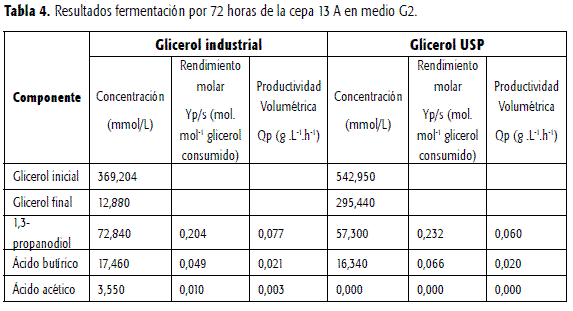
Fermentación en el medio de cultivo G2 (glicerol industrial): la cepa 13A fue cultivada bajo las mismas condiciones del medio G1A, pero la fuente de carbono fue glicerol industrial proveniente de la producción de biodiésel a partir de aceite de palma, sin ningún tratamiento de purificación (13). Los resultados obtenidos muestran una reducción del 12% en el rendimiento molar de 1,3-propanodiol, aunque la productividad obtenida con la misma cepa se incrementó en 28,3% con respecto al medio G1A (tabla 4). También presentó mayor generación de ácido acético y la concentración de ácido butírico se mantuvo constante. Este resultado concuerda con lo reportado por diferentes autores quienes afirman que el glicerol crudo es un sustrato conveniente para la producción biotecnológica de 1,3-PD. Cabe resaltar que no se observó una disminución en la eficiencia de fermentación a pesar de utilizar un producto industrial con gran cantidad de impurezas dentro de las que se encuentran inhibidores del crecimiento como metanol o etanol, metales pesados y sales de sodio, por tanto estas cepas nativas son una alternativa para la bioconversión del residuo en 1,3 PD (16, 20, 21).
Aunque los resultados de este trabajo son prometedores, se requieren estudios posteriores con control de condiciones de fermentación y pH, que permitan incrementar rendimientos para establecer la rentabilidad del proceso en términos de negocio y con ello estimar si es posible hacer viable la producción de biodiésel dando valor agregado a uno de sus subproductos. De esta forma será posible hacer que los rendimientos de la fermentación sean comparables con los presentados por cepas utilizadas actualmente a nivel industrial. Adicionalmente, se requiere un mayor conocimiento de la estructura genética que regula la asimilación de glicerol para considerar la posibilidad de hacer cambios genéticos que favorezcan la producción de 1,3 PD y disminuyan otros subproductos como el ácido butírico y el etanol, lo cual podría rentabilizar más el proceso.
CONCLUSIONES
En este trabajo se demostró que las cepas nativas IBUN 13A, IBUN 18A, IBUN 18S, IBUN 22A, IBUN 64A, IBUN 95B, IBUN 125C, IBUN 137K, IBUN 140B, IBUN158B, Clostridium acetobutylicum ATCC 824, Clostridium butyricum DSM 2478 y Clostridium butyricum DSM 523, tienen la capacidad de crecer en un medio que contiene glicerol como única fuente de carbono y producir 1,3-propanodiol. De estas, la cepa IBUN 13A es capaz de emplear el glicerol industrial proveniente de la producción de biodiésel sin purificación como única fuente de carbono para producción de 1,3-PD. Por otra parte se determinó que los componentes del medio G1B aumentan la producción de 1,3-propanodiol de las cepas nativas con respecto a los del medio G1A. Finalmente se confirmo que el inóculo en medio RCM, debe prepararse en la fase exponencial de crecimiento.
AGRADECIMIENTOS
Este trabajo fue desarrollado dentro del marco del proyecto "Producción de 1,3-propanodiol a partir de glicerol generado del proceso productivo de biodiésel, empleando cepas nativas de Clostridium sp: estudio del operón condiciones de producción por fermentación y su viabilidad económica", código 1101-12-17848 financiado por el Instituto Colombiano Francisco José de Caldas, Colciencias, y la Universidad Nacional de Colombia. Los autores agradecen a la empresa SI99, Bogotá-Colombia por el suministro de glicerol industrial para el desarrollo de este proyecto.
BIBLIOGRAFÍA
1. S. Abbad-Andaloussi, C. Dürre, J. Amine, E. Petitdemange, H. Petitdemange, Isolation and characterization of Clostridium butyricum DSM 5431 mutants with increased resistance to 1,3-propanediol and altered production of acids, Applied and Environmental Microbiology, 61, 4413(1995). [ Links ]
2. S. Abbad-Andaloussi, E. Guedon, E. Spiesser, H. Petitdemange, Glycerol dehydratase activity: The limiting step for 1,3-propanediol production by Clostridium butyricum DSM 5431, Letters in Applied Microbiology, 22, 311(1996). [ Links ]
3. S. Abbad-Andaloussi, C, Dürre, G. Raval, H. Petitdemange, Carbon and electron flow in Clostridium butyricum grown in chemostat culture on glycerol and on glucose, Journal of Microbiology, 142, 1149 (1996). [ Links ]
4. T. Ames, C.H. Babowicz, Development of a Fermentation-Based Process for 1,3-Propanediol:Highlights of a Successful Path from Corn to Textile Fiber, En "Proceedings of the Twenty-Fifth Symposium on Biotechnology for Fuels and Chemicals", por M. Finkelstein y B.H. Davison, Humana Press Editors, pp. 876, (2004). [ Links ]
5. C. Arévalo, "Contribución a la caracterización molecular de cepas nativas de Clostridium spp. con potencial biotecnológico", Tesis de grado para optar al título de Magíster Scientiae en Microbiología. Universidad Nacional de Colombia, 2001, pp 1-100. [ Links ]
6. F. Barbirato, C. Camarasa-Calaret, B. Grivet, A. Bories, A, Glycerol fermentation by a new 1,3-propanediol-producing microorganism: Enterobacter agglomerans, Applied Microbiology and Biotechnology, 43,786 (1995). [ Links ]
7. F. Barbirato, P. Soucaille, A. Bories, Physiologic mechanisms involved in accumulation of 3-hydroxypropionaldehyde during fermentation of glycerol by Enterobacter agglomerans, Applied Environmental Microbiology, 62,4405 (1996). [ Links ]
8. F. Barbirato, E.H. Hassan,T. Conte, A. Bories, 1,3-Propanediol production by fermentation: An interesting way to valorize glycerin from the ester and ethanol industries, Industrial Crops and Products, 7 ,281, (1998). [ Links ]
9. H. Biebl, N. Pfenning, En "The Procaryotes: A handbook on habitats, isolation and identification of Bacteria", Ed. por M.P. Starr et al., Springer-Verlag, Berlin, 1981, Vol.1, pp. 267-273. [ Links ]
10. H. Biebl, Glycerol fermentation to 1,3-propanediol by Clostridium butyricum. Measurement of product inhibition by use of a pH-auxostat, Applied Microbiology and Biotechnology, 35, 701 (1991). [ Links ]
11. H.Biebl, S. Marten, H. Hippe, W.D. Deckwer,. Glycerol conversion to 1,3-propanediol by newly isolated clostridia, Applied Microbiology and Biotechnology, 36, 59 (1992) [ Links ]
12. H. Biebl, K. Menzel, A.P. Zeng, W.D. Deckwer, Microbial production of 1,3-propanediol, Applied Microbiology and Biotechnology, 52, 289 (1999). [ Links ]
13. D. Cárdenas y C. Pulido, "Evaluación del potencial de las cepas nativas de Clostridium spp. para producir 1,3-Propanodiol por medio de la fermentación de glicerol", Tesis de Grado, Universidad Nacional de Colombia. Bogotá D.C., Colombia. 2004.120p. [ Links ]
14. D. Cameron, J. Koutsky, Conversion of glycerol from soy diesel production to 1,3-propanediol. Final report, National Biodiesel Development Board. UW Madison, Madison, 1994.URL: http://www.biodiesel.org/resources/reportsdatabase/reports/gen/19941001_gen-243.pdf, noviembre , (2005). [ Links ]
15. T.Colin, A. Bories, G. Moulin, Inhibition of Clostridium butyricum by 1,3-propanediol and diol during glycerol fermentation, Applied Microbiology and Biotechnology, 54, 201 (2000). [ Links ]
16. B.Dabrock, H. Bahl, G. Gottschalk,. Parameters affecting solvent production by Clostridium pasterianum, Applied Environmental Microbiology, 58, 1233 (1992). [ Links ]
17. W.D. Deckwer, Microbial conversion of glycerol to 1,3 Propanediol, FEMS Microbiology Reviews, 16,143(1995). [ Links ]
18. M. Finkelstein, B.H. Davison, "Twenty-Fifth Symposium on Biotechnology for Fuels and Chemicals", Humana Press Eds., New Jersey, 2004, pp 1223. [ Links ]
19. C. Forsberg, Production of 1,3-propanediol from Glycerol by Clostridium acetobutylicum and other Clostridium species, Applied Environmental Microbiology,53, 639 (1987). [ Links ]
20. M. GonzálezPajuelo, J.C. Andrade, J.J. Vasconcelos, Production of 1,3-propanediol by Clostridium butyricum VPI 3266 using a synthetic medium and raw glycerol. Journal of Industrial Microbiology and Biotechnology, 31, 442 (2004). [ Links ]
21. M. González-Pajuelo, J.C. Andrade,I. Vasconcelos, Production of 1.3 Propanediol by Clostridium butyricum VPI 3266 in continuos cultures with high yield and productivity, Journal of Industrial Microbiology and Biotechnology,32,1 (2005). [ Links ]
22. E.H. Himmi, A. Bories, F. Barbirato, Nutrient requirements for glycerol conversion to 1, 3 Propanediol by Clostridium butyricum, Bioresource Technology, 67,123-128. (1999). [ Links ]
23. T. Hornbæk, A.K. Nielsen, J. Dynesen, M. Jakobsen. The effect of inoculum age and solid versus liquid propagation on inoculum quality of an industrial Bacillus licheniformis strain, FEMS Microbiology Letters, 236 145-151. (2004). [ Links ]
24. C.P. Jaimes, F.A. Aristizabal, M. Bernal, Z.R. Suárez; D. Montoya, AFLP fingerprinting of Colombian Clostridium spp strains, multivariate data analysis and its taxonomical implications, Journal of Microbiological Methods, 67,64-69 (2006). [ Links ]
25. E.R. Kashket, Z.Y. Cao. Isolation of a Degeneration Resistant Mutant of Clostridium acetobutylicum NCIMB 8052. Applied Environmental Microbiology, 59 (12):4198 4202 (1993). [ Links ]
26. J.V. Kurian, A new polymer platform fro the future- Sorona® from corn derived 1,3-Propanediol, Journal of Polymers and the Environment,13,159-167 (2005). [ Links ]
27. Y. Liu, "New biodegradable Polymers from renewable resources", Department of polymer Technology, Royal Institute of Technology (KTH), Sweeden, 3 (2000). [ Links ]
28. F. Luers, M. Seyfried, R. Daniel, G. Gottschalk G, Glycerol conversion to 1,3-propanediol by Clostridium pasteurianum: cloning and expression of the gene encoding 1,3-propanediol dehydrogenase, FEMS Microbiology Letters, 154, 337 (1997). [ Links ]
29. H. Malaoui, R. Marczak, Influence of glucose on glycerol metabolism by wild-type and mutant strains of Clostridium butyricum E5 grown in chemostat culture, Applied Microbiology and Biotechnology, 55, 226 (2001). [ Links ]
30. K. Menzel, A.P. Zeng, W.D. Deckwer, High concentration and productivity of 1,3-propanodiol from continuous fermentation of glycerol by Klebsiella pneumoniae, Enzyme Microbial Technology, 20, 82 (1997). [ Links ]
31. D. Montoya, J. Sierra, E. Silva, G. Buitrago, J. Ramos, Optimizacion de un medio de cultivo industrial para la fermentación acetobutílica, Revista Colombiana de Biotecnología,2, 37(1999). [ Links ]
32. D. Montoya, S. Espitia, E. Silva, W. Schwarz, Isolation of mesophilic Solvent producing Clostridia from Colombian sources: Physiological characterization, solvent producing and polysaccharide hydrolysis, Journal of Biotechnology, 79, 117(2000). [ Links ]
33. D. Montoya, C. Arévalo, S. Gonzáles, F.A. Aristizábal, W.H. Schwarz, New solvent-producing Clostridium sp. Strains, hydrolyzing a wide range of polysaccharides, are closely related to Clostridium butyricum, Journal of Industrial Microbiology and Biotechnology, 27, 329 (2001).
34. S. Papanikolaou, P. Ruiz, B. Pariset, F. Blanchard, M. Fick, High production of 1,3-propanediol from industrial glycerol by a newly isolated Clostridium butyricum strain, Journal of Biotechnology, 77, 191 (2000). [ Links ]
35. S. Peguin, P. Soucaille, Modulation of carbon and electron flow in Clostridium acetobutylicum by Iron limitation and Methyl viologen addition, Applied and Environmental Microbiology, 61, 403 (1995). [ Links ]
36. C. Raynaud, P. Sarçabal, I. Meynial-Salles, C. Croux, P. Soucaille, Molecular characterization of the 1,3-propanediol (1,3-PD) operon of Clostridium butyricum , Proceedures of the National Academy of Sciences USA, 100, 5010 (2003). [ Links ]
37. A. Reimann, H. Biebl, W.D Deckwer, Influence of iron, Phosphate and methyl viologen on glycerol fermentation of Clostridium butyricum, Applied Microbiology and Biotechnology, 45, 47(1996). [ Links ]
38. A. Reimann, S. Abbad-Andaloussi, H. Biebl, H. Petitdemange, 1,3-propanediol formation with product-tolerance mutants of Clostridium butyricum DSM 5431 in continuous culture: productivity, carbon and electron flow, Journal of Applied Microbiology, 84, 1125 (1998). [ Links ]
39. S. Saint Amans, l. Girbal, J. Andrade, K. Ahrens, P. Soucaille, Regulation of carbon and electron flow in Clostridium butyricum VPI 3266 grown on glucose glycerol mixtures, Journal of Bacteriology, 77, 191(2001). [ Links ]
40. Z. Suárez, B. Cháves, F.A. Aristizábal, D. Montoya, "Polyphasic approach to the taxonomy of thirteen Clostridium spp. strains by means of multivariate data analysis: Strategy for describing a new species". Proceedings of the 158th SGM Meeting . Warwick University. England. (2006). [ Links ]
41. U.Szewzyk, T. Griebe, S.Straker, Polyurethanes Expo 1999: Conference Proceedings, CRC Press, Orlando, 1999, pp. 1-623. [ Links ]
42. S. Vollenweider, C.Lacroix,3-Hydroxypropionaldehyde:Applications and perspectives of biotechnological production, Applied Microbiology and Biotechnology, 64,16 (2004). [ Links ]
43. M. Zappi, R. Hernández, D. Sparkz, J. Horne, M. Brough, S. Arora, D. Montsenbacker, A review of the engineering aspects of the biodiesel industry, URL: http://www.mississippi.org/programs/energy/Biodiesel%20Study/Eng_AspectsCh1.pdf, noviembre 2005. [ Links ]
44. A.P. Zeng, H. Biebl, Bulk Chemicals from Biotechnology: The Case of 1,3 propanediol production and the New Trends, Advances in Biochemical Engineering, 74, 240 (2002). [ Links ]
45. A.P. Zeng, Pathway and kinetic analysis of 1,3-Propanediol production from glycerol fermentation by Clostridium butyricum, Bioprocess Engineering,14,169 (1996). [ Links ]














