Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.61 no.4 Bogotá Oct./Dec. 2013
ARTÍCULO DE REVISIÓN
Proceso de Cicatrización de heridas de piel, campos endógenos y su relación con las heridas crónicas
Wound healing process of skin, endogenous fields related and chronic wounds
Claribeth Guarín-Corredor1; Paola Quiroga-Santamaría1; Nancy Stella Landínez-Parra MSc2
1 Fisioterapia. Universidad Nacional de Colombia. Bogotá, Colombia.
2 Departamento del Movimiento Corporal Humano, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
Correspondencia: nslandinezp@unal.edu.co.
Recibido: 16/10/2013 / Aceptado: 20/12/2013
Guarín-Corredor C, Quiroga-Santamaría P, Landínez-Parra NS. Proceso de Cicatrización de heridas de piel, campos endógenos y su relación con las heridas crónicas. rev.fac.med. 2013;61:441-448.
Resumen
Antecedentes. La cicatrización de heridas en piel es un proceso de alta complejidad orientado a recuperar la integridad del tejido, permitiendo su regeneración y restaurando sus funciones.
Objetivo. Revisar los procesos de cicatrización normal y de heridas crónicas en la piel y su relación con las corrientes endógenas.
Materiales y métodos. Se realizó una búsqueda de artículos en diferentes bases de datos, la cual se hizo con base en los títulos de términos médicos (Medical Subjects Headings) MESH, con la utilización de los vocablos "Wound Healing", "Pressure Ulcer" y el subencabezado "Electrophysiology", "Electric Stimulation" and "Skin".
Resultados. La alteración de factores intrínsecos o extrínsecos puede conducir a heridas crónicas, lo que se evidencia en cambios en el comportamiento bioeléctrico de la piel y sus características dieléctricas. La activación de la migración celular y, con esta, el proceso de cicatrización, mediante la generación de un estimulo eléctrico exógeno es posible en presencia de alteraciones de los campos endógenos.
Conclusión. El proceso de cicatrización depende de múltiples factores tanto intrínsecos como extrínsecos, los cuales son fácilmente alterables. Para esto, es fundamental comprender a cabalidad el comportamiento de la piel ante una lesión y cuáles son los mecanismos que se alteran cuando se instaura una lesión crónica.
Palabras clave: Cicatrización de Heridas, Úlcera por Presión, Electrofisiología, Estimulación Eléctrica, Piel (DeCS).
Summary
Background. The skin wound healing is a highly complex process that can recover tissue integrity allowing regeneration and restoring its functions.
Objective. To review literature about normal healing processes and altered.
Materials and methods. Research of articles in different databases, which was based on the titles of medical terms (Medical Subject Headings) MESH, with the use of the terms "Wound Healing", "Pressure Ulcer" and the subheader "Electrical Physiology", "Electric Stimulation" and "Skin".
Results. The alter of intrinsic or extrinsic factors can lead to chronic wounds, as is evidenced in changes of the skin bioelectrical behavior and its dielectric properties. Activation of cell migration and wound healing this by generating an electrical stimulus exogenous, it's possible in presence of alterated endogenous fields.
Conclusion. The healing process depends on many extrinsic and intrinsic factors, which are easily alterable. For this, it's essential to fully understand the behavior of the skin to injury and what the mechanisms are altered when it establishes a chronic injury.
Key words: Wound Healing, Pressure Ulcer, Electrophysiology, Electric Stimulation, Skin (MeSH).
Introducción
La piel es una membrana fibroelástica, considerada la "envoltura viva del cuerpo"; es un órgano que desempeña una gran gama de funciones que incluyen la protección frente a agresiones externas, la termorregulación, la absorción de radiaciones ultravioleta y la producción de vitamina D. Adicionalmente, tiene una importante función de reconocimiento inmunitario, es una eficaz barrera de protección contra micro-organismos patógenos, siendo el órgano de mayor extensión y un potente receptor de estímulos sensoriales (1,2).
La frecuente exposición a las agresiones del entorno hace que este órgano sea susceptible a sufrir lesiones que comprometan su integridad alterando el normal desarrollo de sus funciones (3). Uno de los factores que comprometen la continuidad de este tejido son las heridas crónicas como las úlceras por presión (UPP), las cuales han constituido un problema de salud pública que afecta principalmente a aquellas personas que deben permanecer en cama durante largos periodos de tiempo como consecuencia de enfermedades crónicas (4).
Este tipo de lesiones crónicas han sido estudiadas desde el siglo XIV (5,6); desde entonces se ha analizado su etiología y fisiopatología en busca de proponer la mejor opción de tratamiento para su resolución. Existen distintas técnicas de manejo, dentro de ellas se encuentran: las curas húmedas (7), el debridamiento (8,9), el uso de modalidades físicas como el láser (10), el ultrasonido (11) y la electro-estimulación (12). Sin embargo, el más utilizado, por su fácil manejo y accesibilidad, ha sido el uso de hidrocoloides (7).
Dentro de las modalidades físicas, una de las más empleadas para el manejo de este tipo de lesiones ha sido la electro-estimulación. Diferentes estudios han reportado los efectos de esta técnica en la aceleración del proceso de cicatrización, aunque también se han reconocido sus efectos bactericidas (13-16). Estos proponen diferentes parámetros de aplicación, aspecto que dificulta que en la actualidad sea utilizada como herramienta útil en el manejo de las heridas crónicas, de tal manera que contribuya a una mejor calidad de vida en individuos que presenten este tipo de lesión (17).
La piel también se caracteriza por ser una batería eléctrica que produce una corriente endógena capaz de emitir señales bio-eléctricas que generan potenciales, los cuales tienen la facultad de estimular la activación de grupos celulares para la continua remodelación del tejido. Este potencial eléctrico acompaña a los estímulos químicos y mecánicos que se producen cuando se genera una lesión en la piel y desencadena un proceso de cicatrización que permite restituir las características y funciones del tejido (18). Esta revisión tiene como objetivo analizar el proceso de cicatrización normal de la piel, los factores que intervienen en este proceso, así como, los mecanismos que interfieren y que generan heridas crónicas.
Materiales y métodos
Se realizó un estudio de tipo exploratorio-descriptivo a partir de la implementación secuencial de dos fases: (a) revisión de la literatura y (b) clasificación y análisis de la misma.
Revisión de la literatura
Esta permitió comprender los procesos de cicatrización y no cicatrización de la piel, así como también el comportamiento bio-eléctrico y de campos endógenos en sus continuos procesos de restauración. De igual forma, permitió analizar desde la teoría la alteración de estos comportamientos a causa de factores extrínsecos o intrínsecos que interfieren con el normal proceso de cicatrización, alterando la regeneración de la piel y la recuperación de las funciones propias de la misma.
Para desarrollar esta búsqueda de literatura se exploraron las siguientes bases de datos: PubMed, MEDLINE, All EMB Reviews, Blackwell Sinergy, Doaj (Directory Of Open Access Journals), Dynamed, Nature.com, OVID-Journal, Springer Journal, Science Direct y JSTOR. La búsqueda se realizó entre octubre de 2011 y marzo de 2012, con base en los títulos de términos médicos (Medical Subjects Headings) MESH, con la utilización de los vocablos "Wound Healing" y los subencabezados "Electrophysiology", "Pressure Ulcer", "Electrical Stimulation" and "Skin"; para ello se empleó el conector boleano AND.
Clasificación y análisis de la información
Durante esta fase se evaluaron, desde la evidencia, las principales características de los procesos de cicatrización, así como los fenómenos bio-eléctricos que suceden de la mano de las fases de cicatrización. De igual forma, se realizó un acercamiento a los eventos intrínsecos y extrínsecos que pueden afectar el proceso secuencial y solapado de cicatrización normal y su expresión desde los procesos de alteración de los campos endógenos; lo anterior se realizó con el propósito de entender la importancia funcional que tiene el conocer, desde el punto de vista fisiológico y bio-eléctrico, las alteraciones ocurridas en las heridas que se hacen crónicas, con el propósito de plantear alternativas de solución que aseguren el restablecimiento de los procesos de regeneración de piel de manera eficiente y selectiva.
Resultados
Después de realizada la fase de búsqueda bibliográfica en las bases de datos, se encontraron 352 artículos, de los cuales se seleccionaron 122 que cumplieron con los criterios de búsqueda. De estos se seleccionaron 98 relacionados con los enfoques específicos de esta revisión. A continuación se presentan, de manera resumida, los principales aportes compilados desde la evidencia bibliográfica e investigativa de diversos autores, en torno al tema propuesto.
Proceso de cicatrización
El proceso de cicatrización activado a partir del daño producido se describe, por lo general, como una sucesión de eventos independientes. En esencia se puede entender como un conjunto de cuatro fases solapadas e interconectadas y dependientes de la activación y de la acción celular que estimulan el crecimiento, reparación y remodelación del tejido, lo que permite el restablecimiento de las características físicas, mecánicas y eléctricas que favorecen las condiciones normales del tejido. Para entender un poco más este proceso, a continuación se describen las 4 fases referidas:
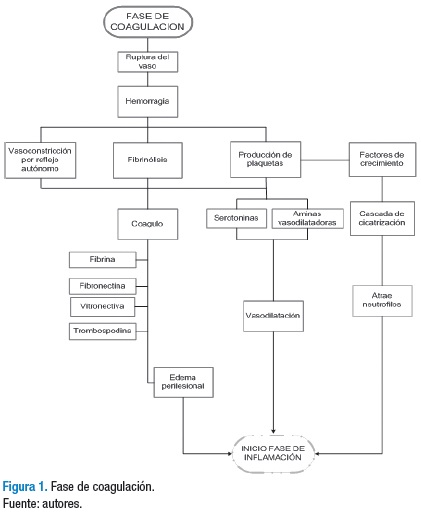
Fase de coagulación
Esta fase inicia inmediatamente después de presentarse la lesión y se altera la integridad del tejido; tiene una duración de hasta 15 minutos. Su objetivo principal es evitar la pérdida de fluido sanguíneo mediante el cese de la hemorragia y la formación del coágulo, protegiendo así el sistema vascular y la función de los órganos vitales. El coágulo formado tiene funciones específicas tanto de activación celular como de mediación y andamiaje para las células que promueven la fase de inflamación y regeneración del tejido (19) (Figura 1).
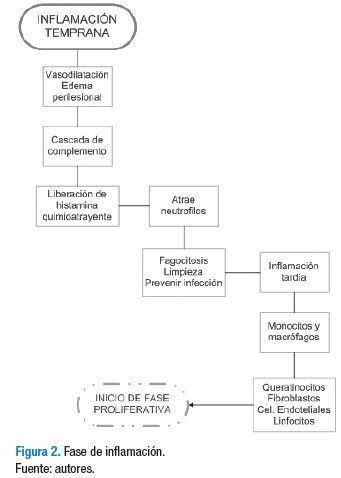
Fase de inflamación
Esta fase tiene su inicio hacia el minuto 16 y presenta una duración de hasta seis días; se presenta como respuesta protectora e intenta destruir o aislar aquellos agentes que representen peligro para el tejido, ya que sin dicha remoción de las células afectadas no se dará inicio a la formación de nuevo tejido mediante la activación de queratinocitos y fibroblastos (1,20) (Figura 2).
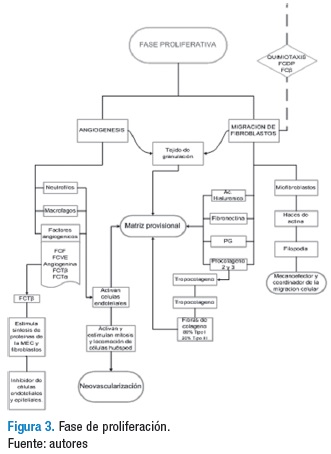
Fase de proliferación
Es la tercera etapa dentro del proceso de cicatrización, derivada del proceso de inflamación y precursora de la fase de maduración; se inicia hacia el tercer día y dura aproximadamente de 15 a 20 días. El objetivo de esta fase es generar una barrera protectora, con el fin de aumentar los procesos regenerativos y evitar el ingreso de agentes nocivos; se caracteriza por la activación de dos grandes procesos: angiogénesis y migración de fibroblastos, los cuales facilitan la formación de una matriz extracelular (MEC) provisional, que proporciona una andamiaje para la migración celular y la síntesis de una MEC madura (19,20) (Figura 3).
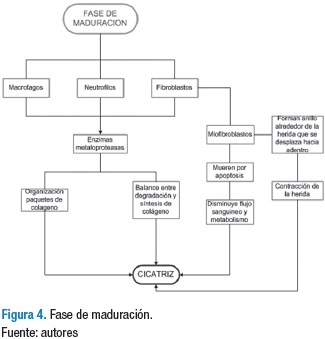
Fase de maduración
Esta fase se caracteriza por la formación, organización y resistencia que obtiene el tejido al formar la cicatriz, lo cual se obtiene de la contracción de la herida generada por los miofibroblastos y la organización de los paquetes de colágeno; esta inicia simultáneamente con la síntesis de la matriz extracelular en la fase de proliferación y puede durar entre uno y dos años, dependiendo la extensión y características de la lesión (21,22) (Figura 4).
Como se puede entender, cuando este proceso, normalmente articulado, se ve interrumpido por alguna causa interna o externa, se produce una falla en la cicatrización, lo cual genera un proceso de no cicatrización que caracteriza a las heridas crónicas como las UPP. Tal como se había mencionado, la piel constituye una batería eléctrica capaz de producir corrientes endógenas capaces de activar diferentes células en los procesos de una continua remodelación del tejido; a continuación se describen con mayor precisión.
Campos endógenos en tejidos biológicos
Los campos eléctricos endógenos (CEE) se encuentran de manera natural en los organismos vivos y son los encargados de controlar procesos de crecimiento y comportamientos celulares. Para comprender su función es importante saber que un campo eléctrico (CE) es un campo de fuerza creado por la atracción y repulsión de cargas eléctricas, en el cual genera una diferencia de potencial entre dos puntos (23,24).
A nivel celular se produce una señal bio-eléctrica generada por un potencial transmembrana (PTM), el cual permite a las células: a) transportar moléculas alrededor de la membrana, b) señalizar los eventos ocurridos en la superficie o fuera del medio y c) enviar señales a larga distancia. Este potencial está generado de forma activa, dependiendo de una bomba continua y un sistema de transporte de iones (como la bomba sodio-potasio o los canales de entrada de calcio), en el cual actúan diversos mecanismos de transferencia (25).
Las características eléctricas presentes en la piel están dadas principalmente por la epidermis, específicamente por la capa córnea, en la cual las uniones celulares generadas permiten que haya una comunicación continua entre ellas, representando una actividad que se considera eléctricamente positiva. La generación de señales y el transporte de estas se logra mediante el Potencial Transepitelial (PTE), el cual proviene de los gradientes de concentración de iones a través de las membranas que rodean las células (26,27).
El CEE que se produce en la piel, mediado por la actividad del PTE, muestra propiedades catódicas al exterior del tejido y anódicas a su interior, siendo consistente con los hallazgos de Foulds y Barker (28), los cuales demuestran la presencia de un CE generado entre la dermis y el estrato córneo, cuyo voltaje está alrededor de los 8 a 60 mV. Ante la presencia de una lesión se altera la integridad de este circuito, lo que hace necesaria una variación del comportamiento normal del circuito en busca de restablecer el contacto.
Proceso de no cicatrización
El proceso de cicatrización o curación de heridas está determinado por la continuidad de cada una de las fases que lo caracteriza (hemostasia, inflamación, proliferación y remodelación); cuando se presenta algún tipo de alteración que entorpezca su desarrollo en el tiempo preestablecido como normal, se genera una lesión crónica, la cual presenta un detenimiento o retraso en la fase de inflamación o en la fase proliferativa (29).
La respuesta humoral ante estas lesiones refleja exceso en la producción de metaloproteinasas, factores de crecimiento y citoquinas (30). Las metaloproteinasas son proteínas adhesivas necesarias para que se genere el proceso normal de curación de una herida y son importantes en el proceso de degradación de la MEC y la remodelación del tejido que está en proceso de cicatrización (31,32). Adicional a esta respuesta, un factor común es la presencia de microorganismos que colonizan las lesiones y retardan el proceso de cicatrización (30).
La remodelación de la matriz en las heridas crónicas no se genera de la misma forma que en una herida aguda. El aumento del proceso proteolítico produce una degradación incontrolada del tejido lo que conduce a una herida que no cicatriza. Esto se debe a que el fluido presente en la herida que no cicatriza contiene una alta concentración de metaloproteinasas, estas generan una disminución en la proliferación celular y en la angiogénesis, incrementando la degradación de la MEC y alterando la adecuada reparación tisular (33,34).
Los factores de crecimiento juegan un papel importante en el proceso de cicatrización de las heridas, sin importar su cronología, pues estimulan los procesos de división celular que tienen cualidades mitógenas; provocan la migración celular hacia el centro de la herida, gracias a su efecto quimiotáctico, el cual atrae las células inflamatorias y a los fibroblastos, estimulan la angiogénesis y la formación de nuevos vasos internos. Estos factores tienen una importante influencia en la deposición y degradación de la matriz extracelular y, adicionalmente, influyen en la síntesis de citoquinas (35).
Comportamiento bioeléctrico de la heridas
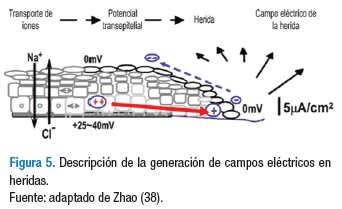
El flujo de iones en el medio intraepidérmico genera un PT en un rango entre 20 y 50 mV (28); ante la presencia de agresiones que afecten la integridad de la piel, se presentan cambios en la membrana celular que alteran el PTM y PTE, generándose un corto circuito. Dicho potencial genera en la lesión características eléctricas específicas y una menor resistencia en comparación con el tejido íntegro y da lugar a una salida de corriente de entre 1 y 10 μA/cm2 y una densidad de corriente estimada en 300 μA/cm2 cerca al borde de la herida (36,37). La herida se torna más negativa hacia el centro, lo que genera una corriente direccionada de forma lateral hacia este sitio (38) (Figura 5).
Las células de la herida se encargan de mantener el flujo de iones que permanecerá activo hasta el cierre de la lesión, gracias a la distribución homogénea de los canales de NA, K y Cl. Este CE en la herida es la primera señal que se genera y da inicio al proceso de cicatrización, activando la migración de los queratinocitos y de otro tipo de células por efecto galvanotáxico; el PTE varía durante el desarrollo de la herida entre 100-150 mV/mm y se ha propuesto como contribuyente en el control de su cicatrización (39,40).
El borde de la herida está caracterizado por un gradiente de voltaje mayor a 200 mV/mm y una corriente entre 1 y 1,5 mA/mm (por milímetro de circunferencia de la herida), la cual fluye a través del circuito creado, llegando a las capas subcorneales y evidenciando la ubicación de las células dentro de un campo eléctrico. Adicional a esto, el potencial dérmico permanece intacto en una distancia de 2 a 3 mm alrededor del borde de la herida facilitando así la migración celular desde el tejido periférico hasta encontrar el lado opuesto. El cambio de la conductividad de la herida a lo largo del proceso de cicatrización hace que, a medida que esta va sanando, el flujo de la corriente cese (38,39).
El restablecimiento del potencial eléctrico endógeno durante la cicatrización normal requiere de la interacción de muchos procesos biológicos; la interrupción de alguno de estos genera una lesión crónica que presenta unas características determinadas a nivel molecular como disminución de las citoquinas pro-inflamatorias y la presencia de metaloproteinasas (41), entre otros factores que inciden directamente en la prolongación de la fase inflamatoria, alterando el potencial eléctrico e inhibiendo la cicatrización, tal como ocurre en las UPP.
El principal factor etiológico que contribuye al desarrollo de las UPP es la presión, la cual se acompaña de otros factores predisponentes como la fricción, la fuerza de roce y la humedad (42,43). Al contrario de lo que se piensa, la lesión inicial no se origina en la piel: esta se desarrolla en las capas musculares profundas y progresa hacia la piel. La elevación de la presión cutánea produce hipoxia tisular, como resultado de la disminución del flujo capilar. Las fuerzas de presión conducen también al deterioro de la eliminación de los metabolitos tóxicos, como los radicales libres, a causa de la obstrucción de las vénulas. La lesión tisular inicial es seguida fisiológicamente por vasodilatación con la siguiente hiperemia, la que en ocasiones conduce de manera paradójica a un mayor daño tisular a través de la formación posterior de radicales libres (44-46).
Para el tratamiento de este tipo de lesiones se han utilizado distintas técnicas de manejo en las que se incluyen desbridamientos, apósitos, cierre quirúrgico mediante injertos o colgajos, uso de modalidades físicas como: láser, UV, ultrasonido y electro-estimulación, siendo esta última uno de los tratamientos más utilizados para favorecer procesos de curación (47-49), cuya función esencial es restablecer los campos endógenos alterados en los procesos de cicatrización retardados (50,51).
La electroterapia como modalidad terapéutica, especialmente la estimulación eléctrica, activa el comportamiento bio-eléctrico de la piel cuando se produce un estímulo eléctrico de tipo exógeno que le recuerda al tejido las características dieléctricas que se generan a nivel celular; por lo tanto, se estimula la producción, proliferación y migración de todos los agentes celulares intervinientes en cada una de las fases del proceso normal de cicatrización, esto con el fin de eliminar los residuos tóxicos de una cicatrización crónica y, a su vez, activar la cascada de cicatrización normal (50,51).
En resumen, se puede entender que la piel como tejido biológico presenta características de material dieléctrico, ante la presencia de una lesión: este mecanismo se altera, produciéndose un "corto circuito" que modifica el comportamiento normal del campo endógeno e interfiere con el proceso de cicatrización, el cual está caracterizado por ser un proceso continuo, mediado por diversos factores que favorecen el desarrollo de cada una de sus fases. Ante la presencia de lesiones crónicas como las UPP, este mecanismo se ve alterado, la actividad de factores como las metaloproteinasas y los factores de crecimiento se encuentran alterados, lo cual prolonga la fase de inflamación y proliferación celular, a su vez, impide la activación de la fase de maduración y de cierre de la herida (30-32,41), lo cual puede superarse con la aplicación de una corriente exógena que reactive los procesos normales celulares.
Conclusión
El proceso de cicatrización depende de múltiples factores tanto intrínsecos como extrínsecos, los cuales son fácilmente alterables, por lo cual es fundamental comprender a cabalidad el comportamiento de la piel ante una lesión y cuáles son los mecanismos que se alteran cuando se instaura una lesión crónica.
En presencia de lesiones crónicas, como las úlceras por presión, es necesario comprender su etiopatología para determinar los factores comprometidos en la lesión y así poder enfocar los diferentes esfuerzos terapéuticos de manera selectiva, acorde con los procesos alterados; esto se reflejará en la pronta resolución de este tipo de lesiones.
En el momento de manejar integralmente este tipo de lesiones, es importante recordar que se debe analizar el comportamiento bioeléctrico de la piel y sus características dieléctricas para hacer un mejor uso de estrategias como la electroterapia, en busca de activar la migración celular y, con esta, el proceso de cicatrización, mediante la generación de un estímulo eléctrico exógeno.
La comprensión a profundidad de estos procesos permite dimensionar la importancia del trabajo interdisciplinar y de la sincronía del mismo, lo cual genera estrategias costo efectivas en el tratamiento de lesiones en piel, especialmente en lesiones como las úlceras por presión.
Conflicto de interés
Los autores declaran no tener ningún tipo de conflicto de interés.
Financiación
El proyecto recibió financiación parcial de la DIB (Dirección de Investigación de la Universidad Nacional sede Bogotá).
Agradecimientos
Los autores desean agradecer a la DIB (Dirección de Investigación de la Universidad Nacional sede Bogotá), quienes financiaron parcialmente el proyecto a través de la convocatoria "Semilleros de creación e investigación", en la modalidad de "Apoyo a trabajos de investigación o creación en el país", código 14996.
Referencias
1. Aum C, Rpey CJ. Normal Cutaneous Wound Healing: Clinical Correlation with Cellular and Molecular Events. Dermatol Surg. 2005;31:674-86. [ Links ]
2. Robert L, Labat-Robert J, Robert A. Physiology of skin aging. Clin Plast Surg. 2012;39(1):1-8. [ Links ]
3. Falanga V. The chronic wound: impaired healing and solutions in the context of wound bed preparation. Blood Cells Mol Dis. 2004;32:88-94. [ Links ]
4. Chamorro J, Cerón E, Fernández F. Úlceras por presión. Nutrición Clínica en Medicina. 2008;2:65-84. [ Links ]
5. Assimacopoulos D. Wound healing promotion by the use of negative electric current. Am Surg. 1968;34(6):423-31. [ Links ]
6. Leyva Pereira L. Anatomía patológica de las heridas y tratamiento de ellas. rev.fac.med. 1940;9(5):274-82. [ Links ]
7. Graumlich J, Blough L, McLaughlin R et al. Healing pressure ulcers with collagen or hydrocolloid: a randomized, controlled trial. J Am Geriatr Soc. 2003;51(2):147-54. [ Links ]
8. Ayello E, Cuddigan J. Debridement: controlling the necrotic/cellular burden. Adv Skin Wound Care. 2004;17(2):66-75. [ Links ]
9. Palmier S, Trial C. Use of high-pressure waterjets in wound debridement. Surgery in wounds. 2004:72-6. [ Links ]
10. Basford J. Low intensity laser therapy: still not an established clinical tool. Lasers Surg Med. 1995;16:331-42. [ Links ]
11. Dyson M. Non-thermal cellular effects of ultrasound. Br J Cancer. 1982;45:165-71. [ Links ]
12. Weiss D, Kirsner R, Eaglstein W. Electrical stimulation and wound healing. Arch Dermatol. 1990;126:222-5. [ Links ]
13. Reger S, Hyodo A, Negami S, Kambic H et al. Experimental Wound healing with electrical stimulation. Artif Organs. 1999; 23(5):460-2. [ Links ]
14. Godbout C, Frenette J. Periodic direct current does not promote wound closure in an in vitro dynamic model of cell migration. Phys Ther. 2006;86:50-59. [ Links ]
15. Feedar J, Kloth L, Gentzkow G. Chronic dermal ulcer healing enhanced with monophasic pulsed electrical stimulation. Phys Ther. 1991;71:639-49. [ Links ]
16. Houghton P, Campbell K, Fraser C et al. Electrical Stimulation Therapy Increases Rate of Healing of Pressure Ulcers in Community-Dwelling People With Spinal Cord Injury. Arch Phys Med Rehabil. 2010;91:669-78. [ Links ]
17. Shaw T, Martin J. Wound repair at a glance. J Cell Sci. 2009;122:3209-13. [ Links ]
18. Watson T. Electroterapia: práctica basada en la evidencia. 12 Ed. Barcelona: Elsevier; 2009. [ Links ]
19. Velnar T, Baley T, Smrkolj V. The wound healing process: an overview of the cellular and molecular mechanisms. J Int Med Res. 2009;37:1528-42. [ Links ]
20. Williamson D, Harding K. Wound healing. Medicine. 2004;32:12:4-7. [ Links ]
21. Witte MB, Barbul A. General principles of wound healing. Surg Clin North Am. 1997;77:509-28. [ Links ]
22. Lawrence W. Physiology of the acute wound. Clin Plast Surg. 1998;25:321-40. [ Links ]
23. Messerli M. Extracellular electrical fields direct wound healing and regeneration. Biol Bull. 2011;221:79-92. [ Links ]
24. Acevedo M, Cruz J, Pinedo C. Los campos bioeléctricos y algunas aplicaciones médicas. Revista Ingeniería Biomédica. 2011;5(9):50-9. [ Links ]
25. Berral F. Impedancia bioeléctrica y su aplicación en el ámbito hospitalario. Rev Hosp Jua Mex. 2007;74(2):104-12. [ Links ]
26. Nuccitelli R. A role for endogenous electric fields. Curr Top Dev Biol. 2003;58:1-26. [ Links ]
27. Offner F. Bioelectric potentials - Their source, recording and significance. IEEE Trans Biomed Eng. 1984;31(12):863-8. [ Links ]
28. Foulds I, Barker A. Human skin battery potentials and their possible role in wound healing. Br J Dermatol. 1983;109:515-22. [ Links ]
29. Jaul E. Non-healing wounds: The geriatric approach. Arch Gerontol Geriatr. 2009;49(2):224-6. [ Links ]
30. Bjarnsholt T, Kirketerp-Møller K, Jensen PØ et al. Why chronic wounds will not heal: a novel hypothesis. Wound Repair Regen 2008;16(1):2-10. [ Links ]
31. Matrisian L. The matrix-degrading metalloproteinases. Bioessays. 1992;209-22. [ Links ]
32. Wysocki A. Wound fluids and the pathogenesis of chronic wounds. J Wound Ostomy Continence Nurs. 1996;23(6):283-90. [ Links ]
33. Lobmann R, Ambrosch A, Schultz G et al. Expression of matrix-metalloproteinases and their inhibitors in the wounds of diabetic and non-diabetic patients. Diabetología. 2002;45:1011-6. [ Links ]
34. Trengove N, Stacey M, MacAuley S et al. Analysis of the acute and chronic wound environments: the role of proteases and their inhibitors. Wound Repair Regen. 1999;7:442-52. [ Links ]
35. Greenhalgh D. The Role of Growth Factors in Wound Healing. J Trauma. 1996;41(1):159-67. [ Links ]
36. Barker A, Jaffe L, Vanable J. The glabrous epidermis of cavies contains a powerful battery. Am J Physiol. 1982;242:358-66. [ Links ]
37. Zhao M, Song B, Wada B et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase- and PTEN. Nature. 2006;442:457-60. [ Links ]
38. Zhao M. Electrical fields in wound healing- An overriding signal that directs cell migration. Semin Cell Dev Biol. 2009;20(6):674-82. [ Links ]
39. Nuccitelli R, Nuccitelli P, Ramlatchan S et al. Imaging the electric field associated with mouse and human skin wounds. Wound Repair Regen. 2008;16(3):432-41. [ Links ]
40. Ojingwa J, Rickah R. Electrical Stimulation of Wound Healing. J Invest Dermatol. 2002;36:1-12. [ Links ]
41. Trengove N, Stacey M, MacAuley S et al. Analysis of acute and chronic wound environments: the role of proteases and their inhibitors. Wound Repair Regen. 1999;7(6):442-52. [ Links ]
42. Regan M, Teasell R, Wolfe D et al. A systematic review of therapeutic interventions for pressure ulcers after spinal cord injury. Arch Phys Med Rehabil. 2009;90:213-31. [ Links ]
43. Enoch S, Leaper DJ. Basic science of wound healing. Surgery. 2007;26:(2):31-7. [ Links ]
44. Wassermann E, van Griensven M, Gstaltner K et al. A chronic pressure ulcer model in the nude mouse. Wound Repair Regen. 2009;17(4):480-4. [ Links ]
45. Mustoe T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. Am J Surg. 2004;187:65S-70S. [ Links ]
46. Argolis DM, Naus JK, Bilker W et al. Medical conditions as risk factors for pressure ulcers in an outpatient setting. Age Ageing. 2003;32:259-64. [ Links ]
47. Falanga V. Chronic wounds: pathophysiologic and experimental considerations. J Invest Dermatol. 1993;100:721-5. [ Links ]
48. Niitsuma J, Yano H, Togawa T. Experimental study of decubitus ulcer formation in the rabbit ear lobe. J Rehabil Res Dev. 2003;40:67-73. [ Links ]
49. Peirce S, Skalak T, Rodeheaver G. Ischemia-reperfusion injury in chronic pressure ulcer formation: A skin model in the rat. Wound Repair Regen. 2000;8(1):68-76. [ Links ]
50. Gardner SE, Frantz RA, Bradley ND. The validity of the clinical signs and symptoms used to identify localized chronic wound infection. Wound Repair Regen. 2001;9:178-86. [ Links ]
51. Nicola L. Los fundamentos biofísicos de la actividad eléctrica celular en aritmias cardiacas. 2da ed. Bogotá: Panamericana; 2003. [ Links ]