Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488On-line version ISSN 2665-4385
Rev. Colomb. Entomol. vol.32 no.2 Bogotá July/Dec. 2006
Estructura de las comunidades de Orthoptera (Insecta) de un gradiente altitudinal de un bosque andino
Structure of the Orthoptera communities (Insecta) in an altitudinal gradient of an Andean cloud forest
Andrés Sandoval Mojica1, Giovanny Fagua2
1Laboratorio de Entomología. Pontificia Universidad Javeriana. Biólogo, email:artropodo_sandoval@hotmail.com
2Autor para correspondencia. Profesor Asistente. M.Sc., Pontificia Universidad Javeriana. Carrera 7 # 43-82, Edificio 53. Laboratorio 106b. Email:fagua@javeriana.edu.co
Resumen. Se estudio la variación de la composición, abundancia, riqueza, diversidad y dominancia de las comunidades de ortópteros de un gradiente altitudinal entre los 2000 y 3000 m, en un bosque andino del Santuario de Flora y Fauna Guanentá - Alto Río Fonce (Santander, Colombia), entre enero y octubre de 2004. A lo largo del gradiente se ubicaron cinco estaciones de muestreo, una cada 250 m en altitud (a los 2000 m, 2250 m, 2500 m, 2750 m y 3000 m). En cada estación se delimitaron cuatro cuadrantes de 50 m x 5 m, donde se realizó captura manual diurna. El muestreo general obtuvo un elevado porcentaje de eficacia (98.8 % ACE; 82.2 % Jackknife 1). Los análisis de correspondencia destendido y similitud definieron dos comunidades: la integrada por los ortópteros de las estaciones 2000 - 2250 m y la de los 2750 - 3000 m, evento relacionado posiblemente con las diferencias en la estructura y composición de la vegetación a lo largo del gradiente. La riqueza y la diversidad declinaron directamente con el aumento de la altitud, lo que se relacionó con la reducción de la diversidad y disponibilidad de recursos vegetales en altitudes superiores. La dominancia aumentó con la altitud por el mayor aporte en abundancia de especies generalistas, probablemente de mayor tolerancia a condiciones adversas. La abundancia de ortópteros no presentó una asociación evidente con el nivel altitudinal. Se presentan regresiones lineales para obtener valores de riqueza, diversidad y dominancia de ortópteros.
Palabras Clave: Ecología de comunidades. Riqueza de Insectos. Altitud. Bosque tropical montano.
Summary. The variation in abundance, richness, diversity, dominance and composition of the Orthoptera communities was studied along an altitudinal gradient, between 2000 and 3000 m, in an Andean forest at “Santuario de Flora y Fauna Guanentá - Alto Río Fonce” (Santander, Colombia), from January to October of 2004. Surveys were conducted at five places every 250 m in altitude (located at 2000 m, 2250 m, 2500 m, 2750 m and 3000 m). The methods by study area included four quadrants (50 m x 5m each) for manual sampling. The general sampling was efficient (98.8 % ACE - 82.2 % Jackknife 1). The correspondence analysis and the similarity coefficients defined two different groups of communities (2000 m – 2250 m and 2750 m - 3000 m) due possible to the structural differences across the vegetation on altitudinal gradient. Species richness, as well as diversity, decreased gradually with increasing altitude, due to the reduced plant resource at high elevations. There was a positive correlation between altitude and dominance of Orthoptera species by the high proportion of the generalist species, probably by the best tolerance to adverse conditions. Not evident association between elevation and species abundance was observed. Regression models by Orthoptera richness, diversity and dominance are showed.
Key Words: Community ecology. Insect richness. Altitude. Tropical mountain forest.
Introducción
Estudiar la distribución de plantas y animales a lo largo de gradientes ambientales puede evidenciar los factores que gobiernan y mantienen la diversidad de especies en el planeta (Sanders 2002). Dentro de la variación altitudinal de la fauna, la relación existente entre la riqueza de especies y la elevación es un patrón ecológico frecuentemente documentado pero polémico, debido a que generalizaciones o explicaciones universales del fenómeno no han podido ser desarrolladas. Esto se debe a que el comportamiento de la curva de riqueza de especies es muy variado, ya que puede diferir entre taxones idénticos o disímiles y cambiar local o regionalmente (Rahbek 1995).
Existen dos patrones generales de la asociación entre la altitud y la riqueza de especies (Rahbek 1995, Lomolino 2001): una disminución de la riqueza con el aumento de la elevación (Alexander y Hillard 1969, Claridge y Singhrao 1978, Hebert 1980, Lawton et al. 1987, Wolda 1987, McCoy 1990, Lobo 1992, Fisher 1996, Davis et al. 1999, IAvH 1999, Lobo y Halffter 2000, Brehm et al. 2003, Brehm y Fiedler 2003, 2004) o una relación en forma de joroba, en donde los valores máximos de riqueza se observan en las altitudes medias (Janzen 1973, Janzen et al. 1976, Morón y Terrón 1984, McCoy 1990, Olson 1994, Rahbek 1995, Gutiérrez y Menéndez 1995, Fleishman et al. 1998, Fagua 1999, IAvH 1999, Rincón 1999, Blanche y Ludwig 2001, Donovan et al. 2002, Sanders 2002, Pyrcz y Wojtusiak 2002, Braun 2002, Escobar et al. 2005.).
Por lo menos cuatro razones han sido sugeridas para explicar el decline directo de la riqueza de especies con el aumento de la altitud (Lawton et al. 1987): disminución del área de los hábitats con la altitud; reducción de la diversidad de recursos; aumento de ambientes hostiles y extremos con la altitud; y reducción de la productividad primaria en altitudes elevadas. Por otro lado, se han propuesto diferentes mecanismos para explicar la cresta de la riqueza de especies en altitudes medias. McCoy (1990), con base en varios estudios, ha planteado dos procesos: el primero, “los finales son malos”, enfatiza la restricción ambiental sobre la distribución de las poblaciones de insectos. Los límites superiores de la distribución de las especies están establecidos principalmente por la severidad climática y la restricción de recursos, mientras que los límites inferiores están determinados esencialmente por la veleidad del clima y la depredación (Randall 1982, Gutiérrez y Menéndez 1995, Fleishman et al. 1998). El segundo proceso, “la mitad es buena”, recalca el incremento de los recursos disponibles en altitudes intermedias. Se asume que las tasas fotosintéticas y respiratorias de las plantas son mayores en altitudes bajas y menores en altitudes elevadas; como resultado, la acumulación neta de compuestos fotosintéticos es superior en altitudes medias. El aumento de la productividad primaria neta en estos niveles altitudinales intermedios se debe a que las plantas emplean menos fotosintato diario en la respiración nocturna, debido a que la temperatura del periodo nocturno no es tan alta como en las tierras bajas ni tan baja como en las cumbres montañosas. El fotosintato extra de las plantas provee a los insectos herbívoros de un recurso base mayor, lo que incrementa sus densidades poblacionales y la de los insectos omnívoros y carnívoros de los que son recurso (Janzen 1976, Janzen et al. 1973).
Rahbek (1995) presentó una revisión de literatura crítica sobre los patrones de la riqueza de especies en relación con la altitud, demostrando que la mayoría de estudios detectan los máximos valores de riqueza en altitudes medias. Discute también la influencia del régimen de muestreo y del efecto del área, factores que influyen drásticamente en la relación altitud – riqueza. En Colombia se han realizado pocos trabajos sobre variación altitudinal de la fauna de artrópodos, centrándose la mayoría en escarabajos coprófagos (Coleoptera: Scarabaeidae), mariposas (Lepidoptera: Papilionoidea, Hesperioidea) y hormigas (Hymenoptera: Formicidae). Escobar y Valderrama (1995) realizaron una comparación de la distribución altitudinal de coleópteros coprófagos, arañas orbiculares y hormigas en el costado Oeste de la Cordillera Occidental, encontrando un patrón de riqueza y abundancia diferente para cada taxón: declinación en coleópteros coprófagos con la altitud, mayor riqueza en elevaciones intermedias en arañas y ninguna asociación para hormigas. Amat y Reyes-Castillo (1996) definen dos grupos altitudinales que componen la fauna pasálida (Coleoptera: Passalidae) del país: las especies de Tierras Bajas (0 – 1000 m) y las de Tierras Altas (1000 – 2800 m). Estos mismos autores encuentran comportamientos opuestos para la relación de riqueza de pasálidos con la altitud: declinación en Girardot–Soche, e incremento en Honda-Aguadas (Amat y Reyes-Castillo 1999), aunque un análisis de su tabla de distribución de especies de la Cordillera Oriental revela una curva con incremento de la riqueza a altitudes intermedias. Fagua (1999) en un gradiente en la Cordillera Oriental, encontró una correlación inversa entre la altitud, la riqueza (con una cresta en las altitudes medias para mariposas) y la diversidad, así como una correlación positiva entre la altitud y la dominancia de especies. El patrón de mayor riqueza intermedia es registrado también por Escobar y Fagua para escarabajos coprófagos y mariposas, respectivamente, en varios gradientes andinos, dentro del trabajo general de caracterización de la biota del flanco oriental de la Cordillera Oriental (IAvH 1999). Así mismo, Rincón (1999), para tricópteros, y Barriga Bernal (2000), para arañas orbiculares, observaron mayor diversidad y abundancia en altitudes intermedias. Arias y Huertas (2001) mencionan, aunque no presentan, una declinación de la riqueza de especies de mariposas con la altitud. Prieto (2003) presenta un trabajo en mariposas satírinas. Escobar et al. (2005), en seis transectos del flanco oriental de la Cordillera Oriental, ratifican el modelo de incremento de la riqueza de escarabajos coprófagos a alturas intermedias.
Pese a los trabajos mencionados, es insuficiente la información en la distribución altitudinal de los organismos, en especial en insectos (Sanders 2002); lo que demanda su obtención para revelar si existe un patrón general o no, o por qué éste varía. Es necesario un entendimiento profundo de la distribución altitudinal de estos artrópodos para evaluar la efectividad de las estrategias de conservación de los sistemas montañosos tropicales, ya que estos organismos representan la mayoría de especies en los bosques tropicales y típicamente exponen, junto con las plantas, la diversidad beta más alta (Olson 1994).
Por lo tanto, el presente estudio describe la variación en la riqueza, diversidad y composición de la comunidad de ortópteros a lo largo de un gradiente altitudinal, comprendido entre los 2000 m y los 3000 m, en un bosque andino del municipio de Encino (Santander, Colombia), en predios del Santuario de Fauna y Flora Guanentá - Alto Río Fonce. El estudio empleó puntos de muestreo detallados a diferentes altitudes, en donde se evaluaron las propiedades emergentes de la comunidad de ortópteros; utilizados por ser uno de los tres taxones más importantes en el aporte de biomasa de artrópodos en ecosistemas arbóreos (Greenberg & Forrest 2003). Además, los ortópteros son de gran importancia en la dinámica de las redes tróficas de los biomas tropicales por constituir una fuente primaria de proteína animal para primates, roedores, murciélagos, aves, reptiles, y anfibios entre los vertebrados, y arañas, avispas, hormigas, mantis y otros insectos (Nickle 199a, 1992b).
Materiales y Metodología
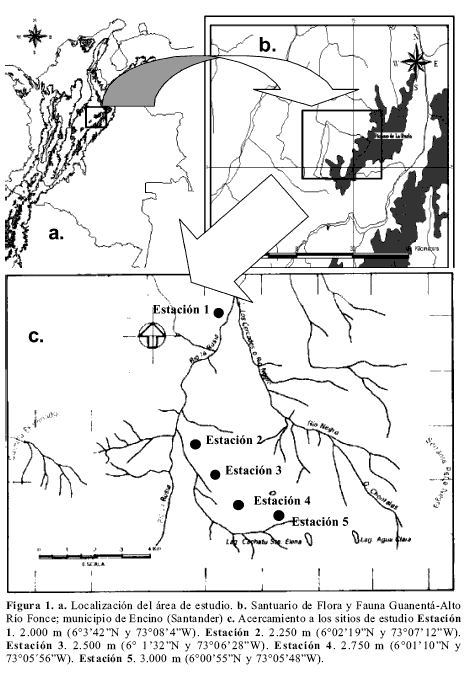
Área de estudio. La investigación se realizó en el costado occidental de la Cordillera Oriental, en predios del Santuario de Fauna y Flora Guanentá - Alto Río Fonce, correspondientes a la vereda Río Negro, municipio de Encino, Santander (Fig. 1). El clima del área se encuentra en la transición entre el tropical húmedo tipo isotérmico hacia el isomicrotérmico (según la clasificación de Koeppen), con temperaturas promedio de 21 ºC. El régimen de lluvias es de tipo bimodal, con valores máximos entre abril – mayo y octubre – noviembre y una precipitación anual promedio de 1.950 mm (UAESPNN 1998). El relieve se caracteriza por ser quebrado y escarPado, debido a la estructura de anticlinales, con plegamientos y fallas que han sido labrados en profundos valles fluvioglaciales (UAESPNN 1998). El santuario conserva el reducto forestal más grande y de mayor representatividad altitudinal de los bosques de la vertiente occidental del área del alto río Fonce; se pueden diferenciar como formaciones vegetales dominantes los bosques húmedos montanos (submontanos a montano alto) y páramo. En el bosque sobresalen las asociaciones de roble (Quercus humboldtii), especie registrada como dominante, seguida por especies de los géneros Clusia y Miconia, así como algunos representantes de las familias Lauraceae y Araliaceae (UAESPNN 1998). Del Pino et al. (2006) y Rios (2006) presentan un detallado análisis de la vegetación del área de estudio.
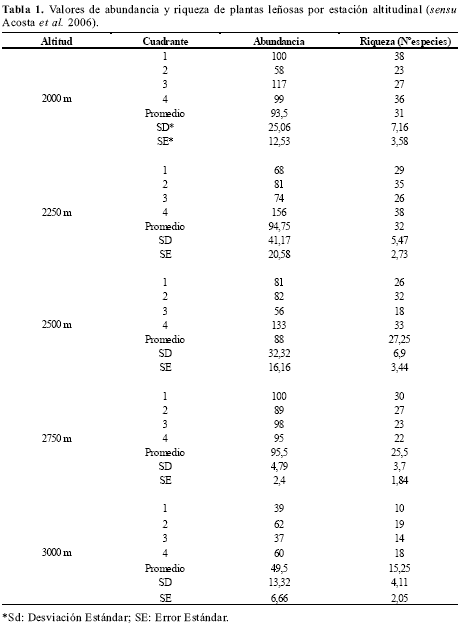
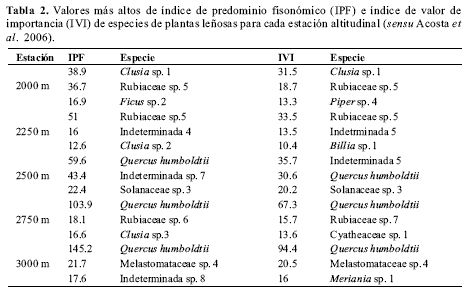
De acuerdo con Acosta et al. (2006), en los sitios específicos de trabajo se observaron, a lo largo del gradiente, 212 especies vegetales, siendo las familias más ricas Melastomataceae, Rubiaceae, Araliaceae, Lauraceae, Arecaceae, Clusiaceae y Euphorbiaceae. La abundancia y riqueza presentaron una disminución con la altitud (Tabla 1). Entre los 2000 y los 2500 m no se compartieron las especies con índice de valor de importancia (IVI) e índice de predominio fisonómico (IPF) más altos (Tabla 2): para los 2000 m los valores respectivos más elevados fueron para Clusia sp. 1; a los 2250 m los alcanzó Rubiaceae sp. 5. A partir de los 2500 m Quercus humboldtii, en general, fue dominante tanto para IVI como para IPF (Tabla 2). Los valores de IVI e IPF presentaron un aumento con la altitud, compartiendo la misma especie los más altos valores en varios casos.
Fase de campo
Se realizaron tres muestreos; el primer muestreo se llevó a cabo entre enero y mayo de 2004, comprendiendo periodo seco y periodo lluvioso, mientras que el segundo y tercer muestreo correspondieron, respectivamente, a periodo seco (junio – julio 2004) y lluvioso (septiembre – octubre 2004).
Los sitios de muestreo fueron seleccionados dentro de los bosques primarios pertenecientes a las cuencas de los ríos La Rusia y Cercados (Fig. 1), empleando para su ubicación geográfica (coordenadas y altitud) altímetro y sistema de posicionamiento global (GPS). Sobre el gradiente se ubicaron cinco estaciones de muestreo separadas entre si por 250 m en altitud, iniciando desde la cota altitudinal más baja que presentó el área de estudio, para el caso los 2000 m, hasta obtener un gradiente de 1000 m (estaciones a los: 2000 m, 2250 m, 2500 m, 2750 m y 3000 m; Fig. 1).
En cada altitud o estación se delimitaron cuatro cuadrantes de 50 m x 5 m, separados entre si por una distancia igual o superior a los 25 m. En los cuadrantes se realizó captura manual diurna de todos los insectos pertenecientes al orden Orthoptera; el muestreo se hizo sistemáticamente recorriendo los cuadrantes en un zigzag irregular, removiendo exhaustivamente la hojarasca presente, revisando el fuste y el follaje (haz y envés de las hojas) de árboles y arbustos, inspeccionando detenidamente las epífitas, líquenes y briofitos, escudriñando entre troncos caídos y levantando rocas. Todos los cuadrantes fueron recorridos dos veces en direcciones contrarias (cinco horas por recorrido) en cada uno de los muestreos efectuados; para un total de 120 horas de esfuerzo de muestreo por estación (40 horas por estación por salida) y 600 h de muestreo efectivo para el estudio. También se instalaron 20 trampas tipo pitfall por estación que permanecieron activas por 48 horas (dos días con sus noches). No obstante, dada su comparativamente muy baja eficiencia de colecta y representatividad, no fueron contempladas en el presente análisis.
Fase de laboratorio
Los ortópteros recolectados se conservaron en alcohol al 70%, debidamente rotulados. Para la identificación de los ortópteros se utilizaron: las claves e ilustraciones de Rentz (1996) para la determinación de familias y subfamilias de Ensifera y Caelifera; las claves e ilustraciones de Nickle (1992a, 1992b) para la identificación de subfamilias y géneros de Ensifera únicamente; y el catálogo ilustrado de Naskrecky & Otte (1999) para corroborar los géneros obtenidos de la familia Tettigoniidae. Tambien se consultaron los estudios de Hebard (1927, 1933) realizados en Colombia.
Aunque estas fuentes permitieron identificar familias, subfamilias y géneros, debido a la ausencia de claves taxonómicas a especie se optó por establecer morfoespecies, es decir, un patrón morfológico definido, constante, independiente del tamaño, y distinguible de los otros patrones morfológicos. El nivel de desarrollo que se empleó para la determinación de ortópteros fue principalmente de adultos pero se tuvieron en cuenta también ninfas cuyas características morfológicas permitieran asociarlas con ejemplares adultos. El material está depositado en la Colección Entomológica del Museo Javeriano de Historia Natural (MPUJ).
Análisis de datos
Con la información recolectada, se elaboraron matrices con el número de ejemplares obtenidos de cada morfoespecie en las cinco estaciones, para cada muestreo. Para los tres muestreos independientes y el muestreo total se obtuvo la riqueza de morfoespecies observada y estimada para cada altitud mediante los estimadores Chao 1, Jackknife 1, ACE, MMMean y Coleman, junto con sus respectivas curvas de acumulación mediante el programa EstimateS versión 6.0b1 (Colwell 1994 - 2000). La diversidad fue descrita a través del índice de heterogenidad de Shannon y el índice de dominancia de Simpson (Magurran 1989). La diversidad ß de las estaciones de muestreo y su composición se comparó mediante análisis de similitud, empleando el coeficiente de Jaccard y el método de ligamiento por la media aritmética no ponderada (UPGMA), mediante el programa PAST-PALaeontologial STatistics (Ryan et al. 1995). Se realizó también un análisis de correspondencia “destendido” (DCA) para observar la ordenación entre las estaciones, en los tres muestreos efectuados y el grado de asociación con las especies presentes en cada altitud, por medio del programa PCORDWIN (McCune y Mefford 1997).
Los datos de abundancia, riqueza, diversidad o dominancia por cuadrante, para cada estación altitudinal, en el muestreo total y en los tres muestreos independientes, fueron comparados mediante análisis de varianza de una vía (ANOVA) o pruebas no paramétricas de Kruskal-Wallis, dependiendo de lo obtenido en las pruebas de normalidad de Shapiro-Wilk y homogeneidad de varianzas. Pruebas paramétricas a posteriori LSD fueron aplicadas para identificar cuales eran las estaciones significativamente disímiles entre sí, de acuerdo con la variable observada. El grado de asociación entre el nivel altitudinal y las variables evaluadas, tanto para el muestreo total como para los tres muestreos independientes se estableció por medio del coeficiente de correlación Pearson (rP) o el coeficiente de correlación de Spearman (rS). Para aquellas variables que presentaron correlaciones significativas, se realizaron regresiones lineales para establecer una relación de dependencia funcional entre las variables estudiadas; es decir, un cambio estimable en las variables estudiadas según la variación en la altitud. Todas las pruebas estadísticas fueron realizadas mediante el programa STATISTICA versión 6.0 (StatSoft, Inc. 2001).
Resultados
Riqueza, eficiencia del muestreo y composición. Se capturaron en total de 4.128 ortópteros, identificándose 56 morfoespecies contenidas en 16 subfamilias, siete familias, siete superfamilias y dos subórdenes (anex 1). Las morfoespecies Eugryllina sp. 1 y Eugryllina sp. 2 (Gryllidae, Phalangopsinae) fueron los taxones más abundantes en las cinco altitudes y en los tres muestreos; junto con Acla sp. 2, fueron también las únicas presentes a lo largo de todo el gradiente (Table 3). Los valores de abundancia por especie y por altitud revelaron un continuo decrecimiento para la gran mayoría de los taxones; unos cuantos fueron más abundantes a altitudes intermedias y solamente seis fueron exclusivas de las dos últimas estaciones, a las que se adicionaron las tres únicas especies comunes a todo el gradiente (Table 3).
Los estimadores y las curvas de acumulación de especies indicaron un elevado porcentaje de eficacia del muestreo general a lo largo de todo el gradiente altitudinal fig2a, comprendiendo las capturas entre el 98.8 % (según el estimador ACE) y el 82.2 % (Jackknife 1) de las morfoespecies esperadas. Se observó una coincidencia entre el número de las morfoespecies que son representadas en la muestra por solo un individuo (singletons) y las morfoespecies representadas exactamente por dos individuos (doubletons; fig2a), lo que es considerado indicador de muestreo con eficiencia “óptima”, es decir, que contempla la gran mayoría de las especies que tiene el ecosistema para el muestreo efectuado (Mao y Colwell 2005). De igual forma, los estimadores y las curvas de acumulación de especies indicaron un muestreo eficiente para cada estación en altitud, aunque con el efecto local del aporte de las especies raras (sensu Mao y Colwell 2005), que no permite el obtener un óptimo: 2000 m obtuvo entre el 93.8 % (MMMean) y el 76.1 % (ACE) de lo esperado (fig2b); 2250 m entre un 87 % (MMMean) y un 74.1 % (Jackknife 1; fig2c); 2500 m entre un 91 % (Chao 1) y un 80.7 % (Jackknife 1; fig2d); 2750 m entre un 88.5 % (MMMean) y un 58.7 % (Chao 1; fig2e); 3000 m entre un 93.4 % (MMMean) y un 62.3 % (ACE) de las morfoespecies esperadas (fig2f). Lo anterior permite suponer que el muestreo general y por estación constituyó una muestra representativa de las comunidades estudiadas.
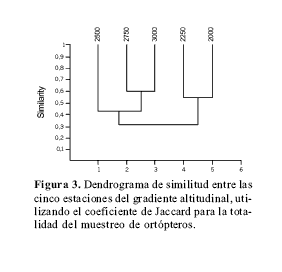
Al evaluar la similitud entre las muestras de las cinco altitudes en la totalidad del muestreo (Jaccard cualitativo; Fig. 3) fue posible distinguir dos grupos: las estaciones de 2750 m y 3000 m, que se asociaron en un 60 %, y las altitudes de 2000 m y 2250 m, que se agruparon con un porcentaje de semejanza del 54.76 %; la tercera estación (2500 m) se relacionó más al grupo 2750 m - 3000 m con un porcentaje de similitud del 43 % (Fig. 3). Si bien la similitud fue baja, la aun más baja relación entre los dos grupos extremos de estaciones permite suponer, de acuerdo con su composición, que se trata de dos comunidades diferentes.
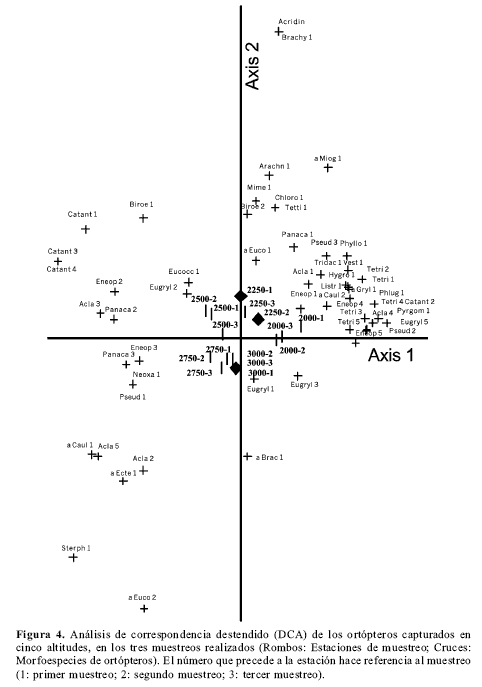
El análisis de correspondencia destendido (DCA), empleando todas las morfoespecies de los tres muestreos (Fig. 4), ordenó los datos en dos ejes principales los cuales presentaron valores eigen de 0.250 y 0.112 respectivamente; estos valores expresaron un reducido grado de asociación entre las morfoespecies de ortópteros y las tres muestras obtenidas en cada una de las cinco altitudes. Sin embargo, se observó un agrupamiento por parte de las muestras pertenecientes a la misma elevación y una organización de las altitudes en forma secuencial de derecha a izquierda (2000-2250-2500-2750-3000 m; Fig. 4); fue posible apreciar también una gran semejanza entre los tres muestreos en las dos últimas estaciones del gradiente altitudinal (2750 m y 3000 m). Por otra parte, los dos ejes presentaron una baja diversidad beta total (longitud del gradiente del eje 1 = 1.458, longitud del gradiente del eje 2 = 1.202), es decir que los extremos opuestos en los ejes expusieron especies comunes. Aunque la fuerza de la relación entre las altitudes y las morfoespecies fue baja, se observó que estas últimas se ubicaron cerca de las elevaciones en las cuales fueron capturadas, o por lo menos en el mismo cuadrante, lo que permite diferenciar ortópteros de altitudes bajas (2000 m y 2250 m), intermedias (2500 m) y elevadas (2750 m y 3000 m).
Para confirmar esta organización se realizó otro análisis de correspondencia destendido (fig.5) eliminando las dos morfoespecies más abundantes (Eugryllina sp. 1 y Eugryllina sp. 2). De igual forma se apreció un agrupamiento por parte de las muestras de cada altitud y un ordenamiento de las altitudes en forma secuencial, pero el grado de asociación entre las morfoespecies de ortópteros y las cinco altitudes fue elevado para el primer eje (eigenvalue = 0.720); lo anterior corrobora la diferenciación de ortópteros de altitudes elevadas (3000 y 2750 m), medias (2500 m) y bajas (2250 y 2000 m). La diversidad beta total para el primer eje aumentó también (longitud del gradiente del eje 1 = 3.801), al eliminar las dos morfoespecies más abundantes, las cuales estuvieron presentes en todas las estaciones.
Relación entre las variables de la comunidad de ortópteros y altitudLa abundancia total de morfoespecies presentó una correlación positiva con el nivel altitudinal en el primer muestreo (rP= 0.78, p< 0.01, N= 20), una correlación negativa en el segundo (rP= -0.46, p= 0.04, N= 20) y ninguna en el tercero (rP= -0.078, p= 0.743, N= 20). Tampoco presentó relación alguna en el muestreo general (rP= 0.032, p= 0.808, N= 60; fig.6a,b). Por el contrario, la riqueza de ortópteros exhibió una asociación negativa con la altitud en el segundo (rP= -0.906, p< 0.01, N= 20) y tercer muestreo (rP= -0.845, p< 0.01, N= 20), así como en el muestreo total (rS= -0.78, p< 0.01, N= 60; fig.6b), presentándose los mayores valores de riqueza en la altitud más baja del gradiente (2000 m; fig.6c,d). No se encontraron diferencias significativas en la riqueza de las cinco estaciones para el primer muestreo (Kruskal-Wallis= 8.09, p= 0.88, N= 20), pero si una correlación negativa con la altitud (rS= -0.61, p< 0.01, N= 20).
Igualmente, la diversidad (Shannon) disminuyó con el incremento de la altitud (fig.6e,f) en cada uno de los tres muestreos (primero: rP= -0.87, p< 0.01, N= 20; segundo: rP= -0.822, p< 0.01, N= 20; tercero: rP= -0.815, p< 0.01, N= 20) y en el muestreo general (rP= -0.831, p< 0.01, N= 60; fig.6f). Pese a un aparente comportamiento inverso en cuanto a la diversidad de las dos primeras estaciones (fig.6e), las pruebas a posteriori LSD no revelaron diferencias significativas entre la primera y la segunda estación (primer muestreo: p= 0.845; segundo muestreo: p= 0.802), lo que esclareció la propensión de la diversidad a disminuir con el aumento del nivel altitudinal. La dominancia (Simpson), por el contrario, se correlacionó positivamente con la altitud (fig.6g,h), tendencia observada en cada uno de los tres muestreos efectuados (primero: rP= 0.88, p< 0.01, N= 20; segundo: rP= 0.67, p< 0.01, N= 20; tercero: rP= 0.818, p< 0.01, N= 20) y en el total (rP= 0.79, p< 0.01, N= 60; fig.6h), presentándose los mayores valores de dominancia en la última estación del gradiente altitudinal (3.000 m).
Las ecuaciones de las regresiones lineales simples relacionan valores conocidos de altitud con valores predecibles de la riqueza, diversidad y dominancia de ortópteros para los muestreos independientes y para el muestreo general dentro del rango de 2000 m a 3000 m de altitud (Tabla 2). Los valores de mayor interés, por contener la mayor variabilidad, fueron los del muestreo general; de acuerdo con lo obtenido, cabría esperar que, por ejemplo, la riqueza de ortópteros en un muestreo del estrato rasante y hasta los dos metros en bosques primarios del flanco oeste de la Cordillera Oriental fuese de, aproximadamente, 13 morfoespecies a los 2000 m de altitud y ésta disminuiría hasta cerca de cuatro morfoespecies a los 3000 m. Según la ecuación, cabría esperar cerca de 27 especies para bosques entre los 100 y 300 m. La validación de este modelo es una labor debe ser constatada en campo por posteriores estudios y se insiste que el valor propuesto sería para una parcela de 50 por 5 metros.
Discusión
La riqueza y la diversidad de ortópteros declinaron directamente con el aumento de la altitud. Este patrón concuerda con lo observado por numerosos autores que trabajaron con diferentes órdenes de insectos (Hebert 1980, Wolda 1987, Lawton et al. 1987, McCoy 1990, Lobo 1992, Fisher 1996, Davis et al. 1999, Lobo y Halffter 2000, Brehm y Fiedler 2003, 2004), e inclusive con investigaciones que involucraban a los ortópteros como grupo de estudio (Alexander y Hillard 1969, Claridge y Singhrao 1978, Wolda 1987). Sin embargo, si se aumenta la escala de observación, no se puede descartar la otra opción, la de un incremento a altitudes intermedias, debido a lo extremo del gradiente tomado. Los 2000-3000 m en altitud pueden representar el tercio final de la curva de variación altitud-riqueza, que siempre es una declinación directa (Rahbek 2005). Faltaría observar qué ocurre entre los 0 y los 2000 m del gradiente; infortunadamente, conseguir un continuo con vegetación conservada entre los 100 m y los 3000 m de altitud en el flanco occidental de la Cordillera Oriental es actualmente imposible. Para estudios en sitios con tales condiciones, los datos para otros organismos indican el incremento a altitudes intermedias (Fagua 1999, IAvH 1999, Prieto 1999, Barriga Bernal 2000, Escobar et al. 2005). No obstante, estos trabajos contemplaron en su mayoría altitudes hasta los 2400 m, o a 2750 m pero en transectos discontinuos, por lo que un trabajo en gradiente completo aun hace falta por realizar.
El presente trabajo, con un porcentaje de eficiencia general elevado (fig.2), así como la ubicación del muestreo en bosques primarios, permite suponer que otros factores que pueden alterar la relación entre la altitud y las variables de comunidad como son la eficiencia del muestreo o los disturbios antrópicos (sensu Wolda 1987) estarían atenuados en el área elegida, por lo que los patrones observados serían representativos. Al respecto Wolda (1987) sugirió que la obtención de patrones divergentes en distintos estudios –declinación gradual o cresta intermedia-, se podían atribuir al tipo de muestreo, indicando que los muestreos continuos a lo largo de periodos largos evidenciarían el pico de riqueza y diversidad en las altitudes bajas, mientras que muestreos en periodos cortos expresarían los mayores valores de diversidad y riqueza en elevaciones medias. Por otro lado, los disturbios de tipo antrópico, en especial los que tienen lugar en los niveles altitudinales más bajos, pueden establecer una cresta de riqueza y diversidad en altitudes medias como una condición permanente (Wolda 1987, McCoy 1990, Escobar y Valderrama 1995, inédito), al alterar la composición vegetal presente en dichas altitudes.
La declinación de la riqueza y diversidad de ortópteros observada al incrementar la altitud podría explicarse a la luz de algunas de las razones expuestas por Lawton et al. (1987), siendo consecuencia de la reducción de la diversidad y disponibilidad de recursos alimentarios y de la menor productividad primaria en altitudes elevadas, lo que concuerda con las características de los bosques de niebla andinos. La diversidad vegetal de los bosques andinos disminuye linealmente con la altitud por encima de los 1500 m (Gentry 1995), evento que también se presentó en este gradiente (Acosta et al., 2006, Del Pino 2006, Rios 2006) lo que limita la heterogeneidad del recurso alimenticio disponible para el orden Orthoptera, cuyas especies son en su mayoría fitófagas que consumen follaje, flores o semillas (Rentz 1996). Con el aumento de la altitud, las hojas en los bosques andinos tienden hacia la microfilia y nanofilia, al ser más pequeñas, gruesas y coriáceas (Bruijnzeel y Veneklaas 1998), lo que representa una barrera física para insectos con un aparato bucal masticador. Las especies vegetales de altitudes superiores podrían ser más resistentes a la herbivoría, si las bajas temperaturas restringen más al crecimiento vegetal que a la fotosíntesis: en temperatura bajas, los carbohidratos fotosintetizados se acumulan en exceso, más allá de lo necesario para el crecimiento y mantenimiento de las plantas, lo que termina en un aumento de los metabolitos secundarios con base de carbono (Erelli et al. 1998). Altas concentraciones de flavonoides (compuesto fenólico reductor de la digestibilidad) han sido reportadas en las hojas de los bosques de niebla tropicales (Bruijnzeel y Veneklaas 1998). Cabe recordar que la productividad primaria disminuye con la elevación, como respuesta a una reducción en la temperatura promedio (aproximadamente 1º C cada 180 m altitudinales) y a la menor radiación solar como consecuencia de la mayor nubosidad (Bruijnzeel y Veneklaas 1998).
Los herbívoros generalistas son más resistentes que los especialistas a los reductores de digestibilidad (Stiling 1999). Esto, y la reducción en la heterogeneidad vegetal (Tabla 1; Acosta et al., 2006, Del Pino 2006, Rios 2006), sería coherente con el incremento en la dominancia de ortópteros que se presentó con la altitud. Las comunidades de ortópteros sufrieron una paulatina transición desde la más rica, heterogénea y taxonómicamente diversa comunidad de los 2000-2250 m a la muy pobre comunidad de los 2750-3000m. Precisamente Eugryllina sp. 1, Eugryllina sp. 2 y Acla sp. 2 que presentaron el mayor número de individuos en las cinco altitudes y en cada uno de los tres muestreos, pertenecen a taxones registrados como generalistas omnívoros (Gangwere 1961). Esto podría estar relacionado con que, al no verse limitados por la reducción de la diversidad de recursos con el aumento de la altitud, y al estar libres de la competencia, estarán “llenando” el vacío dejado por morfoespecies más especialistas o menos tolerantes a las adversas condiciones de los sitios de mayor altitud. En efecto, la proporción de individuos de Eugryllina sp. 1 más sp. 2, respecto del total por estación, pasa de cerca del 60% en 2000-2250 m a cerca del 93% a los 3000 m (Tabla 1). Esta tendencia ha sido también observada por Lobo (1992) en escarabajos coprófagos del Sistema Central Ibérico, quien lo interPretó como un posible mecanismo compensatorio para adecuar las poblaciones de coleópteros a los recursos disponibles. Igualmente Fagua (1999), en un gradiente altitudinal en la Cordillera Oriental, relacionó el aumento de la dominancia de grupos de mariposas generalistas como Satyrinae, Pieridae y Lycaenidae con el tipo de estrategias defensivas de plantas de media y alta montaña, con gran acumulación de reductores de digestibilidad.
La abundancia de ortópteros no presentó una asociación evidente con el nivel altitudinal, tendencia que ha sido observada también en escarabajos coprófagos (Lobo 1992) e insectos herbívoros (Lawton et al. 1987). Diferentes patrones han sido registrados por Wolda (1987), una relación inversa en insectos capturados mediante trampas de luz en Panamá, y Janzen et al. (1976), mayor abundancia de insectos en altitudes intermedias en los andes venezolanos. La ausencia de un patrón predominante de relación entre abundancia de insectos y altitud indicaría que esta no es necesariamente un factor muy influyente.
Acorde con el análisis de correspondencia (DCA) y de similitud de Jaccard, es posible deducir que existen dos grupos de comunidades de ortópteros, ubicadas en los extremos superior (2750 m - 3000 m) e inferior (2000 m – 2250 m) del gradiente altitudinal, presentándose, más que un cambio en la composición de especies, una paulatina reducción en la riqueza a medida que se aumenta en altitud en el bosque andino presente en el Santuario de Fauna y Flora Guanentá - Alto Río Fonce. Dicho cambio en las especies de ortópteros presentes estaría relacionado, principalmente, con las diferencias en la estructura y composición de la vegetación, que pasa de bosques montanos heterogéneos a los 2000 m y 2250 m a robledales típicos en la cuarta (2750 m) y en la quinta estación (3000 m), con amplia predominancia de Quercus humboldtii (Tablas 1, 2; Del Pino 2006, Ríos 2006). Esta relación ha podido ser apreciada en otros trabajos como el de Fisher (1996), quien encontró una división en la comunidad de hormigas de Madagascar entre las de menor (785-825 m) y mayor (1275-1680 m) altitud de sus gradientes, lo que coincidió con la transición de las selvas bajas al bosque nublado. También Davis et al. (1999) observaron una zonación altitudinal de escarabajos estercoleros en Sur Africa, definiendo tres comunidades según las discordancias estructurales de la vegetación a medida que la altitud aumentaba.
Conclusiones
Los análisis de correspondencia y similitud definieron dos comunidades: una muy rica y con bajo aporte de las especies dominantes, la integrada por los ortópteros de las estaciones 2000-2250 m; y otra más pobre, de las estaciones 2750-3000 m, caracterizada por el gran aporte de sólo dos especies dominantes. Los 2500 m son una zona de transición, que evidencia el paulatino proceso de declinación de la riqueza entre uno y otro extremo del gradiente, que fue el modelo encontrado en el presente estudio. Este evento se asociaría con las diferencias en la estructura y composición de la vegetación a lo largo del gradiente, que pasa de un bosque montano a un robledal, ecosistema con pocas especies vegetales y menos complejo en estructura. Esta transición explicaría también la declinación en la riqueza y la diversidad de ortópteros con el aumento de la altitud y el aumento en la dominancia, por la reducción de la diversidad y disponibilidad de recursos vegetales en altitudes superiores. En adición, el mayor aporte en abundancia de especies generalistas probablemente se deba también a su mayor tolerancia a condiciones adversas. La abundancia de ortópteros no presentó una asociación evidente con el nivel altitudinal.
Dada la alta dependencia de los insectos por las plantas, bien como recurso, refugio o como generadoras de microhábitats, es frecuente relacionar los cambios en la composición faunística de insectos con los cambios en la composición, diversidad y estructura de la vegetación (Fagua 1999, Brehm y Fiedler 2003). En este sentido, y según las ecuaciones obtenidas por los análisis de regresión, cabría esperar que en un muestreo de ortópteros semejante al acá propuesto, en bosques primarios de tierras bajas (300 m – 500 m) del flanco oeste la Cordillera Oriental, mucho más heterogéneos, complejos y ricos en vegetación, se tendría una comunidad con cerca de 26 morfoespecies de ortópteros, muy diversa (H´=3,7 a 3,5) y con una baja dominancia, aunque para esta variable el modelo propuesto no es muy fiable por debajo de los 2000 m. Es labor de próximos trabajos el corroborar y mejorar los modelos propuestos.
Agradecimientos
A la Sociedad Colombiana de Entomología (SOCOLEN) y la Vicerrectoría Académica de la Pontificia Universidad Javeriana por el apoyo al presente proyecto (No. Registro 1580). A la Fundación Natura por la ayuda logística. A Diana Montañez, por la localización del sitio de estudio. A José Sinisterra, de la Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales por su diligencia en la obtención del permiso de colecta. A Diana Del Pino y Julián Ríos. A Mitzy Fernanda Porras.
Literatura Citada
ACOSTA, A.; FAGUA, G.; DIAZGRANADOS, M. 2006. “Variación de la comunidad de ortópteros, anuros y vegetación a lo largo de un gradiente altitudinal en bosque andino del municipio de Encino (Santander, Colombia). Informe final, Vicerrectoría académica, Pontificia Universidad Javeriana. Bogotá. Colombia. 39 pp. [ Links ]
ALEXANDER, G.; HILLARD, J.R. 1969. Altitudinal and seasonal distribution of Orthoptera in the Rocky Mountains of northern Colorado. Ecological Monographs 39: 385 – 431. [ Links ]
AMAT, G.; REYES-CASTILLO, P. 1996. Capítulo IV. Los escarabajos-pasálidos (Coleoptera: Passalidae) de Colombia-II: Distribución geográfica y altitudinal. p. 75–92. En: Andrade – C., M. G.; Amat, G.; Fernández, F. (eds.). Insectos de Colombia Vol 1. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Colección Jorge Álvarez Lleras No. 10. Centro Editorial Javeriano (CEJA). Bogotá. Colombia. 541 p. [ Links ]
AMAT, G.; REYES-CASTILLO, P. 1999. Capítulo VIII. Escarabajos-pasálidos (Coleoptera: Passalidae) de Colombia-IV: Tipificando las especies de montaña. p.: 249 – 266. En: Amat, G.; Andrade–C., M. G.; Fernández, F. (eds.). Insectos de Colombia Vol 2. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Colección Jorge Alvarez Lleras. No 13. Bogotá. Colombia. 433 p. [ Links ]
ARIAS B., J.J.; HUERTAS H., B.C. 2001. Mariposas diurnas de la Serranía de los Churumbelos, Cauca. Distribución altitudinal y diversidad de especies (Lepidoptera: Rhopalocera: Papilionoidea). Revista Colombiana de Entomología 27(3-4): 169-176. [ Links ]
BARRIGA BERNAL, J. 2000. Cambios en la diversidad de arañas constructoras de tela a lo largo de un gradiente altitudinal en el Parque Nacional Natural Munchique. Tesis de grado, Biología, Pontificia Universidad Javeriana. Bogotá. Colombia. 103 p. [ Links ]
BLANCHE, K. R.; LUDWIG., J. A. 2001. Species richness of gall – inducing insects and host plants along an altitudinal gradient in Big Bend National Park, Texas. The American Midland Naturalist 145: 219 – 232. [ Links ]
BRAUN, H. 2002. Die Laubheuschrecken (Orthoptera, Tettigoniidae) eines Bergregenwaldes in Süd – Ecuador faunistische, bioakustische und ökologische Untersuchungen. Erlangung des Doktorgrades. Den Naturwissenschaftlichen Fakultäten der Friedrich – Alexander – Universität Erlangen – Nürnberg. Deutschland. 142 p. [ Links ]
BREHM, G.; FIEDLER., K. 2003. Faunal composition of geometrid moths changes with altitude in an Andean montane rain forest. Journal of Biogeography 30: 431 – 440. [ Links ]
BREHM, G.; FIEDLER., K. 2004. Bergmann’s rule does not apply to geometrid moths along an elevational gradient in an Andean montane rain forest. Global Ecology and Biogeography 13: 7–14. [ Links ]
BREHM, G.; HOMEIER, J.; K. FIEDLER. 2003. Beta diversity of geometrid moths (Lepidoptera: Geometridae) in an Andean montane rainforest. Diversity and Distributions 9: 351–366. [ Links ]
BRUIJNZEEL, L. A.; VENEKLAAS, E. J. 1998. Climatic conditions and tropical montane forest productivity: The fog has not lifted yet. Ecology 79 (1): 3 – 9. [ Links ]
CLARIDGE, M. F.; SINGHRAO, J. S. 1978. Diversity and altitudinal distribution of grasshoppers (Acridoidea) on a Mediterranean mountain. Journal of Biogeography 5: 239 – 250. [ Links ]
COLWELL, R. K. 1994 – 2000. EstimateS. Statistical estimation of species richness and shared species from samples. http://viceroy.eeb.uconn.Edu/EstimateS. Fecha última revisión: dicembre 2000. Fecha último acceso: 09 enero 2006. [ Links ]
DAVIS, A. L. V.; SCHOLTZ, C. H.; CHOWN, S. L. 1999. Species turnover, community boundaries and biogeographical composition of dung beetle assemblages across an altitudinal gradient in South Africa. Journal of Biogeography 26: 1039 – 1055. [ Links ]
DEL PINO, D. F. 2006. Variación de la composición, la riqueza y la diversidad de la vegetación a lo largo de un gradiente altitudinal, en un bosque andino del Santuario de fauna y flora Guanentá-Alto Río Fonce Santander, Colombia). Trabajo de grado, Carrera de Biología. Pontificia Universidad Javeriana. 170 pp. Bogotá. [ Links ]
DEL PINO, D.; DÍAZGRANADOS, M.; RÍOS, J. 2005. Variation of Composition, Diversity and Structure of Vegetation along an altitudinal gradient in a Tropical Mountain Forest (SFF Guanentá – Alto del Río Fonce, Colombia). p. 567. in: Abstracs book. XVIII Internacional Botanical Congress. Viena. Austria. 731 p. [ Links ]
DONOVAN, S. E.; EGGLETON, P.; MARTIN, A. 2002. Species composition of termites of the Nyika plateau forests, northern Malawi, over an altitudinal gradient. East African Wild Life Society 40: 379 – 385. [ Links ]
ESCOBAR, F.; VALDERRAMA, C. 1995. inédito. Comparación de la biodiversidad de artrópodos de bosque a través del gradiente altitudinal Tumaco-Volcan de Chiles (Nariño): Evaluación del efecto de la deforestación. Informe Final, Fondo José Celestino Mutis FEN-Colombia. Bogotá. Colombia. 39 p. [ Links ]
ESCOBAR, F.; LOBO, J. M.; HALFFTER, G. 2005. Altitudinal variation of dung beetle (Scarabaeidae: Scarabaeinae) assemblages in the Colombian Andes. Global Ecology and Biogeography 14: 327–337. [ Links ]
ERELLI, M. C.; AYRES, M. P.; EATON; G. K. 1998. Altitudinal patterns in host suitability for forest insects. Oecología 117: 133 – 142. [ Links ]
FAGUA, G. 1999. Capítulo XI. Variación de las mariposas y hormigas de un gradiente altitudinal de la Cordillera Oriental (Colombia). p: 317 – 362. En: Amat, G.; Andrade–C., M. G.; Fernández, F. (eds.). Insectos de Colombia Vol 2. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Colección Jorge Alvarez Lleras. No 13. Bogotá. Colombia. 433 p. [ Links ]
FISHER, B. L. 1996. Ant diversity patterns along an elevational gradient in the Reserve Naturelle Integrale d’ Andringitra, Madagascar. Fieldiana Zoologica 85: 93 – 108. [ Links ]
FLEISHMAN, E.; AUSTIN, G. T.; WEISS, A. 1998. An empirical test of Rapoport’s rule: elevational gradients in montane butterfly communities. Ecology 79: 2472 – 2483. [ Links ]
GANGWERE, S.K. 1961. A monograph on food selection in Orthoptera. Transactions of the American Entomological Society 87:67-230. [ Links ]
GREENBERG, C.H.; FORREST, T.G. 2003. Seasonal abundance of ground-occurring macroarthropods in forest and canopy gaps in the southern Appalachians. Southeastern Naturalist 2(4):591-608 [ Links ]
GENTRY, A. H. 1995. Patterns of diversity and floristic composition in neotropical montane forests. p. 103 - 126. En: Churchill, S. P.; Balslev, H.; Forero, E.; Luteyn, J. L. (eds). Biodiversity and Conservation of Neotropical Montane Forests. The New York Botanical Garden, New York. USA. 702 p. [ Links ]
GUTIÉRREZ, D.; MENÉNDEZ, R. 1995. Distribution and abundance of butterflies in a mountain area in the northern Iberian peninsula. Ecography 18: 209 – 216. [ Links ]
HEBARD, M. 1927. Studies in the Dermaptera and Orthoptera of Colombia, fourth paper. Transactions of the American Entomological Society. 52 : 275-354, pl. 18-22. [ Links ]
HEBARD, M. 1933. Studies in the Dermaptera and Orthoptera of Colombia. Supplement to papers one to five. Transactions of the American Entomological Society. 59(970):13-67, 2 pls. [ Links ]
HEBERT, P. D. N. 1980. Moth communities in montane Papua New Guinea. Journal of Animal Ecology 49: 593– 602. [ Links ]
IAVH, INSTITUTO ALEXANDER VON HUMBOLDT. 1999. Caracterización de la biodiversidad en áreas prioritarias de la vertiente oriental de la cordillera oriental. Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt, Villa de Leyva, Colombia. 25 pp. http://www.humboldt.org.co/humboldt/homeFiles/inventarios/VOCO.pdf Fecha última revisión: dicembre 2001. Fecha último acceso: 09 enero 2006. [ Links ]
JANZEN, D. H. 1973. Sweep samples of tropical foliage insects: effects of seasons, vegetation types, elevation, time of day, and insularity. Ecology 54: 687 – 708. [ Links ]
JANZEN, D. H., ATAROFF, M.; FARINAS, M.; REYES, S.; RINCÓN, N.; SOLER, A.; SORIANO, P.; VERA, M. 1976. Changes in the arthropod community along an elevational transect in the venezuelan Andes. Biotropica (3): 193 – 203. [ Links ]
LAWTON, J. H.; MACGARVIN, M.; HEADS, P. A.. 1987. Effects of altitude on the abundance and species richness of insects herbivores on bracken. Journal of Animal Ecology 56: 147 – 160. [ Links ]
LOBO, J. M. 1992. Modificación de las comunidades de Scarabaeoidea coprófagos (Coleoptera) en pastizales de altura del sistema central ibérico (España) a lo largo de un gradiente altitudinal. Acta Zoológica Mexicana 53: 15 – 31. [ Links ]
LOBO, J. M.; HALFFTER, G. 2000. Biogeographical and ecological factors affecting the altitudinal variation of mountainous communities of coprophagous beetles (Coleoptera: Scarabaeoidea): a comparative study. Annals of the Entomological Society of America 93: 115 – 126. [ Links ]
LOMOLINO, M. B. 2001. Elevation gradients of species density: historical and prospective views. Global Ecology & Biogeography 10: 3 – 13. [ Links ]
McCOY, E. D. 1990. The distribution of insects along elevational gradients. Oikos 58: 313 – 332. [ Links ]
MAGURRAN, A. 1989. Diversidad ecológica y su medición. Ediciones VEDRA. Barcelona. España. 200 p. [ Links ]
MAO, C. X.; COLWELL, K.R. 2005. Estimation of species richness: mixture models, the role of rare species, and inferential challenges. Ecology, 86(5), 2005, pp. 1143–1153. [ Links ]
MCCUNE, B.; MEFFORD, M. J. 1997. Multivariate Analysis of Ecological Data Version 3.17. MJM Software. Gleneden Beach, Oregon. U. S. A. [ Links ]
MORÓN - R, M. A.; TERRÓN – S., R. A. 1984. Distribución altitudinal y estacional de los insectos necrófilos en la sierra norte de Hidalgo, México. Acta Zoológica Mexicana 3: 1 – 47. [ Links ]
NASKRECKI, P.; OTTE, D. 1999. An illustrated Catalog of Orthoptera. Vol. I. Tettigonioidea (CD ROM). The Orthopterists’ Society at the Academy of Natural Sciences of Philadelphia. Philadelphia. USA. [ Links ]
NICKLE D. A. 1992. Katydids of Panama (Orthoptera: Tettigoniidae). p. 142 – 184. En: Quintero, D.; Aiello, A. Insects of Panama and Mesoamerica (Selected Studies). Oxford Science Publications, Washington D.C. USA. 692 p. [ Links ]
NICKLE D. A. 1992. The Crickets and Mole Crickets of Panama (Orthoptera: Gryllidae and Gryllotalpidae). P. 185 – 197. En: Quintero, D.; Aiello, A. Insects of Panama and Mesoamerica (Selected Studies). Oxford Science Publications, Washington D.C. USA. 692 p. [ Links ]
OLSON, D. M. 1994. The distribution of leaf litter invertebrates along a neotropical altitudinal gradient. Journal of Tropical Ecology 10: 129 – 150. [ Links ]
PRIETO CH. 2003. Satírinos (Lepidoptera: Nymphalidae: Satyrinae) del Parque Nacional Natural Munchique, diversidad de especies y distribución altitudinal. Revista Colombiana de Entomología 29(2): 203-211. [ Links ]
PYRCZ, T. W.; WOJTUSIAK, J. 2002. The vertical distribution of pronophiline butterflies (Nymphalidae, Satyrinae) along an elevational transect in Monte ZerPa (Cordillera de Mérida, Venezuela) with remarks on their diversity and parapatric distribution. Global Ecology & Biogeography 11: 211–221. [ Links ]
RAHBEK, C. 1995. The elevational gradient of species richness: a uniform pattern? Ecography 18: 200–205. [ Links ]
RAHBEK, C. 2005. The role of spatial scale and the perception of large-scale species-richness patterns. Ecology Letters 8: 224-239. [ Links ]
RANDALL, M. G. M. 1982. The dynamics of an insect population throughout its altitudinal distribution: Coleophora alticolella (Lepidoptera) in northern England. Journal of Animal Ecology 51: 993 – 1016. [ Links ]
RENTZ, D. C. F. 1996. Chapter 24. Orthoptera. P. 369-393. En: Waterhouse, D.F.; Carne, P.B.; Naumann, I.D. The Insects of Australia: A textbook for students and research workers. Vol. I. Segunda Edición. Me1bourne University Press. Melbourne. Australia. 1137 p. [ Links ]
RIOS, J. F. 2006. Variación de la estructura de la vegetación a lo largo de un gradiente altitudinal, en un bosque andino del Santuario de Fauna y Flora Guanentá-Alto Río Fonce Santander, Colombia). Trabajo de grado, Carrera de Biología. Pontificia Universidad Javeriana. Bogotá. 96 pp. [ Links ]
RINCON H., M. E. 1999. Capítulo IX. Estudio preliminar de la distribución altitudinal y espacial de los tricópteros en la Cordillera Oriental (Colombia). P. No 13: 267 – 284. En: Amat, G.; Andrade–C., M. G.; Fernández, F. (eds.). Insectos de Colombia Vol 2. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Colección Jorge Álvarez Lleras. No 13. Bogotá. Colombia. 433 p. [ Links ]
RYAN, P. D., D. A. T. HARPER y J. S. WHALLEY. 1995. PAST-PALaeontologial Statistics. http://folk.uio.no/ohammer/past. Fecha última revisión: dicembre 1999. Fecha último acceso: 09 enero 2006. [ Links ]
SANDERS, N. J. 2002. Elevational gradients in ant species richness: area, geometry, and Rapoport’s rule. Ecography 25: 25 – 32. [ Links ]
STATSOFT, INC. (2001). STATISTICA (data analysis software system), version 6. http://www.statsoft.com. [ Links ]
STILING, P. D. 1999. Ecology, theories and applications. Tercera Edición. Prentice-Hall. New Jersey. USA. 638 p. [ Links ]
UAESPNN. 1998. Santuario de Fauna y Flora Guanentá – Alto Río Fonce. p. 315–318. En: Castaño–Uribe, C.; Cano Correa, M. El sistema de parques nacionales naturales de Colombia. Editorial Nomos. Bogotá. Colombia. [ Links ]
WOLDA, H. 1987. Altitude, habitat and tropical insect diversity. Biological Journal of the Linnean Society 30: 313 – 323. [ Links ]
Recibido: 11-ene-06 • Aceptado: 31-oct-06