Introducción
La mosca blanca algodonosa de los cítricos, Aleurothrixus floccosus (Maskell, 1895) (Hemiptera: Aleyrodidae) es una de las plagas más importantes en cítricos a nivel mundial (Giliomee y Millar 2009; Tello et al. 2014). Este insecto ocurre en las siguientes zonas biogeográficas: Neártica, Neotropical, Paleártica Oeste, Africa tropical, Paleártica Este, Islas Orientales y del Pacífico (Evans 2007). Está ausente en Australasia y Hawaii. Además, está asociada con alrededor de 31 familias botánicas (Evans 2007). En Chile, este hemíptero, se distribuye desde la Región de Arica y Parinacota hasta la Región Temuco, asociándose a guayaba (Psidium guajava L.), limón [Citrus limon (L.)], mandarina (Citrus reticulata B.), naranjo [Citrus sinensis (L.)], pomelo (Citrus grandis H.) (Klein y Waterhouse 2000).
Las formas imaginales, tanto machos como hembras, tienen sus cuerpos y alas cubiertos con una sustancia cerosa de color blanco. Los huevos son pedunculados, curvados (reniformes), ovipuestos en círculo o semi-círculo. Los tres primeros estadios ninfales son sésiles, de forma oval, dorso-ventralmente aplanadas, color transparente, protegidas por una masa de hebras cerosas. Las ninfas de cuarto estadio, también sé-siles y de forma suboval, de color blanco amarillo pálido, siendo de color marrón en su madurez, cubiertas por hebras algodonosas cerosas (Paulson y Kumashiro 1985; Luppichini et al. 2008; Alford 2014).
Las moscas blancas prefieren alimentarse y oviponer sobre la superficie abaxial de las hojas jóvenes (Ripa et al.1999; Giliomee y Millar 2009). En el Desierto de Atacama (Regiones de Arica y Parinacota y Tarapacá), esta especie se reproduce continuamente a través del año, constituyendo una plaga importante en cítricos (Luppichini et al. 2008).
El Oasis de Pica se localiza a 300 msnm y presenta temperaturas que varían entre 2 a 3 °C en invierno y desde 10 a más de 45 °C en verano. No existen lluvias a lo largo del año. El agua de riego se obtiene por bombeo desde napas subterráneas (20-40 m de profundidad). El tipo de suelo es arenoso y se utiliza estiércol de aves marinas y de cabras como fertilizantes. En el Oasis de Pica, se entremezclan diferentes sistemas de manejo de cultivo: sistema tradicional, el cual no presenta marco de plantación ni manejo de poda; sistema intensivo, con marco de plantación (5 x 5 m) y con manejo de poda y un tercer sistema que es una mezcla de los mencionados. Las plagas más relevantes que afectan a los cítricos son: A. floccosus, Aphis citricola (van der Goot, 1914) (Hemiptera: Aphididae) y la arañita Panonychus citri (McGregor, 1916) (Acari: Tetranychidae). Para el manejo de estas plagas no se aplican pesticidas sintéticos (Rojas 2005), solamente se realizan lavados con agua a alta presión (Ragusa et al. 2000; Tello et al. 2014).
Tres especies de Hymenoptera, dos Aphelinidae Cales noacki (Howard, 1907) y Eretmocerus paulistus (Hempel, 1904) y un Platygastridae Amitus spiniferus (Brethes, 1914) son los enemigos naturales conocidos de A. floccosus. C. noacki es una microavispa endémica de Chile que no siempre se ha comportado como un buen agente de control biológico de la mosca blanca de los cítricos, situación que ha sido claramente observada en cítricos cultivados en la zona central de Chile (Rojas 2005). A. spiniferus fue introducido en Chile desde Perú entre 1965 y 1968, logrando su establecimiento a partir de 1970 y posteriormente mostrando una alta efectividad en reducir la plaga en el Valle de La Ligua (Región de Valparaíso). Con respecto a E. paulistus, la información generada en este estudio es la primera documentación acerca de esta avispa para el Oasis de Pica. Acerca del hiperparasitoide Signophora sp., Ripa et al. (1999) reportaron que este insecto fue registrado por primera vez para Chile en 1997, actuando como parásito secundario sobre ninfas ya parasitadas por A. spiniferus y C. noacki. Sin embargo, la fluctuación poblacional y la efectividad de estos parasitoides aún no ha sido evaluada así como tampoco el efecto que podría tener el tipo de manejo de cultivo sobre el parasitismo ejercido por estas microavispas sobre la mosca blanca algodonosa de los cítricos, en las condiciones de ecosistema de oasis en el Desierto de Atacama, el más árido del mundo.
Materiales y métodos
Material biológico
Con anterioridad a los muestreos se realizó una minuciosa clasificación de las especies. C. noacki y A. spiniferus se identificaron mediante claves y por comparación con material de referencia depositado en la Facultad de Recursos Naturales Renovables de la Universidad Arturo Prat. E. paulistus fue identificado por las doctoras Svetlana Myartseva y Juana M. Coronado-Blanco, de la Universidad Autónoma de Tamaulipas, México. Actualmente, aún se trabaja en el reconocimiento de la especie Signiphora sp. con la colaboración de Jim Woolley de Texas A&M University, Estados Unidos.
Muestreo absoluto en hojas de Citrus sinensis
Los trabajos de campo se realizaron en árboles de C. sinensis en tres huertos típicos del oasis de Pica: 1) Sector Miraflores Bajo (20º29’12,1”S, 69º19’34,7”O) con marco de plantación (5 x 5 m) y manejo de poda, 2) Sector San Lorenzo (20º28’48,6”S, 69º19’18,3”O) sin marco de plantación ni manejo de poda y 3) Sector Miraflores (20º28’54,4”S, 69º 19’14,7”O) que representa un sistema mixto entre los dos, es decir, con poda pero sin marco de plantación. Se muestreó, en forma quincenal, desde febrero del 2009 hasta febrero del 2011.
Para el muestreo absoluto se siguió el método aplicado por Katsoyannos et al. (1997) y Ulusoy et al. (2003). Se recolectaron 36 hojas por árbol (tres de la zona apical, tres de la parte media y otras tres hojas basales escogidas de cada cuadrante de cuatro árboles marcados), obteniéndose 144 hojas por sector, y muestreando dos veces por mes. Las hojas se examinaron en el laboratorio bajo microscopio estereoscópico con un aumento de 50 x (Carl Zeiss, modelo Stemi SV6, Alemania). Se registró el número de huevos y ninfas de A. floccosus parasitadas y no parasitadas, con lo cual se calculó el nivel de infestación como el número promedio de huevos y ninfas vivas de A. floccosus en cinco cuadrados de 0,25 cm² de superficie foliar, llevándose a 1 cm2. El examen de las ninfas parasitadas se realizó aplicando la técnica desarrollada por Garrido et al. (1978) que consistió en introducir la hoja completa en una placa Petri con xilol. Una vez impregnados los especímenes se separaron de la hoja con ayuda de una aguja entomológica. Posteriormente, con un pincel se depositaron en otra placa Petri con una capa de xilol de 1,5 cm de espesor para permitir que se fueran al fondo y aclararan. Se mantuvieron por espacio de 3 h y se procedió a su observación con un microscopio estereoscópico con fondo negro. El porcentaje de parasitismo fue calculado siguiendo a Santamaría et al. (1998) y Hoelmer y Simmons (2008).
Muestreo relativo (trampas amarillas pegajosas)
Se siguió una modificación del método propuesto por Ekbom y Xu (1990). Se muestrearon adultos de A. floccosus, C. noacki, E. paulistus y Signiphora sp. a través de trampas cromo-atrayentes de color amarillo rey (Industrias Ceresita®), con una superficie útil de 199,92 cm2, se aplicó como adherente el pegamento Point Sticky Glue® (Point Chile, SA). Las trampas se colocaron en la parte central de cada uno de los cuatro árboles marcados y utilizados para el muestreo de hojas. Las 12 trampas se reemplazaron dos veces al mes, abarcando el mismo período que el muestreo absoluto.
Análisis estadístico
Se comparó el número promedio de huevos y ninfas (parasitadas y no parasitadas) y los adultos capturados en trampas amarillas pegajosas, entre los tres manejos del cultivo. Los datos se analizaron con el software R version 3.5.1 (R Core Team 2018). Al no cumplir los residuales los requisitos de normalidad y homocedasticidad, se aplicó el análisis factorial de datos no paramétrico denominado Transformación de Rango Alineado (“Aligned Rank Transform”) mediante la función art en la librería “ARTool” (Wobbrock et al. 2011; Kay and Wobbrock 2018). Las pseudo-repeticiones fueron tratadas con un análisis de varianza de medidas repetidas sobre las respuestas y prueba posthoc de Tukey (contrastes a pares respecto a cada sector) mediante la función emmeans (Lenth 2018). La comparación de dos medias fue realizada con la prueba no paramétrica de rango con signo de Wilcoxon. El nivel de significancia utilizado fue 0,05. Se graficó mediante la librería plotrix (Lemon 2006). Se realizaron correlaciones sobre el número de ninfas y “pupas” parasitadas A. floccosus registradas en hojas y adultos de parasitoides capturados por trampas pegajosas amarillas. Se utilizó la correlación de Spearman debido a que los residuales no se distribuyeron con normalidad.
Resultados
Fluctuación poblacional de A. floccosus, C. noacki, E. paulistus, Signiphora sp. en hojas y en trampas cromoatrayentes
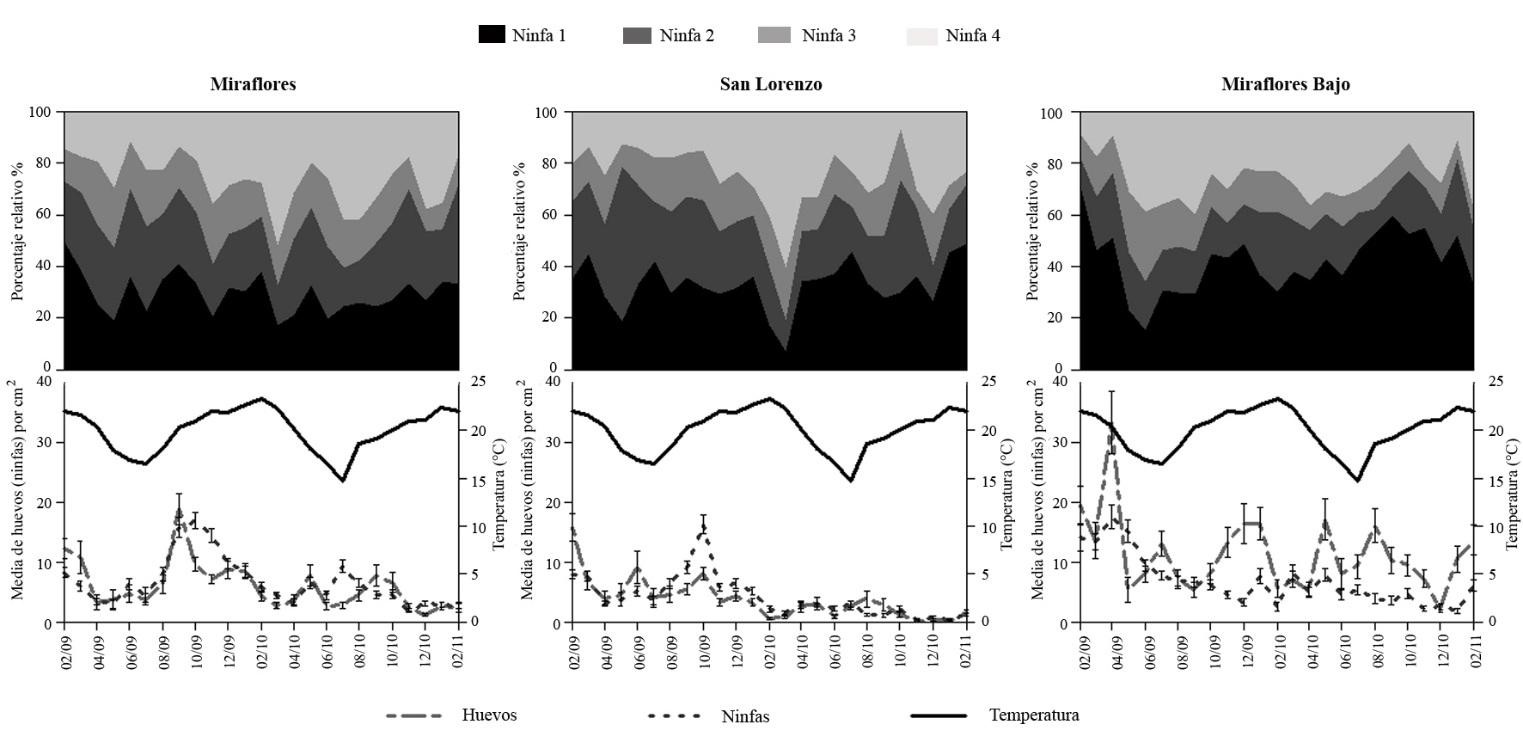
Las temperaturas promedios mensuales registradas en el Oasis de Pica para el período que abarcó el estudio son mostradas en la Figura 1. En 2009, la temperatura promedio fue de 19,67 ± 0,04 °C, la temperatura mínima promedio que se registró en julio (invierno) fue 16,55 ± 0,13 °C y la máxima promedio fue 22,02 ± 0,20 °C en noviembre (primavera). El año 2010 la temperatura promedio registrada fue de 19,74 ± 0,04 °C, la mínima promedio fue de 14,69 ± 0,14 °C (julio) y la máxima promedio de 23,26 ± 0,13 °C, registrada en febrero.
Muestreo absoluto:
muestreo en hojas
Los resultados para la fluctuación poblacional de huevos, ninfas y “pupas” de A. floccosus se muestran en la Tabla 1 y Figura 1. La multiplicación de A. floccosus fue continua para los dos años de muestreo (2009 y 2010) superponiéndose los diferentes estadíos (huevos, ninfas y “pupas”). Los máximos poblacionales de huevos coincidieron con los de las ninfas 1 en el sector de Miraflores Bajo. Un descenso en las densidades poblaciones se registró en los sectores de San Lorenzo y Miraflores, que coincidió con lavados con agua a presión realizados en febrero del 2010, los cuales no se realizaron en Miraflores Bajo.
Tabla 1 Número (media ± EE1) de juveniles (huevos, ninfas y pupoides) por cm2 de Aleurothrixus floccosus en hojas de Citrus sinensis cultivados en tres huertos con distinto manejo del cultivo en el Oasis de Pica, Desierto de Atacama, Chile. Período 2009-2010.
| Sector | Huevos | Ninfa 1 | Ninfa 2 | Ninfa 3 | Ninfa 4 | “Pupa” | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | |
| Miraflores 2 | 8,31 ± 0,47 b3 | 3,73 ± 0,2 9 b | 3,03 ± 0,15 b | 1,12 ± 0,07 a | 2,36 ± 0,12 a | 1,03 ± 0,07 a | 1,67 ± 0,07 a | 0,72 ± 0,04 a | 2,00 ± 0,08 a | 1,43 ± 0,07 a | 0,56 ± 0,03 a | 0,23 ± 0,02 a |
| San Lorenzo4 | 5,95 ± 0,12 c | 1,59 ± 0,05 c | 2,23 ± 0,03 b | 0,52 ± 0,01 b | 2,03 ± 0,03 b | 0,35 ± 0,01 c | 1,13 ± 0,02 c | 0,23 ± 0,01 c | 1,29 ± 0,02 b | 0,42 ± 0,01 c | 0,44 ± 0,01 b | 0,06 ± 0,00 c |
| Miraflores Bajo5 | 13,51 ± 0,21 a | 9,28 ± 0,15 a | 3,70 ± 0,07 a | 1,93 ± 0,03 a | 1,71 ± 0,03 c | 0,81 ± 0,02 b | 1,44 ± 0,02 b | 0,46 ± 0,01 b | 2,07 ± 0,02 a | 1,25 ± 0,02 b | 0,73 ± 0,01 a | 0,17 ± 0,00 b |
| F | 15,35 | 110,49 | 8,13 | 66,9 | 30,26 | 65,12 | 21,18 | 85,09 | 30,39 | 109,13 | 19,49 | 56,46 |
| P-valor | < 0,0001 | < 0,0001 | 0,0003 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 |
1 EE: Error estándar. 2 Con marco de plantación y con poda. 3 Medias con diferentes letras minúsculas dentro de cada columna son significativamente diferentes de acuerdo a la prueba de Tukey (P < 0,05). 4 Sin marco de plantación y sin poda. 5 Mixto.
Huevos
La densidad promedio de huevos de A. floccosus fluctuó entre 1,59 y 13,51 huevos·cm-2 (Tabla 1). Hubo diferencias significativas entre los tres sectores para los dos años de muestreo (2009: F(2,10.362) = 15,35, P < 0,0001; 2010: F(2,10.794) = 110,49, P < 0,0001), siendo Miraflores Bajo el que presentó las mayores densidades.
Ninfas (estadios 1, 2, 3 y 4 temprana)
La densidad promedio de ninfas de A. floccosus fluctuó entre 0,23 y 3,70 ninfas/cm2 (Tabla 1). Las ninfas de primer instar fueron más abundantes en el sector de Miraflores Bajo, las de segundo fueron más abundantes en el sector de Miraflores, las de tercer en el sector de Miraflores y las de cuarto en los sectores Miraflores y Miraflores Bajo. Al analizar las ninfas totales se encontraron diferencias significativas entre los tres sectores (2009: F (2, 10.362) = 26,79, P < 0,0001; 2010: F(2, 10.794) = 116,69, P < 0,0001).
Ninfas 4 avanzadas
La densidad promedio de ninfas 4 avanzadas de A. floccosus fluctuó entre 0,06 y 0,73 “pupas”·cm-2 (Tabla 1). Al comparar los sectores, se presentaron diferencias significativas para cada año de muestreo, siendo los sectores de Miraflores y Miraflores Bajo los que presentaron las mayores densidades.
Según este estudio, para los cítricos de Pica las mayores infestaciones ocurrieron en el 2009 con un promedio de 8,22 ± 0,18 ninfas·cm-2, en cambio el 2010 se registró un promedio de 3,42 ± 0,10 ninfas·cm-2, alcanzando su mayor población en plena primavera (octubre con 13,11 ± 0,78 ninfas de A. floccosus·cm-2). Los mayores aumentos en el 2009 se obtuvieron en el sector Miraflores Bajo en otoño, en abril y mayo con 17,50 ± 1,95 y 15,10 ± 1,89 ninfas·cm-2, respectivamente. En Miraflores, en octubre y noviembre se obtuvieron 16,86 ± 1,41 y 15,72 ± 1,72 ninfas·cm-2, respectivamente, y en San Lorenzo en octubre y septiembre fueron de 16,28 ± 1,58 y 9,14 ± 1,09 ninfas·cm-2, respectivamente. Es decir que, en estos dos últimos huertos, los más altos niveles de población de ninfas se registraron principalmente en el periodo de primavera.
La supervivencia media de huevo a ninfa de primer instar fue muy similar para los sectores de San Lorenzo y Miraflores y levemente menor para Miraflores Bajo (36,50; 34,41 y 24,66 %, respectivamente). La supervivencia de huevo a “pupa” fue inferior al 10 % en todos los sectores (6,62; 6,59 y 3,90 % para San Lorenzo, Miraflores y Miraflores Bajo, respectivamente).
Muestreo relativo:
Muestreo con trampas cromoatrayentes. Aleurothrixus floccosus
Este estudio muestra que para las moscas blancas existió un descenso de la población del año 2009 al 2010 (Tabla 2, Fig. 2). En 2009 la mayor captura de adultos de A. floccosus se registró en el sector de Miraflores Bajo (menor cobertura) en marzo y abril, con 5,25 ± 0,73 adultos·cm-2 y 5,25 ± 0,90 adultos·cm-2, respectivamente. En el sector de San Lorenzo (el de mayor cobertura) las mayores capturas se registraron en abril y mayo con 4,45 ± 0,68 adultos·cm-2 y 3,00 ± 0,45 adultos·cm-2, respectivamente. En el sector de Miraflores (cobertura intermedia) la mayor captura se registró en agosto con 3,50 ± 0,40 adultos·cm2. El año 2010, el número mayor de adultos de A. floccosus se capturó en el sector de Miraflores Bajo en abril y febrero (3,43 ± 0,41 y 3,25 ± 0,48 adultos·cm-2, respectivamente). En el sector de Miraflores el máximo de captura fue en enero con 1,90 ± 0,42 adultos·cm-2 y por último en el Sector de San Lorenzo, el máximo de capturas de adultos de A. floccosus se registró en agosto con 1,35 ± 0,28 adultos·cm-2.
Tabla 2 Número (media ± EE1) de adultos de Aleurothrixus floccosus, Cales noacki, Signiphora sp., Eretmocerus paulistus y Amitus spiniferus colectados en trampas amarillas pegajosas en árboles de Citrus sinensis cultivados en tres huertos con distinto manejo del cultivo en el Oasis de Pica, Desierto de Atacama, Chile. Período 2009-2010.
| Sector | Aleurothrixus floccosus | Cales noacki | Signiphora sp. | Eretmocerus paulistus | Amitus spiniferus | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | 2009 | 2010 | |
| Miraflores2 | 2,20 ± 0,11 b3 | 0,95 ± 0,07 b | 0,24 ± 0,04 b | 0,19 ± 0,02 a | 0,39 ± 0,05 b | 0,34 ± 0,05 b | 0,34 ± 0,04 a | 0,15 ± 0,02 a | 0,02 ± 0,01 a | 0,00 ± 0,00 a |
| San Lorenzo4 | 1,31 ± 0,09 c | 0,51 ± 0,04 c | 0,15 ± 0,03 b | 0,11 ± 0,02 b | 0,31 ± 0,04 b | 0,08 ± 0,01 c | 0,41 ± 0,04 a | 0,16 ± 0,02 a | 0,01 ± 0,01 a | 0,01 ± 0,01 a |
| Miraflores Bajo5 | 2,99 ± 0,14 a | 1,56 ± 0,08 a | 0,01 ± 0,00 a | 0,03 ± 0,02 c | 1,12 ± 0,13 a | 0,58 ± 0,08 a | 0,37 ± 0,04 a | 0,23 ± 0,02 a | 0,01 ± 0,01 a | 0,00 ± 0,00 a |
| F | 69,65 | 64,43 | 23,14 | 32,81 | 32,33 | 44,42 | 1,56 | 2,55 | 0,29 | 0,80 |
| P-valor | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | 0,2108 | 0,0786 | 0,7483 | 0,4481 |
1 EE: Error estándar. 2 Con marco de plantación y con poda. 3 Medias con diferentes letras minúsculas dentro de cada columna son significativamente diferentes de acuerdo a la prueba de Tukey (P < 0,05). 4 Sin marco de plantación y sin poda. 5 Mixto.
Cales noacki
Las capturas más altas de adultos de C. noacki registradas el año 2009 en los tres sectores fueron: San Lorenzo con 1,25 ± 0,29 adultos·cm-2 en marzo; seguido de Miraflores Bajo con 1,00 ± 0,38 adultos·cm-2 y por último Miraflores registró, en abril, una captura máxima promedio de 0,95 ± 0,28 adultos·cm-2 (Tabla 2). El año 2010 las capturas máximas de C. noacki, por sector, fueron: Miraflores con 0,38 ± 0,12 adultos·cm-2 en agosto; San Lorenzo con 0,33 ± 0,17 adultos·cm-2 en marzo y Miraflores Bajo con 0,20 ± 0,20 adultos·cm-2 en marzo.
Eretmocerus paulistus
Registró un promedio máximo en marzo del 2009 en el sector de San Lorenzo con 1,25 ± 0,29 adultos·cm-2, en Miraflores Bajo se registró un promedio máximo, en abril del 2009, de 1,00 ± 0,38 adultos·cm-2 y en Miraflores se registró un promedio máximo de 0,95 ± 0,28 adultos·cm-2 en marzo del 2009 (Tabla 2). El año 2010 la captura máxima fue en el sector Miraflores Bajo en abril con 0,45 ± 0,11 adultos·cm-2; en San Lorenzo la máxima captura promedio fue de 0,38 ± 0,09 adultos·cm-2 en agosto y en Miraflores fue de 0,33 ± 0,08 adultos·cm-2 en abril.
Amitus spiniferus
La captura de A. spiniferus en los dos años y en los tres sectores muestreados fue la más baja de los parasitoides estudiados. No hubo diferencias significativas entre los tres sectores para los años 2009 (F(2,894) = 0,29, P = 0,7483) y 2010 (F(2,1.434 ) = 0,80, P = 0,4481) (Tabla 2). La mayor captura se registró el mes de agosto del 2009 en el sector de Miraflores con 0,10 ± 0,05 adultos·cm-2; en los sectores de Miraflores Bajo y San Lorenzo, se registró el mismo nivel de captura de 0,08 ± 0,04 adultos·cm-2 en junio y agosto del 2009, respectivamente. El año 2010 la mayor captura se registró en el sector de San Lorenzo (0,05 ± 0,05 adultos·cm-2 el mes de agosto). En los sectores de Miraflores Bajo y Miraflores se registró el mismo nivel máximo de capturas (0,03 ± 0,03 adultos·cm-2) en los meses de enero y abril, respectivamente.
Signiphora sp
En cuanto a Signiphora sp, los muestreos de adultos mostraron diferencias significativas entre los tres sectores, tanto para el año 2009 (F(2,1.374) = 32,33, P < 0,0001) como para el 2010 (F(2, 1.434) = 44,42, P < 0,0001) (Tabla 2). Es importante destacar la alta captura de este hiperparasitoide en el sector de Miraflores Bajo la cual alcanzó un valor de 4,08 ± 1,02 adultos·cm-2. En San Lorenzo, en julio del 2009, la máxima captura de adultos de Signiphora sp. fue de 0,80 ± 0,27 adultos·cm-2. En Miraflores la máxima captura se registró en octubre con 0,68 ± 0,28 adultos·cm-2. En 2010 las máximas capturas se registraron en marzo, abril y mayo en el sector de Miraflores Bajo con el mismo nivel de 1,08 adultos·cm-2. En Miraflores la máxima cantidad de individuos capturados se registró en abril con 0,85 ± 0,31 adultos·cm-2. En San Lorenzo se registró un nivel máximo de 0,28 ± 0,09 adultos·cm-2 en agosto.
En resumen, la abundancia promedio de adultos de parasitoides capturados por trampas, integrando los tres sectores y los dos años de muestreo, de mayor a menor densidad es: Signiphora sp.: 0,47 ± 0,03 adultos·cm-2, E. paulistus: 0,27 ± 0,01 adultos·cm-2. C. noacki: 0,21 ± 0,01 adultos·cm-2 y A. spiniferus: 0,01 ± 0,00 adultos·cm-2.
Evaluación de parasitismo en ninfas y “pupas” de A. floccosus
Respecto al parasitismo de enemigos naturales de la mosca blanca, en la Figura 3 se muestra la acción de C. noacki, E. paulistus, A. spiniferus y Signiphora sp. sobre ninfas y “pupas” de A. floccosus. La cantidad de ninfas parasitadas disminuye en 2010 con respecto a 2009. El parasitismo de ninfas fue estadísticamente igual para los sectores de Miraflores y Miraflores Bajo y ambos fueron diferentes al sector de San Lorenzo, que registró el menor número de ninfas parasitadas (Tabla 3).
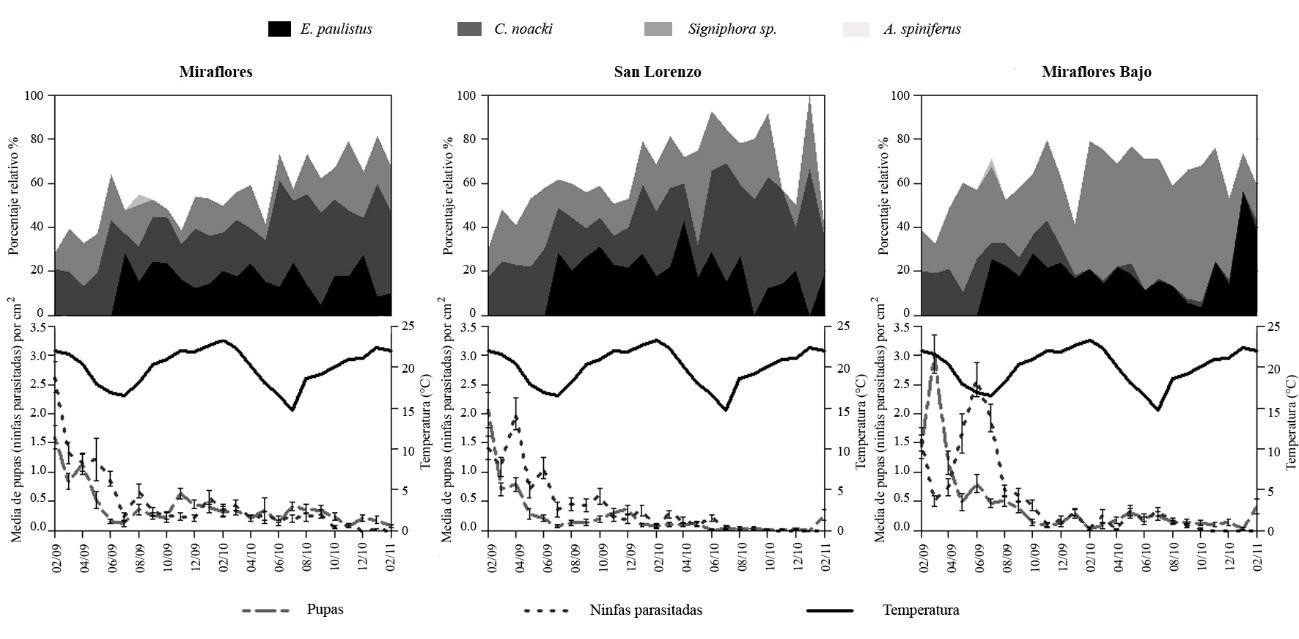
Figura 3 Número de ninfas de mosquita blanca parasitadas y porcentaje relativo de C. noacki, E. paulistus y A. spiniferus sobre A. floccosus e hiperparasitismo de Signiphora sp. en hojas de C. sinensis en tres huertos con distinto manejo de cultivo en el oasis de Pica. Período 2009-2010.
Tabla 3 Número (media ± EE1) de ninfas y “pupas” de Aleurothrixus floccosus parasitadas por Cales noacki, Eretmocerus paulistus, Amitus spiniferus y Signiphora sp. en hojas de Citrus sinensis cultivados en tres tipos de huertos en el Oasis de Pica, Desierto de Atacama, Chile. Período 2009-2010.
| Sector | Ninfas parasitadas | “Pupas” parasitadas por | |||||
|---|---|---|---|---|---|---|---|
| 2009 | 2010 | Total | C. noaki | E. paulistus | A. spiniferus | Signiphora sp. | |
| Miraflores2 | 0,79 ± 0,04 a3 | 0,16 ± 0,02 a | 0,47 ± 0,02 a | 0,21 ± 0,01 a | 0,11 ± 0,01 a | 0,00 ± 0,00 a | 0,12 ± 0,01 b |
| San Lorenzo4 | 0,71 ± 0,01 b | 0,07 ± 0,00 b | 0,39 ± 0,02 b | 0,12 ± 0,01 b | 0,07 ± 0,01 b | 0,00 ± 0,00 a | 0,10 ± 0,01 b |
| Miraflores Bajo5 | 0,87 ± 0,01 a | 0,11 ± 0,00 b | 0,48 ± 0,02 a | 0,12 ± 0,01 b | 0,13 ± 0,01 a | 0,00 ± 0,00 a | 0,30 ± 0,02 a |
| F | 8,01 | 15,05 | 13,57 | 44,16 | 18,19 | 2,72 | 65,10 |
| P-valor | 0,0003 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | 0,0662 | < 0,0001 |
1 EE: Error estándar. 2 Con marco de plantación y con poda. 3 Medias con diferentes letras minúsculas dentro de cada columna son significativamente diferentes de acuerdo a la prueba de Tukey (P < 0,05). 4 Sin marco de plantación y sin poda. 5 Mixto.
Al comparar el número de “pupas” parasitadas con las no parasitadas se observa que para el sector Miraflores no hubo diferencias significativas (V = 321360, P = 0,1327), las que sí se registraron para los sectores de San Lorenzo (V = 116030, P < 0,001) y Miraflores Bajo (V = 249840, P < 0,0001) (Tabla 4). Al analizar en forma conjunta las ninfas + “pupas” Se observaron diferencias significativas entre los tres sectores (Tabla 4) siendo Miraflores el que presentó el mayor número de ninfas+”pupas” parasitadas, seguido por Miraflores Bajo y por último San Lorenzo. También hubo diferencias significativas al comparar, para cada sector, el número de ninfas + “pupas” no parasitadas con las parasitadas (Miraflores: V = 2787500, P < 0,0001; San Lorenzo: V = 1272700, P < 0,0001; Miraflores Bajo: V = 2184900, P = 0,0001).
Tabla 4 Parasitismo total de ninfas y pupoides (media ± EE1) y eclosión de adultos (media ± EE) de Aleurothrixus floccosus en hojas de Citrus sinensis cultivado en tres huertos del Oasis de Pica, Desierto de Atacama, Chile. Período 2009-2010.
| Sector | Parasitismo total | Eclosión de adultos | ||||||
|---|---|---|---|---|---|---|---|---|
| Ninfas | “Pupas” | Ninfas + “Pupas” | ||||||
| No parasitadas | Parasitadas | No parasitadas | Parasitadas | No parasitadas | Parasitadas | A. floccosus | Parasitoides | |
| Miraflores2 | 6,63 ± 0,18 Ab3 | 0,47 ± 0,02 Bb | 0,39 ± 0,02 Ab | 0,43 ± 0,02 Ab | 7,02 ± 0,19 Ab | 0,89 ± 0,033 Bb | 0,46 ± 0,02 Bb | 0,83 ± 0,04 Ab |
| San Lorenzo4 | 4,05 ± 0,141 Aa | 0,39 ± 0,022 Ba | 0,25 ± 0,02 Aa | 0,27 ± 0,02 Ba | 4,29 ± 0,14 Aa | 0,66 ± 0,03 Ba | 0,24 ± 0,02 Ba | 0,62 ± 0,031 Aa |
| Miraflores Bajo5 | 6,63 ± 0,21 Ac | 0,48 ± 0,02 Bb | 0,44 ± 0,02 Ab | 0,53 ± 0,03 Bb | 7,07 ± 0,22 Ac | 1,01 ± 0,04 Bc | 0,64 ± 0,031 Bc | 1,65 ± 0,06 Ac |
| Valor F | 111,36 | 13,57 | 50,64 | 38,67 | 112,60 | 44,35 | 54,02 | 46,58 |
| P-value | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 |
1 EE: Error estándar. 2 Con marco de plantación y con poda. 3 Medias con diferentes letras mayúsculas en la misma fila y para cada ítem, son significativamente diferentes de acuerdo a la prueba de Wilcoxon (P < 0,05). Medias con diferentes letras minúsculas dentro de cada columna son significativamente diferentes de acuerdo a la prueba de Tukey (P < 0,05). 4 Sin marco de plantación y sin poda. 5 Mixto.
Finalmente, se examinaron las exuvias ninfales vacías como signos de parasitación. La típica forma de letra “T” del agujero de salida en la ninfa indica la emergencia de un adulto de la mosca blanca, mientras que la emergencia de un parasitoide se corresponde a un agujero circular. La emergencia de adultos de A. floccosus desde sus propias exuvias fue diferente entre los tres sectores (Tabla 5) produciéndose la mayor eclosión de adultos en el sector de Miraflores Bajo y la menor en San Lorenzo. En cuanto a la emergencia de parasitoides, también fue diferente entre los tres sectores, registrándose en Miraflores Bajo la emergencia y en San Lorenzo la menor eclosión de adultos. También se registraron diferencias significativas para los tres sectores al comparar la eclosión de A. floccosus y parasitoides (Tabla 4) (Miraflores: W = 23804000; P < 0,0001; San Lorenzo: W = 23794000; P < 0,0001; Miraflores Bajo: W = 23637000; P < 0,0001). La mayor emergencia de parasitoides se registró en Miraflores Bajo y la menor en San Lorenzo.
Tabla 5 Número (media ± EE1) de “pupas” de Aleurothrixus floccosus sanas y parasitadas por Cales noacki, Eretmocerus paulistus, Signiphora sp. y Amitus spiniferus en hojas de Citrus sinensis cultivado en tres huertos con distinto manejo del cultivo del Oasis de Pica, Desierto de Atacama, Chile. Período 2009-2010.
| Sector | No parasitada | Parasitada | F | P-valor | ||||
|---|---|---|---|---|---|---|---|---|
| Total | C. noacki | E. paulistus | Signiphora sp. | A. spiniferus | ||||
| Miraflores2 | 0,39 ± 0,02 b3 | 0,43 ± 0,02 b | 0,21 ± 0,01 bA4 | 0,11 ± 0,01 bB | 0,12 ± 0,01 aB | 0,00 ± 0,00 aC | 132,54 | < 0,0001 |
| San Lorenzo5 | 0,25 ± 0,02 a | 0,27 ± 0,02 a | 0,12 ± 0,01 aA | 0,07 ± 0,01 aB | 0,10 ± 0,01 aB | 0,00 ± 0,00 aC | 80,83 | < 0,0001 |
| Miraflores Bajo6 | 0,44 ± 0,02 b | 0,53 ± 0,03 b | 0,12 ± 0,01 aB | 0,13 ± 0,01 bB | 0,30 ± 0,02 bA | 0,00 ± 0,00 aC | 146,12 | < 0,0001 |
| F | 50,64 | 38,67 | 44,16 | 18,19 | 65,10 | 2,72 | ||
| P-valor | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | 0,0662 | ||
1 EE: Error estándar. 2 Con marco de plantación y con poda. 3 Medias con diferentes letras minúsculas dentro de cada columna son significativamente diferentes de acuerdo a la prueba de Tukey (P < 0,05). 4 Medias con diferentes letras mayúsculas en la misma fila y para cada ítem, son significativamente diferentes de acuerdo a la prueba de Wilcoxon (P < 0,05). 5 Sin marco de plantación y sin poda. 6 Mixto.
Análisis de correlaciones
Los resultados de las correlaciones entre la cantidad de adultos capturados en trampas y los conteos de los diferentes estadios de A. floccosus en hojas de C. sinensis son mostrados en la Tabla 6.
Tabla 6 Correlaciones entre la cantidad de adultos capturados en trampas amarillas pegajosas y los conteos de los diferentes estadios de Aleurothrixus floccosus realizados en hojas de Citrus sinensis cultivados en tres huertos con distinto manejo del cultivo en el Oasis de Pica, Desierto de Atacama, Chile. Febrero de 2009- febrero de 2011.
| Adultos/Sector | Huevos | Ninfa 1 | Ninfa 2 | Ninfa 3 | Ninfa 4 temprana | Total Ninfas | "Pupas" |
|---|---|---|---|---|---|---|---|
| Miraflores 1 | 0,42752 | 0,3694 | 0,3313 | 0,3287 | 0,1639 | 0,3567 | 0,5811 |
| 0,03313 | 0,0692 | 0,1057 | 0,1086 | 0,4336 | 0,0801 | 0,0023 | |
| San Lorenzo 4 | 0,6126 | 0,421 | 0,4668 | 0,4051 | 0,3702 | 0,4832 | 0,5387 |
| 0,0011 | 0,0361 | 0,0187 | 0,0445 | 0,0685 | 0,0144 | 0,0055 | |
| Miraflores Bajo 5 | 0,1735 | 0,2566 | 0,5007 | 0,6174 | 0,5061 | 0,5343 | 0,4975 |
| 0,4069 | 0,2156 | 0,0108 | 0,001 | 0,0099 | 0,0059 | 0,0114 |
1 Con marco de plantación y con poda. 2 Coeficiente de correlación de Spearman. 3 Probabilidad >ǀRǀ bajo Ho: Rho = 0. 4 Sin marco de plantación y sin poda. 5 Mixto.
En el sector de Miraflores el coeficiente de Spearman varió entre 0,16 y 0,58, siendo significativo (P < 0,05) sólo para huevos y “pupas”. En el sector de San Lorenzo el coeficiente de Spearman varió entre 0,37 y 0,61, siendo significativo (P < 0,05) para huevos, ninfa1, ninfa2, ninfa3, ninfas totales y “pupas”. En Miraflores Bajo el coeficiente de Spearman varió entre 0,17 y 0,62 siendo significativo (P < 0,05) para todos los estadios ninfales.
Los resultados de las correlaciones entre los parasitoides adultos capturados en trampas y los conteos de ninfas y “pupas” parasitadas de A. floccosus en hojas de C. sinensis son mostrados en la Tabla 7. Los adultos C. noacki se correlacionaron significativamente (P≤ 0,05) sólo con ninfas parasitadas en el Sector de Miraflores. Los adultos E. paulistus se correlacionaron significativamente (P ≤ 0,05) tanto con ninfa como con “pupas” parasitadas en los tres sectores. Los adultos de Signiphors sp. Se correlacionaron significativamente (P ≤ 0,05) con ninfas parasitadas en los sectores de San lorenzo y Miraflores Bajo; y con “pupas” parasitadas en los mismos sectores. Por último, los adultos de A spiniferus no se correlacionaron (P ≤ 0,05) ni con ninfas ni con “pupas” de A. floccosus.
Tabla 7 Correlaciones entre la cantidad de parasitoides adultos capturados en trampas amarillas pegajosas y los conteos de ninfas y “pupas” parasitadas de Aleurothrixus floccosus realizados en hojas de Citrus sinensis cultivados en tres huertos con distinto manejo del cultivo en el Oasis de Pica, Desierto de Atacama, Chile. Período 2009-2010.
| Sector | Cales noacki | Eretmocerus paulistus | Signiphora sp. | Amitus spiniferus |
|---|---|---|---|---|
| Ninfas parasitadas de Aleurothrixus floccosus | ||||
| Miraflores 3 | - 0,4980¹ | 0,6940 | 0,3413 | 0,1951 |
| 0,0113² | 0,0001 | 0,0950 | 0,3501 | |
| San Lorenzo 4 | - 0,2046 | 0,7064 | 0,7577 | 0,0309 |
| 0,3266 | 0,0001 | 0,0000 | 0,8834 | |
| Miraflores Bajo 5 | 0,1056 | 0,5905 | 0,6989 | 0,2868 |
| 0,6153 | 0,002 | 0,0001 | 0,1645 | |
| "Pupas" parasitadas de Aleurothrixus floccosus | ||||
| Miraflores 3 | - 0,12851 | 0,5119 | 0,1965 | - 0,2134 |
| 0,54042 | 0,0089 | 0,3464 | 0,3058 | |
| San Lorenzo 4 | - 0,1486 | 0,4219 | 0,4286 | - 0,1889 |
| 0,4785 | 0,0357 | 0,0325 | 0,3657 | |
| Miraflores Bajo 5 | 0,0434 | 0,6421 | 0,6520 | 0,2475 |
| 0,8367 | 0,0005 | 0,0004 | 0,2330 | |
¹ Coeficiente de correlación de Spearman. ² Probabilidad >ǀRǀ bajo Ho: Rho = 0. 3 Con marco de plantación y con poda. 4 Sin marco de plantación y sin poda. 5 Mixto.
Discusión
La mosca blanca algodonosa de los cítricos, A. floccosus, es una plaga nativa de los trópicos y subtrópicos del Nuevo Mundo; los estudios sobre su taxonomía, historia y distribución así lo indican (Myartseva et al. 2012). La composición poblacional mostrada por A. floccosus, indica que en el Oasis de Pica persisten todos los estadios ninfales durante todo el año. Estos resultados revelan el alto potencial que tiene esta plaga, ya que prácticamente no prevalecen las formas de invernación y la ovipostura permanece constante a través del tiempo. Lo anterior es confirmado por Luppichini et al. (2008), quienes indican que en el norte de Chile pueden registrarse elevadas poblaciones en pleno invierno (junio, julio y agosto) con el consiguiente daño durante la principal época de cosecha. Estos mismos autores informan que en las tres regiones más septentrionales de Chile existe una reproducción continua de A floccosus durante todo el año, constituyéndose en uno de los principales problemas del cultivo de cítricos. Este fenómeno es consecuencia de las condiciones climáticas, especialmente, las altas temperaturas que se registran en el Oasis de Pica, las cuales, en promedio, durante los dos años del estudio fue-ron superiores a los 14 °C. Los mismos autores señalan una fecundidad promedio de 49,1 huevos/hembra (ciclo iniciado en diciembre) y de 53,4 huevos/hembra (ciclo iniciado en octubre) de A. floccosus sobre limonero var. Eureka. Paulson y Beardsley (1986), señalan valores promedio de 53,2 ± 9,3 huevos por hembra de A. floccosus sobre plántulas de limón dentro de jaulas cubiertas con nylon con una temperatura que fluctuó entre 17,0 y 28,5 °C y una humedad relativa que varió entre 40 y 85 %. Tello et al. (2014) registraron una fecundidad de 73,3 huevos por hembra para A. floccosus colectado en Pica y alimentado con C. sinensis.
Es importante considerar que los menores niveles de infestación se obtuvieron en el sector de San Lorenzo, que es la zona de máxima cobertura. Esta cobertura diferenciada entre los sectores podría constituir una importante barrera para los organismos en un hábitat en específico, dado por el tipo de vegetación adyacente, su cobertura, etc. (Myers et al. 2000).
Durante 2010 las poblaciones de mosca blanca se mermaron especialmente en el segundo semestre en los sectores San Lorezo y Miraflores, posiblemente atribuible a los lavados masivos mencionados. En las parcelas comerciales de cítricos donde existe “monocultivo” (Miraflores Bajo) la tendencia fue encontrar una mínima presencia de C. noacki, una mayor de E. paulistus y aun mayor presencia de Signiphora sp. Mientras que las zonas donde existe una mayor cobertura (Miraflores y San Lorenzo), se presentó un aumento de C. noacki. Es factible que estas diferencias sean producto de los microclimas que produce el grado de cobertura. Además, los resultados pueden ser explicados por distintos mecanismos, incluyendo cambios, perturbaciones históricas, condiciones climáticas, estabilidad del medioambiente, heterogeneidad u homogeneidad del hábitat, productividad y relaciones interespecíficas, etc. (Gaston 2000; Andrew y Hughes 2005).
El cociente entre el total de insectos en forma de ninfa de primera edad, o de “pupas”, y el número total de huevos (individuos que inician el desarrollo), puede considerarse como indicador aproximado de la mortalidad que se produce en el paso de huevo a primer estadio ninfal o de la mortalidad a lo largo del desarrollo completo, respectivamente. Estos resultados son algo menor a los descrito por Soto et al. (2001), quienes registraron una mortalidad promedio de huevo a ninfa1 de 88 % y de huevo a “pupa” superior al 95 %. Carrero y Tarancón (1979) observaron que los estadios más sensibles son los de huevo y ninfas de primer y segundo estadio, encontrando una mortalidad natural de hasta el 75 % en huevos.
El número máximo de adultos de A. floccosus capturados por las trampas adhesivas fue de 5,3 adultos·cm-2 muy por debajo a lo obtenido por Santaballa et al. (1980), quienes reportaron un máximo promedio de 4.500 adultos por 1,5 dm2 (20 adultos·cm-2). Estos mismos autores registraron una captura máxima promedio de 3.750 adultos de C. noacki por 1,5 dm2 (16,7 adultos·cm-2) muy superior a la obtenida en nuestro estudio (1,3 adultos·cm-2). Esta baja densidad de C. noacki puede deberse a la acción del hiperparásito Signiphora sp. (Ripa et al. 1999). La presencia muy marginal de A. spiniferus en el Oasis de Pica puede deberse a su baja adaptación a las condiciones climáticas imperantes en esta localidad, sobre todo la baja humedad relativa, factor que para este parasitoide es clave para su supervivencia (Rojas 2005). Los niveles poblacionales de E. paulitus, levemente superiores a C. noacki pueden deberse a la preferencia de Signiphora sp. por parasitar a C. noacki y A. spiniferus (Luppichini et al. 2008).
En cuanto a parasitismo, verificado por la salida del parasitoide (cualquiera de ellos) desde las exuvias “pupas” de A. floccosus, en el Oasis de Pica, varió entre 11,3 y 13,3 %. Estos bajos valores de parasitismo contradicen lo encontrado para esta plaga, con porcentajes de 95,0 % de reducción en California (Debach y Rose 1976) y de 99,5 % (Rose y Woolley 1984; Guerrieri y Viggiani 1988). Los resultados presentados se asemejan a los niveles de parasitismo encontrados por Soto et al. (2001) para Encarsia strenua (Silvestri, 1927) (Hemiptera: Aphelinidae) sobre A. floccosus, con porcentajes de parasitismo muy bajos, no superando en la mayoría de los casos el 20 %. Otros autores como Yerliyaya et al. (2016), indican que el parasitismo ejercido por C. noacki sobre ninfas + “pupas” de A. floccosus fue de 27,2 % en Turquía.
Con respeto a las trampas pegajosas amarillas, éstas se introdujeron como una herramienta de monitoreo en la década de 1980 y en la actualidad se utilizan en diferentes especies de plagas voladoras en cultivos de campo y de invernadero (Pinto-Zevallos y Vänninen 2013). La aplicación de trampas en el monitoreo de A. floccosus está bien documentada (Katsoyannos et al. 1997; Soto et al. 1999, 2001; Ulusoy et al. 2003). Con respecto a la relación entre ninfas y adultos de A. floccosus, los resultados obtenidos en este estudio coinciden con los de Soto-Sánchez et al. (2004) quienes encontraron correlaciones significativas entre adultos de A. floccosus capturados en trampas pegajosas amarillas y los estados ninfales presentes en las hojas de naranjo dulce cultivado en Valencia (España). De acuerdo a estos autores, dicha correlación, parece estar muy influida por la estación y por la intensidad de brotación. En cuanto a la relación entre parasitoides adultos y ninfas de A. floccosus, los resultados de este estudio coinciden con los obtenidos por Santaballa et al. (1980) quienes determinaron que la evolución de las curvas del porcentaje de parasitismo (me-dido en hojas) se correspondía con las de adultos de C. noacki capturados en trampas en cítricos cultivados en Valencia (España).
Conclusiones
En el Oasis de Pica, los diferentes estadios de A. floccosus, se distribuyen a lo largo de todo el año. Los tres sectores muestreados, seleccionados por presentar condiciones de manejo del cultivo diferentes, presentaron distintos niveles poblacionales de A. floccosus. Se corroboró una alta mortalidad en el paso de huevos a la primera ninfa migratoria (> 60 %) y también de huevo a “pupa” (> 90 %). De los parasitoides presentes en Pica, el hiperparasitoide Signiphora sp., es el que presenta mayor densidad poblacional. Este signifórido podría estar afectando la capacidad reproductiva de C. noacki, cuya acción, sumada a la de E. paulistus y A. spiniferus apenas logran un porcentaje promedio de parasitismo < 15 %. Amitus spiniferus es un eficiente parasitoide platygástrido pero en Pica, presenta muy baja densidad y un escaso porcentaje de parasitismo, al contrario de E. paulistus, afelínido no registrado anteriormente en este Oasis y que podría ser utilizado, a través de crianzas masivas, como un agente de control biológico de A. floccosus. Estudios de parasitismo de E. paulistus, incluyendo el efecto que pudiera tener Signiphora sp. sobre esta avispa, son necesarios para evaluar su verdadero potencial como biocontrolador de las poblaciones de la mosquita blanca de los cítricos.