Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.21 no.3 Medellín July/Sept. 2008
Comunicaciones breves
Simplificación de la fertilización de ovocitos durante la producción in vitro de embriones bovinos¶
Simplification of oocytes fertilization during in vitro production of bovine embryos
Simplificação da fecundação de oócitos durante produção in vitro de embriões de bovinos
Rodrigo Urrego1*, Zoot, MS; Ariel Tarazona2, 3 Zoot, MS; Martha Olivera Ángel4, MV, Dr. Sci. Agr; Omar Camargo2, 4 MVZ, MS.
1Grupo INCA-CES. Facultad de Medicina Veterinaria y Zootecnia. Universidad CES. Medellín, Colombia.
2Grupo de Biotecnología Animal, y 3DPA/FCA/BIOGEM Universidad Nacional de Colombia sede Medellín. Medellín, Colombia.
4Biogénesis, Facultad de Ciencias Agrarias, Universidad de Antioquia. Medellín, Colombia.
(Recibido: 14 enero, 2008; aceptado: 21 julio, 2008).
Resumen
El objetivo de este estudio fue evaluar un nuevo procedimiento de fertilización in vitro (FIV) de ovocitos bovinos, en el cual se omitió la centrifugación de los espermatozoides para los procesos de lavado y selección espermática. Dentro de cada uno de los pozos de los platos convencionales de cuatro pozos (pozos externos) se introdujo un nuevo pozo más pequeño (pozos internos) de aproximadamente 50 μl hecho en material de vidrio (0.3 mm de alto por 0.8 mm de diámetro). El procedimiento consistió en llenar los pozos interno y externo con 700 μl de medio de fertilización, hasta que el pozo interno quedara cubierto de medio, luego se depositaron 10 CCOs por pozo interno; luego 30 μl de semen previamente descongelado se depositaron en el fondo del pozo externo. Después de una hora se removió todo el contenido del pozo externo y se dejó el contenido del pozo interno con el medio y las células germinales por un periodo de incubación de 16 h. Los presuntos cigotos fueron cultivados en medio CR1aa por un periodo de siete días con un cambio de medio a las 72h. Como control, se utilizó un gradiente de Percoll 45-90% para la selección espermática. La tasa de de ovocitos divididos fue de (70.8 vs. 73.1) y la proporción de ovocitos que llegaron al estadio de morúla y blastocisto fue de (18.8 vs. 20.3), respectivamente. Los resultados obtenidos con la nueva propuesta metodológica son similares a los obtenidos con la metodología convencional (p<0.05). Estos resultados indican que ambos métodos producen resultados similares pero la nueva propuesta metodológica permite ahorrar tiempo, es menos laboriosa, consume menos reactivos y permite reducir la manipulación de las células espermáticas con buenos efectos eventuales en el mejoramiento de los procedimientos de reproducción in vitro.
Palabras clave: centrifugación de espermatozoides, embriones bovinos, fertilización in vitro
Summary
This study was conducted to evaluate an in vitro fertilization (IVF) procedure that avoids the washing-selection-centrifugation of spermatozoa prior to coincubation with oocytes. A special dish was constructed as follows: in the middle of each of the 4-wells of a conventional plastic dish (larger wells), another little (≈50 μl) glass dish (inner well) was placed (0.3 mm-tall x 0.8 mm in diameter), in such a way that when the larger plate was filled with 700 μl of IVF media (Fert–TALP), the inner well was also filled up to overflowing. Ten in vitro matured oocytes were set into the inner well, and 30 μl of thawed semen were placed on the bottom of the outer well. After one hour of incubation, the media from the outer well was removed, and the well with the remaining media and the germ cells, were incubated for 16 hours. Presumptive zygotes were cultured in a CR1aa media for seven days with a culture media replace at 72 h. As a control, a conventional IVF, using the classical 45%-90% Percoll gradient selection, was carried out. The cleavage rates (70.8 vs. 73.1) and the proportion of oocytes reaching morula and blastocyst stages (18.8 vs. 20.3) by the “easy-IVF” were similar to the results obtained by the classical method (p<0.05). These results indicate that the two methods yield similar results but the “easy-IVF” definitely saves time, human effort, reagents, and after all reduces the manipulation of the sperm with eventual good effects in the long run toward improving in vitro reproduction procedures.
Key words: bovine embryos, in vitro fertilization, sperm centrifugation
Resumo
O objetivo deste estudo foi avaliar um novo procedimento de fertilização in vitro (FIV) de oócitos bovinos, que foi omitida na centrífuga esperma lavar os processos de seleção e de esperma. Dentro de cada um dos poços pratos convencionais quatro poços (poços externa) um novo bem menor (poços internos) cerca de 50 μl fato em vidro (0,3 mm de altura por 0,8 mm de diâmetro) foram introduziu. O procedimento foi de encher poços interna e externamente com 700 μ l meio de fertilização, até que a fossa foi coberto por meios internos e, em seguida, depositadas 10 CCOs em poços internos; então 30 μl previamente descongelados sêmen foi depositado no fundo da cova fora. Depois de uma hora é retirada a todo o conteúdo da cova, e foi deixada fora da doméstica no conteúdo do bem com o ambiente e células germinativas por um período de incubação de 16 h. A alegada zygotes foram cultivados em meio CR1aa por um período de 7 dias com uma mudança no meio-72h. Como um controle, utilizado uma gradiente de Percoll 45-90% de selecção de espermatozóides. A taxa de oócitos foi dividida (70.8 vs 73.1) e da proporção de oócitos que atingiu o estádio e foi Mórula blastocisto (18.8 vs 20.3), respectivamente. Os resultados obtidos com a nova metodologia proposta são semelhantes aos obtidos com a metodologia convencional (p<0.05). Estes resultados indicam que ambos os métodos produzem resultados semelhantes, mas a nova proposta metodológica economiza tempo, é menos trabalhoso, consome menos reativo e reduzem a manipulação de células espermáticas com bons potenciais efeitos na melhoria dos procedimentos reprodução in vitro.
Palavras chave: centrifugação de sêmen, embriões bovinos, fertilização in vitro
Introducción
La producción in vitro de embriones bovinos (PIVE), ha demostrado ser una tecnología reproductiva con una positiva relación costo-beneficio; por ejemplo, para la industria lechera de Nueva Zelanda la PIVE y el sexado de embriones representa en términos económicos un ingreso adicional por año de más de ochocientos mil dólares. En otros países como Holanda (Holland Genetics), Inglaterra (Genus), Italia (CIZ), Francia (UNCEIA), Canadá (DELTA) y Estados Unidos (EMTRAM), por citar algunos, se viene aplicando esta tecnología en forma comercial por las compañías referidas en paréntesis (26). Básicamente, la PIVE comprende tres pasos: 1) la maduración in vitro de los ovocitos (MIV) obtenidos de ovarios por medio de aspiración folicular, 2) la fertilización in vitro (FIV) de los ovocitos madurados y 3) el cultivo in vitro (CIV) de embriones. En el mejor de los casos, aproximadamente el 40% de los ovocitos sometidos a la MIV alcanzan el estado de blastocisto, lo cual se ha convertido en el cuello de botella más importante de esta biotecnología (2, 3). Sin embargo, al modificar algunos procedimientos dentro de la PIVE como la tensión de oxígeno durante la incubación (21), la duración en la maduración, el tiempo de coincubación de los gametos, la concentración espermática (27) y el método para seleccionar los espermatozoides (17), se pueden mejorar las tasas de desarrollo embrionario.
Con la finalidad de aumentar las tasas de desarrollo embrionario, uno de los pasos que frecuentemente es sometido a modificaciones en la PIVE es la FIV. In vivo, el proceso de fertilización se lleva a cabo cuando las células espermáticas de un eyaculado fresco son activadas en el tracto genital femenino durante un proceso llamado capacitación, el cual consiste en una serie de cambios moleculares que hacen al espermatozoide competente para la fertilización. Una vez capacitadas, las células espermáticas adquieren un movimiento hipermóvil y además, son capaces de unirse a la matriz extracelular del ovocito. La unión del espermatozoide a la zona pelúcida (ZP) produce la reacción acrosómica que implica múltiples fusiones entre la membrana acrosomal externa y la membrana plasmática, lo que conlleva que se libere el contenido acrosomal, ocurra la penetración del espermatozoide a través de la ZP y la fusión de este con la membrana plasmática u oolema del ovocito (6, 7, 9).
Generalmente, en la FIV bovina se utiliza semen de alta calidad que ha sido previamente congelado, lo que implica someter a los espermatozoides a un procedimiento de lavado y selección en el cual, los de mejor movilidad son separados del plasma seminal, de los muertos e inmóviles, de los diluyentes y crioprotectores y de otras estructuras por medio de técnicas como el Swim up y el gradiente de percoll. En el Swim up, se seleccionan los espermatozoides en virtud de su movilidad intrínseca; para ello, el semen es depositado en el fondo de un tubo de ensayo con el medio adecuado y se incuban por espacio de una hora. Sólo los espermatozoides con mejor movilidad nadarán hacía arriba de tal manera que al momento de retirar el contenido de la parte superior del tubo se estarán seleccionando los espermatozoides vivos y con movilidad rectilínea progresiva. De otro lado, en el gradiente de percoll los espermatozoides se seleccionan en virtud de su velocidad potencial y su relativa alta densidad; en esta técnica se pone el semen en la parte superior del percoll, el cual posee una concentración diferencial de 45 y 90%, diluidas en medio de capacitación, y posteriormente se procede a la centrifugación. Al fondo van las células más densas (espermatozoides vivos) y en las fases del gradiente van quedando los espermatozoides muertos o de baja movilidad, el plasma seminal y demás estructuras (5, 10, 14).
Las metodologías anteriormente mencionadas requieren como mínimo una centrifugación, paso fundamental en el lavado y selección de los espermatozoides, en el cual se puede generar daño a la membrana plasmática de los gametos masculinos (1, 17, 20) y aumentar la producción basal de radicales libres (1, 13, 22). Además de la correlación establecida entre la centrifugación y el incremento en la producción basal de especies reactivas del oxígeno (EROs) y sus efectos adversos sobre membrana plasmática y ADN, también se ha asociado con la activación de proteinasas en el acrosoma, la cual conlleva una reacción acrosomal prematura (19, 20) que hace inviable a la célula espermática para llevar a cabo el proceso de fertilización, pues tal situación inhabilita al espermatozoide para unir y penetrar la zona pelúcida con pretensiones de fertilizar (9). En consecuencia, y con el fin de optimizar la PIVE, en este trabajo se evaluó un nuevo proceso que simplifica la selección de espermatozoides en la FIV de ovocitos bovinos, en donde se omite el paso de la centrifugación debido a su asociación con efectos deletéreos sobre las células espermáticas.
Materiales y métodos
En el estudio se hizo una comparación entre las tasas de desarrollo embrionario obtenidas mediante un protocolo de PIVE convencional en el cual el lavado y selección de los espermatozoides para la FIV implican la centrifugación de los mismos (Tratamiento I) y un nuevo protocolo propuesto, en el cual se obvia el paso de la centrifugación (Tratamiento II). La metodología utilizada en el segundo tratamiento se basa en la aplicación del principio de migración sedimentación aplicado por Jondet et al (22) para aislar espermatozoides móviles, en este caso adaptado directamente a la FIV, no como un paso previo sino simultáneo.
Recolección de ovarios
Los ovarios de bovino fueron obtenidos de hembras sacrificadas en la Central Ganadera de Medellín, se depositaron en solución salina estéril a 35 °C y se transportaron durante 15-20 minutos al Laboratorio de Biología del Desarrollo de la Universidad de Antioquia. Una vez en el laboratorio, bajo condiciones asépticas se lavaron los ovarios tres veces con solución salina a 35 °C con el fin retirar el material contaminante, sangre y detritus. Luego, con jeringa de 10 ml provista de aguja N° 18 se procedió a la aspiración de los folículos que poseían un diámetro entre 4 y 8 mm y su contenido fue recolectado en un tubo cónico de 15 ml colocado en baño maría a 38 °C. Después de dejar sedimentar el aspirado por un espacio de 15 min se procedió bajo estereomicroscopio a la selección de los complejos cúmulos-ovocitos (CCO): se clasificaron como buenos, los ovocitos que poseían un cúmulos con capas múltiples de células de la granulosa, compacto pero translúcido, un ooplasma con granulación fina, densa y uniforme; como regulares, los ovocitos con un cúmulos ligeramente expandidos, con menor número de capas de células de la granulosa que pueden cubrir la mitad de la zona pelúcida y granulaciones ligeramente más gruesas; y como malos, a los ovocitos desnudos, pequeños, cúmulos muy oscuros, ooplasma de color muy negro. En la PIVE bovina, sólo los ovocitos clasificados como buenos producen buenas tasas de mórulas y blastocistos y son los que se seleccionaron para este estudio. Sin embargo, en algunos experimentos los ovocitos clasificados como regular son también incluidos dentro de los procesos in vitro (8, 15).
Maduración in vitro
Una vez obtenidos los CCOs se lavaron tres veces en medio TL-Hepes suplementado con 0.3% (W/V) de albúmina sérica bovina (BSA) y 0.2 mM de ácido pirúvico. Para el proceso de maduración se pusieron 10 CCOs en gotas de 50 μl de medio TCM-199 suplementado con 10% de SBF, 0.5 μg/ml de FSH, 0.5 g/ml de LH, 1 μg/ml de 17-β estradiol, 0.25 mM de ácido pirúvico. Las gotas fueron cubiertas con aceite mineral y preincubadas bajo condiciones de cultivo a 38.5 °C/2 h (mínimo)/5% de CO2 /humedad relativa del 99%. La maduración se realizó por un periodo de 24 horas (11).
Fertilización in vitro con percoll
Los CCOs previamente madurados fueron lavados tres veces con medio TL-Hepes suplementado con 0.3% (W/V) de BSA y 0.2 mM de ácido pirúvico; posteriormente fueron depositados en gotas de 44 µl de medio de fertilización basado en una solución Tyrodes lactato-piruvato suplementado con 0.6% de BSA (libre de ácidos grasos), 0.2 mM de ácido pirúvico, 100 IU/ml de penicilina y 50 μg/ml de estreptomicina. Después de la transferencia de los CCOs se adicionaron a cada gota 2 µl de heparina (concentración final 2 μg/ml) y 2 µl de PHE (2 mM de penicilamina, 1 mM de hipotaurina y 250 mM de epinefrina). Una pajilla de semen fue descongelada en baño maría a 35 °C/1 min y los espermatozoides móviles fueron obtenidos por centrifugación a 700 x g /10 min/temperatura ambiente. El condensado celular fue removido, resuspendido en TL-Hepes y centrifugado a 250 x g/5 min/temperatura ambiente; después de remover el sobrenadante los espermatozoides fueron resuspendidos en medio de fertilización. La concentración espermática fue determinada usando cámara de Neubauer (Boeco, Germany) y se le adiciononaron 2 µl de suspensión espermática a cada gota de fertilización a una concentración final de 1 x 106 espermatozoides/ml. Después de 18 horas de fertilización los presuntos cigotos fueron llevados a medio de desarrollo.
Fertilización in vitro con la nueva metodología
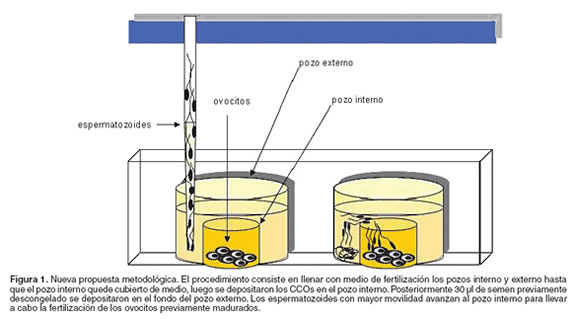
Para llevar a cabo la nueva propuesta metodológica para fertilizar los ovocitos bovinos se utilizaron cajas de cultivo de cuatro pozos. En cada pozo se introdujo otro pozo (de vidrio) más pequeño: 3 mm de alto x 8 mm de diámetro (1/3 de la altura y la mitad del diámetro del pozo original). El procedimiento consistió en llenar con medio de fertilización suplementado con 0.6% de BSA (libre de ácidos grasos), 0.2 mM de ácido pirúvico, 100 IU/ml de penicilina y 50 μg/ml de estreptomicina los pozos interno y externo del plato doble fondo hasta que el pozo interno quede cubierto de medio, las cajas se dejaron preincubando en condiciones de cultivo a 38.5 °C/5% de CO2/humedad relativa del 99%/ h (mínimo). Luego se depositaron los CCOs previamente madurados, que igualmente fueron lavados tres veces con medio TL-Hepes suplementado con 0.3% de BSA y 0.2 mM de ácido pirúvico; y además, se adicionaron heparina (concentración final 2 μg/ml) y PHE (2 mM de Penicilamina, 1 mM de Hipotaurina y 250 mM de Epinefrina). Posteriormente, se depositaron en el fondo del pozo externo 30 µl del semen previamente descongelado en baño maría a 35°C/1 min y se dejó por un tiempo de 1 hora en condiciones de cultivo para luego retirar el medio externo y dejar sólo la copa interna la cual contiene los CCOs y espermatozoides con una alta movilidad a una concentración final de 1 x 106 espermatozoides/ml por un periodo de 18 horas (véase Figura 1).
Cultivo in vitro de embriones
Pasadas las 18 horas de fertilización, los presuntos cigotos obtenidos por los dos métodos de fertilización previamente descritos, fueron lavados tres veces en medio TL-Hepes suplementado con 0.3% (W/V) de BSA (libre de ácidos grasos) y 0.2 mM de ácido pirúvico. Durante los lavados los cigotos fueron desnudados de sus células del cúmulos mediante repetidos lavados usando una pipeta de punta fina para luego ser llevados al medio de cultivo. El cultivo de los embriones fue llevado a cabo en medio de desarrollo CR1-AA, el cual posee una combinación de aminoácidos no esenciales (AANE) y aminoácidos esenciales (AAE) a una concentración de 10 y 20 μl/ml, respectivamente. Además, fue suplementado con 0.3% de BSA (libre de ácidos grasos), 0.2 mM de ácido pirúvico, 10% de SBF, 100 IU/ml de penicilina y 50 μg/ml de estreptomicina. Los presuntos cigotos fueron transferidos en grupos de 10 a gotas de 50 μl de medio de desarrollo cubiertas con aceite mineral y preincubadas por un tiempo mínimo de dos horas bajo las condiciones de cultivo. La división fue evaluada 48 horas post-inseminación y la tasa de mórulas y blastocistos fue evaluada al día siete de cultivo, después de 4 días de cultivo los embriones fueron transferidos a nuevas gotas de medio.
Análisis estadístico
La comparación entre el porcentaje de ovocitos desarrollados hasta morúla y blastocisto de ambos métodos para llevar a cabo la FIV bovina, se realizó mediante un análisis de varianza y una prueba de Fisher. El análisis estadístico fue realizado usando el paquete estadístico Statgraphics Plus, versión 4.1.
Resultados
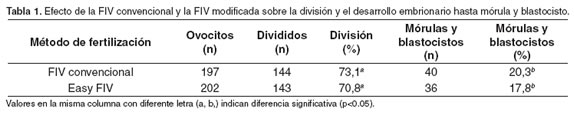
El análisis de resultados (véase tabla 1) mostró que no hubo diferencia estadística significativa (p>0.05) entre las variables estudiadas. No se encontró diferencia entre el porcentaje de ovocitos divididos y las tasas de desarrollo embrionario hasta los estadios de mórula y blastocisto en la FIV convencional donde está implícita la centrifugación de los espermatozoides y la nueva propuesta metodológica en la cual se omite la centrifugación.
Discusión
Con el surgimiento de la FIV y otras biotecnologías de reproducción asistida, la selección de espermatozoides ha comenzado a ser un importante procedimiento para obtener resultados óptimos. La selección de espermatozoides no sólo es necesaria para remover el plasma seminal y crioprotectores, sino que también es utilizada para obtener una fracción de espermatozoides con un mínimo de 70% de movilidad rectilínea progresiva de una muestra de semen que ha sido congelada y descongelada. Existen varios métodos para la selección de espermatozoides y la escogencia de uno de estos métodos depende no sólo de la obtención de espermatozoides móviles, sino también de la complejidad de la técnica, el material y equipo requerido, el tiempo y los costos (12). En el presente estudio, se comparó una nueva, rápida y fácil metodología para seleccionar los espermatozoides y fertilizar los ovocitos previamente madurados (véase Figura 1) con una metodología convencional para seleccionar los espermatozoides, el gradiente diferencial de percoll, el cual es más costoso.
Varios reportes indican que con la utilización del percoll se obtiene una fracción de espermatozoides cualitativamente superior con significativamente más movilidad, con mayor número de espermatozoides viables y morfológicamente normales en comparación con otros métodos (4, 14, 16). En el presente estudio los diferentes métodos para seleccionar los espermatozoides previo a la fertilización, tuvieron un efecto similar sobre las tasas de ovocitos divididos y de producción de mórulas y blastocistos (véase Tabla 1).
De acuerdo con Rodríguez-Martínez et al (18), la tasa de división es un mejor indicativo para evaluar una muestra de semen que las tasas de blastocistos, ya que el desarrollo embrionario temprano in vitro depende en gran medida de las condiciones de cultivo, mientras que la división no tanto. En este estudio, se utilizaron como parámetros de comparación tanto las tasas de división como las morúlas y blastocistos obtenidos y no hubo diferencia estadística significativa entre las dos metodologías utilizadas para llevar a cabo la selección y fertilización. Estos resultados indican que bajo las condiciones utilizadas en la nueva propuesta metodológica, un suficiente número de espermatozoides son capaces de migrar de la copa externa a la copa interna en la cual se encuentran los ovocitos previamente madurados y llevar a cabo la fertilización y un normal desarrollo embrionario hasta los estadios de morúla y blastocisto.
Una innovación de este tipo en los sistemas de cultivo de embriones son los sistemas de microcultivo en los cuales se combinan un pequeño volumen de medio en contacto directo con el embrión con un volumen de medio mayor circundante. En esencia, se busca generar un microambiente (hoyuelo) en el cual los factores embriotróficos son retenidos alrededor del embrión mientras que al mismo tiempo se facilita la difusión de pequeñas moléculas procedentes de un volumen de medio mayor periférico (pozo) (23). Este concepto fue desarrollado por Vajta et al (25) mediante el sistema llamado “Well of the well” (WOW), el cual consiste en una simple modificación en el fondo de los pozos de los platos Nunc de cuatro pozos a los que se les hace una pequeña perforación (sin traspasarlos) con una aguja caliente o un pequeño perforador en la cual se ubican uno o varios embriones dependiendo del tamaño de la misma.
En conclusión, los resultados del presente trabajo sugieren que la utilización de una nueva propuesta metodológica para la fertilización de ovocitos bovinos, en la cual se obvia la centrifugación de los espermatozoides y que se basa en la utilización de una caja de cuatro pozos doble fondo produce igual tasa de ovocitos fertilizados e igual tasa de morúlas y blastocistos que una metodología convencional en la cual los espermatozoides son seleccionados por percoll.
Agradecimientos
Los autores agradecen a la División de Investigaciones Medellín (DIME) por financiar este trabajo, además a los directores de los laboratorios de Biotecnología Animal y Biología Celular y Molecular de la Universidad Nacional de Colombia sede Medellín y a la directora del laboratorio Singamia de la Universidad de Antioquia por prestar sus instalaciones. Los autores también agradecen a la planta de procesamiento de semen de la Universidad Nacional, y al profesor Luis Emilio Trujillo, por proporcionarnos el material seminal.
Referencias
1. Aitken RJ, Clarkson S. Significance of reactive oxigen species and antioxidants in defining the efficacy of sperm preparation techniques. J Androl 1988; 9:367-376. [ Links ]
2. Blondin P, Sirard, MA. Oocyte and follicular morphology as determining characteristics for developmental competence in bovine oocyte. Mol Rep Dev 1995; 41:54-62. [ Links ]
3. Blondin P, Bousquet D, Twagiramungu H, Barnes F, Sirard MA. Manipulation of follicular developmental to produce developmentally competent bovine oocytes. Biol Reprod 2002; 66:38-43. [ Links ]
4. Correa JR, Zavos PM. Preparation and recovery of frozen-thawed bovine spermatozoa via various sperm selection techniques employed in assisted reproductive technologies. Theriogenology 1996; 7:1225-1232. [ Links ]
5. Dode MAN, Rodovhalo NC, Ueno VG, Fernandes CE. The effect of sperm preparation and co-Incubation time on in vitro fertilization of Bos indicus oocytes. Anim Reprod Sci 2002; 69:15-23. [ Links ]
6. Flesh F, Gadella B. Dynamics of the mammalian sperm membrane in the process of fertilization. Biochim Byophys Acta 2000; 1469:197-235. [ Links ]
7. Harrison RAP. Capacitacion mechanims, and the role of capacitacion as seen in eutherian mammals. Reprod Fertil Dev 1996; 8:581-594. [ Links ]
8. Hawk HW, Wall RJ. Improved yields of bovine blastocysts from in vitro produced oocytes. I. Selection oocytes and zygotes. Theriogenology 1994; 41:1571-83. [ Links ]
9. Knobil E and Neill JD editors. The physiology of reproduction. 2nd ed. New York: Raven Press. 1994. [ Links ]
10. Kochhar HS, Kochhar KP, Basrur PK, King WA. Influence of the duration of gamete interaction on cleavage, growth rate and sex distribution of in vitro produced bovine embryos. Anim Reprod Sci 2003; 77:33-49. [ Links ]
11. Leibfried ML, Critser ES, Parrish JL, Fist NL. In vitro maturation and fertilization of bovine oocytes. Theriogenology 1989; 31:61-74. [ Links ]
12. Mortimer D. Sperm recovery techniques to maximize fertilizing capacity. Reprod Fertil Dev 1994; 6: 25-31. [ Links ]
13. Niwa K, Ohgoda O. Synergistic effect of caffeine and heparin of in vitro fertilization of cattle oocyte mature in culture. Theriogenlogy 1988; 30:733-741. [ Links ]
14. Parrish JJ, Krogeneas A, Susko-Parrish L. Effect of bovine sperm separation by either swim-up or percoll method on success of in vitro fertilization and early embryonic development. Theriogenlogy 1995; 44:859-869. [ Links ]
15. Pope CE, Mcrae MA, Plair BL, Keller GL, Dresser BL. In vitro and in vivo developmental of embryos produced by in vitro maturation and in vitro fertilization of cat oocytes. J Reprod Fertil 1997; 51:69-82. [ Links ]
16. Prakash P, Leyki NL, Chen T, Sayegh R, Schiff I, et al. Preparation by differential gradient centrifugation is better than swim-up in selection of sperm with normal morphology (strict criteria). Fertil Steril 1998; 69:722-726. [ Links ]
17. Risopatrón J, Sánchez R, Sepúlveda N, Peña P, Villagran E et al. Migration /sedimentation sperm selection method used in bovine in vitro fertilization: comparison with washing/centrifugation. Theriogenlogy 1996; 46:65-73. [ Links ]
18. Rodriguez-Martínez H, Larsson B, Pertoft H. Evaluation of sperm damage and techniques for sperm clean-up. Reprod Fertil Dev 1997; 9:297-308. [ Links ]
19. Sánchez R, Risopatron J, Sepúlveda G, Peña P, Miska W. Evaluation of the acrosomal membrane in bovine spermatozoa: effects of proteinase inhibitors. Theriogenology 1994; 43:761-768. [ Links ]
20. Sánchez R, Risopatrón J, Sepulveda G, Peña P, MiSka W. Evaluation of the acrosomal membrane in bovine spermatozoa: Effects of Proteinase Inhibitars. Theriogenlogy 1995; 45: 761-768. [ Links ]
21. Takahashi M, Keicho K, Takahashi H, Ogawa H, Schultz M et al. Effect of oxidative stress on development and DNA damage in in vitro cultured bovine embryos by comet assay. Theriogenology 2000; 54:137-145. [ Links ]
22. Tea NT, Jondet M, Scholler R. Procede d'isolement des spermatozoides mobiles du sperme humain por la méthode de “migration-sedimentation”. Path Biol 1983; 31:688-690. [ Links ]
23. Thompson JG. Culture without the petri-dish. Theriogeniology 2007; 67:16-20. [ Links ]
24. Twigg J, Irvine DS, Houston P, Foulton N, Michale L, et al. Iatrogenic DNA damage induced in human spermatozoa during sperm preparation: protective significance of seminal plasma. Mol Hum Reprod 1998; 4:439-444. [ Links ]
25. Vajta G, Peura TT, Holm P, Páldi A, Greve T, et al. New method for culture of zona-included or zona-free embryos: the well of the well (WOW) system. Mol Rep Dev 2000; 55:256-264. [ Links ]
26. Vivanco W. Mejoramiento genético bovino a través de tecnologías reproductivas de avanzada. III Seminario Internacional. Competitividad en Leche y Carne 2002; 227-247. [ Links ]
27. Ward F, Enright B, Rizos D, Boland M, Lonergan P. Optimization of in vitro bovine embryo production: effect of duration of maturation, lenght of gamete co-incubation, sperm concentration and sire. Theriogenology 2002; 57:2105-2117. [ Links ]
¶ Para citar este artículo: Urrego R, Tarazona A, Olivera Ángel M, Camargo O. Simplificación de la fertilización de ovocitos durante la producción in vitro de embriones bovinos. Rev Colomb Cienc Pecu 2008; 21:398-405.
* Autor para el envío de la correspondencia y la solicitud de separatas: Grupo INCA-CES. Facultad de Medicina Veterinaria y Zootecnia. Universidad CES. Medellín, Colombia E-mail: rurrego@ces.edu.co Tel (+574)